硝唑尼特对日本脑炎病毒和脂多糖诱导炎症的体外抑制效果比较
2023-10-19苏钰陈栋梁马慧王霄旸王春梅周文张可煜
苏钰,陈栋梁,马慧,2,王霄旸,王春梅,周文,张可煜*
(1. 中国农业科学院上海兽医研究所/农业农村部兽用化学药物与制剂学重点实验室,上海 201100;2. 云南农业大学,云南 昆明 650000)
当外界各种病原微生物感染机体时,病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)或损伤相关分子模式(danger-associated molecular patterns,DAMPs)的生物分子能被体内巨噬细胞等免疫细胞的模式识别受体(pattern recognition receptor,PRRs)识别[1],启动细胞内信号传导,从而导致天然免疫细胞活化,诱导表达效应细胞分子和分泌受体[2]。各种细胞因子的过量激活将引起细胞因子风暴和严重的炎症反应,并进一步损伤机体。脂多糖(LPS)是最具代表性的革兰阴性菌产生的PAMPs。本实验室前期研究结果显示硝唑尼特(nitazoxanide,NTZ)及其主要代谢产物替唑尼特(tizoxanide,TIZ)能够通过抑制丝裂原活化蛋白激酶(MAPK)和核转录因子(NF-κB)途径来调控LPS诱导的炎症反应[3]。由于新型冠状病毒的大流行,人们在寻找抗新冠病毒药物时发现NTZ能够减轻新型冠状病毒感染引起的炎症反应和细胞因子风暴,降低病毒感染对机体造成的免疫损伤[4-6]。实验室前期研究也显示NTZ能有效地在中早期抑制日本脑炎病毒(Japanese encephalitis virus,JEV)在体内外的复制[7],但其发挥抗乙脑病毒的作用机制尚未明确。
为治疗绦虫感染而面世的NTZ是一种四氢噻唑类化合物,由勒马克实验室的Rossignol等[8]首先合成并在拉丁美洲、非洲等国家被广泛用于治疗隐孢子虫和蓝氏贾第鞭毛虫引起的腹泻。经过多年临床实践和实验室研究,人们逐渐发现NTZ具有广谱抗多种寄生虫、细菌和病毒的活性,但是NTZ对不同病原体的作用机制却仍不清楚[9-10]。对于不同病原体或PAMPs激活的天然免疫,NTZ是否采取了相同或相似的调节应对机制,从而发挥广泛的病原体抑制作用需要进一步研究和探讨[11]。因此,本研究比较了NTZ体外抑制JEV和LPS诱导的炎症反应的差异,为NTZ作用机制研究和临床的合理科学使用提供依据。
1 材料与方法
1.1 细胞与毒株
小鼠腹腔巨噬细胞(RAW264.7)、乳仓鼠肾细胞(BHK-21)均由本实验室保存,JEV VA毒株由中国农业科学院上海兽医研究所猪传染病风险预警与阻断技术团队馈赠。
1.2 药品与试剂
NTZ由中国农业科学院上海兽医研究所兽用抗感染药物与创新团队合成,纯度大于98%。将药物溶于二甲基亚砜(DMSO)中,配制成100 mmol/L的储备液并使用有机相滤器(0.22 μm)过滤除菌,-20 ℃分装避光保存,使用前用培养基稀释至相应的工作浓度。LPS购自MERCK公司;胎牛血清(FBS)、DMEM培养基、青霉素与链霉素双抗溶液购自Gbico公司;TRIzol Reagent购自Invitrogen公司;GoScript Reverse PCR 试剂盒购自Promega试剂公司;Hieff qPCR SYBR Green Master Mix(Low Rox Plus)购自Yeason公司;细胞活力检测(CCK8)试剂盒、蛋白浓度检测试剂盒、细胞裂解液(强)、蛋白酶抑制剂(PMSF)、磷酸酶抑制剂、SDS-PAGE蛋白上样缓冲液(5×)、小鼠白介素6(IL-6)和肿瘤坏死因子α(TNF-α)ELISA检测试剂盒均购自碧云天生物公司;PAGE凝胶快速制备试剂盒(10%)、Tris/甘氨酸/SDS电泳缓冲液(10×)、TBS/Tween缓冲液(10×)、Omni-Flash免冰浴快速转膜缓冲液(10×)均购自雅酶生物公司;诱导型一氧化氮合成酶(iNOS)和环氧合酶2(COX-2)抗体购自美国CST生物科技公司;非结构蛋白3(NS3)抗体购自Gene Tex公司;β-actin抗体、HRP标记山羊抗兔(鼠)IgG(H+L)购自碧云天生物公司。
本研究所用的引物序列见表1。

表1 引物序列
1.3 病毒效价的测定及感染复数(MOI)的计算
将BHK-21细胞以8×103个/孔的密度接种于96孔板,置于37 ℃、5% CO2培养箱中培养12 h。待细胞贴壁生长良好时接种病毒,将JEV VA毒株按照10-1~10-10的浓度进行倍比稀释并接种于培养孔,每个浓度设置6个复孔,100 μL/孔;置于37 ℃、5% CO2培养箱孵育2 h后,吸弃含有病毒的培养基,PBS清洗2遍后加入2% FBS DMEM培养基,于细胞培养箱中培养3~4 d,每天观察细胞病变(CPE)并记录终点,根据Reed-Muench法计算病毒的半数组织细胞感染量(TCID50)。
按照公式(MOI=0.7TCID50/感染细胞数)计算MOI值。本研究以MOI=10的剂量感染RAW264.7细胞开展相关研究。
1.4 细胞活力的检测
取生长状态良好的RAW264.7细胞,1×104个/孔的密度接种于96孔板中,待细胞完全贴壁后,加入1 μg/mL的LPS或MOI=10的JEV以及不同浓度的NTZ处理,每组设置6个复孔,继续培养18 h后,吸弃原培养液,加入新的培养液与CCK8,置于培养箱中孵育2~4 h后,酶标仪检测450 nm下的吸光度(OD)值,根据公式计算细胞活力。

1.5 体外炎症模型的建立
将细胞以2×106~3×106个/孔接种到六孔板中,待细胞完全贴壁后,分别用1 μg/mL的LPS和MOI=10的JEV诱导细胞炎症,随后给予不同浓度(15、25和50 μmol/L)的NTZ处理。将孔板置于培养箱中继续培养18 h后,收集细胞上清液并提取蛋白和细胞总RNA,-80 ℃保存。
1.6 炎症因子mRNA表达水平的检测
1.6.1 细胞总RNA的提取及反转录
采用TRIzol法提取RAW264.7细胞中的总RNA,反转录后将cDNA置于-20 ℃保存。反转录条件:25 ℃,5 min;42 ℃,1 h;70 ℃,15 min,-20 ℃保存。
1.6.2 实时荧光定量PCR
实时荧光定量PCR反应体系配制参照Hieff qPCR SYBR Green Mix (Low Rox Plus)试剂盒说明书。反应条件:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火/延伸34 s,共40个循环。
1.7 炎症因子蛋白水平的检测
1.7.1 Western blot检测
收集细胞,以每孔100 μL的量配制裂解液,PMSF与RIPA比例为1∶100,冰上裂解15 min,用干净的细胞刮刮取细胞,将细胞碎片和裂解液转移至新的离心管中并标记。12 000 r/min,4 ℃离心10 min后收集上清液至新的离心管中,加入5×蛋白上样缓冲液(1∶4),之后将混匀的蛋白放入100 ℃的金属浴中,10 min后取出,并放于-20 ℃保存。样品采用BCA蛋白浓度检测试剂盒测定其蛋白含量,上样前调整至3 mg/mL,上样量均为10 μL。首先将电压调整为80 V,电泳约30 min,待泳道样品下降至分离胶中;然后将电压调至150 V,当蛋白样品迁移至距分离胶底部约1 cm时,停止电泳(约50 min),取出玻璃板准备电转。将蛋白从SDS-PAGE转至活化的PVDF膜上,以250 mA电流转印45 min,结束后用TBST洗去膜上的转印缓冲液,然后用含5%脱脂牛奶的TBST室温封闭2 h。封闭完成后,加入一抗(1∶1 000稀释),4 ℃过夜。次日用TBST洗涤PVDF膜3次,每次10 min;之后加入二抗(1∶5 000稀释),室温孵育1 h,洗涤条件同上。最后将条带置于ECL发光显色液中,沥去多余发光液后放入Tanon全自动发光仪中成像。用ImageJ软件分析条带的灰度值。
1.7.2 ELISA法检测细胞上清液中细胞因子水平
参照碧云天ELISA试剂盒说明书,检测RAW264.7细胞上清液中IL-6的分泌水平。
1.8 统计分析
试验数据采用统计学软件GraphPad Prism 6.0分析处理,采用单因素方差分析(One-way ANOVA)比较组间差异。数据以“平均数±标准差”表示。
2 结果与分析
2.1 NTZ最佳作用浓度范围筛选
LPS与NTZ共同孵育18 h后,细胞活力变化如图1a所示,当NTZ浓度在50 μmol/L及以下时细胞活力在80%左右,但是当NTZ浓度升至75 μmol/L时,细胞活力降至68%。对于LPS诱导的炎症模型,后续试验将采用50 μmol/L以下的药物浓度进行。JEV感染细胞2 h,后给予不同浓度NTZ处理,细胞活力变化如图1b,当NTZ剂量高于25 μmol/L时,细胞活力只有60%。后续选择25 μmol/L以下的药物浓度进行JEV侵染RAW264.7细胞试验。比较上述结果可见,相同药物浓度下,MOI=10剂量的JEV侵染对RAW264.7的毒性大于1 μg/mL的LPS刺激。
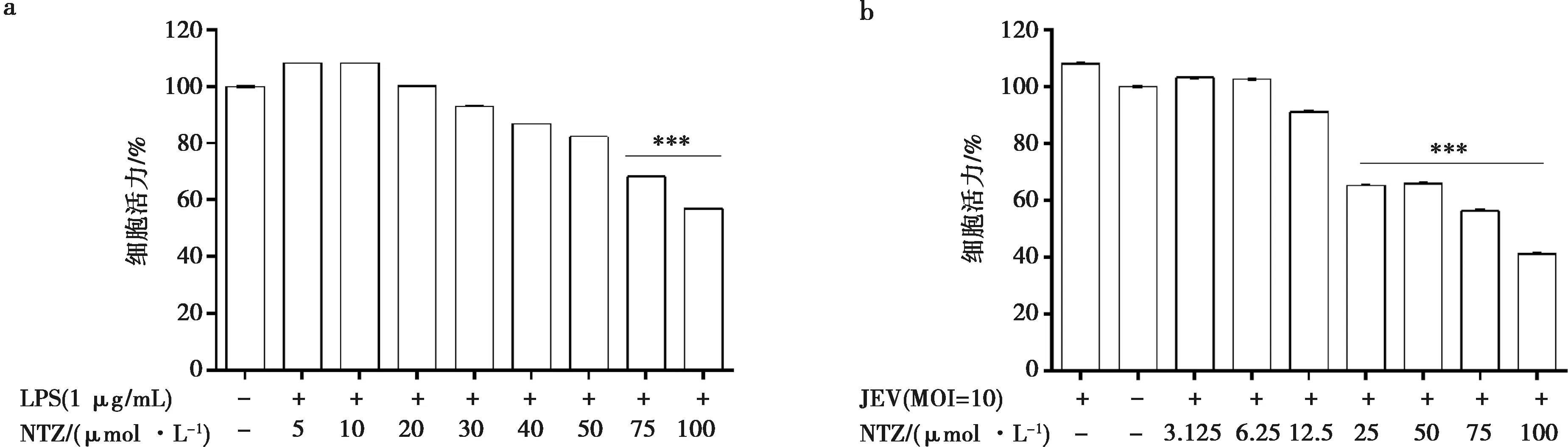
***表示NTZ处理组与对照组相比差异极显著(P<0.01)。图1 LPS(a)和JEV(b)诱导并给予NTZ处理后细胞活力变化的比较
2.2 NTZ抑制JEV的复制
将RAW264.7细胞以MOI=10的剂量感染JEV,2 h后给予不同浓度的NTZ处理。18 h后采用实时荧光定量PCR和Western blot分别检测细胞中病毒NS1 mRNA和NS3蛋白表达变化。如图2所示,与对照组相比,病毒感染组中NS1 mRNA和NS3蛋白的表达水平极显著上升(P<0.01),表明JEV感染RAW264.7细胞成功。NTZ处理JEV感染后的细胞,各个处理组的病毒mRNA和NS3蛋白的表达水平显著低于JEV感染组(P<0.01),其中10和15 μmol/L处理组的下降幅度又进一步低于5 μmol/L处理组(P<0.01),即病毒mRNA和NS3蛋白的表达水平与NTZ呈剂量依赖性降低。以上结果说明NTZ能够抑制JEV在RAW264.7细胞中的复制,即具有抗JEV作用。
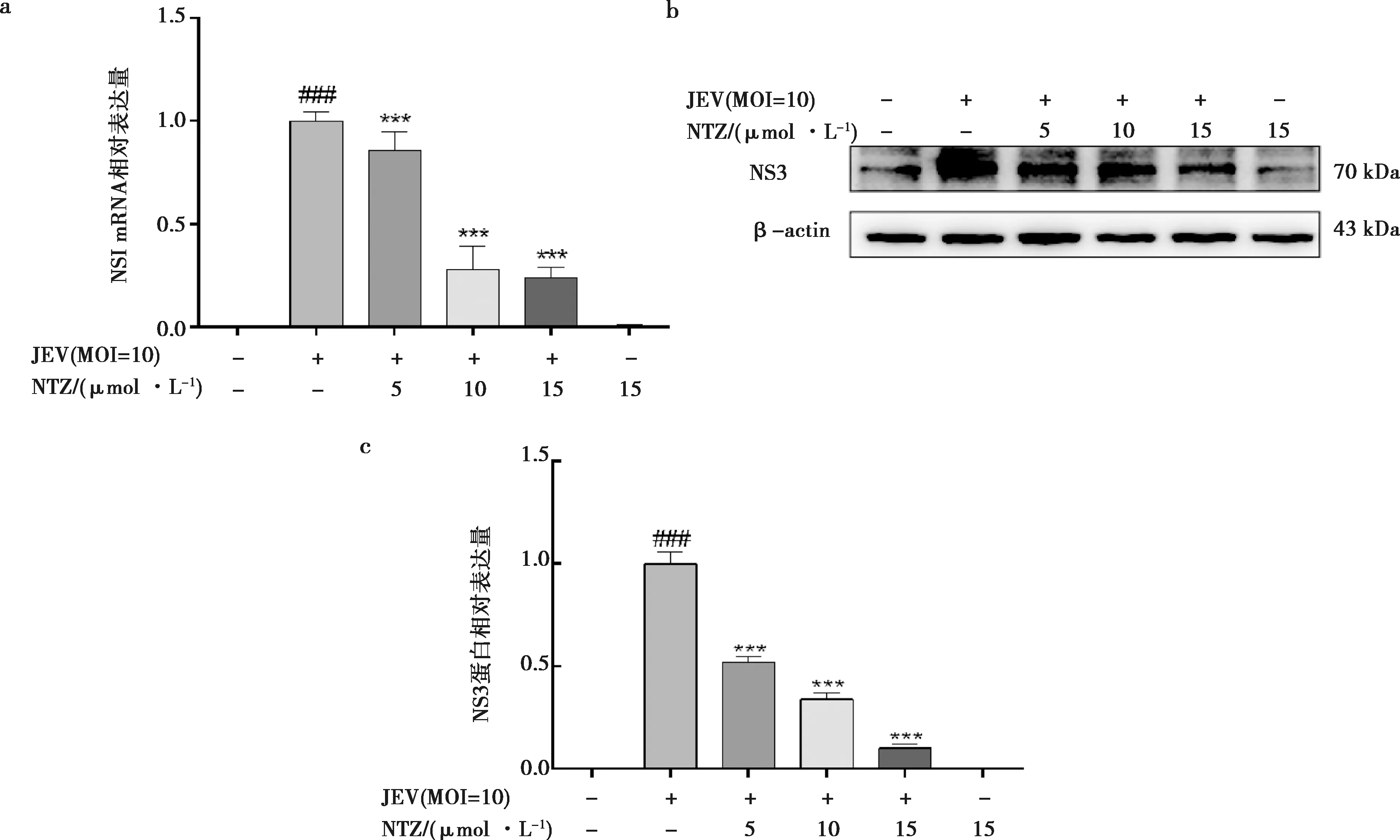
a.NTZ抑制JEV非结构蛋白NS1 mRNA的转录;b. NTZ抑制JEV非结构蛋白NS3在RAW264.7细胞中表达;c. NS3蛋白表达变化的统计学分析。###表示JEV处理组与对照组相比具有极显著差异(P<0.01),***表示NTZ处理组与JEV模型组相比具有极显著差异(P<0.01),下同。图2 NTZ抑制JEV在RAW264.7细胞中的复制
2.3 NTZ对JEV诱导炎症反应的影响
2.3.1 NTZ对炎症因子mRNA表达的影响
JEV侵染RAW264.7细胞后的相关炎症因子mRNA转录水平见图3。JEV侵染RAW264.7细胞能够引起TNF-α、IL-1β等炎症因子mRNA的表达量显著上升(P<0.01)。JEV侵染的RAW264.7细胞,经NTZ处理后,细胞中TNF-α和IL-1β的mRNA转录水平显著下调,且当NTZ浓度为15 μmol/L时,细胞中TNF-α和IL-1β的转录水平仅为JEV侵染组的20%左右。结果提示,NTZ可抑制JEV刺激巨噬细胞转录炎症因子。IL-6 mRNA转录水平较低,未检测到(结果未显示)。
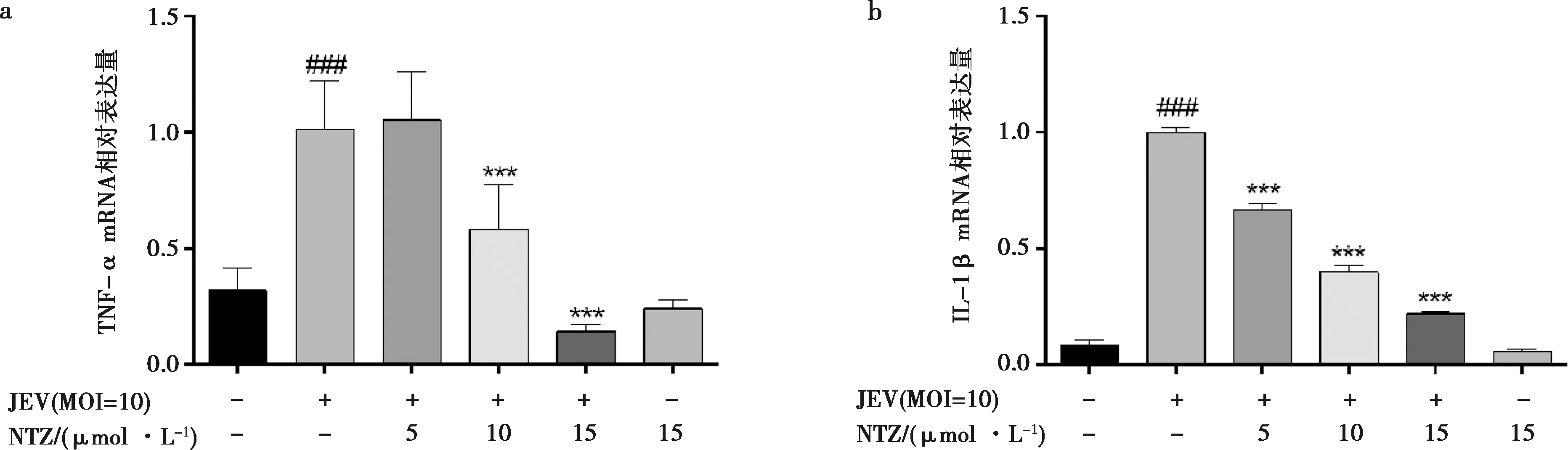
图3 NTZ抑制JEV诱导的RAW264.7细胞中TNF-α(a)和IL-1β(b)mRNA的表达
2.3.2 NTZ对炎症及JNK蛋白表达的影响
Western blot结果显示(图4),与空白对照组相比,JEV刺激后细胞中iNOS和COX-2蛋白的表达升高,具有显著差异(P<0.01)。然而,与JEV模型组相比,不同浓度的NTZ处理组中炎症相关蛋白iNOS和COX-2的表达并未下降,表明NTZ对iNOS和COX-2蛋白的表达几乎没有抑制作用。除此之外,JEV模型组中磷酸化JNK(pJNK)蛋白的表达与对照组相比显著上调(P<0.01),给予不同浓度的NTZ处理后并未抑制JNK蛋白的磷酸化。以上结果表明,JNK信号通路参与JEV诱导的巨噬细胞炎症反应,但NTZ对JEV诱导的JNK通路并无抑制作用。
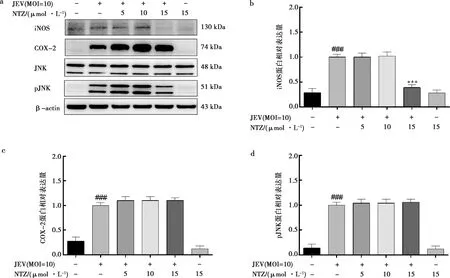
a.NTZ对JEV诱导的iNOS、COX-2、JNK以及pJNK蛋白的影响;b. iNOS蛋白表达变化的统计学分析;c. COX-2蛋白表达变化的统计学分析;d. pJNK蛋白表达变化的统计学分析。图4 NTZ对JEV诱导的炎症蛋白及JNK蛋白的影响
2.4 NTZ抑制LPS诱导的炎症反应
2.4.1 NTZ对炎症因子mRNA表达的影响
NTZ对LPS诱导的巨噬细胞内炎症因子IL-6、IL-1β和TNF-α mRNA表达的影响如图5所示。与对照组相比,模型组细胞内IL-6、IL-1β和TNF-α mRNA的表达显著上升(P<0.01),说明LPS诱导细胞炎症模型成功。给予不同浓度NTZ处理后,细胞内IL-6、IL-1β和TNF-α mRNA的表达呈剂量依赖性地显著下调(P<0.01)。
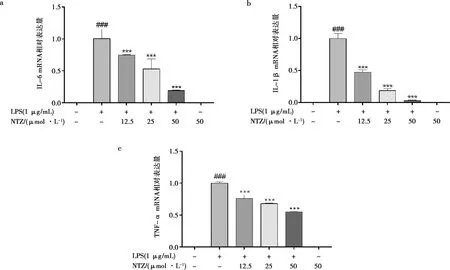
图5 NTZ抑制LPS诱导后RAW264.7细胞中IL-6(a)、IL-1β(b)和TNF-α(c)mRNA的表达
2.4.2 NTZ对炎症及JNK蛋白表达的影响
如图6所示,Western blot结果显示,LPS刺激可显著上调细胞内iNOS和COX-2蛋白的表达(P<0.01)。给予不同浓度NTZ处理后,iNOS和COX-2蛋白的表达被下调。其中,NTZ对iNOS蛋白的表达抑制效果最显著,当NTZ浓度为12.5 μmol/L时,iNOS的表达就已被完全抑制;而对于COX-2的表达,则与NTZ的浓度有关。随着药物浓度升高,COX-2蛋白的表达逐渐下降,当药物浓度为50 μmol/L时,COX-2的表达降至30%左右。以上结果表明NTZ对LPS诱导的炎症具有良好的抑制效果。此外,LPS诱导后,MAPKs信号通路中pJNK蛋白与对照组相比显著上调(P<0.01),给予不同浓度NTZ处理后,pJNK蛋白表达量下降,当药物浓度高于25 μmol/L时,pJNK的表达已被完全抑制。以上结果表明NTZ通过抑制JNK信号通路调控LPS诱导的细胞炎症反应。
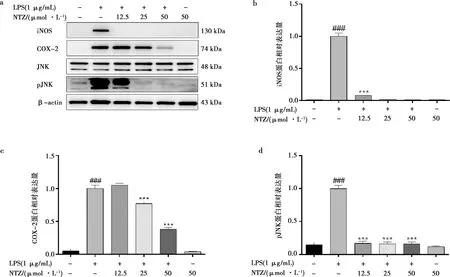
a.NTZ抑制LPS诱导后RAW264.7细胞中iNOS、COX-2、JNK以及pJNK蛋白的表达;b. iNOS蛋白表达变化的统计学分析;c. COX-2蛋白表达变化的统计学分析;d. pJNK蛋白表达变化的统计学分析。图6 NTZ对LPS诱导的炎症蛋白及JNK蛋白的影响
2.5 NTZ对JEV和LPS诱导IL-6的影响
为进一步验证JEV组中IL-6的水平,以及LPS与JEV诱导RAW264.7细胞炎症模型的区别,采用实时荧光定量PCR和ELISA检测了JEV和LPS诱导后巨噬细胞内炎症因子IL-6 mRNA和蛋白的表达量变化。如图7所示,LPS诱导组中IL-6的表达量与对照组和JEV诱导组相比显著上升(P<0.01),而JEV组中IL-6的mRNA表达与对照组相比无显著差异(P>0.05)。ELISA结果显示,LPS诱导后IL-6的表达量比对照组显著上调(P<0.01),经不同浓度NTZ处理后,IL-6的分泌量逐渐下降;而JEV处理组中IL-6的分泌量与对照组相比上升,但无差异性显著(P>0.05)。以上结果表明,LPS诱导可激活巨噬细胞中炎症因子IL-6的表达,而JEV并不能激活巨噬细胞中的IL-6;此外,NTZ处理后能显著下调LPS诱导后的炎症因子IL-6(P<0.01)。提示JEV和LPS通过不同的途径激活巨噬细胞中的炎症反应。
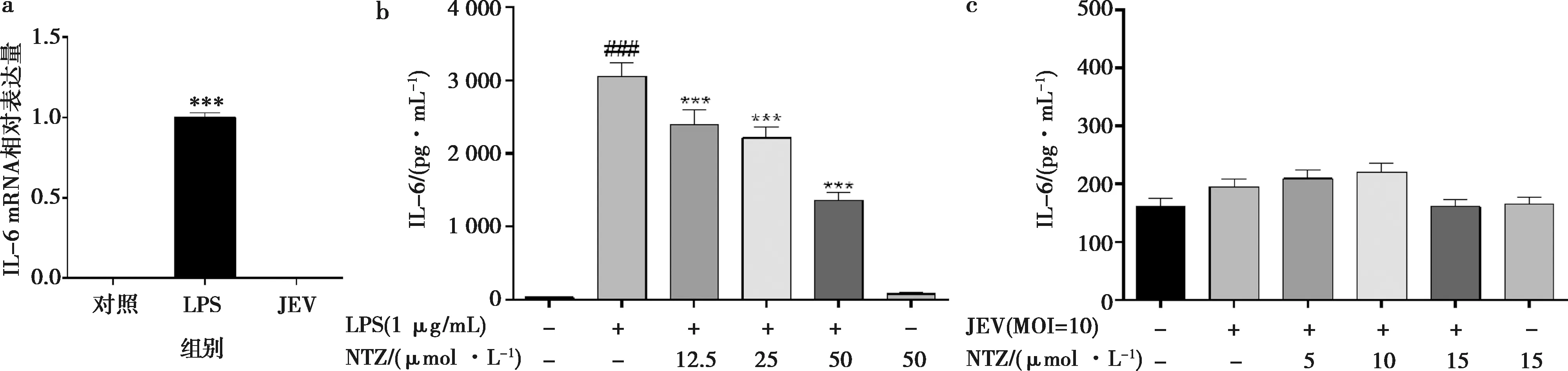
a.LPS和JEV模型组中IL-6 mRNA的表达变化;b. LPS模型组中NTZ抑制IL-6的分泌;c. JEV模型组中NTZ处理后IL-6的分泌变化。图7 NTZ对JEV和LPS诱导后的巨噬细胞中IL-6的调控作用
3 讨论
NTZ化学名为2-乙酰氧基-N-(5-硝基-2噻唑基)苯甲酰胺,在体内迅速被血浆酯酶水解为TIZ[12],而其主要代谢产物TIZ与NTZ具有一致的生物活性。2002年美国食品药品管理局(FDA)批准NTZ用于治疗隐孢子虫和蓝氏贾第鞭毛虫引起的腹泻,并在拉丁美洲和印度等地区广泛用于治疗肠道寄生虫感染[8],在我国被批准用于犬绦虫的防治。除抗寄生虫外,NTZ及TIZ还被发现对多种细菌和病毒具有广泛的活性[13]。新冠病毒肆虐全球以来,体外筛选抗新型冠状病毒(SARS-CoV-2)的评估认为NTZ的EC50达2.12 μmol/L,具有潜在的抗新型冠状病毒活性[14]。NTZ对多种病原体的药理活性成为人们关注的焦点。
NTZ对大肠杆菌等革兰阴性需氧或微需氧细菌几乎没有抗菌活性[13]。但是研究显示,LPS所诱导的细胞炎性反应却可以被NTZ所抑制[3,15]。本研究也证实,LPS刺激RAW264.7细胞所导致的IL-6、TNF-α和IL-1β等炎症因子可以被NTZ显著抑制,其机制可能涉及JNK等信号通路途径。
JEV是一种重要的人畜共患病毒,我国是该病的高发区[16]。主要通过蚊媒传播,感染后会引起宿主神经系统炎症,目前尚无特效药物治疗[17]。研究显示,NTZ能有效地在中早期抑制JEV在BHK-21细胞中的复制,并提高JEV感染小鼠的存活率[7]。本研究中,JEV相关基因NS1的转录和翻译都受到NTZ显著的抑制,再次证明NTZ的抗JEV活性;同时研究还发现,JEV侵染RAW264.7细胞所刺激的炎症因子TNF-α和IL-1β的mRNA表达也受到NTZ有效抑制。然而,相较于NTZ对LPS所诱导的各种细胞炎性因子的全面抑制,NTZ对JEV诱导的炎性因子抑制作用谱仍非常有限。JNK诱导转录因子如核因子-κB p65蛋白(NF-κB p65)、转录激活因子ETS样蛋白1(ELK-1)以及调节细胞增殖、分化和转化的因子c-Fos和c-Jun基因和信号转导转录激活因子1(STAT1)的活化,这些转录因子在调节病毒感染的免疫应答中起关键作用[18]。本研究发现,NTZ能显著地抑制LPS诱导的JNK磷酸化激活,却并未能有效阻止JEV激活的JNK信号激活,这可能也与本研究中的病毒感染量偏大有关。
作为革兰阴性菌的主要PAMPs,LPS是Toll样孕体4(TLR4)的配体,在受体识别之后经MyD88-TRAF6途径在胞内激活NF-κB、MAPK等信号通路,最终上调多种炎症因子mRNA的转录与表达[19]。TLR4-NF-κB信号通路是一条经典的炎症反应信号通路,广泛参与机体多种炎症反应。而病毒的PAMPs主要指非甲基化寡核苷酸CpGDNA、单链RNA等病毒成分,主要被TLR3和TLR9等模式识别受体所识别,但TLR4也可以识别某些病毒的蛋白[20]。已有研究证明,JEV感染小鼠小胶质细胞能诱导TLR3和RIG-I受体蛋白表达量升高,RNA干扰TLR3和RIG-I的表达能降低细胞炎症因子的表达量,证明TLR3、RIG-I参与JEV诱导的炎症反应[21]。本研究中,JEV和LPS都能诱导TNF-α和IL-1β等炎性因子,但有别于LPS,JEV并未显著诱导IL-6的增加。IL-6作为经典的促炎因子,能够被LPS刺激后表达,且涉及多条炎症相关的信号通路,在炎症进程中起着重要作用。有文献表示,NTZ对LPS刺激后RAW264.7细胞中IL-6的分泌具有抑制作用[15]。因此本研究重点分析了LPS和JEV诱导RAW264.7细胞后,NTZ对IL-6分泌的调控作用。结果显示,JEV并不能上调RAW264.7细胞中IL-6的转录与表达,说明两种炎症刺激模式存在关联又各有特点。NTZ对IL-6的抑制作用充分说明其调节天然免疫的作用主要依赖于对NF-κB、MAPK等信号通路的调控作用,这些调控可能通过各种信号通路之间的串扰抑制JEV诱导的TNF-α和IL-1β等炎性因子的表达,也可能是NTZ的药物靶点位于两种PAMPs激活模式的通路的交汇点导致的。
总之,NTZ对不同PAMPs诱导的天然免疫都具有调控作用,鉴于其对病毒抑制的复杂性,其抗病毒机理和调控天然免疫的机制仍需要继续探索,这将为NTZ应用于病毒等病原体的感染和相关炎症的治疗提供有力的支撑。
