木犀草素的结构修饰及其生物活性研究进展
2023-10-19姜亚玲李文渊刘金海翟广玉
姜亚玲,李文渊,冯 爽,刘金海,翟广玉
木犀草素的结构修饰及其生物活性研究进展
姜亚玲,李文渊,冯 爽,刘金海,翟广玉*
郑州工业应用技术学院,药学与化学工程学院河南省水环境与健康工程技术研究中心,河南 郑州 451150
木犀草素属于黄酮类化合物,是天然抗氧化剂,具有丰富的生物活性,可调节众多与疾病进展有关的细胞内和细胞外信号通路,具有抗氧化、抗炎、抗糖尿病、抗癌等作用。由于低溶解度和生物利用度等限制了其在临床上的应用。然而,木犀草素的低相对分子质量和易修饰的化学基团,使其具有药物开发的吸引力。通过对木犀草素的结构修饰及其衍生物的生物活性进行综述,为天然产物的研究、开发及利用提供参考。
木犀草素;结构修饰;衍生物;黄酮;生物活性
木犀草素是一种植物化学物质,属于黄酮类化合物,主要以糖苷的形式存在于蔬菜、水果和中草药中,如胡萝卜、辣椒、苹果、橙子、菊花、金银花、丹参等[1]。木犀草素属于天然抗氧化剂,具有抗氧化[2]、抗炎[3-4]、抗糖尿病[5]、抗癌[6-8]、化学预防和心脏保护[9-10]等作用。木犀草素能调节多种炎症介质,改变参与炎症的各种信号通路。木犀草素抑制巨噬细胞磷酸化,抑制核因子-κB(nuclear factor-κB,NF-κB)的活性,抑制脂多糖诱导的巨噬细胞产生白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症因子的表达,而这些炎症是反映炎症程度的敏感指标。木犀草素还能提高γ干扰素,降低特异性免疫球蛋白E,减少嗜酸性粒细胞的浸润。含有木犀草素的制剂临床研究显示,对炎症相关疾病具有很好的治疗效果[11]。木犀草素具有抗氧化剂作用,对高血压、炎症性疾病和癌症具有治疗作用。木犀草素可通过下调与肿瘤发生相关的关键调控通路,诱导氧化应激,细胞周期停滞,上调凋亡基因,抑制癌细胞的细胞增殖和血管生成,发挥抗癌活性[12]。
木犀草素具有丰富的生物活性和广泛的药理活性,可调节众多与疾病进展有关的细胞内外信号通路,其化学结构见图1。然而,低溶解度和较低的生物利用度限制了木犀草素的应用。因此,研究者试图通过各种方法设计和合成许多新的木犀草素衍生物,以改善这种不利因素,主要包括对羟基的修饰生成醚和酯,对羰基的修饰生成羰基氧被取代的产物,对木犀草素A、B环的修饰等。通过优化修饰获得了溶解性能好、生物利用度高、活性明显改善、抗癌活性增强的木犀草素衍生物[13-14],本文通过对木犀草素的结构修饰及其衍生物的抗菌、抗炎、抗糖尿病、抗癌等生物活性进行综述,为天然产物的研究、开发及利用提供参考。

图1 木犀草素的结构
1 木犀草素的结构修饰及生物活性
1.1 羟基的修饰
1.1.1 酯化反应 木犀草素对许多癌细胞的增殖具有抑制作用,在癌症的治疗中具有潜在的实用价值[15]。5-或7-位的衍生化导致木犀草素具有更好的综合性能,治疗潜力更大。Lo等[16]合成了9个酰基衍生物,检测了这些衍生物清除自由基活性,对人结肠癌HCT116细胞和人乳腺癌MDA-MB-231细胞的抗增殖活性。木犀草素与溴化苄反应得到三--苄基木犀草素,加入酰氯-三乙胺反应,得到5--酰基三--苄基木犀草素衍生物,加入钯碳催化氢化,除去苄基,得到5--酰基木犀草素衍生物(1a~1i),见图2。实验结果表明,与木犀草素相比,含脂肪链的5-酰基衍生物具有更好的抗肿瘤细胞增殖活性,且具有与木犀草素相似的自由基清除活性,表明该类衍生物的抗增殖活性与清除自由基活性无关。含苯基的木犀草素衍生物可显著降低其抗增殖活性和清除自由基的活性。本研究中所有的单酰基衍生物中,1g对HCT116细胞和MDA-MB-231细胞的半数抑制浓度(half inhibitory concentration,IC50)值最低,分别为(6.17±0.92)、(4.87±0.23)µmol/L(木犀草素的IC50值>10 µmol/L),是最具治疗潜力的化合物。
磷酰胺酸酯是一类新的抗癌药物[17],效力因磷酰胺部分的基团(芳基、酯和氨基酸)而异。Li等[18]合成了5个木犀草素-7-磷酰胺衍生物(图3),并对人肝癌HepG2细胞抗增殖活性进行测试。在低温条件下-氨基酸与亚硫酰氯反应,得到氨基酸酯,与苯氧基二氯化磷反应得到苯基氨基酰基磷酰氯(A)。木犀草素与乙酸酐反应,在硫酚作用下脱去木犀草素-7-位的乙酰基得到化合物B,A与B反应得到化合物C,用吡咯烷脱去化合物C的乙酰基得到化合物2。实验显示,2e对HepG2细胞IC50值是15.70 μmol/L(木犀草素的IC50值为34.70 μmol/L)。化合物2e可诱导HepG2细胞发生G2/M期阻滞,显示出诱导HepG2细胞早期凋亡的作用。

图2 木犀草素-5-O-酰基酯的合成
木犀草素热稳定性良好(200 ℃/7 d),且对于紫外线-A(ultraviolet radiation-A,UV-A)吸收和稳定性良好。UV-A防晒霜具有抗衰老和预防癌症的作用;UV-B防晒霜也有同样的用途,可以防止晒伤。脂肪酸也能吸收紫外线。而木犀草素是天然的抗氧化剂,可以消除自由基,防止细胞损伤,是防晒产品的一项宝贵特性。为了研究木犀草素衍生物的紫外线吸收性能,Fischer等[19]合成了一系列木犀草素衍生物,并与雪绒花提取物中的天然木犀草素进行比较。将木犀草素加入吡啶中,与过量的脂肪酸酰氯反应,分离得到四脂肪酰基木犀草素衍生物(图4)。实验显示,在所有衍生物中,没有观察到木犀草素A~C环体系在紫外光照射下的降解。3种木犀草素衍生物(3a~3c)对UV-A、UV-B和UV-C具有较好的吸收,是紫外线的滤光片。表明该化合物有望作为紫外线吸收剂用于防晒产品。
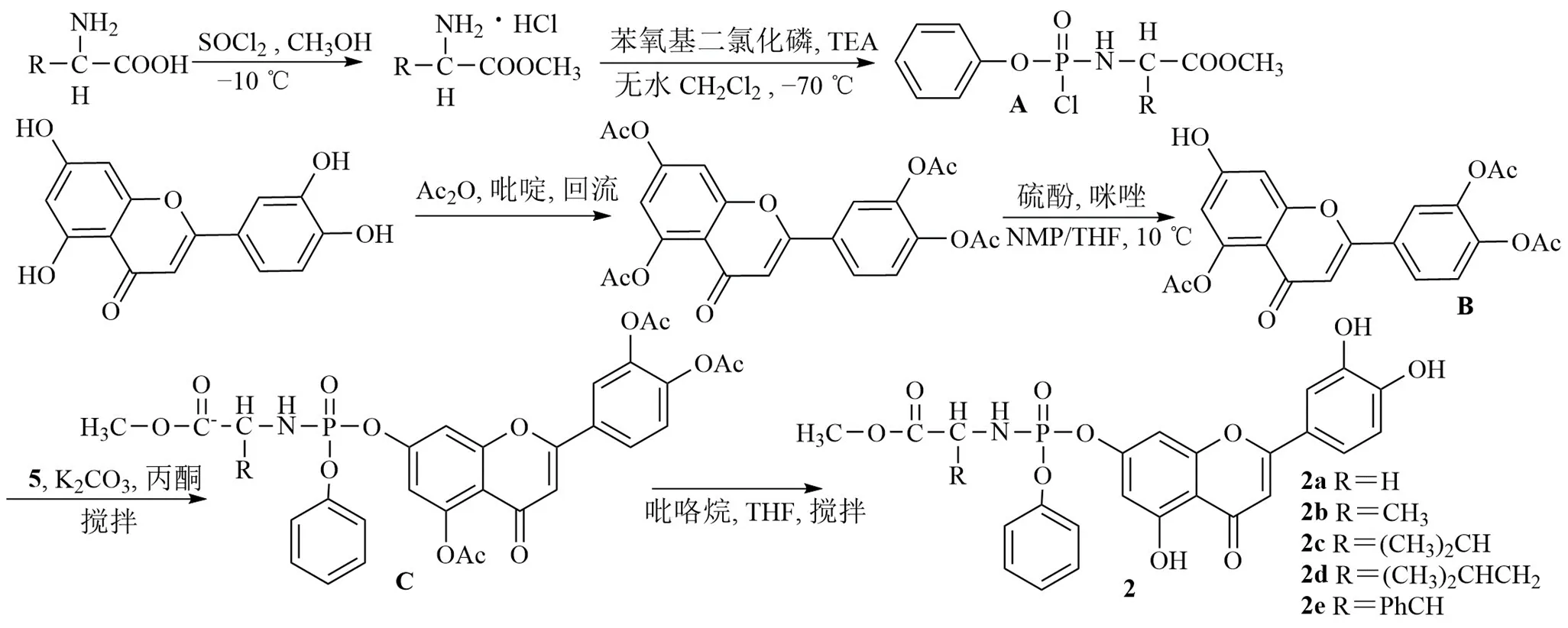
图3 木犀草素-7-O-磷酰胺酯的合成
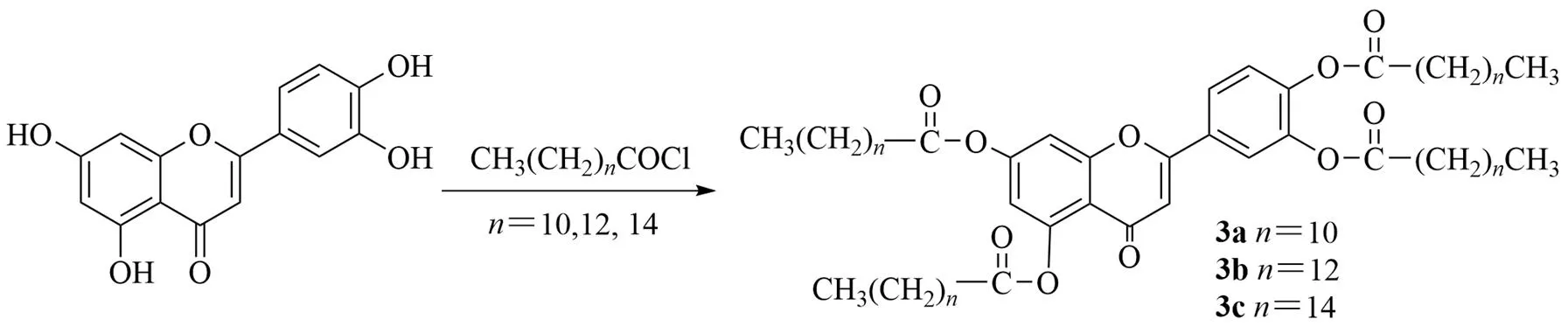
图4 木犀草素四酰基酯的合成
黄酮类磷酸酯溶解度高,抗肿瘤效果好。已经合成了一些对人类恶性肿瘤细胞具有较好活性的磷酸化槲皮素糖苷[20]。为进一步探索黄酮类磷酸酯的生物活性,Osonga等[21]合成了木犀草素四磷酸酯(图5),木犀草素与亚磷酸二苄酯反应,加入5%钯碳,脱去苄基得到木犀草素四磷酸酯。实验显示,木犀草素四磷酸酯(4b)在水中的溶解度是木犀草素的297倍。4b的纳米颗粒具有独特的抗真菌和抗孢子作用。Tsai等[22]为了解决木犀草素在水中难溶解、生物利用度低的问题,合成了3个木犀草素磷酸酯。木犀草素在枯草杆菌作用下,37 ℃反应,经过分离合成了3种可溶于水的磷酸酯(4c~4e),为木犀草素衍生物的进一步开发,奠定了基础。
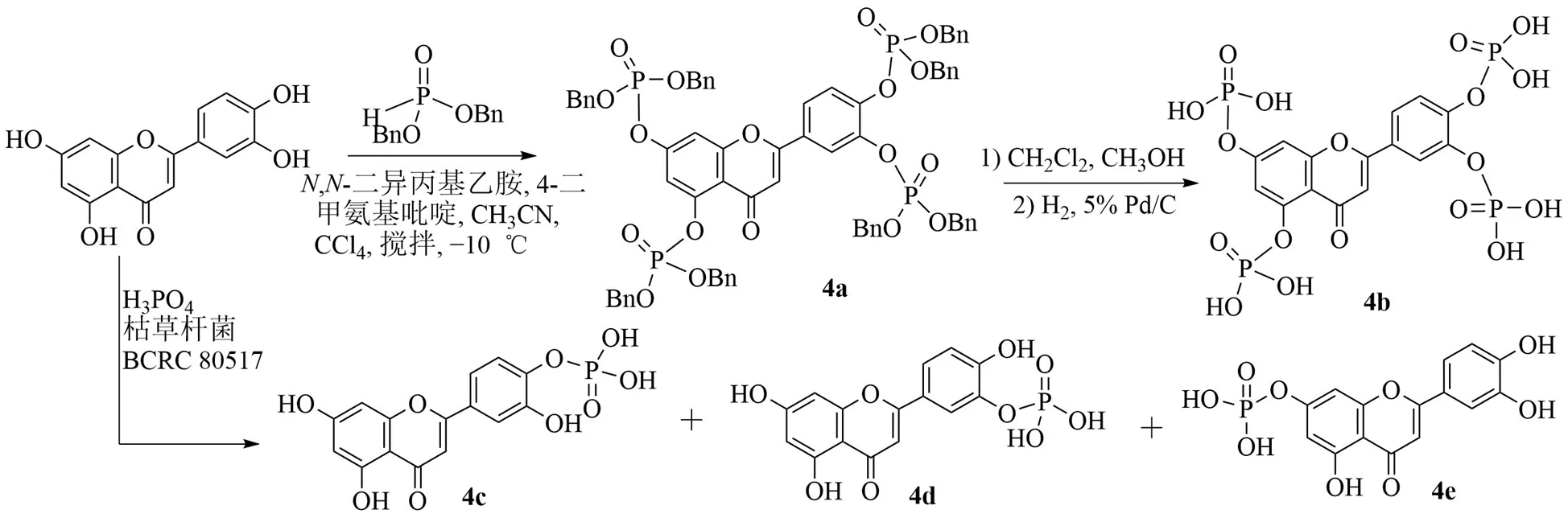
图5 木犀草素磷酸酯的合成
神经精神系统疾病严重威胁人类健康。如多巴胺、去甲肾上腺素(noradrenalin,NA)和5-羟色胺(5-hydroxytryptamine,5-HT)等神经递质被认为在神经精神系统疾病中发挥关键作用。多巴胺是最重要的神经递质之一,如中枢神经系统中的多巴胺容易引起神经传递功能障碍[22],如帕金森病、精神分裂症、注意力缺陷多动障碍及药物成瘾等[23]。多巴胺主要通过多巴胺转运体(dopamine transporter,DAT)的再摄取而失活,DAT是存在于大脑中多巴胺信号常见区域的多巴胺神经元突触前膜上的单胺转运蛋白。DAT激动剂可显著增强DAT的再摄取作用,从而减轻由多巴胺增加引起的精神疾病或神经原性疾病。木犀草素和芹菜素被视为新型的单胺转运蛋白激活剂,但木犀草素的DAT激动力和疗效强于芹菜素。Zhang等[24]选择木犀草素作为先导化合物,探索DAT活性和水溶性更佳的新型化合物,发现木犀草素在二甲基甲酰胺(dimethylformamide,DMF)中与溴化苄反应,与过量的酰氯和NaH在CH2Cl2中与羧酸、1,3-二环己基碳二亚胺和4-二甲氨基吡啶(4-dimethylaminopyridine,DMAP)在室温下进行酯化反应。在氢氧化钯催化下加氢脱去苄基保护基得到目标化合物5a~5i(图6)。实验用转基因CHO细胞系统进行筛选,发现木犀草素衍生物5d、5e和6c具有更强的DAT激动剂活性,尤其是化合物5d的DAT激动剂活性是木犀草素的32倍,有望研发成治疗精神疾病的药物。

图6 木犀草素酰基衍生物的合成
1.1.2 成醚反应 黑色素瘤是一种恶性皮肤肿瘤,由UV对分布在皮肤表面的黑色素细胞(产生色素的细胞)破坏而引起[25]。研究发现木犀草素及其衍生物可有效抑制黑色素的生成[26]。为了证明木犀草素衍生物的抗黑色素瘤的效果,Yamauchi等[27]合成了8个木犀草素衍生物(图7),并对其在小鼠黑色素瘤B16细胞中的黑素生成抑制作用进行评价。由于类黄酮衍生物具有很高的化学反应活性,迄今已有报道对类黄酮类化合物的羟基进行选择性保护。因此,选择在室温下可进行反应的硼砂(四硼酸钠)保护儿茶酚羟基和5-羟基,硼砂可以与A环上的5-羟基和4-羰基及B环上的羟基相互作用。在水中进行7--选择性甲基化和乙基化反应,表明该反应具有很高的选择性。然而,在这种条件下,含有较长碳氢链的基团不发生反应。因此,将冷冻干燥后的木犀草素粉末,在DMF中进行取代反应,效果很好。在高效液相色谱分析中只有1个突出峰存在,证实了所需产物的形成。实验显示,木犀草素衍生物显示出改善的黑色素合成和细胞增殖抑制活性。其中,化合物7f的活性最高,在6.25 μmol/L时对黑素合成的抑制率为34%。
木犀草素对许多细菌具有抗菌活性[28-29],然而,关于木犀草素衍生物的抗菌活性的研究报道甚少。Lv等[30]合成了3′4′-亚乙基-7-乙基(,-二乙基)胺槲皮素等17个木犀草素衍生物,并评价了其对枯草杆菌、金黄色葡萄球菌、荧光假单胞菌和大肠杆菌的抑菌活性。在K2CO3催化下,木犀草素与1,2-二溴乙烷反应,得到具有潜在药效团的化合物H。H与过量的1,2-二溴乙烷在无水DMF中以K2CO3为催化剂,在120 ℃下反应,制得衍生物I。I与不同的烷基胺和芳香胺在无水DMF中于80 ℃反应,得到化合物8a~8q(图8)。生物活性测定表明,部分化合物具有较高的体外抑菌活性,其中吗啉类化合物8m对枯草杆菌、金黄色葡萄球菌、荧光假单胞菌和大肠杆菌的最小抑制浓度分别为1.562、3.125、3.125和6.250 mg/mL。木犀草素衍生物的构效关系研究表明,木犀草素衍生物的亲水性和芳香性可能是影响其抗菌活性的重要因素。

图7 木犀草素-7-烷基醚的合成

图8 木犀草素-7-乙基胺衍生物的合成
糖尿病是一个严重的世界性健康问题,2型糖尿病(type 2 diabetes mellitus,T2DM)更为普遍,其特点是胰岛素敏感性降低和胰岛素分泌受损。α-葡萄糖苷酶抑制剂可以有效治疗T2DM,具有延缓和降低餐后血糖峰值的能力[31]。α-葡萄糖苷酶参与碳水化合物代谢,在糖尿病、病毒感染和癌症中起着至关重要的作用,被认为是一个有吸引力的药物靶点。因此,开发新型α-葡萄糖苷酶抑制剂尤为重要。研究表明,类黄酮可以缓解高血糖,增加胰岛素分泌,并改善胰岛素敏感性[32]。木犀草素、芹菜素和白杨素等黄酮类化合物具有抑制α-葡萄糖苷酶活性的能力[33]。Cheng等[34]合成了3个烷基化木犀草素,并研究了其对α-葡萄糖苷酶抑制活性。将木犀草素和K2CO3加入二甲基亚砜(dimethyl sulfoxide,DMSO)中,滴加1,2-二溴乙烷,在70 ℃加热1 h。加入溴代烷反应,分离得到9a~9c(图9)。实验显示,与参比药物阿卡波糖[C50值(563.60±24.39)μmol/L]和脱氧诺吉霉素[IC50值(226.91±12.57)μmol/L] 相比,所有衍生物的糖苷酶抑制活性(IC50<40.49 μmol/L)均显著高于参比药物。其中,化合物9c的IC50值为(5.18±0.45)μmol/L,抑制作用最强。
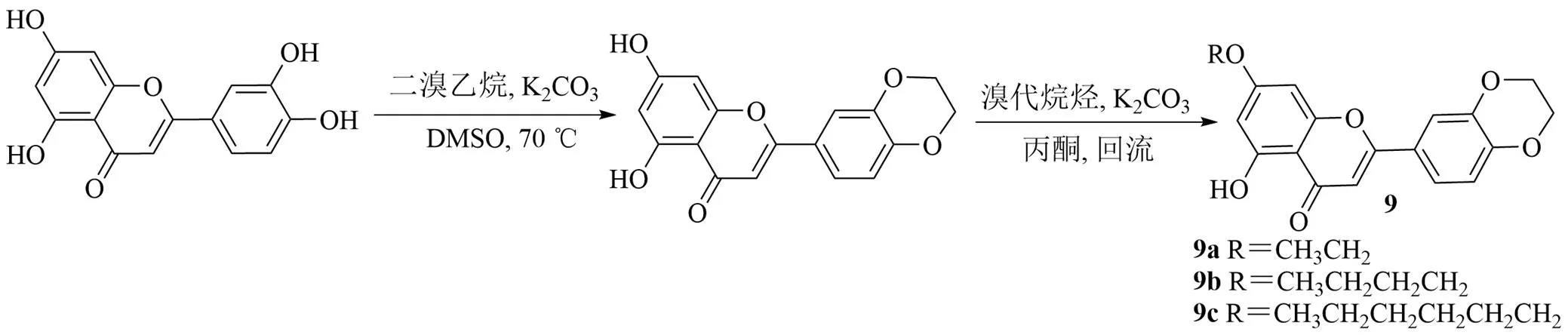
图9 木犀草素-7-烷基醚的合成
1.2 羰基氧被取代的反应
血管生成是从原有的血管形成新的血管,是癌症进展的关键阶段,血管生成抑制剂现在临床上被用作抗癌药物[35]。黄酮类化合物具有抗血管生成的特性[36],为了开发和优化黄酮类化合物抗血管生成的性质,Ravishankar等[37]合成了木犀草素衍生物(图10),并评价了其抗血管生成和抗增殖活性。木犀草素与硫酸二甲酯反应得到四甲基木犀草素(10a),10a加入劳森试剂反应,得到4-硫代四甲基木犀草素(10b)。10b加入BBr3,反应得到4-硫代木犀草素(10c)。实验显示,10c和10b在体外划痕实验中显示出显著的抗血管生成活性。木犀草素衍生物对人乳腺癌MCF-7细胞的细胞毒性评估也显示出直接的抗癌活性[10c的IC50值为(21.60±0.87)μmol/L;木犀草素的IC50值为(27.30±1.55)μmol/L;10a、10b的IC50值>250 μmol/L],表明木犀草素衍生物作为抗血管生成活性显著。
木犀草素中有1个羰基,可以与胺反应生成席夫碱。但是实验发现木犀草素与伯胺不反应,可能是由于木犀草素的环与环共振具有芳香性,4个羟基的给电子效应,使得羰基的活性降低,不能很好的与伯胺反应生成席夫碱。根据氯原子具有吸电子效应,相对于酚羟基能够降低苯环上电子云密度,提高羰基的亲电反应活性,Li等[38]通过将木犀草素的3个羟基被氯取代,使其羰基具有足够高的活性与伯胺直接合成制备席夫碱。取DMF,加入三氯氧磷、木犀草素,68 ℃回流3 h,柱色谱分离得到7,3′,4′-三氯木犀草素。加入胺反应,可得11a~11e(图11)。合成了7,3′,4′-三氯木犀草素席夫碱衍生物,并测定了其抗炎活性。结果表明木犀草素衍生物可以减轻小鼠耳肿胀程度和足肿胀程度,对急性炎症具有明显的抑制作用。
1.3 C-8的氢被取代的反应
流行性感冒(简称流感)是全球性严重传染性疾病,目前抗流感药物面临的主要问题是病毒耐药性和对高致病性流感病毒的效价低。流感病毒RNA聚合酶是病毒在宿主细胞内完成复制和转录过程的关键性酶,其中聚合酶酸性蛋白(polymerase acidic protein,PA)亚基通过内切酶活性为流感病毒的转录过程提供引物,成为潜在抗流感药物靶点[39-40]。核酸内切酶抑制剂的特征是能够螯合位于酶催化位置的镁离子或锰离子。木犀草素的A环5-羟基与4-羰基和B环上的羟基与金属离子的强相互作用使得木犀草素具有很高的亲和力和抑制性。因此,对木犀草素的结构进行修饰,以提高抑制效力和药动学性质。已有研究表明木犀草素可显著抑制PA,且是有效的抑制剂。Reiberger等[41]合成了12个流感核酸内切酶抑制剂C-8木犀草素衍生物(图12),并进行了体外评价。木犀草素与甲醛和仲胺反应,可以得到C-8木犀草素甲基胺衍生物。实验显示,C-8木犀草素甲基胺衍生物是最有效的抑制剂,其抑制效力优于木犀草素。如12d的IC50值为(1.54±0.09)μmol/L [木犀草素IC50值为(18.73±0.03)μmol/L]。

图10 木犀草素-4-硫代衍生物的合成
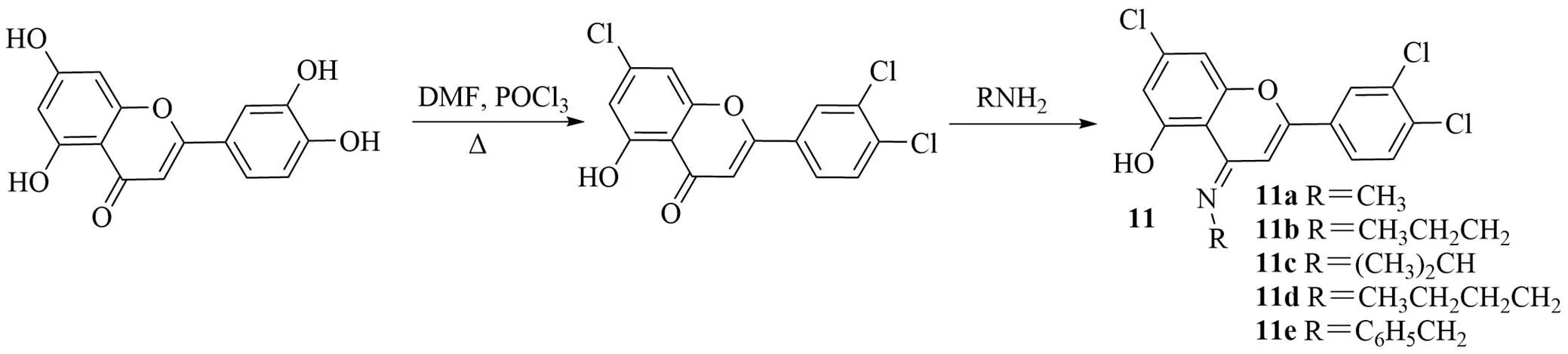
图11 7,3′,4′-三氯木犀草素席夫碱衍生物的合成

图12 C-8木犀草素甲基胺衍生物的合成
任杰等[42]合成了木犀草素Mannich碱衍生物并考察其抗癌活性。室温下木犀草素与甲醛、胺反应得到8种Mannich碱衍生物(图13),结构经核磁氢谱、碳谱和质谱确证。采用四唑盐比色法以5-氟尿嘧啶为阳性对照药,通过对人宫颈癌HeLa细胞、人胃癌SGC-7901细胞、人结肠癌HCT-116细胞、人白血病K562细胞、MCF-7细胞、人前列腺癌DU-145细胞6种肿瘤细胞进行体外抗癌活性评价,以正常人胚肾上皮HEK-293细胞为毒性对照,实验显示,体外抗癌活性实验表明部分化合物(对于K562细胞,13h的IC50值为4.00 μmol/L)显示出比木犀草素(IC50值为61.00 μmol/L)、5-氟尿嘧啶(IC50值为45.00 μmol/L)更好的抗癌活性。对化合物13h进行抗癌分子机制研究显示,13h可能通过线粒体途径抑制SGC-7901细胞增殖从而诱导细胞凋亡。
周美荣等[43]以木犀草素为先导化合物,利用A环C-8位H的活性与脂肪伯、仲胺在甲醛或乙醛水溶液中进行Mannich反应,反应条件温和,合成了10个新的8-氨甲基化衍生物(图14)。采用二甲苯诱发小鼠耳廓炎症模型对抗炎活性进行了初步筛选,试验结果表明,所测试的目标化合物均具有一定程度的抗炎活性,其中14e、14g、14j可显著减轻二甲苯致小鼠耳廓炎症反应,肿胀度与阴性组比较具有显著差异性,其活性亦高于木犀草素的活性。结果提示通过恰当的结构修饰,将可能筛选出更有药用价值的新化合物。

图13 木犀草素-8-甲氨基衍生物的合成

图14 木犀草素-8-氨甲基衍生物的合成
1.4 配位反应
糖尿病是人类最常见的代谢性疾病之一,其患病率逐年上升[44],T2DM是最常见的糖尿病类型,占糖尿病患者总数的90%以上。特征是体质量异常减轻、高血糖、血脂异常和胰岛素抵抗;尽管目前T2DM药物已被证明在治疗高血糖方面非常有效,但大多数药物都有不同程度的不良反应,开发安全有效的天然活性成分有效治疗T2DM尤为重要[45]。天然黄酮类成分木犀草素对T2DM小鼠具有降血糖作用[46]。铬是人体必需的微量元素,在提高胰岛素敏感性方面发挥重要作用[47]。Ge等[48]通过对木犀草素进行结构修饰,合成了6,8-(1,3-二氨基胍)木犀草素(15b)及其铬配合物(15a),并对其降血糖活性和肠道微生物区系组成进行研究。木犀草素溶于丙酮,加入过氧化苯甲酰。加入溶于丙酮的-溴代丁二酰亚胺,得到6,8-二溴木犀草素。加入硼砂,得到6,8-二溴犀草素硼酸络合物。加入甲苯、1,3-二氨基胍盐酸盐,乙酸钯催化,得到15b,将乙醇、15b和醋酸铬加热至60 ℃,得到15a。实验显示,15b和15a对T2DM小鼠的体质量、空腹血糖、葡萄糖耐量试验和糖化血清蛋白均有明显的恢复作用。胰岛功能指数、血清和肝脏生化指标也有明显改善。组织病理学结果表明,15b和15a在肝脏和胰腺中具有较强的修复能力。15b和15a可通过改善胰岛功能指数,调节血清和肝脏生化指标,修复受损组织,调节磷脂酰肌醇3-激酶/蛋白激酶B1信号通路,增加肠道有益微生物的相对丰度和粪便中短链脂肪酸的含量,从而改善T2DM小鼠的高血糖。15a对体质量、血清IL-10、IL-6和胰岛功能指数的降糖作用显著优于15b,见图15。

图15 6,8-(1,3-二氨基胍)木犀草素铬配合物的合成
木犀草素在体内具有抗炎、抗氧化、抗糖尿病、抗菌和抗癌等活性[49]。小分子的抗氧化剂和金属螯合剂作为疾病保护剂和治疗药物受到广泛关注。大多数黄酮类化合物是有效的金属螯合剂,具有很强的抗氧化和清除自由基的活性,如芦丁、槲皮素和木犀草素已被证明是良好的螯合配体[50]。Dong等[51]合成了木犀草素与锰(II)的金属配合物。木犀草素溶于乙醇,加入醋酸锰溶液,调pH值为4,完全反应后得到木犀草素锰配合物(16),见图16。并用UV光谱、红外光谱、热重分析和元素分析对其进行表征。根据光谱数据,发现木犀草素通过5-羟基和4-羰基在2分子木犀草素的络合中心与锰(II)离子反应。与木犀草素相比,16具有更高的生物活性,包括抗氧化、抗菌和降血糖活性。结果表明,木犀草素和16以竞争性方式可逆地抑制黄嘌呤氧化酶,16显示出比木犀草素更强的抑制黄嘌呤氧化酶的活性。16比木犀草素有更显著的降血糖作用,增加了肝组织中葡萄糖的消耗。

图16 木犀草素锰配合物的合成
木犀草素抑制酪氨酸激酶参与肿瘤细胞增殖的作用,是人膀胱癌-乙酰转移酶活性抑制剂,抑制人乳腺癌MDAMB231细胞增殖[52],通过激活线粒体途径诱导细胞凋亡。氧化钒(IV)与不同的黄酮类化合物已被证明具有抗氧化和抗癌性能[53]。为了进一步研究黄酮类化合物及其氧化钒(IV)络合物的结构与活性的关系,Naso等[54]合成了木犀草素钒配合物。木犀草素与VOCl2在无水乙醇中反应,分离得到木犀草素钒配合物(17),见图17。分析了体外抗氧化性能,并评价了其对不同细胞的抗癌作用。固态下的磁性测量表明,相邻的钒离子间存在有效的交换路径,提高了木犀草素对羟基自由基的抗氧化能力。17对MDAMB2311细胞的活性抑制作用(IC50值为70 μmol/L)高于配体,对人肺癌A549细胞的抑制作用(IC50值为6.00 μmol/L),比木犀草素(IC50值为6.80 μmol/L)稍高。

图17 木犀草素钒配合物的合成
席夫碱衍生物及其金属配合物具有抗癌、抗病毒等生物活性,沙靖全等[55]合成了一系列黄酮配合物和席夫碱药物,发现其杀菌抗霉活性更广。为了寻求更为理想的杀菌抗霉药物,将木犀草素的羰基(C=O)和磺胺甲恶唑的伯氨(-NH2)缩合,合成兼有了2种母体分子性能的抗菌、消炎新型黄酮类席夫碱化合物。并以此为配体合成了新的金属配合物,并研究了其抗菌活性。以木犀草素和磺胺甲恶唑进行缩合再与铜或锌离子络合形成木犀草素磺胺配合物,进行初步的抗菌活性实验。在无水乙醇中加入磺胺甲恶唑、木犀草素、催化剂冰醋酸,回流反应,加入醋酸铜(或醋酸锌)反应,分离得到得黑色(棕色)的固体18a和18b。实验结果显示,18a和18b物对多种菌株有明显的抑菌活性且优于各自的母体,见图18。
张宇等[56]利用木犀草素、硫酸和金属盐为原料,合成了4种木犀草素磺酸金属配合物,利用红外光谱、元素分析、核磁共振光谱和质谱等手段表征了配合物的结构。以1,1-二苯基-2-苦基肼自由基(1,1-diphenyl-2-picryl hydrazyl free redical,DPPH)清除率、抑菌环的大小检测配合物的抗氧化、抗菌活性,结果表明木犀草素磺酸配合物对DPPH的清除率和对金黄色葡萄球菌和大肠杆菌的抑制作用随浓度的增大而提高,且效果优于木犀草素。木犀草素加入浓硫酸得到木犀草素磺酸钠盐。分别加入乙酸盐(乙酸锌、乙酸铜、乙酸钴、乙酸锰)溶液,回流搅拌,浓缩,冷却滤过,重结晶得到配合物(19a~19d),见图19。并表征了4个磺化木犀草素金属配合物,均具有较好的水溶性,部分配合物具有较强的抗菌活性,其中19a对金黄色葡萄球菌和大肠杆菌的抑制作用呈剂量相关性,在质量浓度7.5 g/L时最大抑菌环为9.76 mm,对大肠杆菌的最大抑菌环为3.97 mm,磺化木犀草素金属配合物具有清除DPPH自由基的活性且略强于木犀草素,通过本实验明确磺化木犀草素金属配合物的抗菌和抗氧化的生物活性,为该类药物开发提供了一定的实验依据。

图18 木犀草素磺胺锌(或铜)配合物的合成
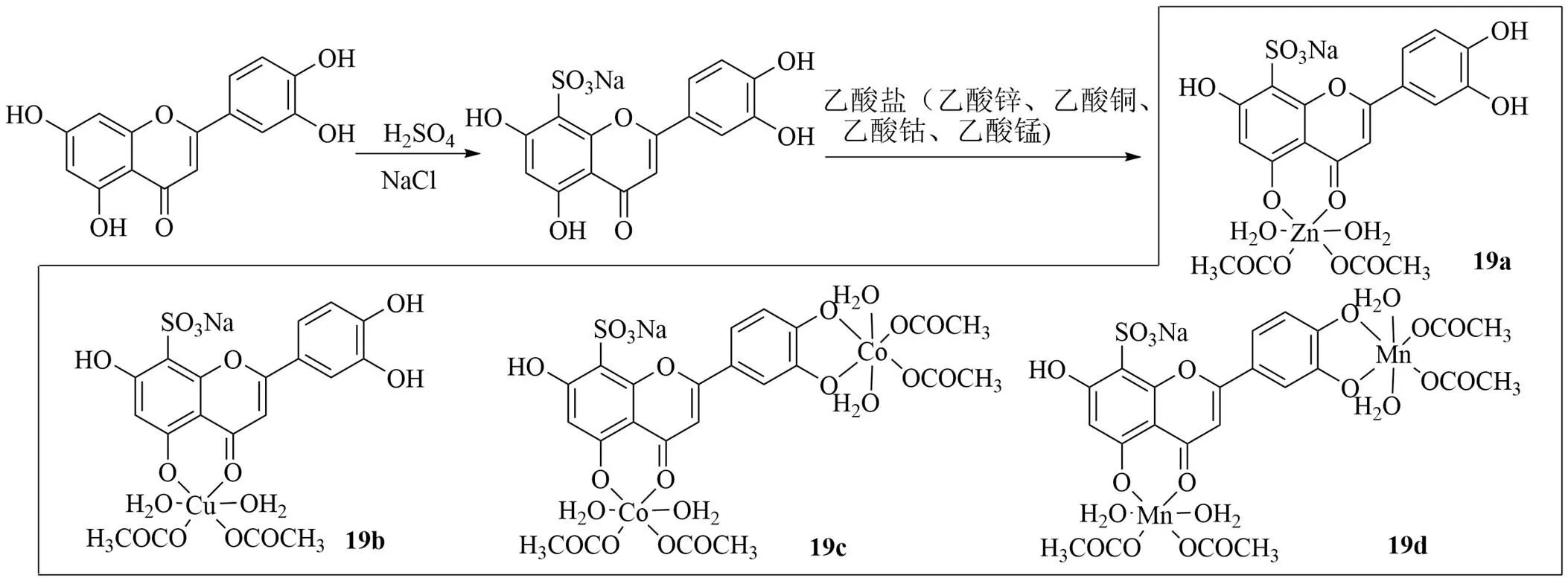
图19 木犀草素磺酸盐配合物的合成
1.5 聚合反应
炎症是机体为抑制感染和修复受损组织而产生的一种免疫反应。然而,慢性炎症可发展为关节炎、慢性阻塞性肺病和癌症等疾病[57]。木犀草素具有强大的抗炎活性,但是生物利用度较低[58]。为了改善木犀草素水溶性和生物利用度,Tawornchat等[59]以木犀草素为原料,采用温和的一锅煮聚合法制备了木犀草素水分散纳米球,通过低聚物的1H-1H相关谱、1H-13C异核单量子相干谱和1H-13C异核多键相关谱鉴定了聚木犀草素的化学结构(图20),并提出了聚合机制。与木犀草素在高剂量下具有细胞毒性不同,聚木犀草素纳米粒具有剂量相关的抗炎活性,在高剂量下没有细胞毒性。表明水分散的聚木犀草素纳米粒有望发展成为一种用于治疗的抗炎剂。
2 构效关系
木犀草素具有C6-C3-C6碳骨架的苯并(γ)-吡喃酮结构,A环中C-5和C-7位存在羟基,属于间二酚结构,B环含有2个相邻的酚羟基(3′,4′-二羟基),是邻苯二酚基团。C环C-4位是个羰基,存在C2-C3双键,即C环含有α,β-不饱和酮结构。4个酚羟基和α,β-不饱和酮结构决定了木犀草素的性质,具有强氧化性。修饰不同的基团,产生不同的生物活性。木犀草素的3个环是扭曲的平面,在该体系中,分子内形成2个氢键:1个氢键是由C5-OH和C4=O羰基建立,另1个在B环的邻位羟基间形成。木犀草素具有良好抗氧化活性的2个重要条件分别是:(1)B环上的邻二羟基结构通过氢键的形成赋予自由基高度的稳定性;(2)C2-C3双键与C环上的4-氧键结合,负责从B环开始的电子离域。木犀草素因其显著的抗氧化和抗癌活性而被广泛研究,修饰不同基团,得到的衍生物具有不同的生物活性和功效[13],见图21。

图20 木犀草素聚合物的合成
通过比较发现,含脂肪链的5-酰基衍生物具有更好的抗肿瘤活性,同时保持了与木犀草素相似的自由基清除活性,含苯基的衍生物显著降低了其抗增殖活性和清除自由基的活性[16]。5-酰基和7-酰基衍生物具有比木犀草素更强的DAT激动剂活性,尤其是化合物5d的DAT激动剂活性是木犀草素的32倍,有望作为治疗精神疾病的药物进一步开发[24]。木犀草素的羟基与磷酸生成酯水溶性增强[21]。木犀草素的C5-OH与卤代烃反应生成的醚具有抑制黑色素瘤作用[27]。木犀草素的C7-OH与胺类反应生成的醚具有很好的抗菌活性[30]。木犀草素的C4=O的氧被硫取代具有很好的抗乳腺癌的活性[37]。木犀草素的C-8位被甲氨基取代抗流感和抗炎效果一般,抗癌效果显著[41-43]。木犀草素的配合物具有抗癌活性,钒配合物效果最好[48,54-56]。
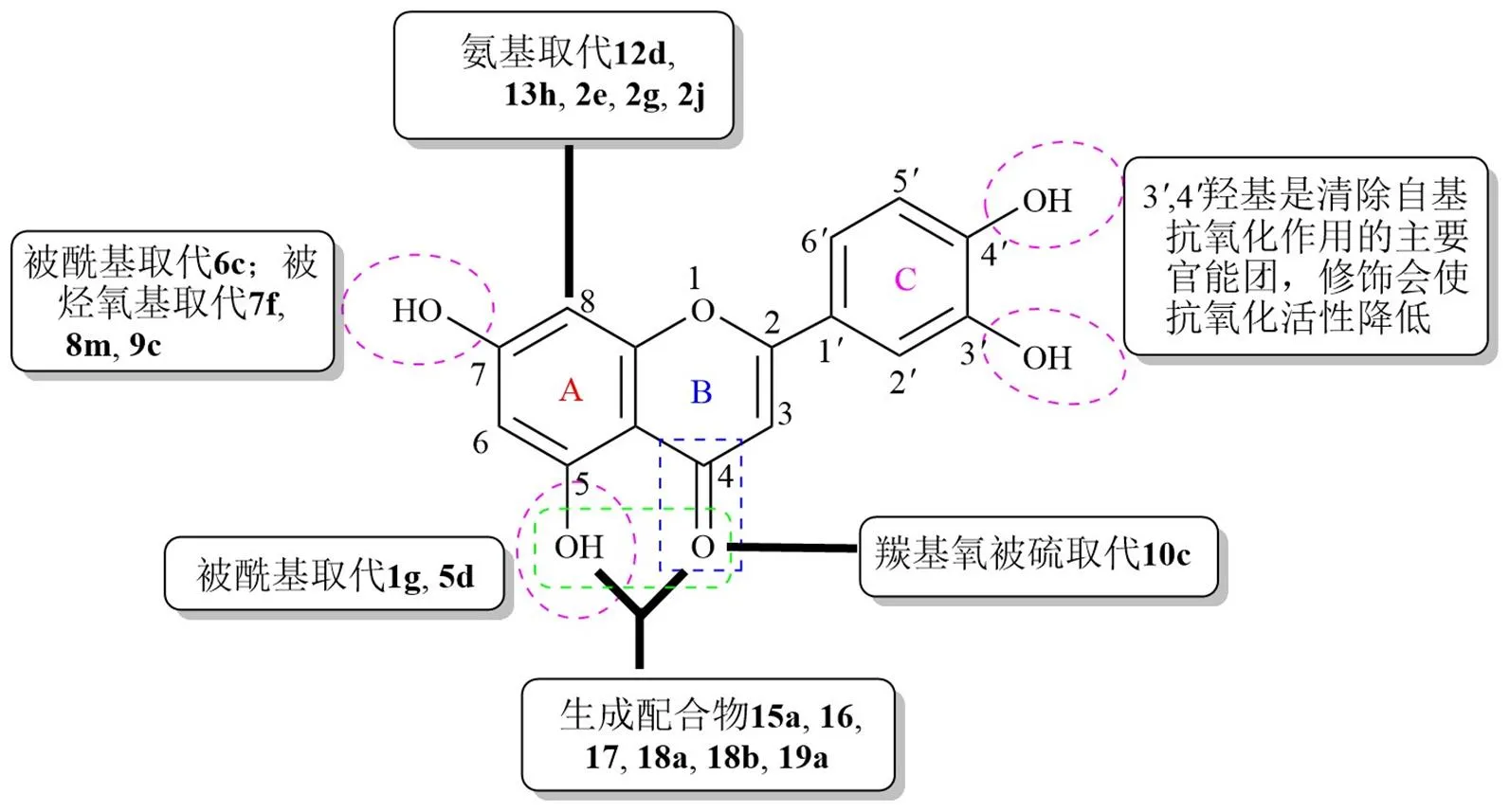
图21 具有较好活性的木犀草素衍生物
3 结语与展望
大量流行病学研究表明,黄酮类化合物的摄入与各种疾病的发生呈负相关,黄酮类化合物可与参与关键途径的酶系统相互作用,表现出多种药理学行为[60]。木犀草素是典型的类黄酮,是天然抗氧化剂,可直接淬灭活性氧,抑制酶反应,螯合金属离子(Fe3+、Cu+),清除自由基。人体内的氧化过程与一些疾病有关,如动脉粥样硬化、冠心病、某些肿瘤和衰老等。类黄酮是最常见、最具活性的食用抗氧化剂,脂溶性生育酚可以在疏水系统中显示其抗氧化能力,而类黄酮可以在亲水和疏水环境中发挥作用[61]。经常食用富含木犀草素的蔬菜水果有益人体健康,主要涉及疾病治疗和化学预防[62]。
木犀草素是一种有价值的天然黄酮类化合物,由于能够调节多种靶点和信号通路而得到了广泛研究。由于木犀草素的低溶解性和生物利用度限制了其应用。因此,设计和合成新的木犀草素衍生物来改变其局限性势在必行。目前,对木犀草素的结构进行优化修饰,已经合成了许多溶解性能好、生物利用度高的木犀草素衍生物,在抗癌、抗氧化、抗菌、抗炎、降糖等方面有许多优势,应用前景广阔。希望更多的研究者积极参与其中,使天然药物经过优化修饰后早日进入临床,发挥天然药物的作用,为患者解除痛苦。
利益冲突 所有作者均声明不存在利益冲突
[1] Punia Bangar S, Kajla P, Chaudhary V,. Luteolin: A flavone with myriads of bioactivities and food applications [J]., 2023, 52: 102366.
[2] Kim J K, Kang K A, Ryu Y S,. Induction of endoplasmic reticulum stress via reactive oxygen species mediated by luteolin in melanoma cells [J]., 2016, 36(5): 2281-2289.
[3] Aziz N, Kim M Y, Cho J Y. Anti-inflammatory effects of luteolin: A review of,, andstudies [J]., 2018, 225: 342-358.
[4] Vajdi M, Karimi A, Karimi M,. Effects of luteolin on sepsis: A comprehensive systematic review [J]., 2023, 113: 154734.
[5] Sangeetha R. Luteolin in the management of type 2 diabetes mellitus [J]., 2019, 7(2): 393-398.
[6] Prasher P, Sharma M, Singh S K,. Luteolin: A flavonoid with a multifaceted anticancer potential [J]., 2022, 22(1): 386.
[7] Çetinkaya M, Baran Y. Therapeutic potential of luteolin on cancer [J]., 2023, 11(3): 554.
[8] Tuorkey M J. Molecular targets of luteolin in cancer [J]., 2016, 25(1): 65-76.
[9] Huang L, Kim M Y, Cho J Y. Immunopharmacological activities of luteolin in chronic diseases [J]., 2023, 24(3): 2136.
[10] Boeing T, da Silva L M, Mariott M,. Diuretic and natriuretic effect of luteolin in normotensive and hypertensive rats: Role of muscarinic acetylcholine receptors [J]., 2017, 69(6): 1121-1124.
[11] 黄龙岳, 宁洪鑫, 姚薛超, 等. 木犀草素提取和纯化工艺的研究进展 [J]. 中草药, 2021, 52(4): 1185-1192.
[12] 姚薛超, 宁洪鑫, 黄欢, 等. 木犀草素制剂的研究进展 [J]. 中草药, 2021, 52(3): 873-882.
[13] Juszczak A M, Wöelfle U, Končić M Z,. Skin cancer, including related pathways and therapy and the role of luteolin derivatives as potential therapeutics [J]., 2022, 42(4): 1423-1462.
[14] Wen G, Liu Q, Hu H B,. Design, synthesis, biological evaluation, and molecular docking of novel flavones as H3R inhibitors [J]., 2017, 90(4): 580-589.
[15] Zuo Q, Wu R Y, Xiao X,. The dietary flavone luteolin epigenetically activates the Nrf2 pathway and blocks cell transformation in human colorectal cancer HCT116 cells [J]., 2018, 119(11): 9573-9582.
[16] Lo S, Leung E, Fedrizzi B,. Syntheses of mono-acylated luteolin derivatives, evaluation of their antiproliferative and radical scavenging activities and implications on their oral bioavailability [J]., 2021, 11(1): 12595.
[17] Slusarczyk M, Lopez M H, Balzarini J,. Application of ProTide technology to gemcitabine: A successful approach to overcome the key cancer resistance mechanisms leads to a new agent (NUC-1031) in clinical development [J]., 2014, 57(4): 1531-1542.
[18] Li Y Q, Yang F, Wang L,. Phosphoramidate protides of five flavones and their antiproliferative activity against HepG2 and L-O2 cell lines [J]., 2016, 112: 196-208.
[19] Fischer F, Zufferey E, Bourgeois J M,. UV-ABC screens of luteolin derivatives compared to edelweiss extract [J]., 2011, 103(1): 8-15.
[20] Wei Y L, Peng A Y, Wang B,. Synthesis and biological evaluation of phosphorylated flavonoids as potent and selective inhibitors of cholesterol esterase [J]., 2014, 74: 751-758.
[21] Osonga F J, Le P, Luther D,. Water-based synthesis of gold and silver nanoparticles with cuboidal and spherical shapes using luteolin tetraphosphate at room temperature [J].:, 2018, 5(4): 917-932.
[22] Tsai H Y, Chen M Y, Hsu C,. Luteolin phosphate derivatives generated by cultivatingvar. natto BCRC 80517 with luteolin [J]., 2022, 70(28): 8738-8745.
[23] Niesler B, Weiss B, Fischer C,. Serotonin receptor genevariants in schizophrenic and bipolar affective patients [J]., 2001, 11(1): 21-27.
[24] Zhang J G, Liu X B, Lei X S,. Discovery and synthesis of novel luteolin derivatives as DAT agonists [J]., 2010, 18(22): 7842-7848.
[25] Lawrence M S, Stojanov P, Polak P,. Mutational heterogeneity in cancer and the search for new cancer-associated genes [J]., 2013, 499(7457): 214-218.
[26] Choi M Y, Song H S, Hur H S,. Whitening activity of luteolin related to the inhibition of cAMP pathway in alpha-MSH-stimulated B16 melanoma cells [J]., 2008, 31(9): 1166-1171.
[27] Yamauchi K, Fujieda A, Mitsunaga T. Selective synthesis of 7--substituted luteolin derivatives and their melanonenesis and proliferation inhibitory activity in B16 melanoma cells [J]., 2018, 28(14): 2518-2522.
[28] Basile A, Giordano S, López-Sáez J A,. Antibacterial activity of pure flavonoids isolated from mosses [J]., 1999, 52(8): 1479-1482.
[29] Ramesh N, Viswanathan M B, Saraswathy A,. Phytochemical and antimicrobial studies of[J]., 2002, 79(1): 129-132.
[30] Lv P C, Li H Q, Xue J Y,. Synthesis and biological evaluation of novel luteolin derivatives as antibacterial agents [J]., 2009, 44(2): 908-914.
[31] Asano N. Glycosidase inhibitors: Update and perspectives on practical use [J]., 2003, 13(10): 93R-104R.
[32] Hanhineva K, Törrönen R, Bondia-Pons I,. Impact of dietary polyphenols on carbohydrate metabolism [J]., 2010, 11(4): 1365-1402.
[33] Ryu H W, Lee B W, Curtis-Long M J,. Polyphenols fromdisplaying potent alpha-glucosidase inhibition [J]., 2010, 58(1): 202-208.
[34] Cheng N, Yi W B, Wang Q Q,. Synthesis and-glucosidase inhibitory activity of chrysin, diosmetin, apigenin, and luteolin derivatives [J]., 2014, 25(7): 1094-1098.
[35] Carmeliet P, Jain R K. Angiogenesis in cancer and other diseases [J]., 2000, 407(6801): 249-257.
[36] Pratheeshkumar P, Son Y O, Budhraja A,. Luteolin inhibits human prostate tumor growth by suppressing vascular endothelial growth factor receptor 2-mediated angiogenesis [J]., 2012, 7(12): e52279.
[37] Ravishankar D, Watson K A, Boateng S Y,. Exploring quercetin and luteolin derivatives as antiangiogenic agents [J]., 2015, 97: 259-274.
[38] Li J F, Wang L S, Bai H Q,. Synthesis and structure characterization of novel luteolin derivatives [J]., 2010, 46(5): 716-718.
[39] Iuliano A D, Roguski K M, Chang H H,. Estimates of global seasonal influenza-associated respiratory mortality: A modelling study [J]., 2018, 391(10127): 1285-1300.
[40] Zima V, Radilová K, Kožíšek M,. Unraveling the anti-influenza effect of flavonoids: Experimental validation of luteolin and its congeners as potent influenza endonuclease inhibitors [J]., 2020, 208: 112754.
[41] Reiberger R, Radilová K, Kráľ M,. Synthesis andevaluation of C-7 and C-8 luteolin derivatives as influenza endonuclease inhibitors [J]., 2021, 22(14): 7735.
[42] 任杰, 潘莎莎, 程虹, 等. 木犀草素Mannich碱衍生物的合成及其抗癌活性 [J]. 中国新药杂志, 2011, 20(8): 743-747.
[43] 周美荣, 李颖, 窦后松, 等. 8-氨甲基取代木犀草素衍生物的合成和抗炎活性研究 [J]. 化学研究与应用, 2008, 20(1): 10-15.
[44] Peng Y, Chen S H, Liu X N,. Efficacy of different antidiabetic drugs based on metformin in the treatment of type 2 diabetes mellitus: A network Meta-analysis involving eight eligible randomized-controlled trials [J]., 2019, 234(3): 2795-2806.
[45] Jin D X, He J F, Luo X G,. Hypoglycemic effect ofChoisy extracts on type 2 diabetes by regulating glucolipid metabolism and modulating gut microbiota [J]., 2019, 52: 479-491.
[46] Ge X D, Wang C E, Chen H L,. Luteolin cooperated with metformin hydrochloride alleviates lipid metabolism disorders and optimizes intestinal flora compositions of high-fat diet mice [J]., 2020, 11(11): 10033-10046.
[47] Farrokhian A, Mahmoodian M, Bahmani F,. The influences of chromium supplementation on metabolic status in patients with type 2 diabetes mellitus and coronary heart disease [J]., 2020, 194(2): 313-320.
[48] Ge X D, He X Y, Lin Z S,. 6,8-(1,3-diaminoguanidine) luteolin and its Cr complex show hypoglycemic activities and alter intestinal microbiota composition in type 2 diabetes mice [J]., 2022, 13(6): 3572-3589.
[49] Fu Y J, Zu Y G, Liu W,. Optimization of luteolin separation from[(L.) Millsp.] leaves by macroporous resins [J]., 2006, 1137(2): 145-152.
[50] Kure A, Nakagawa K, Kondo M,. Metabolic fate of luteolin in rats: Its relationship to anti-inflammatory effect [J]., 2016, 64(21): 4246-4254.
[51] Dong H, Yang X C, He J P,. Enhanced antioxidant activity, antibacterial activity and hypoglycemic effect of luteolin by complexation with manganese(ii) and its inhibition kinetics on xanthine oxidase [J]., 2017, 7(84): 53385-53395.
[52] Shih Y L, Liu H C, Chen C S,. Combination treatment with luteolin and quercetin enhances antiproliferative effects in nicotine-treated MDA-MB-231 cells by down-regulating nicotinic acetylcholine receptors [J]., 2010, 58(1): 235-241.
[53] Islas M S, Naso L G, Lezama L,. Insights into the mechanisms underlying the antitumor activity of an oxidovanadium (IV) compound with the antioxidant naringenin. Albumin binding studies [J]., 2015, 149: 12-24.
[54] Naso L G, Lezama L, Valcarcel M,. Bovine serum albumin binding, antioxidant and anticancer properties of an oxidovanadium (IV) complex with luteolin [J]., 2016, 157: 80-93.
[55] 沙靖全, 李敬芬, 闫红. 木犀草素缩磺胺甲恶唑席夫碱及金属配合物的研究 [J]. 黑龙江医药科学, 2005, 28(4): 8-9.
[56] 张宇, 王朝兴, 沙靖全, 等. 磺化木犀草素金属配合物的合成及抗氧化、抗菌活性研究 [J]. 分子科学学报, 2012, 28(6): 490-494.
[57] Hussain S P, Harris C C. Inflammation and cancer: An ancient link with novel potentials [J]., 2007, 121(11): 2373-2380.
[58] Al-Megrin W A, Alkhuriji A F, Yousef A O S,. Antagonistic efficacy of luteolin against lead acetate exposure-associated with hepatotoxicity is mediated via antioxidant, anti-inflammatory, and anti-apoptotic activities [J]., 2019, 9(1): 10.
[59] Tawornchat P, Pattarakankul T, Palaga T,. Polymerized luteolin nanoparticles: Synthesis, structure elucidation, and anti-inflammatory activity [J]., 2021, 6(4): 2846-2855.
[60] Wang T Y, Li Q, Bi K S. Bioactive flavonoids in medicinal plants: Structure, activity and biological fate [J]., 2018, 13(1): 12-23.
[61] Lesjak M, Beara I, Simin N,. Antioxidant and anti-inflammatory activities of quercetin and its derivatives [J]., 2018, 40: 68-75.
[62] Quideau S, Deffieux D, Douat-Casassus C,. Plant polyphenols: Chemical properties, biological activities, and synthesis [J]., 2011, 50(3): 586-621.
Research progress on structural modification and biological activity of luteolin
JIANG Ya-ling, LI Wen-yuan, FENG Shuang, LIU Jin-hai, ZHAI Guang-yu
Engineering Research Center for Water Environment and Health of Henan, College of Pharmacy andChemical Engineering, Zhengzhou University of Industrial Technology, Zhengzhou 451150, China
Luteolin is a flavonoid, a natural antioxidant, with rich biological activities, which can regulate many intracellular and extracellular signaling pathways related to disease progression, and has antioxidant, anti-inflammatory, anti-diabetic, anti-cancer and other effects. Due to the low solubility and low bioavailability, the clinical application is limited. However, luteolin’s low relative molecular weight and easily modified chemical groups make it attractive for drug development. Therefore, the structural modification of luteolin and the biological activities of its derivatives were reviewed to provide reference for the research, development and utilization of natural products.
luteolin; structural modification; derivatives; flavonoids; biological activity
R282.710.85
A
0253 - 2670(2023)20 - 6889 - 14
10.7501/j.issn.0253-2670.2023.20.032
2023-04-25
郑州市高等学校名师技术技能工作室(郑教高[2015] 70号);河南省科技攻关项目(232102310391)
姜亚玲,女,副教授,从事天然产物提取和结构优化研究。E-mail: 240398169@qq.com
通信作者:翟广玉,男,教授,主要从事天然产物结构优化。E-mail: zhaiguangyu1@sina.com
[责任编辑 赵慧亮]
