山豆根抗肿瘤活性成分及其作用机制研究进展
2023-10-19张胜利王超众闫广利王喜军
张胜利,王超众,闫广利,孙 晖,王喜军
·综 述·
山豆根抗肿瘤活性成分及其作用机制研究进展
张胜利,王超众,闫广利,孙 晖,王喜军*
黑龙江中医药大学国家中医药管理局中医方证代谢组学研究中心,黑龙江 哈尔滨 150040
山豆根et来源于豆科植物越南槐的干燥根和根茎,具有清热解毒、消肿利咽之功效,其化学成分复杂,药理活性多样。现代研究证明,山豆根中生物碱类、黄酮类、苯并呋喃类、三萜类、多糖类等化合物能抑制肿瘤细胞的增殖、黏附、侵袭和转移,诱导细胞凋亡和自噬,抑制肿瘤血管生成,阻滞细胞周期和信号转导,还可通过提高机体免疫功能,抑制肿瘤的发生发展,对不同类型的恶性肿瘤均有良好的拮抗作用,具有多成分、多靶点、多通路的特点。通过对山豆根抗肿瘤活性成分及其作用机制进行综述,为山豆根抗肿瘤的深入研究和新药开发提供参考依据。
山豆根;生物碱类;黄酮类;苯并呋喃类;三萜类;多糖类;抗肿瘤;高丽槐素;氧化苦参碱;木犀草素
恶性肿瘤是世界第2大致死疾病,在全球范围内的发病率和死亡率居高不下,2020年全球有1930万新发肿瘤患者和近1000万死亡病例[1],在我国的患病率为23.7%[2]。恶性肿瘤的病因病机复杂,受DNA突变、衰老、肥胖、炎症反应、不良生活方式和外部环境等内外因素的影响[3],其中吸烟、饮酒和高体质量指数是导致全球癌症死亡的主要因素[4]。目前临床上主要采取手术、放化疗、靶向和免疫疗法等对恶性肿瘤进行综合治疗,其中药物治疗尤为重要,但存在不良反应大、易产生耐药性、患者生存率低、费用高昂等弊端[5-6]。因此,迫切需要新的抗肿瘤疗法和新的抗肿瘤药物。
恶性肿瘤属于中医学“岩”“癥瘕”“痈疽”等范畴,其发生发展与热毒蕴积密切相关[7]。清热解毒类中药常用于肿瘤治疗,是中医防治癌症的重要组成部分[8],如西黄丸、片仔癀等制剂及蒲公英、半枝莲等中药,具有抑制增殖、抗突变、调节免疫等多机制抗癌特点[9-11]。研究表明,中医药在抗肿瘤方面具有增效减毒、减少术后复发、改善生命质量、延长生存期的预防与治疗优势,已从其中发现并开发了许多有效的抗癌药物[12],中西药结合治疗还能弥补化学药抗肿瘤的不足[13-14]。
清热解毒类中药山豆根又称广豆根、壤笃岜,是广西道地药材之一,来源于豆科植物越南槐Gagnep.的干燥根和根茎[15],“山豆根”之名首载于宋代《开宝本草》[16]。现代药理学研究表明山豆根具有良好的抗肿瘤活性,可通过多成分、多靶点、多途径抑制肿瘤细胞增殖、分化、迁移和诱导凋亡,对多种类型的恶性肿瘤均有较好的抗癌效果,具有较高的药用研究价值。现对山豆根抗肿瘤活性成分及其作用机制的研究现状进行总结,为后续山豆根抗肿瘤作用及其抗癌新药物的进一步开发研究提供实验依据与理论参考。
1 抗肿瘤主要成分
山豆根所含成分丰富,根据研究分析,山豆根的抗肿瘤药理活性成分主要集中在生物碱类、黄酮类、苯并呋喃类[17]、三萜类、多糖类[18]等成分,其中生物碱类抗肿瘤成分类型主要为喹诺里西啶类(1~7)[19],黄酮类成分以二氢黄酮(8~10)和黄酮醇(11、12)为主[20],三萜类成分多为齐墩果烷型(21、22)[21],山豆根的水提物、醇提物、氯仿提取物等也具有一定的抗肿瘤作用[22]。山豆根主要化学成分为氧化苦参碱(0.79~14.19 mg/g)、苦参碱(0.25~9.62 mg/g)、氧化槐果碱(0.24~3.27 mg/g)、金雀花碱(0.46~1.55 mg/g)、三叶豆紫檀苷(0.56~2.26 mg/g)、高丽槐素(0.40~1.51 mg/g)、山豆根素(1.63~5.85 mg/g)、越南槐醇(0.79~2.87 mg/g)等,但高丽槐素和山豆根素等成分的极性较小、水溶性较差,且部分成分如山豆根色烯素(0.05~0.68 mg/g)、槲皮素(0.18~0.57 mg/g)、芒柄花素(0.02~0.10 mg/g)的含量较低,使生物利用度降低[23-28]。氧化苦参碱等生物碱及其代谢成分还可能导致机体损伤[29],在一定程度上限制了山豆根的抗癌活性,但在安全剂量下,借助于新型给药系统等现代技术,其抗肿瘤作用仍值得深入研究。山豆根抗肿瘤的主要活性成分见表1和图1。
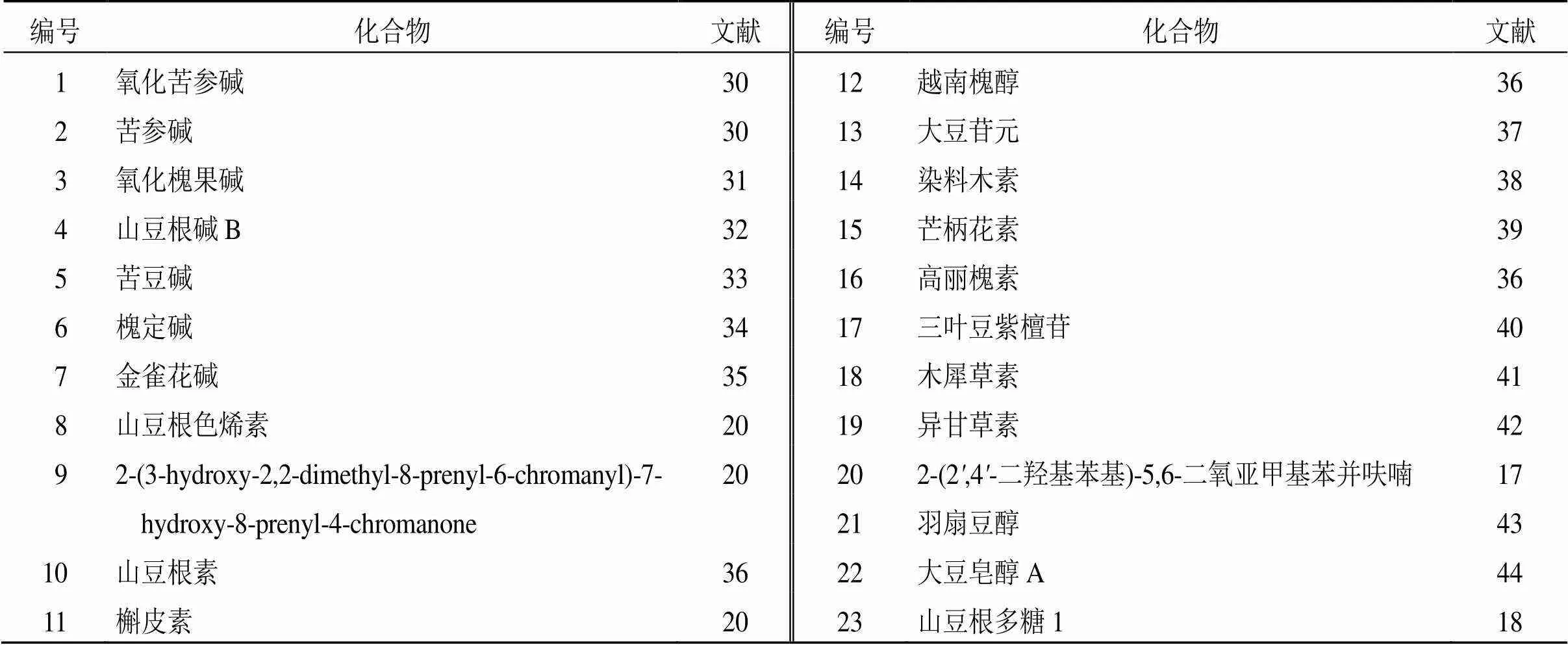
表1 山豆根抗肿瘤主要活性成分
2 抗肿瘤作用
2.1 抗鼻咽癌
鼻咽癌是一种发生于鼻咽部黏膜上皮的头颈部恶性肿瘤,在我国南方地区高发[45]。Ying等[46]使用芒柄花素10、20、40 μmol/L处理人鼻咽癌CNE-2细胞48 h,呈剂量相关性抑制细胞增殖和侵袭,其机制与细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)和核纤层蛋白A/C通路有关。苏雯清等[47]发现,高丽槐素对CNE-1细胞24、48、72 h的半数抑制浓度(half maximal inhibitory concentration,IC50)为133.31、35.52、13.84 μmol/L,抑制增殖和诱导凋亡的机制可能是抑制抑癌基因、细胞周期依赖激酶抑制剂、成纤维细胞生长因子、磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,)、丝裂原活化蛋白激酶8(mitogen-activated protein kinase 8,)等基因的表达。Jiang等[48]分别对高丽槐素和三叶豆紫檀苷进行抗癌研究,结果表明高丽槐素10、20 μmol/L可下调细胞周期蛋白D1(Cyclin D1)、细胞周期依赖性激酶4/6(cyclin-dependent kinase 4/6,CDK 4/6)表达,上调p21、p16表达,将细胞周期阻滞于G0/G1期,高丽槐素体内外均可抑制MAPK/Ras通路,进而抑制CNE-1、CNE-2细胞增殖并诱导凋亡。三叶豆紫檀苷20、40、80 μmol/L可阻滞细胞周期于G0/G1期,及体内注射三叶豆紫檀苷40 mg/kg均能通过抑制PI3K/蛋白激酶B(protein kinase B,Akt)通路抑制人鼻咽癌6-10B、HK1细胞增殖、迁移和侵袭[49]。Wang等[50]使用山豆根氯仿提取物25、50 μg/mL可抑制β-连环蛋白(β-catenin)、波形蛋白、果蝇蜗牛同源蛋白(Snail)而减少细胞迁移侵袭;下调Cyclin D1/B1、CDK4/6水平,将细胞周期阻滞于G1/S期;通过沉默PI3K/Akt/雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路,抑制CNE-1、CNE-2细胞增殖和克隆形成,诱导凋亡,且药物无明显毒性作用。

图1 山豆根抗肿瘤主要活性成分的化学结构
2.2 抗肺癌
肺癌是世界范围内导致死亡的主要原因[51]。路海滨等[52]发现山豆根多糖100、200、400 mg/kg能升高Lewis肺癌小鼠的胸腺指数、CD4+、CD8+T细胞水平及其比值,并提高血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、血管内皮生长因子(vascular endothelial growth factor,VEGF)水平,从而增强免疫力,抑制肿瘤细胞生长。李宜鲜等[53]研究表明,山豆根乙醇提取物100、200、400 mg/kg均可下调Lewis肺癌小鼠的白细胞介素-10(interleukin-10,IL-10)、IL-6,而上调IL-2、TNF-α、γ干扰素水平来增强免疫,降低VEGF、缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)、基质金属蛋白酶2(matrix metalloproteinases 2,MMP2),而升高血管抑素、内皮抑素水平,抑制肿瘤血管的内皮细胞增殖和迁移,进而抑制血管生成。有研究指出,山豆根更适合于治疗非小细胞型肺癌[54]。张奇峰[55]证明山豆根水提物可呈剂量相关性抑制人肺癌A549细胞增殖,并阻碍细胞周期于G0/G1期,还能下调B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)而上调Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)水平,促进细胞凋亡。Xu等[56]发现金雀花碱可抑制A549细胞、人肺癌NCI-H23、NCI-H460细胞增殖,IC50分别为26.83、42.79和32.45 μmol/L,通过增加活性氧水平,进而抑制Akt通路使细胞周期停滞于G2/M期,调节MAPK/信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)/核因子-κB(nuclear factor-κB,NF-κB)途径诱导A549细胞凋亡,同时金雀花碱10 mg/kg可显著抑制荷A549细胞裸鼠的肿瘤生长,并优于同剂量的5-氟尿嘧啶。
2.3 抗肝癌
肝癌是我国最常见的五大癌症之一[57]。Zhou等[58]研究表明,苦参碱0.5 mg/mL可显著降低双微体癌基因2(murine double minute 2,)的mRNA表达,并下调凋亡抑制因子3(inhibitor of apoptosis 3,IAP3)的水平,通过抑制MDM2/IAP3途径引起缺陷型人肝癌Hep3B细胞的凋亡。彭百承等[59]发现ig山豆根颗粒与其饮片20 mL/kg,体内抗肿瘤作用相当,均可提高细胞因子TNF-α、γ干扰素、IL-2含量,从而增强免疫功能,抑制小鼠肝癌腹水瘤H22、实体瘤S180的生长。曹洛云等[60]证明含有氧化苦参碱、苦参碱、氧化槐果碱等的山豆根生物碱组分抗癌机制与环磷酰胺类似,通过上调肿瘤抑制蛋白张力蛋白同源物(phosphatase and tensin homolog deleted on chromosome ten,)mRNA水平,抑制、mRNA表达而改善二乙基亚硝胺诱导肝癌大鼠的免疫调节,延长生存时间。Chui等[61]发现加入5%、10%体积山豆根水提物,能抑制人肝癌HepG2、Hep3B细胞,人乳腺癌MDA-MB-231细胞,A549细胞和人急性髓系白血病KG-1细胞的增殖,并诱导凋亡,其中HepG2细胞中的半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)被激活,导致DNA片段化而促进凋亡。Zhao等[62]成功构建成纤维生长因子受体1(fibroblast growth factor receptor 1,FGFR1)过表达的肝癌细胞,氧化槐果碱可通过下调FGFR1表达及抑制下游Akt/mTOR和ERK信号通路,提高FGFR1过表达肝癌细胞对乐伐替尼的敏感性,结果表明二者联合用药可逆转肝癌细胞耐药性,增强乐伐替尼的治疗效果。彭湘君[63]发现,山豆根多糖SSA对人肝癌SMMC-7721细胞的IC50为862 μg/mL,能抑制集落形成,并诱导早期凋亡,但缺乏体内实验验证。
2.4 抗乳腺癌
2020年乳腺癌成为全球第一大癌,也是我国女性最常见的癌症类型[64]。其中三阴性乳腺癌治疗难度大,占总病例的15%~20%[65]。Peng等[66]对山豆根中具有Cytisine-Pterocarpan新骨架化合物山豆根碱B进行仿生合成,并证明其能有效抑制MDA-MB-231细胞的活性,IC50为19.2 μmol/L,通过介导线粒体凋亡途径,上调Bax/Bcl-2,促进细胞色素C从线粒体向细胞质释放,从而诱导细胞凋亡。Sun等[67]发现山豆根碱B 200 μmol/L可显著抑制MDA-MB-231细胞、小鼠乳腺癌4T1细胞,其IC50为(71.2±6.5)、(56.0±4.4)μmol/L,对小鼠成纤维L-929细胞和RAW264.7细胞的毒性低;不同浓度的山豆根碱B能使MDA-MB-231细胞线粒体膜电位下降,ATP合成丧失,活性氧升高,上调Bax/Bcl-2、Caspase-3/9,下调Akt磷酸化水平,通过线粒体功能障碍和PI3K/Akt通路失活诱导癌细胞凋亡。微小RNA-374a(microRNA-374a,)能促进乳腺癌的转移与进展,且与不良预后有关[68]。Peng等[69]发现高丽槐素可显著抑制MDA-MB-231细胞和人乳腺癌BT549细胞的增殖、集落形成、上皮-间质转化(epithelial-mesenchymal transition,EMT)和体内肿瘤生长,其IC50分别为25.24、20.99 μmol/L,通过下调,促进生长阻滞和DNA损伤诱导45A(growth arrest and DNA damage-induced 45A,GADD45A)表达,诱导细胞凋亡。韦立群等[70-71]多项研究表明,染料木素可抑制表皮生长因子受体(epidermal growth factor receptor,EGFR)/PI3K/Akt与NF-κB和MAPK通路诱导乳腺癌细胞凋亡。
2.5 抗白血病
白血病是儿童中最常见的癌症[72]。Kajimoto等[73]发现,山豆根素可靶向作用于线粒体,在线粒体外以Ca2+依赖的方式诱导活性氧的产生,破坏线粒体膜,山豆根素也可能直接作用于线粒体,诱导线粒体通透性转换孔开放,从而诱导白血病U937细胞凋亡,抑制增殖和诱导凋亡的IC50分别为(3.8±0.6)、(21.5±1.2)μmol/L,对细胞周期没有影响。Tetik Vardarlı等[74]证明苦参碱2.5、3.0 mg/mL可抑制人急性T淋巴细胞白血病CCRF-CEM细胞生长,24、48、72 h的IC50分别为2.898、2.400、2.390 mg/mL,苦参碱2.4 mg/mL可显著诱导癌细胞凋亡,通过下调而上调细胞周期蛋白依赖性激酶抑制因子1A(cyclin dependent kinase inhibitor 1A,CDKN1A)表达,导致细胞周期停滞于G0/G1期。Lin等[75]发现苦参碱可有效抑制人白血病K562、HL-60细胞增殖,48 h的IC50均为0.5 mg/mL,通过抑制骨髓细胞瘤病毒癌基因(cellular-myelocytomatosis viral oncogene,)活性而下调己糖激酶2(hexokinase 2,HK2)表达,从而抑制Warburg效应,促进凋亡,同时HK2负调节Bcl-2/Bcl-xL相关凋亡蛋白拮抗苦参碱诱导的凋亡,苦参碱在体内外均可提高HK2抑制剂氯尼达明治疗白血病的疗效。自噬与肿瘤发生发展密切相关[76]。林泽[77]使用7种喹诺里西啶类生物碱对多种癌细胞株进行体外研究,其中苦豆碱抑癌作用最佳,对HL-60细胞48 h的IC50为(0.040±0.001)mmol/L,苦豆碱0.02 mmol/L作用48 h可显著诱导该细胞凋亡,同时0.05 mmol/L作用18 h引起约50% HL-60细胞自噬,具有剂量相关性。罗有红[19]进一步研究证明,山豆根中喹诺里西啶类生物碱在人白血病K562细胞中的联合效应与凋亡有关,能有效抑制mTOR的表达从而激活细胞自噬。
2.6 抗黑色素瘤
黑色素瘤在青少年中发病率位居第一[72]。Zhang等[78]通过体外细胞实验表明,山豆根水提物对小鼠黑色素瘤B16-BL6细胞增殖呈剂量相关性,并能显著抑制癌细胞与层黏连蛋白的黏附,阻止癌细胞的侵袭和转移。李俊兰等[79]发现山豆根提取物500、600、700、800 μg/mL可抑制B16-BL6细胞的增殖、黏附、侵袭和转移,且呈剂量相关性,其作用机制仍需进一步研究。Jin等[80]发现苦参碱能激活而导致PI3K/Akt通路受到拮抗,从而抑制携带V600EBRAF突变的人黑色素瘤M21细胞的生长与增殖,其IC50为(0.769±0.280)mg/mL,并通过上调Caspase-3和Bax/Bcl-2表达触发细胞凋亡,激活p21和抑制Cyclin D阻滞细胞周期在G0/G1期,M21细胞中MAPK途径的关键成分(ERK1、ERK2和p-ERK1/2)及人黑色素瘤A375细胞中的未受到明显影响。Kim等[81]研究表明,木犀草素对人皮肤癌A2058细胞的IC50为35 μg/mL,通过增加活性氧水平诱导内质网应激(endoplasmic reticulum stress,ERS),引起瘤细胞凋亡。Li等[82]在发现木犀草素5、10、20 μmol/L对A375细胞、小鼠皮肤黑色素瘤B16-F10细胞的活力无显著影响,证实木犀草素可通过抑制HIF-1α/VEGF通路阻止细胞血管形成和转移。Peng等[83]证实槲皮素75 mg/kg抑制体内肿瘤生长效果最佳,能激活视黄酸诱导基因-Ⅰ(retinoic acid-inducible gene-I,RIG-Ⅰ),导致干扰素调节因子7磷酸化,诱导I型干扰素(type I interferons,IFN-Ⅰ)产生,进而激活Janus激酶1(Janus kinase 1,JAK1)/STAT1通路,形成干扰素/JAK/STAT正反馈循环,增强抗肿瘤作用。
2.7 抗宫颈癌
宫颈癌是女性常见癌症之一[84]。Chen等[85]实验证明,染料木素100 μmol/L能通过下调黏着斑激酶(focal adhesion kinase,FAK)与桩蛋白表达,抑制p38与p42/44的磷酸化,降低和的mRNA表达,抑制人宫颈癌HeLa细胞的迁移和侵袭,机制与FAK/桩蛋白和MAPK通路有关。张冬丽等[86]研究表明,氧化苦参碱0.4、0.8、1.6 g/L可将人宫颈癌SiHa细胞阻滞在G1期,抑制β-catenin而使Cyclin D1表达降低,上调Bax的同时下调Bcl-2表达水平,从而抑制细胞增殖并诱导细胞凋亡,其机制可能与抑制Wnt/β-catenin信号通路有关,还有待深入详细验证。胡焕焕等[87]发现大豆苷元10、40、80 μmol/L能下调HeLa细胞的mRNA表达,从而抑制细胞增殖,且呈剂量相关性。Lin等[88]发现高水平的泛素结合酶E2S(ubiquitin-conjugating enzyme 2S,UBE2S)可通过EMT信号传导而促进癌细胞迁移和侵袭,并且UBE2S与希佩尔林道肿瘤抑制因子负相关,与HIF-1α正相关,木犀草素和槲皮素能逆转UBE2S的过表达,达到抑制宫颈癌细胞转移的目的。王慧玲等[89]体外实验证明,槲皮素20、40、80 μmol/L可显著降低人宫颈癌C-33A细胞内的p-JAK2/JAK2、p-STAT3/ STAT3水平,表明槲皮素可通过阻断JAK2/STAT3通路,抑制增殖并诱导细胞凋亡,并阻滞细胞周期于G1/S期,具有时间-剂量相关性。
2.8 抗其他肿瘤
韦正等[90]基于生物信息学对山豆根中紫檀烷类化合物对抗头颈部鳞状细胞癌的作用机理进行了预测,但缺乏药理活性验证。山豆根对其他类型的恶性肿瘤也具有一定的抗癌作用,见表2。
3 山豆根抗肿瘤的临床应用
作为我国常用的抗癌中药之一,山豆根及其复方制剂被广泛应用于临床多种癌症的治疗和辅助治疗,具有较好的疗效。在早期临床探索中就已发现,山豆根浸膏片或其注射液联合喜树碱能有效治疗膀胱癌[102]。由山豆根等10味药组成的鼻咽灵片可用于鼻咽癌的辅助治疗,李济培等[103]在鼻咽癌放疗时口服鼻咽灵片配合治疗,发现鼻咽灵片不影响放疗效果,且能显著减轻放疗引起的口腔黏膜和皮肤损伤等急性反应,提高患者的生存质量,没有明显的肝肾功能损伤等不良反应。山豆根是广谱抗癌药安康欣胶囊的组方药材之一,可协同化疗药物发挥增效减毒疗效,调节肿瘤标记物水平,增强免疫功能,改善癌症患者生活质量,安全性和有效性高[104-105]。山豆根中的苦参碱和氧化苦参碱成分已被开发成新药针剂,在临床用于治疗多种癌症。陈伦宽等[106]使用复方苦参碱注射液联合健脾理气方能有效改善晚期原发性肝癌患者肝功能,治疗效果较佳。措毛吉等[107]采用苦参碱注射液辅助宫颈癌化疗,能增加化疗敏感性,延缓肿瘤进展和免疫功能下降,增加临床获益。刘群等[108]总结分析了苦参碱注射液能够通过静脉滴注同步辅助化疗,治疗多种实体瘤和血液系统疾病,用药剂量为30~320 mg/d。复方木鸡颗粒是在满族民间验方“木鸡汤”基础上增加山豆根和菟丝子而得,能够特异性抑制肝癌标志物甲胎蛋白的升高[109]。秦妍等[110]基于微流控芯片技术,明确了复方木鸡颗粒抗肝癌的7个药效成分,其中木犀草素和槲皮素可能来源于山豆根,有待进一步验证。增生平是由山豆根等6味药制得的纯中药制剂,临床证明其对肿瘤有很好的化学预防作用[111]。Bui等[112]筛选出增生平对人口腔鳞癌SCC-9、Cal-27细胞的4个关键活性成分(苦参碱、白鲜碱、梣酮、高丽槐素),但因首过效应口服生物利用度均较低,并首次报道ip增生平500 mg/kg在小鼠唾液中大量分泌苦参碱和白鲜碱,且与血液中含量相当。
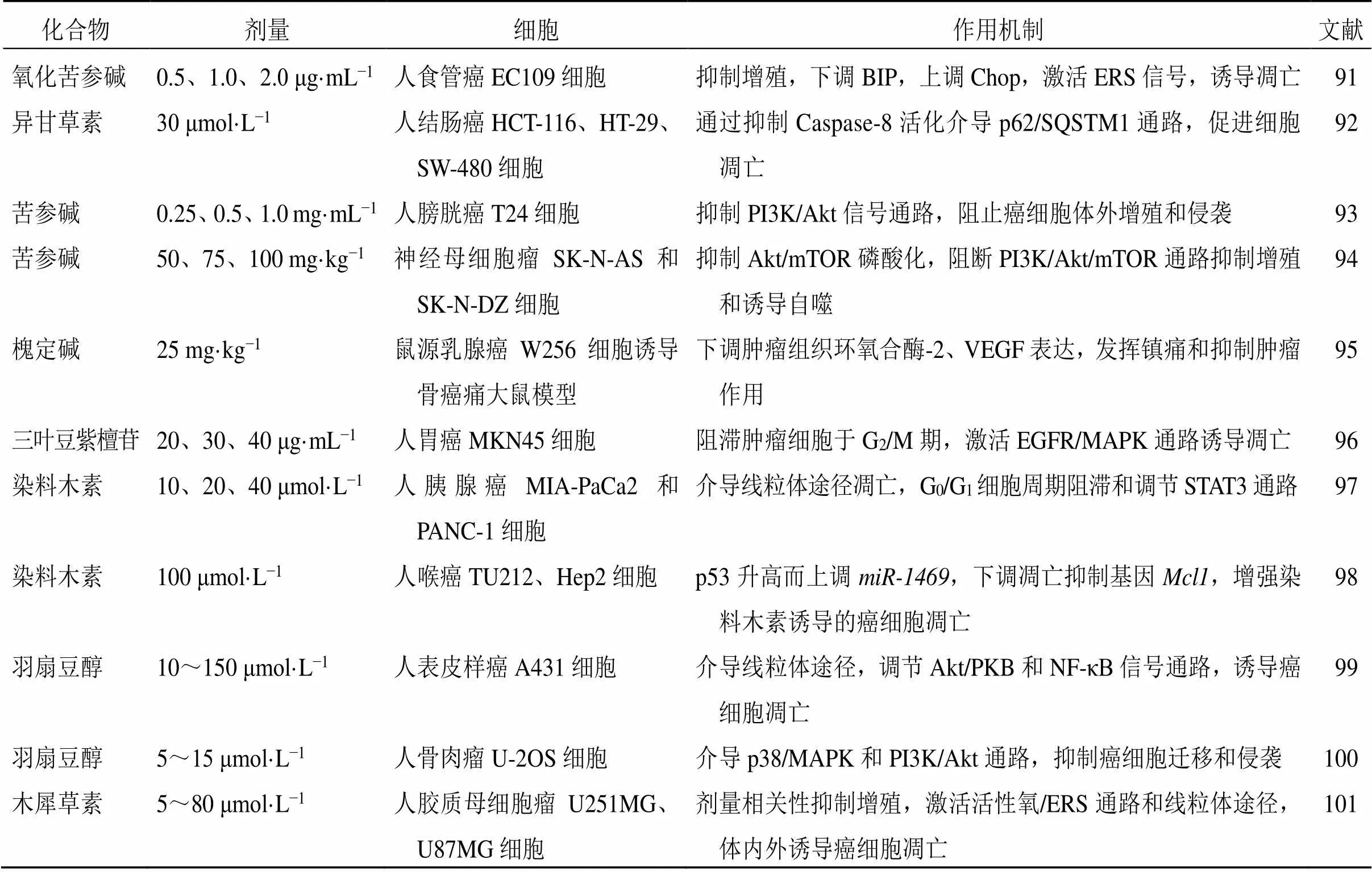
表2 山豆根活性成分抗其他类型恶性肿瘤的作用
4 结语与展望
综上所述,山豆根中的生物碱类、黄酮类、苯并呋喃类、三萜类、多糖类等成分以及混合提取物均有一定的抗肿瘤活性。山豆根生物碱、黄酮和三萜类成分能通过ERK、MAPK、PI3K/Akt/mTOR、FAK-桩蛋白、VEGF、PTEN、p38/MAPK等靶点通路抑制多种癌细胞的增殖、黏附、侵袭和转移;生物碱、黄酮和苯并呋喃类化合物可通过MAPK/Ras、活性氧/ERS、MDM2/IAP3、MAPK/STAT3/NF-κB、miR-374a/GADD45A、EGFR/MAPK、c-Myc/HK2、Wnt/β-catenin、JAK2/STAT3、PI3K/Akt/mTOR、p62/SQSTM1等通路诱导癌细胞凋亡,凋亡途径主要涉及线粒体通路和内质网通路;苦参碱和苦豆碱等生物碱类成分主要通过抑制mTOR的表达而引发肿瘤细胞自噬;木犀草素和山豆根乙醇提取物能抑制HIF-1α/VEGF通路,抑制肿瘤血管生成;苦参碱、金雀花碱和高丽槐素等成分通过降低Cyclin D1/B1、CDK4/6、β-catenin或水平,增加p21、p16或CDKN1A水平,干扰细胞周期;山豆根多糖和苦参碱、氧化苦参碱、氧化槐果碱等生物碱组分通过上调IL-2、TNF-α、γ-干扰素表达,下调IL-6、IL-10表达,改善免疫微环境,提高机体免疫力,抑制肿瘤的发生发展;槲皮素还能干扰肿瘤细胞信号转导,通过RIG-Ⅰ/IFN-Ⅰ通路增强抗肿瘤作用。山豆根抗肿瘤具有多成分、多靶点和多通路的特点,作用机制见图2。
热毒是恶性肿瘤的重要致病因素[113],炎症能促进肿瘤的发生发展[114],清热解毒是中医治疗癌症的重要治法[115]。清热解毒类中药药性寒凉,具有抗炎作用,在肿瘤治疗中能消除体内热毒和抑制炎症反应,具有较好的疗效[116]。山豆根属于清热解毒类中药之一,毒效并存,生物碱类成分氧化苦参碱和苦参碱是主要的毒性成分,具有心脏、肝脏、神经等毒性[117-118],少数研究显示黄酮类成分也具有潜在的肝毒性[119],目前对于山豆根的毒性研究尚不全面,毒性物质-剂量-机制仍需继续完善,在安全合理的毒性控制下,其抗癌潜力仍值得进一步研究。
山豆根抗肿瘤的物质基础与作用机制应深入挖掘,其中生物碱、黄酮类成分抗肿瘤活性是研究的热点,但多数研究使用的是混合提取物[120-122],有待于进一步阐明药效物质基础,分离提纯单体成分并进行抗肿瘤作用机制研究,在探讨单一成分或与化疗药物结合的抗癌作用基础上,可加强组分间的协同抗癌作用研究。苯并呋喃类、三萜类和多糖类的研究较少,尤其是多糖的组成和结构较为复杂,精细的空间结构尚不清楚,抗肿瘤作用的构效关系还需进一步阐明。部分实验仅涉及抑制率、抑制增殖和侵袭转移等表型的研究,应进行更深层次的系统性机制研究。
山豆根具有广泛的抗肿瘤作用,但部分成分的溶解性较差,使其生物利用度大大降低,导致抗癌活性受限,阻碍了山豆根的抗肿瘤研究,因此,有必要对成分进行结构修饰及衍生物合成[123],或使用药物载体[124],从而增加山豆根药效成分的溶解性和稳定性,改善药动学特征,降低毒性而增强抗肿瘤活性,提高生物利用度及安全性、有效性;对于山豆根中部分活性成分含量低,难以在体外合成生产但抗癌活性较高的,可利用微生物基因工程技术来获得[125]。
目前,对山豆根的研究主要集中在化学成分、药理机制、毒性反应等方面[126-128],对山豆根的分子生物学、药动学和代谢组学的相关研究仍较缺乏。山豆根的多种化学成分在抗肿瘤方面显示了良好的活性,有望成为多靶点、多机制的抗肿瘤候选药物,但关于其物质基础的临床应用研究极少,未来还需大规模的临床研究验证和阐明抗癌机制和疗效,并对山豆根抗肿瘤药效物质基础和构效关系及其作用机制进行分子水平的详细探究,开发优良的药物递送系统,促进山豆根抗肿瘤的多机制新药物、新品种研发及其未来临床的安全有效应用,为防治恶性肿瘤疾病提供更多中医药治疗策略。
利益冲突 所有作者均声明不存在利益冲突
[1] Sung H, Ferlay J, Siegel R L,. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]., 2021, 71(3): 209-249.
[2] Qiu H B, Cao S M, Xu R H. Cancer incidence, mortality, and burden in China: A time-trend analysis and comparison with the United States and United Kingdom based on the global epidemiological data released in 2020 [J]., 2021, 41(10): 1037-1048.
[3] Wu S, Zhu W, Thompson P,. Evaluating intrinsic and non-intrinsic cancer risk factors [J]., 2018, 9(1): 3490.
[4] Tran K B, Lang J, Compton K,. The global burden of cancer attributable to risk factors, 2010–19: A systematic analysis for the Global Burden of Disease Study 2019 [J]., 2022, 400: 563-591.
[5] Lu C S, Shieh G S, Wang C T,. Chemotherapeutics-induced Oct4 expression contributes to drug resistance and tumor recurrence in bladder cancer [J]., 2017, 8(19): 30844-30858.
[6] Dare A J, Bayle A, Hatoqai A,. Ensuring global access to cancer medicines: A generational call to action [J]., 2023, 13(2): 269-274.
[7] 刘洪瑞. 齐元富教授运用清热解毒法治疗肺癌的用药配伍规律及特色研究[D]. 济南: 山东中医药大学, 2023.
[8] Zhang J, Li X, Huang L. Anticancer activities of phytoconstituents and their liposomal targeting strategies against tumor cells and the microenvironment [J]., 2020, 154/155: 245-273.
[9] 王兵. 西黄丸联合TP方案治疗中晚期乳腺癌的临床研究 [J]. 现代药物与临床, 2018, 33(7): 1746-1750.
[10] Chen Z L. Pien Tze Huang (PZH) as a multifunction medicinal agent in traditional Chinese medicine (TCM): A review on cellular, molecular and physiological mechanisms [J]., 2021, 21(1): 146.
[11] 刘磊磊, 陈娟, 师彦平. 清热解毒中药抗肿瘤作用研究进展 [J]. 中草药, 2012, 43(6): 1203-1212.
[12] Chopra B, Dhingra A K. Natural products: A lead for drug discovery and development [J]., 2021, 35(9): 4660-4702.
[13] Zhang X Y, Qiu H A, Li C S,. The positive role of traditional Chinese medicine as an adjunctive therapy for cancer [J]., 2021, 15(5): 283-298.
[14] 陈姣, 林聃, 杨杰, 等. 中药抗肿瘤的增效减毒效应研究进展 [J]. 中国科学: 生命科学, 2022, 52(6): 920-934.
[15] 中国药典 [S]. 一部. 2020: 28.
[16] 卢多逊. 开宝本草[M]. 尚志钧辑校. 合肥: 安徽科学技术出版社, 1998: 253.
[17] 张文玉. 山豆根苯并呋喃化合物对鼻咽癌细胞CNE-1和CNE-2增殖、凋亡的影响及其作用机制 [D]. 南宁: 广西中医药大学, 2020.
[18] Shuai X H, Hu T J, Liu H L,. Immunomodulatory effect of apolysaccharide in mice [J]., 2010, 46(1): 79-84.
[19] 罗有红. 喹诺里西啶类生物碱对白血病细胞的联合作用效应 [D]. 汕头: 汕头大学, 2014.
[20] 何常明. 苦参和山豆根黄酮类成分及其生物活性的比较研究 [D]. 上海: 复旦大学, 2010.
[21] 程钱, 王金凤, 王宝丽, 等. 山豆根化学成分、生物活性及质量控制研究进展 [J]. 辽宁中医药大学学报, 2017, 19(7): 119-125.
[22] 朱大诚, 周军, 何莲花, 等. 山豆根水提物对白血病CEM细胞生长抑制及其机制研究 [J]. 时珍国医国药, 2012, 23(8): 1931-1933.
[23] 程钱, 邹秦文, 汪建芬, 等. 高效液相色谱法同时测定山豆根中4种生物碱的含量与聚类分析 [J]. 中国药业, 2017, 26(17): 10-13.
[24] 黄峥蕊. 基于有效性和安全性的中药山豆根质量控制方法研究 [D]. 西安: 西安理工大学, 2021.
[25] 南俊伶, 王超众, 闫广利, 等. 山豆根药材UPLC-UV指纹图谱及3种成分含量测定研究 [J]. 中南药学, 2022, 20(4): 910-915.
[26] 黄乐, 姚彩云, 梁莹, 等. 一测多评法测定山豆根中3个非生物碱成分含量 [J]. 中国现代中药, 2020, 22(12): 2015-2020.
[27] He C M, Cheng Z H, Chen D F. Qualitative and quantitative analysis of flavonoids inby LC/MS and HPLC [J]., 2013, 11(6): 690-698.
[28] 韩馥蔓, 王莉鑫, 陈影, 等. HPLC同时测定山豆根中7种生物碱及3种黄酮的含量 [J]. 中国中药杂志, 2016, 41(24): 4628-4634.
[29] Gu Y M, Lu J Y, Sun W,. Oxymatrine and its metabolite matrine contribute to the hepatotoxicity induced byin mice [J]., 2019, 17(4): 2519-2528.
[30] Liu Y, Xu Y, Ji W D,. Anti-tumor activities of matrine and oxymatrine: Literature review [J]., 2014, 35(6): 5111-5119.
[31] Wang J C, Wei W, Tang Q L,. Oxysophocarpine suppresses hepatocellular carcinoma growth and sensitizes the therapeutic blockade of anti-Lag-3 via reducing FGL1 expression [J]., 2020, 9(19): 7125-7136.
[32] Li X N, Lu Z Q, Qin S,. Tonkinensines A and B, two novel alkaloids from[J]., 2008, 49(23): 3797-3801.
[33] Liu F J, Liu T, Li H Y. Aloperine inhibits the progression of non-small-cell lung cancer through the PI3K/Akt signaling pathway [J]., 2021, 21(1): 662.
[34] Zhu L L, Huang S S, Li J H,. Sophoridine inhibits lung cancer cell growth and enhances cisplatin sensitivity through activation of the p53 and Hippo signaling pathways [J]., 2020, 742: 144556.
[35] Yu L, Jiang B, Chen Z F,. Cytisine induces endoplasmic reticulum stress caused by calcium overload in HepG2 cells [J]., 2018, 39(3): 1475-1484.
[36] 南俊伶, 王超众, 闫广利, 等. 山豆根抗鼻咽癌活性成分的筛选 [J]. 中国药房, 2022, 33(11): 1320-1323.
[37] Mhone T G, Chen M C, Kuo C H,. Daidzein synergizes with gefitinib to induce ROS/JNK/c-Jun activation and inhibit EGFR-STAT/Akt/ERK pathways to enhance lung adenocarcinoma cells chemosensitivity [J]., 2022, 18(9): 3636-3652.
[38] Chan L J, Pang Y H, Wang Y J,. Genistein-induced mitochondrial dysfunction and FOXO3a/PUMA expression in non-small lung cancer cells [J]., 2022, 60(1): 1876-1883.
[39] Ong S, Shanmugam M, Fan L,. Focus on formononetin: Anticancer potential and molecular targets [J]., 2019, 11(5): 611.
[40] Aratanechemuge Y, Hibasami H, Katsuzaki H,. Induction of apoptosis by maackiain and trifolirhizin (maackiain glycoside) isolated from sanzukon (subprostrate Chen et T. Chen) in human promyelotic leukemia HL-60 cells [J]., 2004, 12(6): 1183-1188.
[41] Powe E, Parschauer D, Istifan J,. Luteolin enhances erlotinib’s cell proliferation inhibitory and apoptotic effects in glioblastoma cell lines [J]., 2022, 13: 952169.
[42] Wang kai-lee, Yu Y C, Hsia S M. Perspectives on the role of isoliquiritigenin in cancer [J]., 2021, 13(1): 115.
[43] 韦燕飞, 金丽杰, 刘莎莎, 等. 羽扇豆醇抗肿瘤作用研究进展 [J]. 中国药理学通报, 2021, 37(7): 897-901.
[44] Omar A, Kalra R S, Putri J,. Soyasapogenol-A targets CARF and results in suppression of tumor growth and metastasis in p53 compromised cancer cells [J]., 2020, 10: 6323.
[45] Chen Y P, Chan A T C, Le Q T,. Nasopharyngeal carcinoma [J]., 2019, 394(10192): 64-80.
[46] Ying K, Liu Y N, Zhang C Q,. Medical findings of nasopharyngeal carcinoma patients and anti-tumor benefits of formononetin [J]., 2019, 861: 172619.
[47] 苏雯清, 杨晓男, 何文栋, 等. 高丽槐素对鼻咽癌CNE1细胞增殖、迁移、凋亡的影响及机制 [J]. 广西医科大学学报, 2021, 38(2): 258-264.
[48] Jiang X, Yang X N, Shi Y X,. Maackiain inhibits proliferation and promotes apoptosis of nasopharyngeal carcinoma cells by inhibiting the MAPK/Ras signaling pathway [J]., 2023, 21(3): 185-196.
[49] Jiang X, Yin H H, Su W Q,. Trifolirhizin inhibits proliferation, migration and invasion in nasopharyngeal carcinoma cells via PI3K/Akt signaling pathway suppression [J]., 2023, 667: 111-119.
[50] Wang S, Song Z J, Gong X M,. Chloroform extract fromGagnep. inhibit proliferation, migration, invasion and promote apoptosis of nasopharyngeal carcinoma cells by silencing the PI3K/ Akt/mTOR signaling pathway [J]., 2021, 271: 113879.
[51] Ferlay J, Colombet M, Soerjomataram I,. Cancer statistics for the year 2020: An overview [J]., 2021, 149(4): 778-789.
[52] 路海滨, 高洋, 禹珊珊, 等. 山豆根多糖对Lewis肺癌小鼠抑瘤作用及免疫功能影响的实验研究 [J]. 中药材, 2018, 41(6): 1459-1462.
[53] 李宜鲜, 魏华琳. 山豆根乙醇提取物对Lewis肺癌小鼠的抗肿瘤作用 [J]. 陕西中医药大学学报, 2021, 44(3): 86-91.
[54] Zhang S N, He Y F, Li X Z,. Biolabel-led research pattern positions the effects and mechanisms ofet rhizome on lung diseases: A novel strategy for computer-aided herbal medicine research based on omics and bioinformatics [J]., 2021, 136: 104769.
[55] 张奇峰. 山豆根提取物体外抗肿瘤实验研究 [J]. 中医药临床杂志, 2015, 27(9): 1269-1271.
[56] Xu W T, Li T Z, Li S M,. Cytisine exerts anti-tumour effects on lung cancer cells by modulating reactive oxygen species-mediated signalling pathways [J]., 2020, 48(1): 84-95.
[57] Chen W Q, Zhang S W, Zou X N,. Cancer incidence and mortality in China, 2006 [J]., 2011, 23(1): 3-9.
[58] Zhou N, Li J Q, Li T,. Matrine-induced apoptosis in Hep3B cells via the inhibition of MDM2 [J]., 2017, 15(1): 442-450.
[59] 彭百承, 黄健, 李萍, 等. 山豆根颗粒及其饮片抗肿瘤作用及其机制 [J]. 中国实验方剂学杂志, 2014, 20(23): 190-193.
[60] 曹洛云, 李天娇, 孟宪生, 等. 山豆根生物碱对DEN诱发肝癌大鼠的作用及机制研究 [J]. 中国现代应用药学, 2018, 35(3): 370-374.
[61] Chui C, Lau F, Tang J,. Activities of fresh juice ofand warmed water extract ofon anti-proliferation and apoptosis of human cancer cell lines [J]., 2005, 16(2): 337-341.
[62] Zhao Z W, Song J J, Zhang D K,. Oxysophocarpine suppresses FGFR1-overexpressed hepatocellular carcinoma growth and sensitizes the therapeutic effect of lenvatinib [J]., 2021, 264: 118642.
[63] 彭湘君. 山豆根多糖的提取工艺及抗肿瘤活性研究 [D]. 赣州: 赣南师范学院, 2012.
[64] Cao W, Chen H D, Yu Y W,. Changing profiles of cancer burden worldwide and in China: A secondary analysis of the global cancer statistics 2020 [J]., 2021, 134(7): 783-791.
[65] Morris G J, Naidu S S, Topham A K,. Differences in breast carcinoma characteristics in newly diagnosed African-American and Caucasian patients [J]., 2007, 110(4): 876-884.
[66] Peng T T, Sun X R, Liu R H,. Cytisine-pterocarpan-derived compounds: Biomimetic synthesis and apoptosis-inducing activity in human breast cancer cells [J]., 2018, 23(12): 3059.
[67] Sun X R, Zhang T, Cai Y,. Tonkinensine B induces apoptosis through mitochondrial dysfunction and inactivation of the PI3K/Akt pathway in triple-negative breast cancer cells [J]., 2021, 73(10): 1397-1404.
[68] Zhang J, He Y T, Yu Y,. Upregulation of miR-374a promotes tumor metastasis and progression by downregulating LACTB and predicts unfavorable prognosis in breast cancer [J]., 2018, 7(7): 3351-3362.
[69] Peng F, Wang L, Xiong L A,. Maackiain modulates miR-374a/GADD45A axis to inhibit triple-negative breast cancer initiation and progression [J]., 2022, 13: 806869.
[70] 韦立群, 李婉婷, 李通, 等. 金雀异黄酮对三阴乳腺癌MDA-MB-231细胞凋亡及EGFR/PI3K/Akt通路的影响 [J]. 中国药理学通报, 2017, 33(10): 1376-1381.
[71] 韦立群, 徐成飞, 李婉婷, 等. NF-κB和MAPK信号通路参与金雀异黄酮诱导乳腺癌MDA-MB-231细胞凋亡的体外研究 [J]. 中国药理学通报, 2018, 34(5): 690-694.
[72] Ni X, Li Z, Li X P,. Socioeconomic inequalities in cancer incidence and access to health services among children and adolescents in China: A cross-sectional study [J]., 2022, 400(10357): 1020-1032.
[73] Kajimoto S, Takanashi N, Kajimoto T,. Sophoranone, extracted from a traditional Chinese medicine Shan Dou Gen, induces apoptosis in human leukemia U937 cells via formation of reactive oxygen species and opening of mitochondrial permeability transition pores [J]., 2002, 99(6): 879-890.
[74] Tetik Vardarlı A, Düzgün Z, Erdem C,. Matrine induced G0/G1arrest and apoptosis in human acute T-cell lymphoblastic leukemia (T-ALL) cells [J]., 2017, 18(2):141-149.
[75] Lin G B, Wu Y Z, Cai F T,. Matrine promotes human myeloid leukemia cells apoptosis through Warburg effect mediated by hexokinase 2 [J]., 2019, 10: 1069.
[76] Gao W T, Wang X Y, Zhou Y,. Autophagy, ferroptosis, pyroptosis, and necroptosis in tumor immunotherapy [J]., 2022, 7(1): 196.
[77] 林泽. 槐属植物中药生物碱抗肿瘤作用机制研究 [D]. 汕头: 汕头大学, 2011.
[78] Zhang D X, Liu S, Yao M Z,. Effects ofroot on growth, adhesion, invasion and motility of melanoma cells [J]., 2013, 11(1): 62-66.
[79] 李俊兰, 张东兴, 刘诗. 山豆根对小鼠黑色素瘤细胞B16-BL6生长、增殖的影响 [J]. 光明中医, 2017, 32(9): 1256-1259.
[80] Jin H, Sun Y, Wang S Y,. Matrine activates PTEN to induce growth inhibition and apoptosis in V600EBRAF harboring melanoma cells [J]., 2013, 14(8): 16040-16057.
[81] Kim J K, Kang K A, Ryu Y S,. Induction of endoplasmic reticulum stress via reactive oxygen species mediated by luteolin in melanoma cells [J]., 2016, 36(5): 2281-9.
[82] Li C Y, Wang Q, Shen S,. HIF-1α/VEGF signaling-mediated epithelial-mesenchymal transition and angiogenesis is critically involved in anti-metastasis effect of luteolin in melanoma cells [J]., 2019, 33(3): 798-807.
[83] Peng D H, Chen L J, Sun Y,. Melanoma suppression by quercein is correlated with RIG-I and type I interferon signaling [J]., 2020, 125: 109984.
[84] Arbyn M, Weiderpass E, Bruni L,. Estimates of incidence and mortality of cervical cancer in 2018: A worldwide analysis [J]., 2020, 8(2): e191-e203.
[85] Chen C L, Wang Y X, Chen S,. Genistein inhibits migration and invasion of cervical cancer HeLa cells by regulating FAK-paxillin and MAPK signaling pathways [J]., 2020, 59(3): 403-408.
[86] 张冬丽, 付瑞芳, 孙桂霞. 氧化苦参碱对宫颈癌SiHa细胞增殖和凋亡的影响及其机制 [J]. 吉林大学学报: 医学版, 2021, 47(4): 951-957.
[87] 胡焕焕, 姬国杰, 陈阳, 等. 不同剂量大豆苷元对宫颈癌细胞株Hela VEGF-C基因表达的影响 [J]. 山东医药, 2018, 58(3): 36-38.
[88] Lin T H, Hsu W H, Tsai P H,. Dietary flavonoids, luteolin and quercetin, inhibit invasion of cervical cancer by reduction of UBE2S through epithelial-mesenchymal transition signaling [J]., 2017, 8(4): 1558-1568.
[89] 王慧玲, 赵维楠, 罗瑞, 等. 基于JAK-STAT通路研究槲皮素对人宫颈癌C-33A细胞的影响 [J]. 中医学报, 2021, 36(7): 1525-1529.
[90] 韦正, 许风琴, 张晖英. 基于生物信息学分析山豆根中紫檀烷类化合物对头颈部鳞状细胞癌作用机理 [J]. 产业创新研究, 2021(18): 54-58.
[91] Wang B Y, Zhou H R, Zhu Y Q. Mechanism of oxymatrine-induced human esophageal cancer cell apoptosis by the endoplasmic reticulum stress pathway [J]., 2018, 13(1): 112-118.
[92] Jin H, Seo G S, Lee S H. Isoliquiritigenin-mediated p62/SQSTM1 induction regulates apoptotic potential through attenuation of Caspase-8 activation in colorectal cancer cells [J]., 2018, 841: 90-97.
[93] Yang Y, Guo J X, Shao Z Q,. Matrine inhibits bladder cancer cell growth and invasionthrough PI3K/Akt signaling pathway: An experimental study [J]., 2017, 10(5): 515-519.
[94] Liu N J, Yang C M, Yang L,. Matrine induces autophagy in human neuroblastoma cells via blocking the Akt-mTOR pathway [J]., 2022, 39(11): 1-11.
[95] 严继贵, 杨宇清, 王雅洁, 等. 槐定碱抗骨癌痛作用及其机制研究 [J]. 中国中药杂志, 2013, 38(23): 4134-4137.
[96] Lu X G, Ma J X, Qiu H F,. Anti-proliferation effects of trifolirhizin on MKN45 cells and possible mechanism [J]., 2016, 36(5): 2785-2792.
[97] Bi Y L, Min M, Shen W,. Genistein induced anticancer effects on pancreatic cancer cell lines involves mitochondrial apoptosis, G0/G1cell cycle arrest and regulation of STAT3 signalling pathway [J]., 2018, 39: 10-16.
[98] Ma C H, Zhang Y X, Tang L H,. MicroRNA-1469, a p53-responsive microRNA promotes Genistein induced apoptosis by targeting Mcl1 in human laryngeal cancer cells [J]., 2018, 106: 665-671.
[99] Prasad S, Madan E S, Nigam N,. Induction of apoptosis by lupeol in human epidermoid carcinoma A431 cells through regulation of mitochondrial, Akt/PKB and NF-kappaB signaling pathways [J]., 2009, 8(17): 1632-1639.
[100]Hsu M J, Peng S F, Chueh F S,. Lupeol suppresses migration and invasionp38/MAPK and PI3K/Akt signaling pathways in human osteosarcoma U-2 OS cells [J]., 2019, 83(9): 1729-1739.
[101]Wang Q, Wang H D, Jia Y,. Luteolin induces apoptosis by ROS/ER stress and mitochondrial dysfunction in gliomablastoma [J]., 2017, 79(5): 1031-1041.
[102]中国人民解放军总医院膀胱癌治疗小组. 广豆根、喜树碱联合应用治疗膀胱癌40例初步小结 [J]. 新医药学杂志, 1977, 18(7): 12-14.
[103]李济培, 梁平, 张奕敬. 鼻咽灵片防治鼻咽癌急性放射反应的研究 [J]. 临床肿瘤学杂志, 2004, 9(2): 136-138.
[104]谢双燕. 安康欣联合GP方案治疗对晚期非小细胞肺癌患者临床疗效、肿瘤标记物及免疫功能的影响 [J]. 现代诊断与治疗, 2022, 33(17): 2543-2545.
[105]高鸿杨. 安康欣胶囊联合新辅助化疗治疗中晚期宫颈癌的临床疗效分析 [J]. 中国现代药物应用, 2022, 16(21): 110-112.
[106]陈伦宽, 麻战胜, 陈侃松, 等. 复方苦参碱注射液联合健脾理气方治疗晚期原发性肝癌效果分析 [J]. 中国乡村医药, 2017, 24(8): 54.
[107]措毛吉, 王烈宏, 王榀华, 等. 苦参碱注射液对宫颈癌化疗的增敏效果及对机体免疫功能、预后的影响 [J]. 中国临床医生杂志, 2021, 49(4): 500-503.
[108]刘群, 张学顺. 苦参碱注射液临床应用文献分析 [J]. 临床合理用药杂志, 2021, 14(34): 179-181.
[109]金黎明, 胡文忠, 侯梦阳. 满药复方木鸡颗粒防治肝病的研究进展 [J]. 广州中医药大学学报, 2017, 34(2): 292-296.
[110]秦妍, 包永睿, 王帅, 等. 基于微流控芯片的复方木鸡颗粒抗肝肿瘤的“谱-物-效”关系 [J]. 中国药理学通报, 2023, 39(1): 185-192.
[111]Sun Z, Guan X B, Li N,. Chemoprevention of oral cancer in animal models, and effect on leukoplakias in human patients with ZengShengPing, a mixture of medicinal herbs [J]., 2010, 46(2): 105-110.
[112]Bui D, Yin T J, Duan S N,. Pharmacokinetic characterization and bioavailability barrier for the key active components of botanical drug antitumor B (ATB) in mice for chemoprevention of oral cancer [J]., 2021, 84(9): 2486-2495.
[113]张静, 吴勉华. 试析恶性肿瘤的瘀热病机及证治 [J]. 中国中医药信息杂志, 2009, 16(1): 95-96.
[114]Zappavigna S, Cossu A M, Grimaldi A,. Anti-inflammatory drugs as anticancer agents [J]., 2020, 21(7): 2605.
[115]王雪雁, 杨柱, 龙奉玺, 等. 浅谈清热解毒治则治法在肿瘤疾病中的运用 [J]. 中医药临床杂志, 2018, 30(8): 1409-1412.
[116]陈勇, 林久茂. 清热解毒法防治大肠癌的研究进展 [J]. 云南中医中药杂志, 2022, 43(11): 89-94.
[117]邵珍, 陈江华, 邓中平. 山豆根生物碱部位对大鼠肝脏毒性及其生物标志物的研究 [A] // 中国毒理学会中药与天然药物毒理专业委员会第二次(2017年) 学术交流大会论文集 [C]. 苏州: 中国毒理学会, 2016: 191-208.
[118]聂安政, 赵雪睿, 高梅梅, 等. 山豆根安全问题探讨与合理用药思考 [J]. 中草药, 2018, 49(17): 4152-4161.
[119]袁文琳, 黄峥蕊, 肖思佳, 等. 山豆根黄酮类成分对斑马鱼的急性毒性研究 [J]. 中草药, 2021, 52(10): 2978-2986.
[120]侯海涛, 王斌斌, 李苓. 山豆根通过MAPK信号通路调节乳腺癌细胞增殖、凋亡 [J]. 中国老年学杂志, 2023, 43(8): 1943-1947.
[121]丁虹, 吴紫陆, 蔡纪堂. 基于PERK/Nrf2信号通路研究山豆根提取物诱导鼻咽癌细胞铁死亡作用机制 [J]. 中草药, 2023, 54(8): 2471-2479.
[122]刘博峰, 董晓辉, 刘彦青, 等. 山豆根醇提取物对大鼠脑动脉瘤血管内皮细胞的作用机制 [J]. 西北药学杂志, 2023, 38(2): 92-98.
[123]Wu L C, Wang G Z, Wei J R,. Matrine derivative YF-18 inhibits lung cancer cell proliferation and migration through down-regulating Skp2 [J]., 2017, 8(7): 11729-11738.
[124]陈洋洋, 李梦媛, 李雪莹, 等. 染料木素MePEG-PLGA共聚物胶束体内外抗肿瘤作用 [J]. 中国现代应用药学, 2020, 37(12): 1442-1447.
[125]Zhang J E, Hansen L G, Gudich O,. A microbial supply chain for production of the anti-cancer drug vinblastine [J]., 2022, 609(7926): 341-347.
[126]Liang J J, Zhang P P, Zhang W,. Biological activities and secondary metabolites fromand its endophytic fungi [J]., 2022, 27(17): 5562.
[127]傅月朦, 余登香, 王淑娜, 等. 山豆根黄酮类成分药理作用及机制研究进展 [J]. 中草药, 2022, 53(19): 6234-6244.
[128]周思雨, 陈金鹏, 刘志东, 等. 山豆根的化学成分和药理作用的研究进展 [J]. 中草药, 2021, 52(5): 1510-1521.
Research progress on antitumor bioactive compounds and mechanisms ofet
ZHANG Sheng-li, WANG Chao-zhong, YAN Guang-li, SUN Hui, WANG Xi-jun
Chinmedomics Research Center of National Administration of Traditional Chinese Medicine, Heilongjiang University of Chinese Medicine, Harbin 150040, China
Shandougen (et) is derived from the dried roots and rhizomes of, which is traditionally used for clearing heat and removing toxin, reducing swelling and relieving sore throat. It contains complex chemical components and diverse pharmacological activities. Modern studies have shown that alkaloids, flavonoids, benzofuran, triterpenoids, polysaccharides and other compounds inetcan inhibit the proliferation, adhesion, invasion and metastasis of tumor cells, induce apoptosis and autophagy, inhibit angiogenesis, block cell cycle and signal transduction, and also inhibit the occurrence and development of cancers by enhancing the organism immunity. It has a good antagonistic effect on various types of malignant tumors and has the properties of multiple components, multiple targets and multiple pathways. This study focuses on summarizing the antitumor bioactive compounds and mechanisms ofet, in order to provide reference evidences for the in-depth antitumor research and new drugs development.
et; alkaloids; flavonoids; benzofuran; triterpenoids; polysaccharides; antitumor; maackiain; oxymatrine; luteolin
R285
A
0253 - 2670(2023)20 - 6844 - 12
10.7501/j.issn.0253-2670.2023.20.028
2023-04-25
广西创新驱动发展专项(桂科AA18242040)
张胜利,硕士研究生,研究方向为中药药效物质基础及新药开发。E-mail: slzhang2021@163.com
通信作者:王喜军,教授,博士生导师,从事中药血清药物化学及中医方证代谢组学研究。E-mail: xijunw@sina.com
[责任编辑 赵慧亮]
