基于HPLC指纹图谱和网络药理学的加味四逆散(颗粒)质量标志物分析及含量测定方法的建立
2023-10-19陈静梅李泽宇梁秋明岳子俊唐佐伟郝二伟杜正彩侯小涛邓家刚
陈静梅,李泽宇,梁秋明,岳子俊,唐佐伟,郝二伟,杜正彩,侯小涛*,邓家刚
基于HPLC指纹图谱和网络药理学的加味四逆散(颗粒)质量标志物分析及含量测定方法的建立
陈静梅1, 2, 3, 4,李泽宇2, 3, 4, 5,梁秋明6,岳子俊1,唐佐伟1,郝二伟2, 3, 4, 5,杜正彩2, 3, 4, 5,侯小涛1, 2, 3, 4*,邓家刚2, 3, 4, 5
1. 广西中医药大学药学院,广西 南宁 530200 2. 广西中药药效研究重点实验室,广西 南宁 530200 3. 广西农作物废弃物功能成分研究协同创新中心,广西 南宁 530200 4. 广西中医湿病方药理论与转化重点实验室,广西 南宁 530200 5. 广西中医药大学广西中医药科学实验中心,广西 南宁 530200 6. 广西钦州市中医医院,广西 钦州 535000
基于指纹图谱和网络药理学方法,分析预测加味四逆散(Jiawei Sini Powder,JSP)(颗粒)潜在的质量标志物(quality markers,Q-Marker),并对Q-Marker成分进行含量测定,为其质量控制提供参考。采用HPLC指纹图谱结合化学计量学分析JSP(颗粒)潜在Q-Marker。通过网络药理学构建物质-效应网络,进一步分析预测JSP(颗粒)药效关联的Q-Marker,并建立对预测得到的标志性成分进行含量测定的HPLC方法。建立了JSP(颗粒)的HPLC指纹图谱,标记28个共有峰,对其进行峰归属,其中1、9、11号峰来自白芍,26、27号峰来自枳实,13、28号峰来自炙甘草,2、4、10、12、16、24号峰来自代代花,15、17、22号峰来自半枝莲,25号峰来自白芍和炙甘草共有,3、5~8、14、18~21、23号峰来自枳实和代代花共有,并指认了其中的9个共有峰,分别为芍药内酯苷、芍药苷、甘草苷、野黄芩苷、柚皮苷、橙皮苷、新橙皮苷、柚皮素、甘草酸铵。相似度评价显示,10批JSP(颗粒)样品的相似度为0.954~1.000。主成分分析(principal component analysis,PCA)显示前4个主成分的累积方差贡献率为95.003%,正交偏最小二乘-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)显示有12个成分变量重要性投影(variable importance projection,VIP)值较大。采用网络药理学的方法分析得出芍药内酯苷、芍药苷、柚皮苷、橙皮苷、新橙皮苷5个成分可能为JSP(颗粒)潜在的Q-Marker。同时测定以上5个成分的含量,方法学考察结果良好,平均加样回收率为92.52%~96.48%,RSD为1.3%~2.6%。10批样品中芍药内酯苷、芍药苷、柚皮苷、橙皮苷、新橙皮苷的质量分数分别为0.107 6~0.203 6、0.475 9~1.204 6、2.310 9~5.223 8、0.410 3~0.796 8、4.311 9~8.343 3 mg/g。建立了JSP(颗粒)的HPLC指纹图谱,并结合网络药理学预测出5个Q-Marker成分及建立其定量测定方法,为JSP(颗粒)研制成古代经典名方中药复方制剂提供质量控制依据。
加味四逆散;质量标志物;HPLC;指纹图谱;网络药理学;主成分分析;正交偏最小二乘-判别分析;芍药内酯苷;芍药苷;柚皮苷;橙皮苷;新橙皮苷
胃痛是以胃脘部近歧骨处疼痛为主要症状的一种病证[1]。胃脘部疼痛是其主要的临床表现[2],多发病于青中年阶段,占到总发病人群的65%左右,幼儿和老年人较少,且无显著的性别差异[3]。近年来,中医应用于此病的临床效果卓见成效,利用中医辨证论治的理念,并依据病情需要进行临床加减,可减轻胃痛,改善患者生活质量,安全性高,值得推广。加味四逆散(Jiawei Sini Powder,JSP)是在全国第6批老中医药专家学术思想传承工作指导老师邓家刚教授指导下,在汉代张仲景经典名方四逆散中柴胡、白芍[芍药]、枳实、炙甘草的基础上增加2味药物,即代代花、半枝莲而形成的,共6味药材组成。代代花理气宽胸、和胃止呕,半枝莲清热解毒、活血化瘀、消肿止痛,整个方剂的功效概括为“疏肝解郁,理气止痛”,主要用于中医肝脾气郁证之胃痛、胁痛等多种病症[4-7]。该方长期在临床应用,取得满意效果。目前,尚未有对JSP整体性状控制方面的研究,建立与完善其质量标准具有重要的意义。刘昌孝院士[8-11]提出的质量标志物(quality markers,Q-marker)的概念,旨在建立中药全程质量控制及质量溯源体系。而中药指纹图谱结合化学计量学研究,可以在整体观的基础上筛选出最能反映中药质量的标志性成分[12-13];网络药理学多基因、多靶点的特点与中医药多成分、多靶点的特点有异曲同工之妙,在中医药现代化研究中具有较高的应用价值[14-16]。因此,本研究以JSP颗粒剂为研究对象,将HPLC指纹图谱与网络药理学相结合,并应用相似度评价软件和化学计量学手段,预测其发挥药效的潜在Q-Marker,进而采用HPLC技术对其进行含量测定,可以更加系统、全面地对其质量进行控制,以期为JSP研制成古代经典名方中药复方制剂提供质量控制依据。
1 仪器与材料
1.1 仪器
Waters-HPLC型高效液相色谱仪,沃特世科技有限公司;SQP型十万分之一电子分析天平,赛多利斯科学仪器有限公司;SB25-12D型超声仪,宁波新芝生物科技股份有限公司;DZKW-D-6型电热恒温水浴锅,北京市光明医疗仪器有限公司。
1.2 材料
1.2.1 试药 色谱纯乙腈、甲醇,赛默飞世尔科技(中国)有限公司;磷酸为色谱级,上海阿拉丁生化科技股份有限公司;其余均为分析纯,水为超纯水。
1.2.2 对照品 芍药苷(批号110736-202145)、柚皮苷(批号110722-202116)、橙皮苷(批号110721- 202019)、新橙皮苷(批号111857-201804)、甘草苷(批号111610-201908)、野黄芩苷(批号110842- 202010)、甘草酸铵(批号110731-202122)对照品均购买于中国食品药品检定研究院,质量分数均≥98%;芍药内酯苷(批号MUST-20131601)、柚皮素(批号MUST-20032406)对照品均购买于成都曼思特生物技术有限公司,质量分数均≥98%;JSP(颗粒),批号S211003、S211004、S211005、S211006、S211007、S211008、S211009、S221101、S221102、S221103,依次编号S1~S10,来自广西大海阳光药业有限公司,规格为15 g/袋。
2 方法与结果
2.1 JSP(颗粒)的HPLC指纹图谱研究
2.1.1 供试品溶液的制备 取JSP(颗粒)2 g,精密称定,置于锥形瓶中,精密加入70%甲醇20 mL,密塞,称定质量,超声提取1.5 h,放冷,再称定质量,用70%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得供试品溶液。
2.1.2 对照品溶液的制备 取各对照品适量,精密称定,加70%甲醇分别制成含芍药内酯苷1 mg/g、芍药苷2 mg/g、甘草苷1 mg/g、野黄芩苷1 mg/g、柚皮苷3 mg/g、橙皮苷1 mg/g、新橙皮苷3 mg/g、柚皮素1 mg/g、甘草酸铵1 mg/g的单一对照品储备液。分别吸取以上9种对照品储备液适量,加70%甲醇制成不同质量浓度的混合对照品溶液。
2.1.3 单味药材溶液的制备 按JSP(颗粒)处方比例分别称取柴胡、白芍、枳实、炙甘草、代代花、半枝莲药材,按“2.1.1”项下方法分别制备单味药材溶液。
2.1.4 色谱条件 色谱柱为X Select®HSS T3 C18柱(250 mm×4.6 mm,5 µm);流动相为乙腈-0.1%磷酸水溶液;梯度洗脱条件:0~10 min,5%~7%乙腈;10~15 min,7%~10%乙腈;15~30 min,10%~12.5%乙腈;30~40 min,12.5%~17%乙腈;40~45 min,17%~18%乙腈;45~50 min,18%乙腈;50~60 min,18%~20.5%乙腈;60~68 min,20.5%~21%乙腈;68~70 min,21%~24%乙腈;70~80 min,24%~28%乙腈;80~85 min,28%~35%乙腈;85~90 min,35%~40%乙腈;90~100 min,40%~55%乙腈;体积流量1.0 mL/min;柱温25 ℃;进样体积10 µL;紫外检测波长为240 nm。
2.1.5 精密度试验 取同一批次JSP(颗粒)样品(S1),按“2.1.1”项下方法制备供试品溶液1份,按“2.1.4”项下色谱条件进行测定,连续进样6次,记录各共有峰的保留时间和峰面积,以柚皮苷为参照峰,计算各共有峰的相对保留时间和相对峰面积。28个共有峰的相对保留时间和相对峰面积的RSD分别小于0.30%和2.80%,表明仪器和实验方法精密度良好。
2.1.6 稳定性试验 取同一批次JSP(颗粒)样品(S1),按“2.1.1”项下方法制备供试品溶液1份,分别于室温放置2、4、8、12、16、24 h后,按“2.1.4”项下色谱条件进样分析,记录各共有峰的保留时间和峰面积,以柚皮苷为参照峰,计算各共有峰的相对保留时间和相对峰面积。28个共有峰的相对保留时间和相对峰面积的RSD分别小于0.53%和3.00%,表明供试品溶液在室温条件下24 h内稳定性良好。
2.1.7 重复性试验 取同一批次JSP(颗粒)样品(S1),按“2.1.1”项下方法平行制备6份供试品溶液,按“2.1.4”项下色谱条件进样分析,记录各共有峰的保留时间和峰面积,以柚皮苷为参照峰,计算各共有峰的相对保留时间和相对峰面积。28个共有峰的相对保留时间和相对峰面积的RSD分别小于0.97%和2.90%,表明该提取方法的重复性良好。
2.1.8 指纹图谱的建立及相似度分析 取10批JSP(颗粒)样品(S1~S10),按“2.1.1”项下方法制备供试品溶液,按“2.1.4”项下测定方法分析供试品溶液,并记录生成HPLC图。采用“中药色谱指纹谱图相似度评价系统(2012版)”对上述谱图进行处理分析,以色谱图S1为参照图谱,采用中位数法,时间窗为0.1 min,对10批JSP(颗粒)样品(S1~S10)的指纹图谱进行拟合生成对照指纹图谱(R),根据峰面积的稳定性和分离度共标定了28个共有峰,以柚皮苷为参照峰,结果见图1。10批JSP(颗粒)样品(S1~S10)的指纹图谱与对照指纹图谱自动匹配,其相似度为0.954~1.000,结果见表1。
2.1.9 共有峰的归属与指认 取“2.1.1”“2.1.2”“2.1.3”项下供试品溶液、混合对照品溶液、单味药材溶液,按“2.1.4”项下色谱条件进样分析,通过比较各色谱峰的相对保留时间、紫外吸收光谱图以及单味药材色谱图,确定了JSP(颗粒)中28个共有峰(1~28)在6味药材中的归属,结果见图2、3和表2。结果发现,1、9、11号峰来自白芍,26、27号峰来自枳实,13、28号峰来自炙甘草,2、4、10、12、16、24号峰来自代代花,15、17、22号峰来自半枝莲,25号峰来自白芍和炙甘草共有,3、5~8、14、18~21、23号峰来自枳实和代代花共有。通过对照品比对保留时间和最大吸收波长,确定了其中的9个成分,即9(芍药内酯苷)、11(芍药苷)、13(甘草苷)、17(野黄芩苷)、19(柚皮苷)、20(橙皮苷)、21(新橙皮苷)、26(柚皮素)、28(甘草酸铵)号峰。
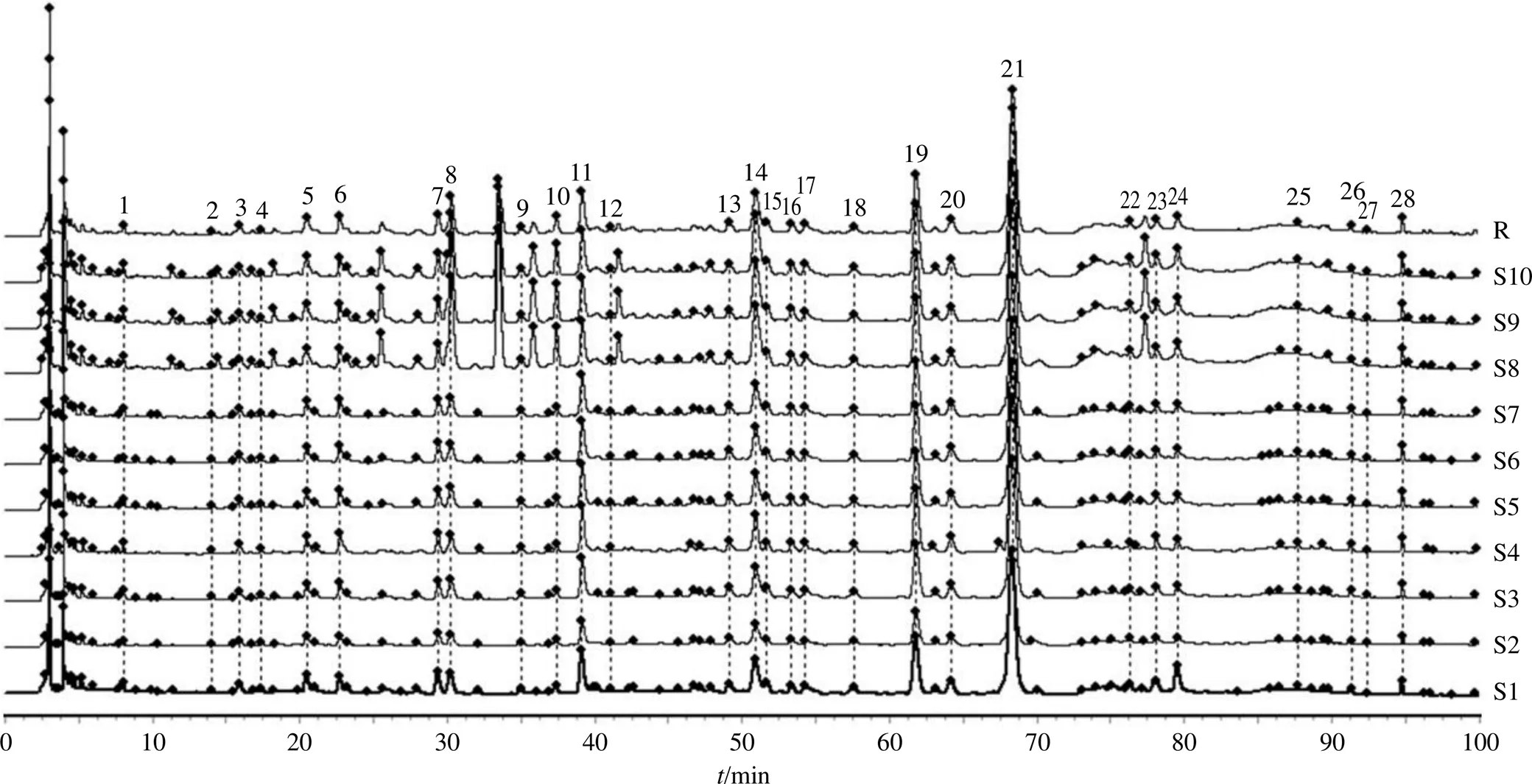
图1 10批JSP (颗粒) 样品(S1~S10)的HPLC指纹图谱和对照指纹图谱(R)
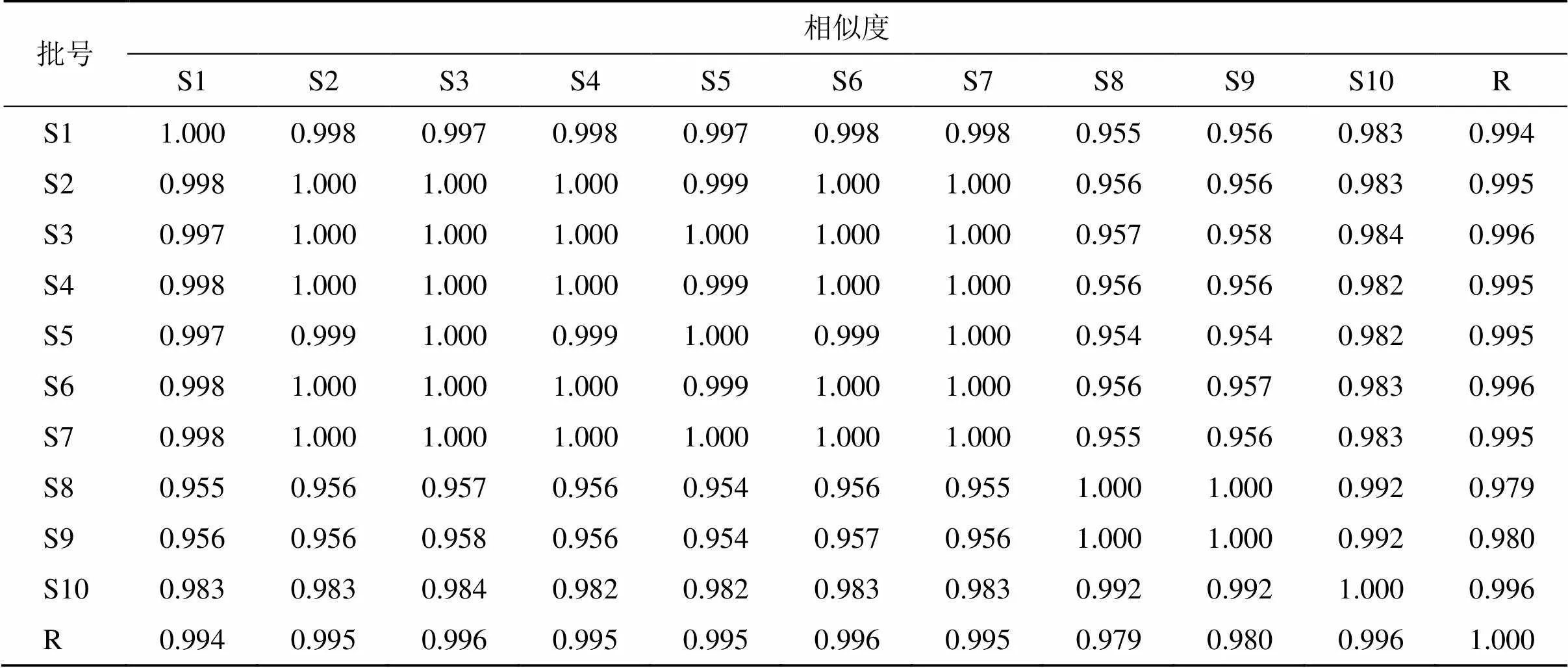
表1 10批JSP(颗粒)指纹图谱相似度计算结果
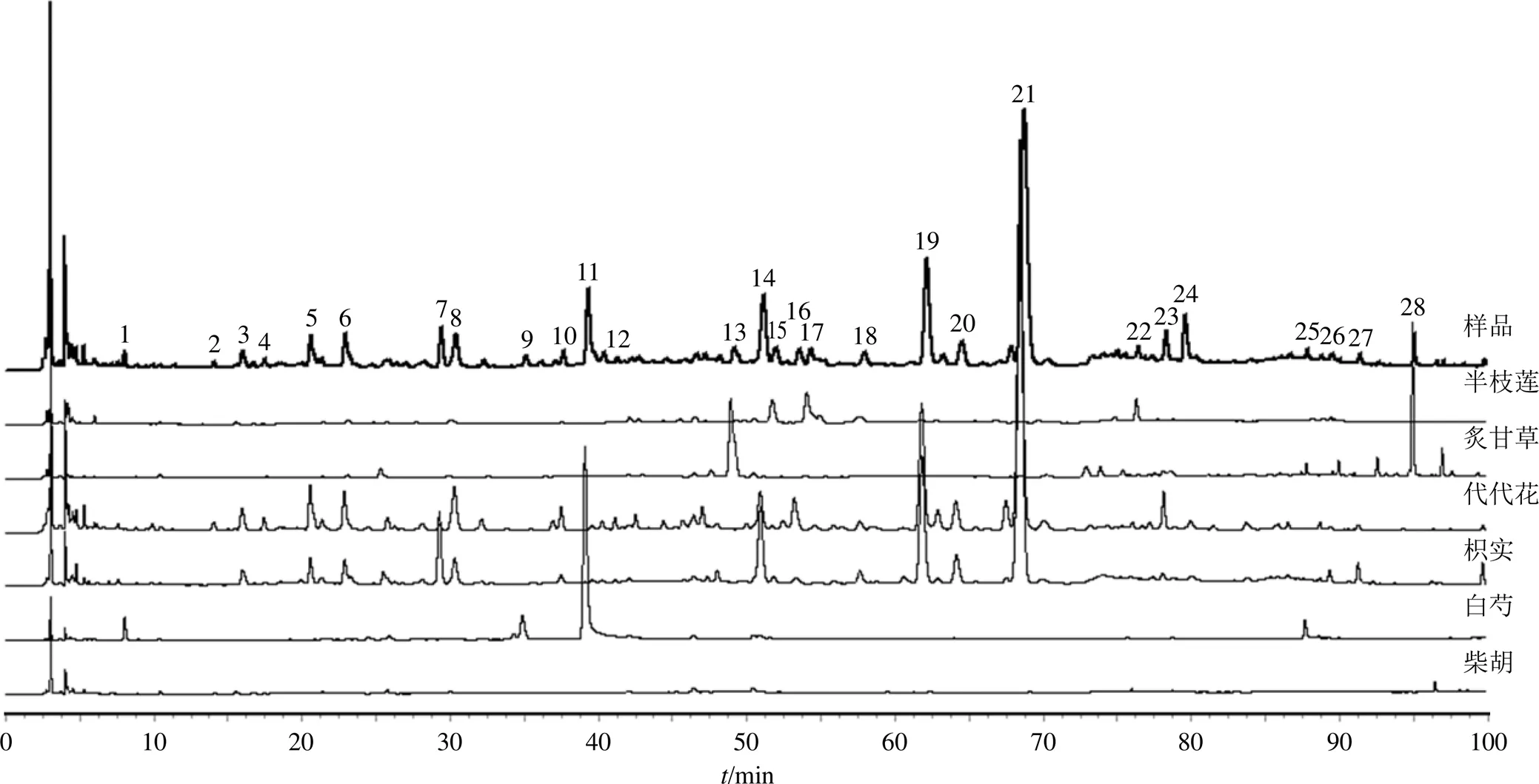
图2 共有峰的药材归属HPLC图

9-芍药内酯苷 11-芍药苷 13-甘草苷 17-野黄芩苷 19-柚皮苷 20-橙皮苷 21-新橙皮苷 26-柚皮素 28-甘草酸铵
2.2 主成分分析(principal component analysis,PCA)
将10批胃痛颗粒指纹图谱共有峰的峰面积为变量,导入SPSS 26.0软件,以特征值>1为提取标准,得到4个主成分,累积方差贡献率为95.003%。说明前4个成分可以反映JSP指纹图谱中的大部分化学信息。通过Kaiser标准化的正交旋转法,处理得到旋转后的成分得分系数矩阵。各色谱峰系数反映了成分贡献率大小,排名前8的成分分别为峰24、23、22、28(甘草酸铵)、26(柚皮素)、27、13(甘草苷)。

表2 JSP (颗粒)共有峰归属
2.3 正交偏最小二乘-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)
在PCA分组的基础上,以10批样品中28个共有峰面积为原始数据,导入SIMCA-P13.0软件,进行OPLS-DA建模分析,结果见图4。从模型验证的参数图可知,模型的稳定性和交叉验证的预测力都较高(2=0.852,R2=0.993,R2=0.986),说明所建立的OPLS-DA模型可以很好地用于不同批次间JSP的分析。

图4 10批JSP(颗粒)的OPLS-DA得分散点图
为了进一步确认对样品分类贡献度较大的成分,采用OPLS-DA中变量重要性投影值(variable importance projection,VIP)筛选差异性标志物,结果见图5。按VIP值由大到小筛选出组间具有差异的标志性成分,VIP值越大,成分对样品分类贡献越大。由图可知前15名VIP值较大,分别为峰18、27、13(甘草苷)、17(野黄芩苷)、20(橙皮苷)、11(芍药苷)、10、14、21(新橙皮苷)、19(柚皮苷)、16、9(芍药内酯苷)、1、7、4。
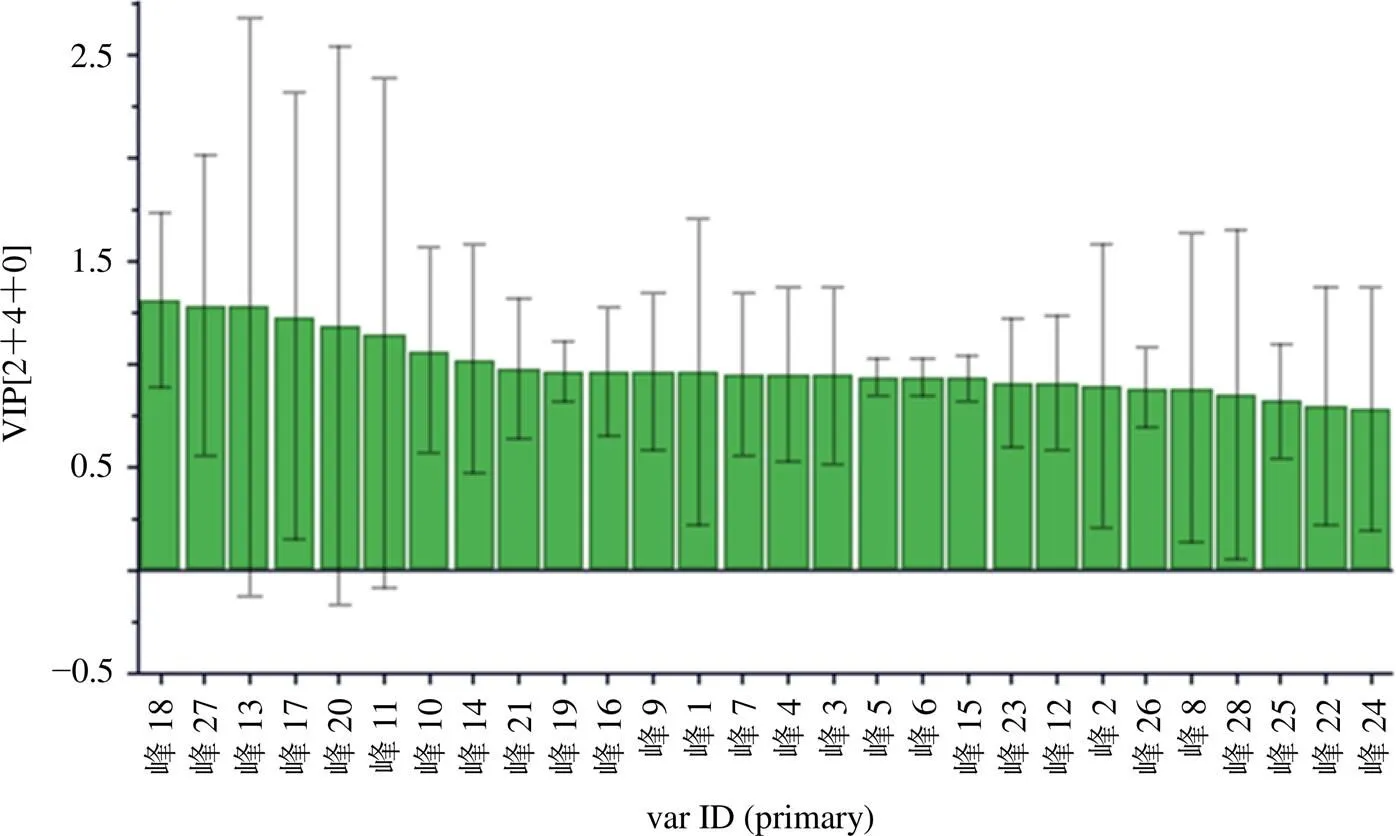
图5 10批JSP(颗粒)中28个共有峰的VIP值
2.4 基于物质-效应关联的JSP(颗粒)核心成分筛选分析
2.4.1 成分与疾病交集靶点的获取 综合考虑JSP的HPLC指纹图谱结合化学计量学结果,以及基于可测性及可溯性的原则,共筛选出潜在芍药内酯苷、芍药苷、甘草苷、野黄芩苷、柚皮苷、橙皮苷、新橙皮苷、柚皮素、甘草酸铵9个指标性成分作为候选成分。在swiss target prediction数据库获取这9个指标性成分的作用靶点,并结合中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP),确定特征图谱鉴定出的有效作用靶点。除甘草酸铵无有效作用靶点外,经过Uniport数据库统一校正去重后共得到成分靶点183个。以“stomachache”“hypochondriac pain”“gastritis”为关键词检索与胃痛疾病相关的基因,在GeneCards数据库中获取疾病作用靶点1581个。最终取药物成分靶点与疾病靶点交集,得到55个JSP治疗胃痛相关疾病的潜在作用靶点(图6)。
2.4.2 蛋白与蛋白相互作用(protein protein interaction,PPI)网络关系的构建与关键靶点分析 将成分与疾病的交集靶点导入STRING软件中进行PPI分析,物种限定为“Homo sapiens”。以置信度>0.9作为筛选条件,隐藏无关联性的点位,得到核心PPI网络,将网络图导入Cytocape 3.8.2软件中进行可视化分析,包括度值(degree)、介数中心性(betweenness centrality)、接近中心度(closeness centrality)的数值分析,详细分析图及拓扑异构参数如图7和表3所示。筛选得到的核心互作蛋白包括血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、肿瘤坏死因子(tumor necrosis factor,TNF)等。
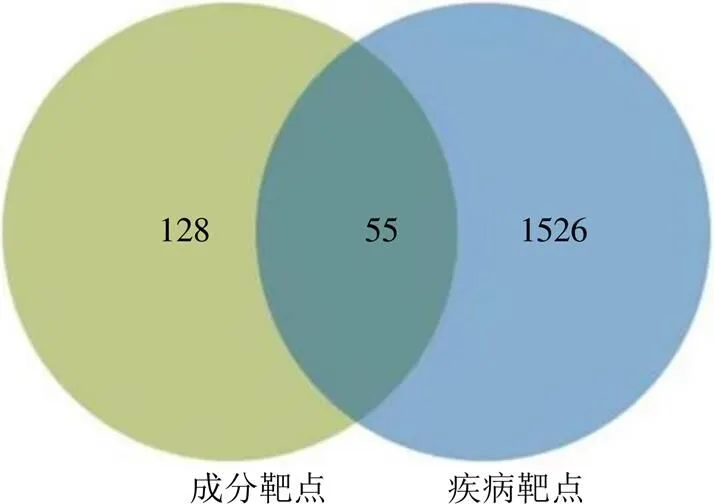
图6 成分靶点与疾病靶点的韦恩图
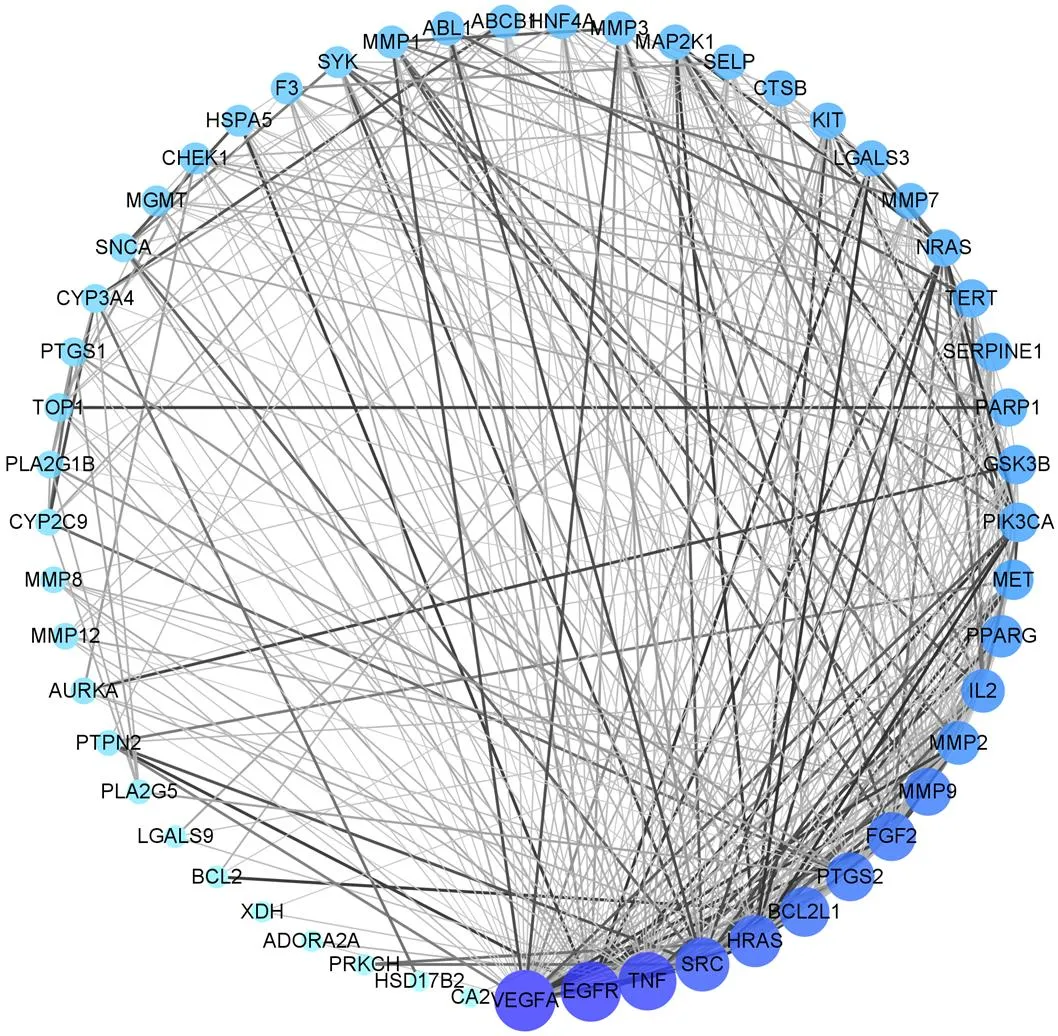
图7 PPI核心网络图
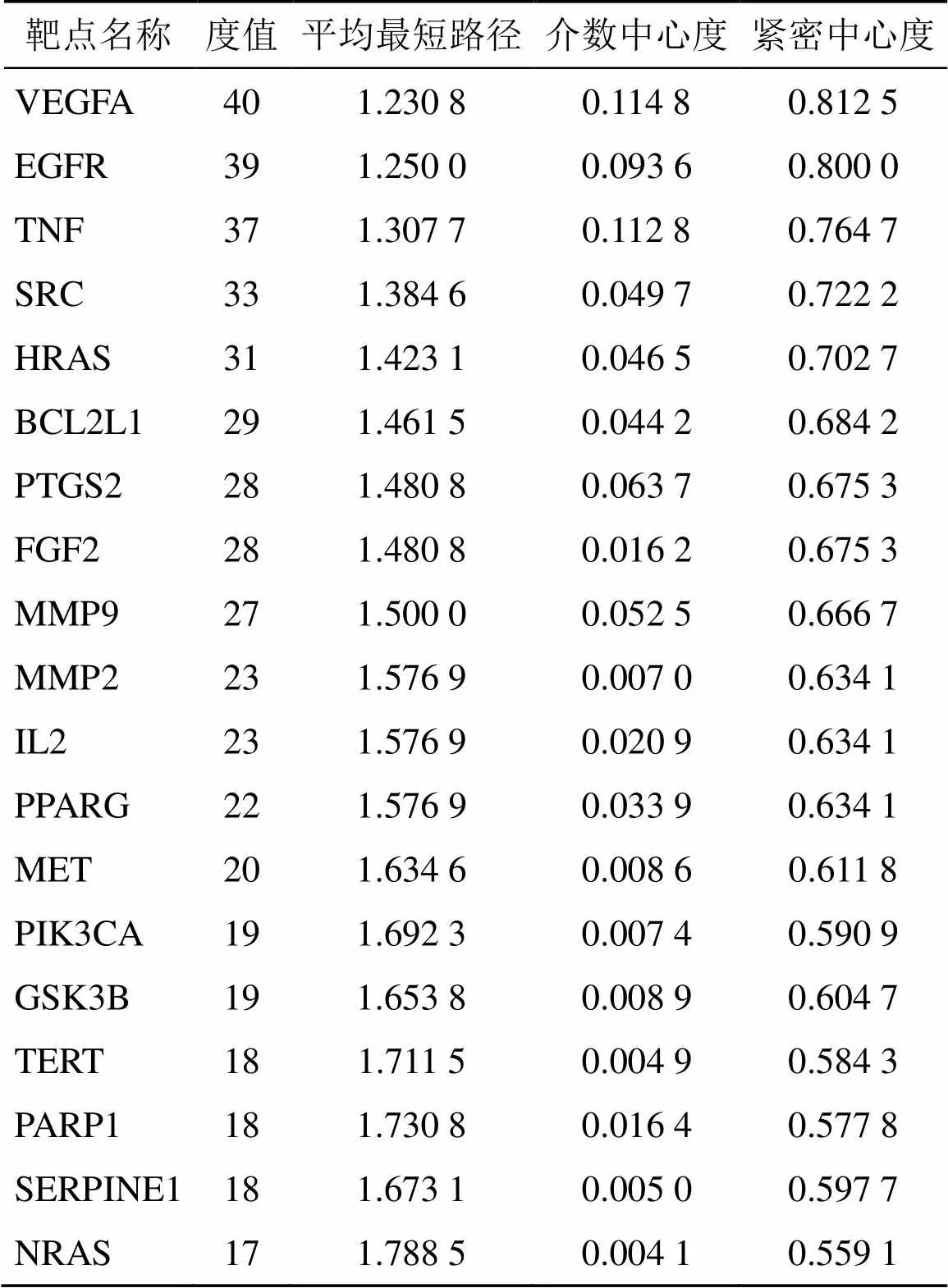
表3 PPI核心拓扑异构参数信息
2.4.3 基因本体论(gene ontology,GO)生物功能注释与京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集 将JSP治疗胃痛相关疾病的核心靶点信息导入Metascape平台和David平台进行功能和信号通路分析,依据<0.01,涉及靶点数量≥3,富集因子>1.5的条件筛选出关键作用通路,结合核心作用通路的有效作用靶点,得到KEGG富集分析-核心靶点-通路作用图(图8)。分析结果显示,JSP治疗胃痛相关疾病作用靶点主要富集在Ras信号通路(Ras signaling pathway)、磷脂酰肌醇-3-羟激酶(phosphatidylinositol-3-hydroxykinase,PI3K)-蛋白激酶B(protein kinase B,Akt)信号通路、松弛素信号通路(Relaxin signaling pathway)、Rap1信号通路(Rap1 signaling pathway)等,提示这些经典通路可能在JSP治疗胃痛相关疾病作用中发挥着重要作用。
JSP治疗胃痛相关疾病在体内的作用位置和生物过程见GO分析图(图9)。生物学过程(biological processes,BP)富集分析提示,细胞迁移的正向调节、细胞对氮化合物的反应、半胱氨酸型内肽酶活性的调控在JSP治疗胃痛相关疾病中比较重要;细胞组分(cellular component,CC)富集分析表明,靶点的产物可能主要在细胞外基质、薄膜侧面、血小板α颗粒部位;分子功能(molecular function,MF)富集分析表明,靶点可能是通过调节蛋白激酶活性、丝氨酸型内肽酶活性、蛋白酪氨酸激酶活性等发挥作用。
2.4.4 物质-效应网络的构建 为了进一步确定JSP的关键效应物质,为后续成分定量及相关方法学检测分析做铺垫,拟通过构建物质-效应网络确定最为核心的效应成分。筛选原则是基于以上的作用靶点及作用通路分析,选出作用最强的前10条作用通路,并与相匹配的作用靶点及成分一一对应,将数据导入Cytoscape软件中,根据节点度值的连接强度确定核心效应物质(图10)。研究发现芍药内酯苷、芍药苷、橙皮苷、新橙皮苷、柚皮苷的连接强度较大,表明这5种物质相对来说对应更强的效应。
2.4.5 Q-Marker的分析 通过建立JSP的HPLC指纹图谱,共标定了28个共有峰,指认了9个化学成分,再根据PCA和OPLS-DA结果可知,PCA中对主成分贡献较大的前8名色谱峰分别为峰24、23、22、28(甘草酸铵)、26(柚皮素)、27、13(甘草苷),OPLS-DA中VIP值前15名色谱峰分别为峰18、27、13(甘草苷)、17(野黄芩苷)、20(橙皮苷)、11(芍药苷)、10、14、21(新橙皮苷)、19(柚皮苷)、16、9(芍药内酯苷)、1、7、4。综合考虑JSP的HPLC指纹图谱结合化学计量学结果,以及基于可测性及可溯性的原则,剔除未知色谱峰,共筛选出芍药内酯苷、芍药苷、甘草苷、野黄芩苷、柚皮苷、橙皮苷、新橙皮苷、柚皮素、甘草酸铵9个指标性成分作为候选成分。将9个候选成分进行网络药理学分析,构建物质-效应的网络,进一步分析JSP的潜在Q-Marker。在物质-效应网络的构建中,其主要靶点为EGFR、转化蛋白p21/H-Ras-1(transforming protein p21/H-Ras-1,HRAS)、人丝裂原激活蛋白激酶激酶1(recombinant mitogen activated protein kinase 1,MAP2K1)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)等靶点;主要通路为癌症相关通路、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、Ras信号通路(Ras signaling pathway)等。主要的靶点和信号通路与治疗胃痛相关疾病均有一定联系,如PI3K/Akt信号通路参与胃黏膜上皮重建、促进胃部肿瘤的发生发展[17]。实验研究表明,PI3K/Akt通路能够调控萎缩性胃炎和胃癌胃黏膜的损伤程度,当PI3K激活后,在细胞质膜上产生磷脂酰肌醇三磷酸酯,该蛋白与信号蛋白Akt和磷酸肌醇依赖性激酶1结合,后者在细胞中含有PH结构域,导致Akt激活,从而调节胃黏膜细胞的增殖、分化和凋亡[18]。由网络图可知芍药内酯苷、芍药苷、橙皮苷、新橙皮苷、柚皮苷的连接强度较大,表明这5种物质相对来说对应更强的效应。

图8 KEGG富集分析-核心靶点-通路作用图

图9 GO富集分析图
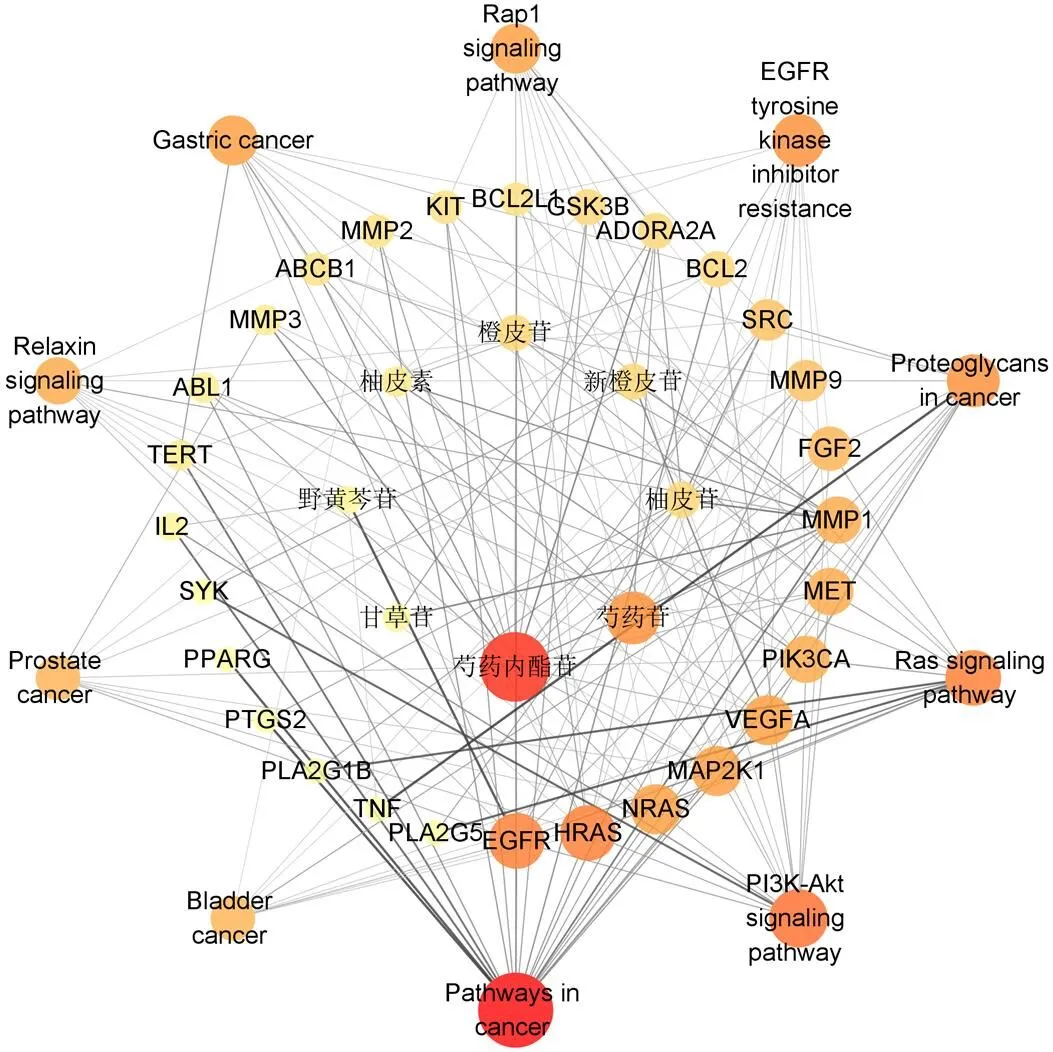
图10 物质-效应网络图
有文献报道,以芍药苷和芍药内酯苷为代表的单萜及其苷类成分具有镇痛、抗炎的作用,是白芍中公认的药效物质,以前者含有量最高,为质量控制指标成分[19-20]。橙皮苷、新橙皮苷、柚皮苷等黄酮类成分具有胃排空、改善大鼠的胃溃疡症状及抗炎镇痛等作用[21-22];枳实中柚皮苷和新橙皮苷被预测为Q-Marker[23]。研究表明[6],代代花中含有丰富的挥发油、柚皮苷、橙皮苷、新橙皮苷等二氢黄酮类成分,具有抗炎、抗病毒、促进胃肠蠕动等药理作用。
综上所述,通过指纹图谱和化学计量学分析所获得的9个指标性成分可通过作用于多靶点、干预多条通路发挥药效作用,说明指纹图谱结合化学计量学所选的指标成分具有合理性。而从物质-效应网络中可知,9个指标性成分中,芍药内酯苷、芍药苷、橙皮苷、新橙皮苷、柚皮苷的连接强度较大,表明这5种物质相对来说对应更强的效应。因此,综合有效性、可测性和可溯源性原则,确定芍药内酯苷、芍药苷、橙皮苷、新橙皮苷、柚皮苷为JSP的潜在Q-Marker,可作为JSP的检测成分。
2.5 JSP(颗粒)中5个成分含量测定
2.5.1 供试品溶液的制备 制备方法同“2.1.1”项。
2.5.2 对照品溶液的制备 取各对照品适量,精密称定,加70%甲醇分别制成含芍药内酯苷1 mg/mL、芍药苷2 mg/mL、柚皮苷3 mg/mL、橙皮苷1 mg/mL、新橙皮苷3 mg/mL的单一对照品储备液:分别吸取以上5种对照品储备液适量,加70%甲醇制成不同质量浓度的混合对照品溶液。
2.5.3 阴性样品溶液的制备 按JSP(颗粒)处方工艺分别制备缺白芍阴性、缺枳实、代代花的阴性样品,按“2.1.1”项下方法制备阴性样品溶液。
2.5.4 色谱条件 色谱柱为X Select®HSS T3 C18柱(250 mm×4.6 mm,5 µm);流动相为乙腈-0.1%磷酸水溶液;梯度洗脱条件:0~10 min,2%~3%乙腈;10~15 min,3%~14%乙腈;15~25 min,14%~19.5%乙腈;25~35 min,19.5%~21.5%乙腈;35~45 min,21.5%~22%乙腈;45~47 min,22%~42%乙腈;47~55 min,42%~50%乙腈;55~58 min,50%乙腈;体积流量1.0 mL/min;柱温25 ℃;进样体积10 µL;紫外检测波长为230 nm。
2.5.5 系统适用性与专属性试验 取“2.5.1”~“2.5.3”项下的供试品溶液、混合对照品溶液和阴性样品溶液,按“2.5.4”项下液相色谱条件进样测定,结果如图11所示,5种指标成分色谱峰于其相邻色谱峰之间的分离度均>1.5,各阴性样品溶液色谱图在待测成分出峰位置无干扰,表明该方法下5种成分专属性良好。

1-芍药内酯苷 2-芍药苷 3-柚皮苷 4-橙皮苷 5-新橙皮苷
2.5.6 线性关系考察 将“2.5.2”项下制成的5个质量浓度的混合对照品溶液,按“2.5.4”项下色谱条件进样测定,并记录5种成分的峰面积。以质量浓度为横坐标(),以峰面积为纵坐标()进行线性回归,分别绘制标准曲线并得到相关系数和线性范围,结果分别为芍药内酯苷=11 338 712.0+8 780.3,=1.000 0,线性范围3.571~238.000 µg/mL;芍药苷=13 110 958.8+59 875.4,=0.999 7,线性范围12.60~492.00 µg/mL;柚皮苷=25 184 174.0+145 092.5,=1.000 0,线性范围254.0~1 222.0 µg/mL;橙皮苷=23 394 991.5-108 034.5,=0.999 6,线性范围6.144~400.000 µg/mL;新橙皮苷=24 395 012.9-122 447.7,=0.999 9,线性范围56.83~1 820.00 µg/mL;结果表明5种成分在各自质量浓度范围内线性关系均良好。
2.5.7 精密度试验 取样品(S1)约2 g,按“2.5.1”项下方法制备供试品溶液,按“2.5.4”项下色谱条件连续进样6次,记录峰面积,计算各成分RSD值。结果显示,5种成分芍药内酯苷、芍药苷、柚皮苷、橙皮苷、新橙皮苷的峰面积RSD分别为0.9%、0.4%、0.6%、0.6%、0.5%,表明仪器精密度良好。
2.5.8 稳定性试验 取样品(S1)约2 g,按“2.5.1”项下方法制备供试品溶液,于室温下放置0、2、4、8、12、24 h后,按“2.5.4”项下色谱条件进样分析,记录峰面积,计算各成分RSD值。结果显示,5种成分芍药内酯苷、芍药苷、柚皮苷、橙皮苷、新橙皮苷的峰面积RSD分别为1.7%、0.7%、0.3%、0.5%、0.4%,表明供试品溶液在24 h内稳定性良好。
2.5.9 重复性试验 取同一批次的样品(S1),每份约2 g,按“2.5.1”项下方法平行制备6份供试品溶液,按“2.5.4”项下色谱条件分别进样分析,记录峰面积,计算各成分含量及其RSD值。结果显示,5种成分芍药内酯苷、芍药苷、柚皮苷、橙皮苷、新橙皮苷质量分数的RSD分别为1.7%、0.7%、0.3%、0.5%、0.4%,表明提取方法的重复性良好。
2.5.10 加样回收率试验 取同一批次已测定5种成分含量的样品(S1)6份,每份1.0 g,精密称定,分别加入具塞锥形瓶中,精密加入1 mL混合对照品溶液(与样品中5种待测成分相同含量的混合对照品溶液),按“2.5.1”项下方法制备供试品溶液,按“2.5.4”项下色谱条件进样测定,记录峰面积,计算6份供试品平均加样回收率及RSD值。结果显示,芍药内酯苷、芍药苷、柚皮苷、橙皮苷、新橙皮苷的平均加样回收率分别为95.23%、96.48%、92.52%、94.26%、93.96%,RSD分别为2.6%、0.95%、2.0%、1.4%、1.3%,表明提取方法的准确度良好。
2.5.11 供试品含量测定 取10批JSP(颗粒)样品(S1~S10)各2 g,按“2.5.1”项下方法分别制备供试品溶液,按“2.5.4”项下色谱条件进样测定,记录峰面积,计算样品中5种成分平均含量,结果见表4。结果显示10批JSP(颗粒)样品(S1~S10)中成分芍药内酯苷在0.107 6~0.203 6 mg/g、芍药苷在0.475 9~1.204 6 mg/g、柚皮苷在2.310 9~5.223 8 mg/g、橙皮苷在0.410 3~0.796 8 mg/g、新橙皮苷在4.311 9~8.343 3 mg/g,10批样品中5种成分平均含量波动范围不大,制备工艺稳定。
3 讨论
本实验基于Q-Marker可测、特有、有效、传递及配伍“五原则”,首先采用HPLC建立JSP(颗粒)指纹图谱,筛选出28个共有峰,确定了28个共有峰在6味药材中的归属,并结合PCA及OPLS-DA和可测性,筛选出9个候选Q-Marker,分别为芍药内酯苷、芍药苷、甘草苷、野黄芩苷、柚皮苷、橙皮苷、新橙皮苷、柚皮素、甘草酸铵。随后采用网络药理学方法从有效性方面对9个可能的标志物成分进行靶点预测及相关通路的富集,涉及的靶点和通路与治疗胃痛相关症状有关,主要包括VEGFA、EGFR、TNF、SRC、HRAS、BCL2L1、PTGS2等核心靶点,富集的通路包括Ras signaling pathway、PI3K-Akt signaling pathway、Relaxin signaling pathway、Rap1 signaling pathway等,最终预测得到5个Q-Marker成分,建立其HPLC含量测定方法。
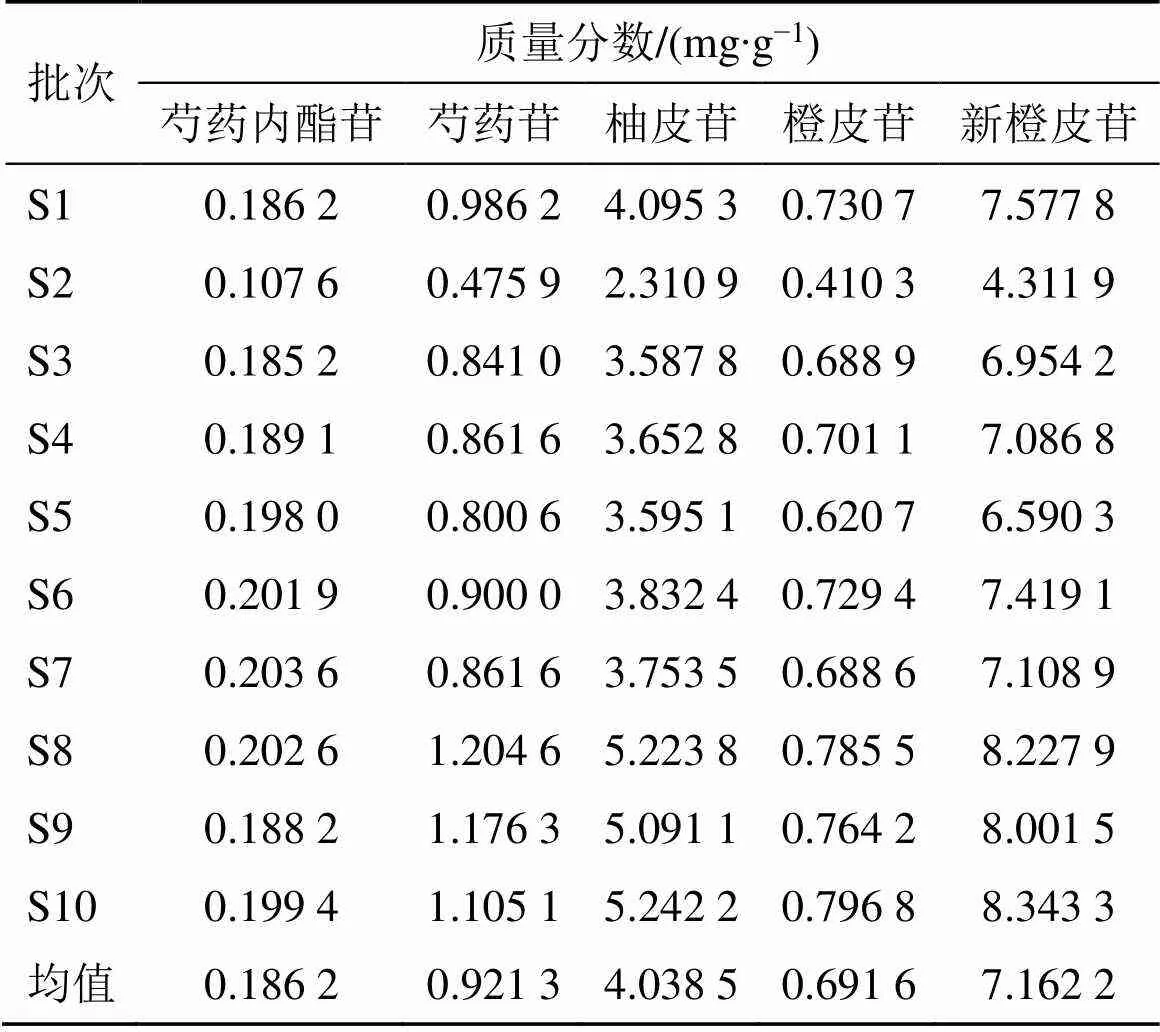
表4 10批JSP (颗粒) 中5个成分的含量测定结果(n = 3)
建立JSP(颗粒)的指纹图谱,从整体上对其质量进行控制,本实验分别考察了甲醇-水、乙腈-水、乙腈-0.1%磷酸水溶液、甲醇-0.1%硫酸水溶液5 种不同的流动相下色谱峰的分离情况,结果发现流动相为乙腈-水、甲醇-水时,峰较少,流动相为乙腈-0.1%磷酸水溶液、甲醇-0.1%磷酸水溶液溶液时,峰的数量接近,但乙腈-0.1%磷酸水溶液系统各峰分离效果好,故选择乙腈-0.1%磷酸水溶液为流动相。同时,采用200~400 nm全波长扫描,发现在240 nm处色谱峰数目较多,各峰吸收较均匀,可体现指纹图谱的整体性和模糊性。而在对芍药内酯苷、芍药苷、柚皮苷、橙皮苷、新橙皮苷5种成分进行含量测定时,发现检测波长230 nm时的峰信号响应值较高,分离度良好,可同时测定5种成分含量。另外,考察了色谱柱温度(25、30、35 ℃),体积流量(0.8、1.0、1.2 mL/min)及不同类型色谱柱,最终确定上述色谱条件。
综上所述,本研究首次采用指纹图谱结合化学计量学联合网络药理学的方法,预测JSP(颗粒)的Q-Marker,然后测定其含量,为JSP研制成古代经典名方中药复方制剂提供质量控制依据,同时也为中药质量控制指标性成分的选择提供了一种新的思路。
利益冲突 所有作者均声明不存在利益冲突
[1] 杨丽华, 马春. 中医治疗胃痛的研究进展 [J]. 世界中西医结合杂志, 2007, 2(9): 553-555.
[2] 吴迁. 疏肝健脾和胃法治疗消化科肝胃不和型胃脘痛的效果分析 [J]. 现代消化及介入诊疗, 2018, 23(S2): 111-112.
[3] 赵爱红, 赵雪勤, 景忠良. 中西医结合治疗胃脘痛的临床观察与辨证施护 [J]. 中国民间疗法, 2012, 20(3): 70.
[4] 徐凌志, 李树波. 四逆散的神经系统药理作用与临床应用 [J]. 长春中医药大学学报, 2010, 26(1): 126-127.
[5] 吴红伟, 李东辉, 张育贵, 等. 四逆散研究进展及质量标志物的预测分析 [J]. 中华中医药学刊, 2021, 39(12): 13-20.
[6] 王婷, 娄鑫, 苗明三. 代代花的现代研究与思考 [J]. 中医学报, 2017, 32(2): 276-278.
[7] 中国药典[S]. 一部. 2020: 122-123.
[8] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[9] 刘昌孝. 中药质量标志物 (Q-marker): 提高中药质量标准及质量控制理论和促进中药产业科学发展 [J]. 中草药, 2019, 50(19): 4517-4518.
[10] Zhang L, Jia Y Z, Li B,. A review of lignans from genusand their spectrum characteristics [J]., 2021, 13(2): 157-166.
[11] 刘昌孝. 中药质量标志物(Q-Marker)研究发展的5年回顾 [J]. 中草药, 2021, 52(9): 2511-2518.
[12] 李佳涵, 王慧, 刘佳星, 等. 整合指纹图谱与多成分含量测定的酸枣仁汤质量评价研究 [J]. 中草药, 2022, 53(15): 4698-4708.
[13] 王堯, 张小飞, 邹俊波, 等. 当归挥发油治疗高血压药理机制的网络分析 [J]. 天然产物研究与开发, 2021, 33(4): 657-666.
[14] 王迎春, 马永犇, 甄亚钦, 等. 基于指纹图谱和网络药理学的芍药甘草汤抗肝损伤活性成分及含量测定研究 [J]. 世界科学技术—中医药现代化, 2022, 24(8): 3030- 3042.
[15] 李海伦, 李恒, 孙飞, 等. 经典名方大秦艽汤HPLC指纹图谱及含量测定方法研究 [J]. 中草药, 2021, 52(1): 99-107.
[16] 牛明, 张斯琴, 张博, 等.《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[17] 孙兆瑞, 刘红梅, 杨志洲, 等. 肠三叶因子介导PI3K/ Akt信号通路保护胃黏膜上皮细胞紧密连接 [J]. 临床急诊杂志, 2014, 15(7): 379-382.
[18] Rao V S, Srinivas K, Sujini G N,. Protein-protein interaction detection: Methods and analysis [J]., 2014, 2014: 147648.
[19] 吴丽, 王丽丽, 费文婷, 等. 芍药苷和芍药内酯苷对小鼠疼痛模型的镇痛作用及对β-EP、PGE2的影响 [J]. 中华中医药杂志, 2018, 33(3): 915-918.
[20] 张燕丽, 田园, 付起凤, 等. 白芍的化学成分和药理作用研究进展 [J]. 中医药学报, 2021, 49(2): 104-109.
[21] Chen K H, Weng M S, Lin J K. Tangeretin suppresses IL-1beta-induced cyclooxygenase (COX)-2 expression through inhibition of p38 MAPK, JNK, and AKT activation in human lung carcinoma cells [J]., 2007, 73(2): 215-227.
[22] 谢仁峰, 文双娥, 李洋, 等. 柚皮苷抗炎镇痛作用的实验研究 [J]. 湖南师范大学学报: 医学版, 2011, 8(4): 5-8.
[23] 许姗姗, 许浚, 张笑敏, 等. 常用中药陈皮、枳实和枳壳的研究进展及质量标志物的预测分析 [J]. 中草药, 2018, 49(1): 35-44.
Analysis of quality markers of Jiawei Sini Powder (Granules) based on HPLC fingerprint and network pharmacology and establishment of content determination method
CHEN Jing-mei1, 2, 3, 4, LI Ze-yu2, 3, 4, 5, LIANG Qiu-ming6, YUE Zi-jun1, TANG Zuo-wei1, HAO Er-wei2, 3, 4, 5, DU Zheng-cai2, 3, 4, 5, HOU Xiao-tao1, 2, 3, 4, DENG Jia-gang2, 3, 4, 5
1. Faculty of Pharmacy, Guangxi University of Chinese Medicine, Nanning 530200, China 2. Guangxi Key Laboratory of Efficacy Study on Chinese Materia Medica, Nanning 530200, China 3. Guangxi Collaborative Innovation Center of Research on Functional Ingredients of Agricultural Residues, Nanning 530200, China 4. Guangxi Key Laboratory of Theory and Transformation of Damp Disease Prescriptions, Nanning 530200, China 5. Guangxi Scientific Experimental Center of Traditional Chinese Medicine, Guangxi University of Chinese Medicine, Nanning 530200, China 6. Guangxi Qinzhou Hospital of Traditional Chinese Medicine, Qinzhou 535000, China
To analyze and predict potential quality markers (Q-Marker) of Jiawei Sini Powder (JSP, 加味四逆散) (Granules), and determine the content of Q-Marker components based on fingerprint and network pharmacology methods, providing reference for quality control.Firstly, the potential Q-Marker of JSP (Granules) were analyzed by fingerprint and chemometrics. On this basis, a substance effect network was constructed through network pharmacology to further analyze and predict the Q-Marker associated with the efficacy of JSP (Granules), and an HPLC method was established to determine the content of the predicted landmark components.An HPLC fingerprint of JSP (Granules) was established, identifying 28 common peaks, and assigning them to different peaks. Among them, peaks 1, 9, and 11 come from Baishao (, PRA), peaks 26, and 27 come from Zhishi (, AFI), peaks 13, and 28 come from Zhigancao (etcum, GRRPM), peaks 2, 4, 10, 12, 16, and 24 come from Daidaihua (var.), peaks 15, 17, and 22 come from Banzhilian (), peaks 25 come from both PRA and GRRPM, peaks 3, 5—8, 14, 18—21, and 23 come from both AFI andvar.. Nine common peaks were identified, including albiflorin, paeoniflorin, glycyrrhizin, scutellarin, naringin, and hesperidin, neohesperidin, naringin, ammonium glycyrrhetate. The similarity evaluation showed that the similarity of 10 batches of JSP (Granules) samples ranges from 0.954—1.000. Principal component analysis (PCA) showed that the cumulative variance contribution rate of the first four principal components was 95.003%, while orthogonal partial least squares-discriminant analysis (OPLS-DA) showed that 12 components had higher variable importance projection values. On this basis, the network pharmacology method was used to analyze and conclude that albiflorin, paeoniflorin, naringin, hesperidin and neohesperidin may be the potential Q-Marker of JSP (Granules). The content of the above five components was determined simultaneously, and the methodological investigation results were good. The average sample recovery rate was 92.52%—96.48%, and the RSD was 1.3%—2.6%. The mass fractions of albiflorin, paeoniflorin, naringin, hesperidin, and neohesperidin in 10 batches of samples were 0.107 6—0.203 6, 0.475 9—1.204 6, 2.310 9—5.223 8, 0.410 3—0.796 8, 4.311 9—8.343 3 mg/g.This study established an HPLC fingerprint of JSP (Granules) and combined it with network pharmacology to predict five Q-marker components and establish a quantitative determination method, providing a quality control basis for the development of JSP (Granules) into ancient classic Chinese medicine compound formulations.
Jiawei Sini San; quality markers; HPLC; fingerprint; network pharmacology; principal component analysis; orthogonal partial least squares-discriminant analysis; albiflorin; paeoniflorin; naringin; hesperidin; neohesperidin
R283.6
A
0253 - 2670(2023)20 - 6682 - 12
10.7501/j.issn.0253-2670.2023.20.012
2023-05-26
中国东盟传统药物研究国际合作联合实验室建设(二期)资助项目(AD19110165);广西中医药大学2022年研究生教育创新计划项目(YCSZ2022004);2020年度广西中药药效研究重点实验室运行补助项目(20-065-38)
陈静梅(1996—),女,广西梧州人,硕士研究生,从事中药分析学研究。Tel: 13257715817 E-mail: 2369375473@qq.com
通信作者:侯小涛(1969—),女,博士生导师,教授,从事中药活性成分与质量控制研究。E-mail: xthou@126.com
[责任编辑 郑礼胜]
