叶酸修饰的克班宁聚乙二醇-聚乳酸羟基乙酸共聚物纳米粒的制备及其体外抗肿瘤活性研究
2023-10-19张海亮赵笑雨唐钧泽吴健铭郑永仁
潘 蕊,张海亮,赵笑雨,唐钧泽,吴健铭,郑永仁,程 欣, 2, 4*
叶酸修饰的克班宁聚乙二醇-聚乳酸羟基乙酸共聚物纳米粒的制备及其体外抗肿瘤活性研究
潘 蕊1, 3, 4,张海亮1, 4,赵笑雨1,唐钧泽1,吴健铭1,郑永仁5,程 欣1, 2, 4*
1. 云南中医药大学中药学院,云南 昆明 650500 2. 云南省高校外用给药系统与制剂技术研究重点实验室,云南 昆明 650500 3. 云南省南药可持续利用研究重点实验室,云南 昆明 650500 4. 云南省傣医药与彝医药重点实验室,云南 昆明 650500 5. 云南中医药大学科学技术处,云南 昆明 650500
制备叶酸修饰的克班宁聚乙二醇-聚乳酸羟基乙酸共聚物纳米粒(folic acid modified crebanine polyethylene glycol-polylactic acid hydroxyacetic acid copolymer nanoparticles,FA-Cre@PEG-PLGA NPs),并考察其体外释放及抗肿瘤活性。以克班宁为模型药,用PEG-PLGA共聚物、叶酸等为材料,通过超声乳化-溶剂挥发法制备FA-Cre@PEG-PLGA NPs,采用激光粒度仪、透射电子显微镜和荧光显微镜对FA-Cre@PEG-PLGA NPs的粒径、ζ电位及形态进行表征,紫外光谱法测定并计算克班宁的包封率和载药量,比较FA-Cre@PEG-PLGA NPs和克班宁原料药72 h的体外释放规律,通过溶血实验考察二者生物学特性,CCK-8实验考察两者对正常肝L02细胞存活率的影响及对肝癌Bel-7402细胞体外增殖抑制作用。细胞划痕法考察纳米粒和原料药对肝癌Bel-7402细胞迁移能力的影响。荧光显微镜观察纳米粒在不同时间点对肝癌Bel-7402细胞的摄取情况。FA-Cre@PEG-PLGA NPs的平均粒径为(247.67±2.49)nm,多分散指数(polydispersity index,PDI)为0.139±0.027,ζ电位为(−9.40±0.54)mV,透射电子显微镜下呈圆球状核壳结构,荧光显微镜下观察纳米粒,其气化后明场呈蓝色光点、暗场呈红色光点。FA-Cre@PEG-PLGA NPs中克班宁的包封率为83.78%,载药量为67.78%。FA-Cre@PEG- PLGA NPs与克班宁原料药体外释放均符合Ritger-Peppas模型;安全性评价结果显示,FA-Cre@PEG-PLGA NPs相比于克班宁原料药在50~300 μg/mL内具有良好的生物相容性。FA-Cre@PEG-PLGA NPs对人正常肝L02细胞毒性较低,相比于克班宁原料药有一定的安全性。体外增殖抑制结果显示,两者对Bel-7402肿瘤细胞的增殖抑制率均呈现出剂量依赖性和时间依赖性,且FA-Cre@PEG-PLGA NPs联合超声辐照后对Bel-7402肝癌细胞具有更强的杀伤作用。细胞划痕实验表明,克班宁原料药、FA-Cre@PEG-PLGA NPs对Bel-7402肿瘤细胞迁移均有抑制作用,呈剂量依赖性,且纳米粒联合超声抑制细胞迁移效果更显著。细胞摄取实验表明,相同时间下超声联合纳米粒能有效增强肿瘤细胞的摄取。成功制得FA-Cre@PEG- PLGA NPs,而且体外具有良好的缓释效果和抑瘤作用,为FA-Cre@PEG-PLGA NPs应用于肝癌的治疗研究提供实验依据。
叶酸;聚乙二醇-聚乳酸羟基乙酸;克班宁;纳米粒;抗肿瘤活性;体外释放;超声乳化-溶剂挥发法
克班宁是一种异喹啉类阿朴菲型生物碱,提取自防己科千金藤属植物云南地不容H. S. Lo的块根中[1-2]。研究表明,克班宁具有镇静[3]、镇痛[4]、抗炎[5-6]、抗心律失常[7]等作用。近期研究表明克班宁对多种肿瘤细胞有明显的增殖抑制作用,如对人肝癌SMMC-7721细胞[8]、人肺腺癌A549细胞[9]、宫颈癌细胞系(KB-3-1和KB-V1)[10]等肿瘤细胞均具有明显的细胞毒性。
作为一种新型的肿瘤治疗方法,纳米粒疗法正逐渐应用于癌症治疗的临床研究,纳米颗粒具有良好的可降解性,可以被递送到肿瘤组织,具有较强的高渗透长滞留效应(enhanced permeability and retention effect,EPR)[11-12]。聚乙二醇-聚乳酸羟基乙酸(polyethylene glycol-polylactic acid hydroxyacetic acid,PEG-PLGA)共聚物中含有亲水段聚乙二醇(polyethylene glycol,PEG)和两亲性的聚乳酸羟基乙酸(polylactic acid hydroxyacetic acid,PLGA)共聚物。PEG具有良好的亲水性,能延长药物在体内的循环和滞留时间并提高稳定性。PLGA具有良好的生物相容性和安全性,在体内可降解为无毒的聚乳酸[13]。用PEG修饰PLGA后,可提高PLGA的亲水性,减少巨噬细胞的识别和吞噬,延长体内的循环时间。有学者认为PEG也可通过EPR效应增加纳米粒肿瘤蓄积[14-15]。叶酸是一种小分子维生素,具有相对分子质量小、无免疫原型、价廉易得、与受体亲和力强等优点,可与叶酸受体(folate receptor,FR)尤其FRα亚型在体内发生特异性结合。叶酸受体在许多恶性肿瘤如肝癌、乳腺癌、宫颈癌等癌细胞表面过度表达,而在正常细胞中几乎不表达或表达水平极低[16-18]。为得到具有叶酸靶向性的运载系统,通过化学修饰将叶酸分子的羧基与PEG-PLGA中PEG的氨基端连接,从而得到靶向运载体聚乙二醇-聚乳酸羟基乙酸-叶酸(polyethylene glycol-polylactic acid hydroxyacetic acid-folic acid,PEG-PLGA-FA)。将药物包裹于PEG-PLGA-FA载体内,将赋予其叶酸靶向功能,特异性地选择FRα高表达的恶性肿瘤细胞,大大降低药物的不良反应,从而促进其在细胞水平或体内的吸收。
针对克班宁毒性较大[19]、半衰期短[20]、水溶性差[21]等缺点,本实验以PLGA-PEG-FA为载体,制备叶酸修饰的克班宁聚乙二醇-聚乳酸羟基乙酸共聚物纳米粒(FA-Cre@PEG-PLGA NPs),期望通过纳米粒的小粒径被动靶向和叶酸的主动靶向作用改善克班宁自身缺点,提高药物安全性和肿瘤细胞靶向性,为后续用于治疗肿瘤的新型纳米制剂研究提供依据。
1 仪器与材料
1.1 仪器
190Plus PALS型纳米激光粒度仪,美国布鲁克海文仪器公司;HT7700型透射电子显微镜,HITACHI公司;JY98-IIIDN型超声破碎仪,宁波新芝生物科技股份有限公司;Sigma3-30k型超高速冷冻离心机,德国Sigma公司;Cary 60型紫外分光光度计,美国安捷伦有限公司;MF52-N型荧光倒置显微镜,广州市明美光电技术有限公司;4750E型二氧化碳培养箱,美国Nuaire公司;DMil LED型倒置显微镜,德国Leica公司;Multiskan型酶标仪,美国Thermo公司;DP-50型便携式超声诊断仪,深圳迈瑞生物医疗电子股份有限公司。
1.2 试剂
克班宁,云南中医药大学药剂实验室自制,批号20141101,质量分数99.2%;PLGA,济南岱罡生物科技有限公司,批号20140921;PEG-PLGA-FA,重庆浦诺维生物科技有限公司,批号RO018242;液态氟碳(PFP),美国Strem Chemicals公司,批号28403300;细胞膜荧光探针DiR碘化物,美国Biotium公司,批号20160814;聚乙烯醇(PVA),美国Sigma公司,批号SLBR4157V;CCK-8试剂,西安瑞禧生物科技有限公司,批号20010335;胎牛血清(批号2144324)、青霉素-链霉素(双抗,批号2233204)、DMEM培养基(批号2211070)、磷酸盐缓冲液(PBS),上海达特希尔生物科技有限公司,批号2237244;耦合胶,天津津亚科技发展有限公司,批号20190393。
1.3 细胞株
正常肝L02细胞、肝癌Bel-7402细胞,均由云南中医药大学药剂实验室提供。
1.4 动物
SPF级KM小鼠,雄性,体质量(20±2)g,购自斯贝福(北京)生物技术有限公司,动物生产许可证号为SCXK(京)2019-0010,本课题经云南中医药大学动物实验伦理委员会批准(批准号R-062022082),实验动物饲养于云南中医药大学实验动物中心,使用许可证号为SYXK(滇)K2022- 0004。
2 方法与结果
2.1 FA-Cre@PEG-PLGANPs的制备
采用超声乳化-溶剂挥发法制备FA-Cre@PEG- PLGA NPs,称取克班宁30 mg溶于2 mL的醋酸乙酯中,依次加入PLGA 25.5 mg、5 mg/mL DiR溶液0.1 mL和PFP 300 μL,避光冰浴下,超声破碎仪上乳化180 s,另精密称取PLGA-PEG-FA 76.40 mg溶于2 mL醋酸乙酯并加入上述溶液中,避光冰浴下,超声破碎仪上乳化90 s后加入25 mL 0.5% PVA溶液再次进行超声乳化。随后加入75 mL纯水稀释,室温下通风橱内避光搅拌过夜。最后将所得乳液于冷冻离心机内4 ℃ 16 000 r/min离心(离心半径7.6 cm)5 min,按此方法共离心3次,弃去上清液,收集沉淀,沉淀以5 mL纯水分散,备用。4 ℃冰箱内避光保存。如图1所示,所制备的FA-Cre@ PEG-PLGA NPs为带有淡蓝色乳光的澄清液体,放置后未产生沉淀或絮凝现象。
2.2 FA-Cre@PEG-PLGANPs的表征
2.2.1 纳米粒的粒径、ζ电位测定 取适量纳米粒以纯水稀释5倍,通过激光粒度仪测定纳米粒的平均粒径和ζ电位,重复操作3次,记录平均值。结果见图2-A、B,测得FA-Cre@PEG-PLGA NPs的平均粒径为(247.67±2.49)nm,多分散指数(polydispersity index,PDI)为0.139±0.027,ζ电位为(−9.40±0.54)mV。

图1 FA-Cre@PEG-PLGA NPs的外观
2.2.2 FA-Cre@PEG-PLGA NPs的稳定性考察 将FA-Cre@PEG-PLGA NPs分别于7、15、30、60、90、120、150、180 d取样观察并测定粒径及ζ电位。结果表明,纳米粒外观仍呈淡蓝色,震摇后均匀分散,粒径、ζ电位无明显变化,结果如表1所示,FA-Cre@PEG-PLGA NPs在180 d内平均粒径为(256.09±4.90)nm,RSD为1.92%;平均ζ电位为(−10.28±0.54)mV,RSD为5.44%;平均PDI为0.144±0.007,RSD为4.89%。表明纳米粒在180 d内稳定性良好。
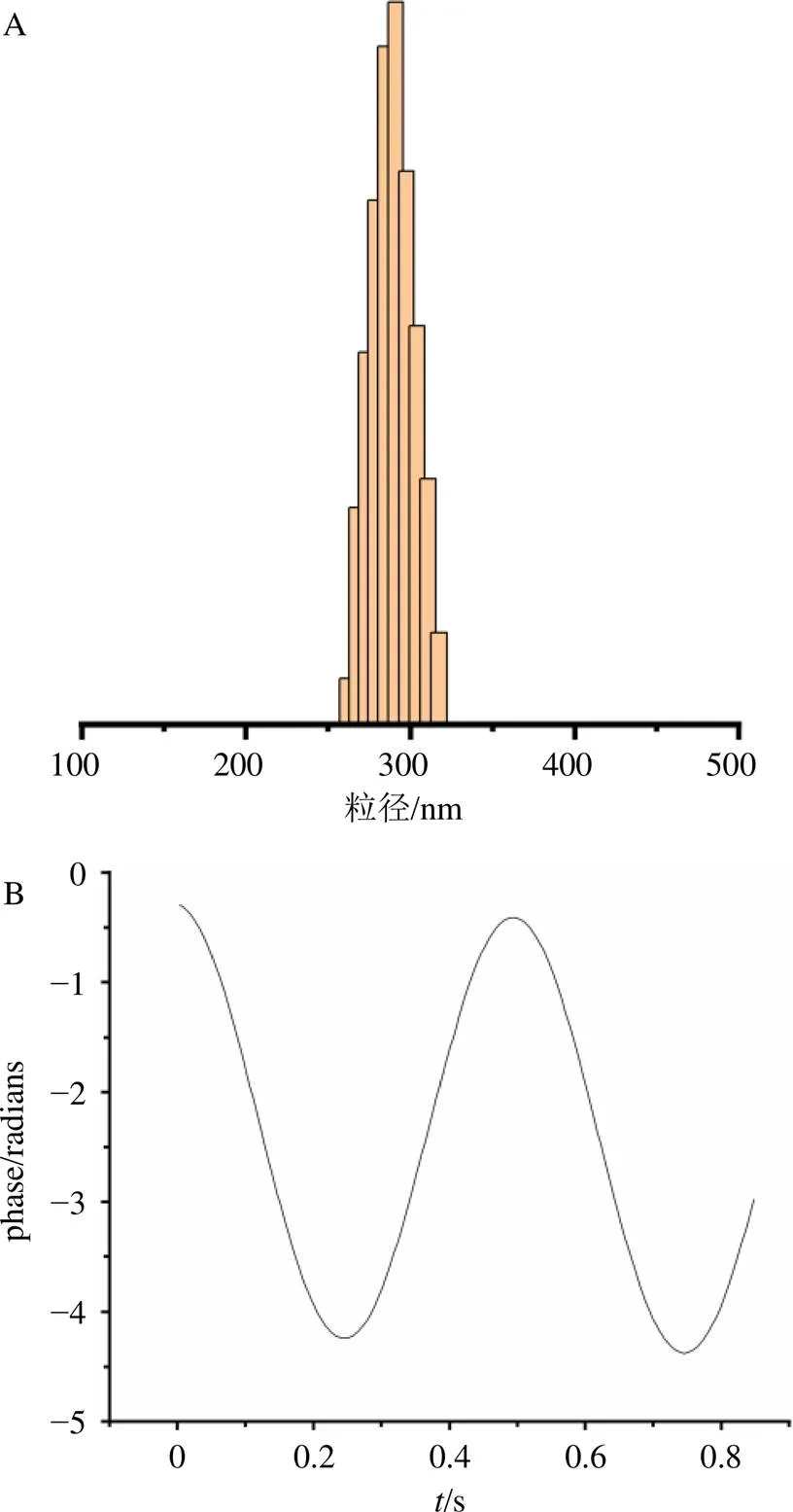
图2 FA-Cre@PEG-PLGA NPs的粒径(A)和ζ电位图(B)
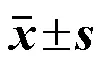
表1 FA-Cre@PEG-PLGA NPs稳定性考察(, n = 3)
2.2.3 纳米粒的形态观察 取适量纳米粒稀释后滴在碳膜铜网上放置5 min,滤纸吸取多余液体,滴加2%磷钨酸溶液染色5 min,自然挥干,采用透射电子显微镜观察纳米粒的形态。如图3-A所示,FA-Cre@PEG-PLGA NPs呈圆球状核壳结构,形态较规整,粒子间未见明显黏连与聚集。另取适量FA-Cre@PEG-PLGA NPs滴于载玻片上。滴入热水使纳米粒稀释气化,于荧光显微镜下观察,得纳米粒明场图和暗场图。并取等量的热水滴于载玻片上,在荧光显微镜下观察热水的明场图和暗场图,并与纳米粒气化后的图像进行对比。如图3-B~E所示,纳米粒气化后明场呈蓝色光点,暗场呈红色荧光点。
2.3 FA-Cre@PEG-PLGANPs中克班宁含量测定方法的建立
2.3.1 线性关系考察 精密称取克班宁2.5 mg对照品置于烧杯中,加适量无水乙醇溶解,用生理盐水定容于25 mL棕色量瓶中,稀盐酸调pH值备用,分别量取0.25、0.50、1.00、1.50、3.00、4.00、5.00 mL于25 mL量瓶中,再加入生理盐水定容,紫外分光光度计280 nm测定吸光度()值。另取适量无水乙醇于量瓶中,加入生理盐水定容作为空白对照。用值对质量浓度()作线性回归方程。得回归方程为=0.061 3-0.013 5,2=0.999 8,结果表明克班宁在1~20 μg/mL线性关系良好。

A-透射电镜图 B-纳米粒明场图 C-纳米粒暗场图 D-热水明场图 E-热水暗场图(×400)
2.3.2 精密度试验 取2、6、16 μg/mL3个不同质量浓度克班宁溶液,测定值,同日内重复3次,连续进样3 d,计算日内日间精密度。结果表明3个质量浓度的日内精密度RSD分别为0.50%、0.16%、0.06%,日间精密度RSD分别为0.51%、0.16%、0.06%,RSD均小于5.0%,符合方法学要求。
2.3.3 重复性试验 制备6份纳米粒样品,每份取0.5 mL,分别置于25 mL棕色量瓶中,用生理盐水定容,同时以生理盐水作为调零溶液,在280 nm处测值。结果,FA-Cre@PEG-PLGA NPs值的RSD为0.49%,表明本方法重复性良好。
2.3.4 稳定性试验 取2 μg/mL克班宁溶液,在室温放置0、2、4、6、8、12、24 h时测定值,考察稳定性,结果显示,克班宁溶液值的RSD为1.01%,稳定性良好,表明克班宁溶液在室温放置24 h内基本稳定。
2.3.5 加样回收率试验 精密量取已测定含量的样品0.5 mL测定1值,之后分别加入样品含量的2、12、20 μg/mL对照品0.5 mL,摇匀,过0.22 μm微孔滤膜,测定吸光度,计算加样回收率,结果显示,低、中、高质量浓度平均回收率为102.05%、101.96%、101.21%,RSD为0.42%、0.27%、0.16%,说明该法测定克班宁含量回收率高、准确可靠。
2.4 包封率和载药量测定
取适量的FA-Cre@PEG-PLGA NPs(投药量1)用无水乙醇稀释后,分别用超声诊断仪探头和超声清洗机超声30 min,得滤液(1),测定其280 nm波长处的吸光度,通过线性回归曲线方程计算出克班宁总质量浓度(1)。取同样体积的纳米粒纯水稀释,离心30 min,取滤液(2),用紫外分光光度法测定并计算出游离克班宁质量浓度(2)。按照下式计算包封率和载药量,得FA-Cre@PEG-PLGA NPs的包封率为83.78%,载药量为67.78%。
包封率=(1-2)/1
载药量=(11-22)/1
2.5 体外释药规律分析
采用透析袋法[23]测定2种制剂体外释药行为。分别取适量的FA-Cre@PEG-PLGA NPs溶液和克班宁无水乙醇溶液于提前处理的透析袋中,透析袋两端系紧。生理盐水(稀盐酸调节pH 6.8)为接受液,在37 ℃,100 r/min条件下,于1、2、4、8、12、24、36、48、72 h取样,并补加10 mL预热的生理盐水。样品测定前经0.45 μm微孔滤膜滤过,用紫外分光光度法测定含量。在280 nm下测量吸光度,计算累积释放率,绘制体外释放曲线。结果见图4,克班宁原料药在释放介质中释放迅速,48 h释放度达到90.67%,FA-Cre@PEG-PLGA NPs仅前12 h属于快速释药期;12~72 h属于缓慢释药期,72 h累积释放率为53.16%。相对于克班宁原料药,FA-Cre@PEG-PLGA NPs有一定的缓释效果。通过软件Origin 2018利用不同释放模型处理克班宁原料药和FA-Cre@PEG-PLGA NPs纳米粒在生理盐水中的释放数据。结果如表2所示,FA-Cre@PEG- PLGA NPs中零级方程2为0.778 1,一级方程2为0.916 1,Higuchi模型2为0.934 2,Ritger-Peppas模型2为0.974 3。其中以Ritger-Peppas模型拟合度最高,符合该模型释放规律。Ritger-Peppas模型可以描述为Q=kt,可以代表药物释放机制,从FA-Cre@PEG-PLGA NPs模型拟合结果可知,释放指数()=0.315 1,当<0.45时,为Fick扩散[22],即药物首先溶解成溶液后再从制剂中扩散出来进入介质,其释药受扩散速率的控制。
2.6 FA-Cre@PEG-PLGANPs安全性评价
2.6.1 溶血实验 预先采集适量小鼠血液,收集在涂有肝素的离心管中,离心,弃去上清液。用生理盐水将离心所得的红细胞轻柔洗涤3次,配制成体积分数2%的红细胞悬液。用生理盐水将FA-Cre@ PEG-PLGA NPs和克班宁原料药分别配制成质量浓度为50、100、150、200、250、300 μg/mL的溶液,并与体积分数2%红细胞悬液混合,作为样品液。体积分数2%红细胞悬液与生理盐水混合作为阴性对照;与纯水混合作为阳性对照。将混合液于37 ℃恒温孵育2 h,3000 r/min离心半径7.6 cm,离心5 min,取上清液至于96孔板中,在405 nm处测定值,并计算溶血率。
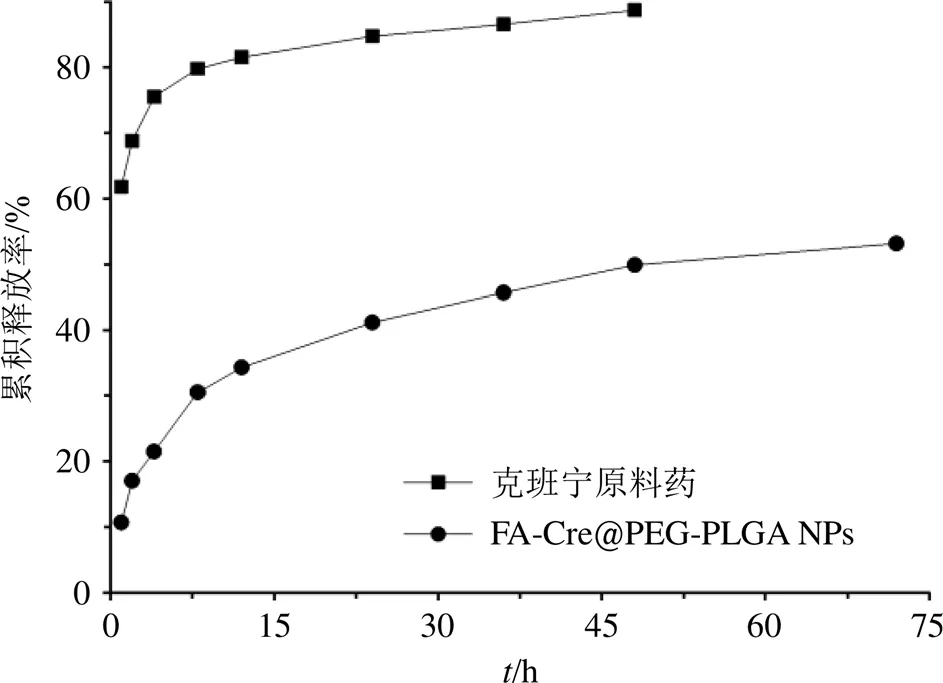
图4 体外释放曲线
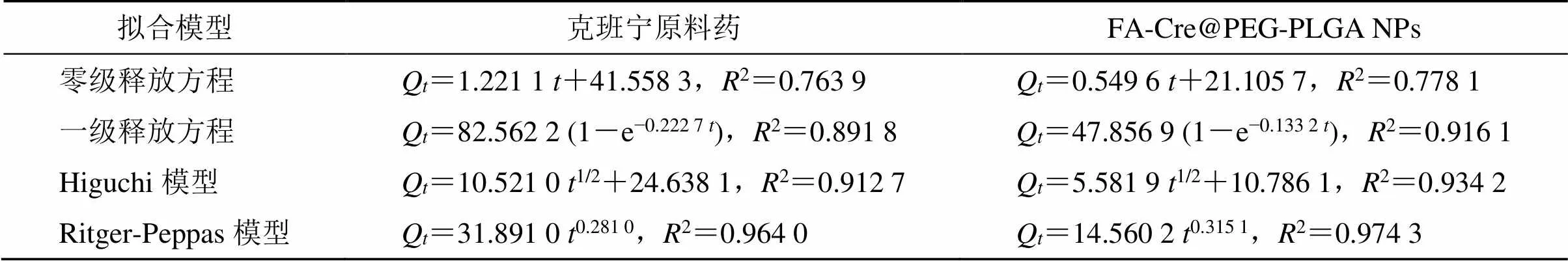
表2 释药模型拟合方程结果
溶血率=(样-阴)/(阳-阴)
样表示不同质量浓度的样品的吸光度,阴表示阴性对照的吸光度,阳表示阳性对照的吸光度
如图5和表3所示,克班宁原料药组仅在50~150 μg/mL,溶血率<5%的标准值;而FA-Cre@ PEG-PLGA NPs在50~300 μg/mL,溶血率分别为0.17%、0.40%、0.76%、0.94%、1.29%、1.70%,溶血率较低,且纳米粒在较高质量浓度(300 μg/mL)时,溶血率仍小于2%,表明FA-Cre@PEG-PLGA NPs相比于克班宁原料药在50~300 μg/mL具有良好的生物相容性。
2.6.2 细胞培养 将正常肝L02细胞培养于含10%胎牛血清和1%双抗(青霉素-链霉素)的RPMI 1640培养基中,放于恒温培养箱(5% CO2、37 ℃)中传代培养,维持细胞处于对数生长期。

从左到右依次为阴性对照组、阳性对照组和50、100、150、200、250、300 μg·mL−1FA-Cre@PEG-PLGA NPs组以及50、100、150、200、250、300 μg·mL−1克班宁原料药组
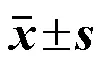
表3 2种克班宁制剂溶血率(, n = 3)
2.6.3 细胞超声方法 超声探头对准96孔板底部,涂抹耦合胶进行间断式超声,每孔超声8 min,暂停1 min,超声2次后,再超声7 min,每孔共计超声25 min。
2.6.4 细胞超声辐照损伤试验 设置超声组与未超声组。超声组方法如下:取对数生长期的正常肝L02细胞接种于96孔板(细胞密度1×104),培养24 h外部添加超声辐照后,分别培养24、48 h,加入CCK-8 10 μL,继续培养2 h,用酶标仪在450 nm波长处读取值。未超声组除不添加超声外,其余处置方式与超声组均相同。超声辐照后细胞死亡率按下式计算。结果如表4所示,正常肝L02细胞24、48 h细胞死亡均<3%,表明此超声条件不会引起细胞大量死亡,超声辐照处置对正常肝L02细胞损伤较小,安全性较好。
细胞死亡率=(未超声-超声)/未超声
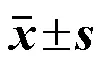
表4 超声辐照处置对正常肝L02细胞损伤影响(, n = 6)
2.6.5 CCK-8法检测正常肝L02细胞的活力 超声组:将对数生长期的正常肝L02细胞接种于96孔板(细胞密度1×104),待细胞贴壁后分别给予不同质量浓度的克班宁原料药和FA-Cre@PEG-PLGA NPs,并设置对照孔(不含克班宁)和空白孔(不含克班宁和细胞),外部添加超声辐照,未超声组除不添加超声辐照外其余条件不变。分别孵育24、48 h后,加入CCK-8 10 μL,继续培养2 h,用酶标仪在450 nm波长处读取值,计算细胞存活率。
细胞存活率=(实验-空白)/(对照-空白)
结果如表5所示,不同质量浓度的克班宁原料药和FA-Cre@PEG-PLGA NPs对正常肝L02细胞存活率出现不同程度的影响。经计算,未进行超声24、48 h后克班宁原料药的半抑制浓度(half maximal inhibitory concentration,IC50)值分别为(208.5±16.0)、(127.6±9.4)μg/mL,克班宁原料药对正常肝L02细胞存活率影响较强,存在一定的肝毒性;FA-Cre@PEG-PLGA NPs在未进行超声24、48 h后IC50值分别为(497.9±28.1)、(380.0±25.8)μg/mL,其在质量浓度50~300 μg/mL时,细胞存活率仍大于50%;且与克班宁原料药相比,在50~250 μg/mL时存在显著性差异(<0.05),表明未超声时FA-Cre@PEG-PLGA NPs对正常肝L02细胞毒性较低,安全性较好。
超声辐照处置24、48 h后,克班宁原料药的IC50值分别为(186.2±14.2)、(117.1±10.3)μg/mL;FA-Cre@PEG-PLGA NPs的IC50值分别为(221.8±19.9)、(150.3±13.8)μg/mL。FA-Cre@PEG-PLGA NPs超声辐照处置24、48 h后分别与FA-Cre@PEG- PLGA NPs未超声24、48 h后相比,在50~300 μg/mL时细胞存活率显著降低,存在极显著性差异(<0.01);FA-Cre@PEG-PLGA NPs超声辐照处置24、48 h后分别与克班宁原料药超声辐照24、48 h相比,在50~250 μg/mL时,FA-Cre@PEG-PLGA NPs对正常肝L02细胞毒性略低于克班宁原料药,在300 μg/mL时FA-Cre@PEG-PLGA NPs对L02细胞毒性略高于克班宁原料药,且在50~250 μg/mL时存在显著性差异(<0.05)。表明FA-Cre@PEG- PLGA NPs对正常肝L02细胞毒性较低,相比于克班宁原料药有一定的安全性。但FA-Cre@PEG- PLGA NPs对正常肝L02细胞仍有一定的细胞增殖抑制作用,推测在纳米粒制备过程中,大部分克班宁被包载进入纳米粒,但仍有部分克班宁以小分子形式附着在PLGA外壳上,使FA-Cre@PEG-PLGA NPs与正常肝L02细胞共孵育时,附着在PLGA上的克班宁被细胞吞噬,从而产生毒性作用。
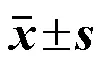
表5 2种克班宁制剂对正常肝L02细胞存活率的影响(, n = 6)
同一处置方法下,同一质量浓度与原料药组24 h比较:**<0.01;同一处置方法下,同一质量浓度与原料药组48 h比较:##<0.01;同一质量浓度,同一时间下与纳米粒未超声组比较:&&<0.01
**< 0.01bulk drug group for 24 h, under the same disposal method and the same mass concentration;##< 0.01bulk drug group for 48 h, under the same disposal method and the same mass concentration;&&< 0.01nanoparticles without ultrasound group, under the same mass concentration at the same time
2.7 FA-Cre@PEG-PLGANPs的体外抗肿瘤活性研究
2.7.1 细胞培养 将肝癌Bel-7402细胞培养于含10%胎牛血清和1%双抗的DMEM培养基中,放于恒温培养箱中传代培养,维持细胞处于对数生长期。
2.7.2 细胞超声辐照损伤试验 超声方法按“2.6.3”和“2.6.4”项下方法,同样设置超声组与未超声组,对肝癌Bel-7402细胞进行超声辐照损伤实验。结果如表6所示,肝癌Bel-7402细胞24、48 h细胞死亡率均<3%,表明此超声条件下对肝癌Bel-7402细胞损伤较小,这种处置方法对实验影响较小,可作为体外细胞超声来源。
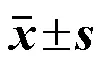
表6 超声辐照处置对Bel-7402细胞损伤影响(, n = 6)
2.7.3 肿瘤细胞增殖抑制能力的检测 采用CCK-8试剂盒检测克班宁原料药和FA-Cre@PEG- PLGA NPs对肝癌Bel-7402细胞增殖抑制的影响。将对数生长期的Bel-7402细胞接种于96孔板(细胞密度1×104),待细胞贴壁后,同样设置超声组与未超声组,操作步骤同“2.6.5”项,计算细胞增殖抑制率。
细胞增殖抑制率=(对照-实验)/(对照-空白)
结果如表7显示,随着药物剂量的增加,克班宁原料药和FA-Cre@PEG-PLGA NPs对肝癌Bel- 7402细胞的增殖均产生了不同程度的抑制,呈现出剂量依赖性。未超声条件下,FA-Cre@PEG-PLGA NPs对肿瘤细胞的增殖抑制效果稍弱于克班宁原料药;但在超声处置24 h和48 h后,FA-Cre@PEG- PLGA NPs对肿瘤细胞的杀伤能力得到增强,特别是超声处置48 h后纳米粒对细胞增殖抑制率均高于原料药,在50~100 μg/mL和300 μg/mL时存在显著性差异(<0.05)。FA-Cre@PEG-PLGA NPs超声辐照24 h后与FA-Cre@PEG-PLGA NPs未超声24 h后相比,在300 μg/mL时细胞增殖抑制率显著升高,存在极显著性差异(<0.01);FA-Cre@PEG- PLGA NPs超声辐照48 h后与FA-Cre@PEG-PLGA NPs未超声48 h后相比,在50~100 μg/mL和300 μg/mL时存在显著性差异(<0.05)。
表7 2种克班宁制剂在未超声、超声条件下对肝癌Bel-7402细胞增殖抑制率的影响(, n = 6)
同一处置方法下,同一浓度与原料药组48 h比较:#<0.05##<0.01;同一浓度,同一时间下与纳米粒未超声组比较:&<0.05&&<0.01
#< 0.05##< 0.01bulk drug group for 48 h, under the same disposal method and the same mass concentration;&< 0.05&&< 0.01nanoparticles without ultrasound group, under the same mass concentration at the same time
经计算,未超声24 h后克班宁原料药和FA- Cre@PEG-PLGA NPs的IC50值分别为(211.2±12.0)、(285.1±13.1)μg/mL;未超声48 h后克班宁原料药和FA-Cre@PEG-PLGA NPs的IC50值分别为(171.5±10.0)、(219.4±13.3)μg/mL;超声辐照24 h后克班宁原料药和FA-Cre@PEG-PLGA NPs的IC50值分别为(180.3±11.2)、(182.3±12.9)μg/mL;超声辐照48 h后克班宁原料药和FA-Cre@ PEG-PLGA NPs的IC50值分别为(161.1±10.2)、(145.0±10.0)μg/mL。超声组24、48 h后FA-Cre@ PEG-PLGA NPs的IC50相比于未超声组降低1.56倍、1.51倍。克班宁原料药超声前后对肝癌Bel-7402细胞增殖抑制率的影响变化不大。
FA-Cre@PEG-PLGA NPs未超声处置时对肝癌Bel-7402细胞抑制率低于克班宁原料药,由“2.5”项体外释放结果可知,48 h纳米粒内药物释放缓慢,猜测克班宁包裹在纳米粒内,因此,对肿瘤细胞抑制率低于原料药;超声处置后对肝癌Bel-7402细胞增殖抑制率显著提升,推测FA-Cre@PEG-PLGA NPs在超声辐照区破碎,激发纳米粒相变释药,改善药物在细胞内的蓄积,提高纳米粒对肝癌Bel-7402细胞的增殖抑制率。结果表明,FA-Cre@PEG-PLGA NPs联合超声辐照后,对肝癌Bel-7402细胞增殖抑制作用增强。
2.7.4 细胞形态观察 将细胞接种于6孔板中,然后于37 ℃培养箱中培养12 h使其贴壁生长,弃去原培养基并补加1 mL含不同质量浓度(0、50、150、300 μg/mL)的原料药和纳米粒的培养基,其中纳米粒分为未超声组与超声组。继续孵育48 h后用显微镜观察细胞形态并拍照记录。结果如图6所示,当原料药组、纳米粒未超声组、纳米粒超声组质量浓度为0 μg/mL时,肝癌Bel-7402细胞呈不规则多边形,细胞间连接紧密、分界清晰,未见明显缝隙,表面光滑;50 μg/mL原料药组、纳米粒未超声组、纳米粒超声组处理48 h后,肝癌Bel-7402细胞分布密度降低,其中原料药组、纳米粒超声组细胞密度低于纳米粒未超声组;而150 μg/mL和300 μg/mL原料药组、纳米粒未超声组、纳米粒超声组处理48 h后,细胞分布密度显著降低,大量细胞出现变圆、皱缩,其中300 μg/mL纳米粒超声组相比于同浓度的原料药组和纳米粒未超声组,细胞尤为稀疏。该结果进一步证实纳米粒联合超声辐照后对肝癌Bel-7402细胞生长具有显著的抑制作用, 并呈明显的剂量效应。
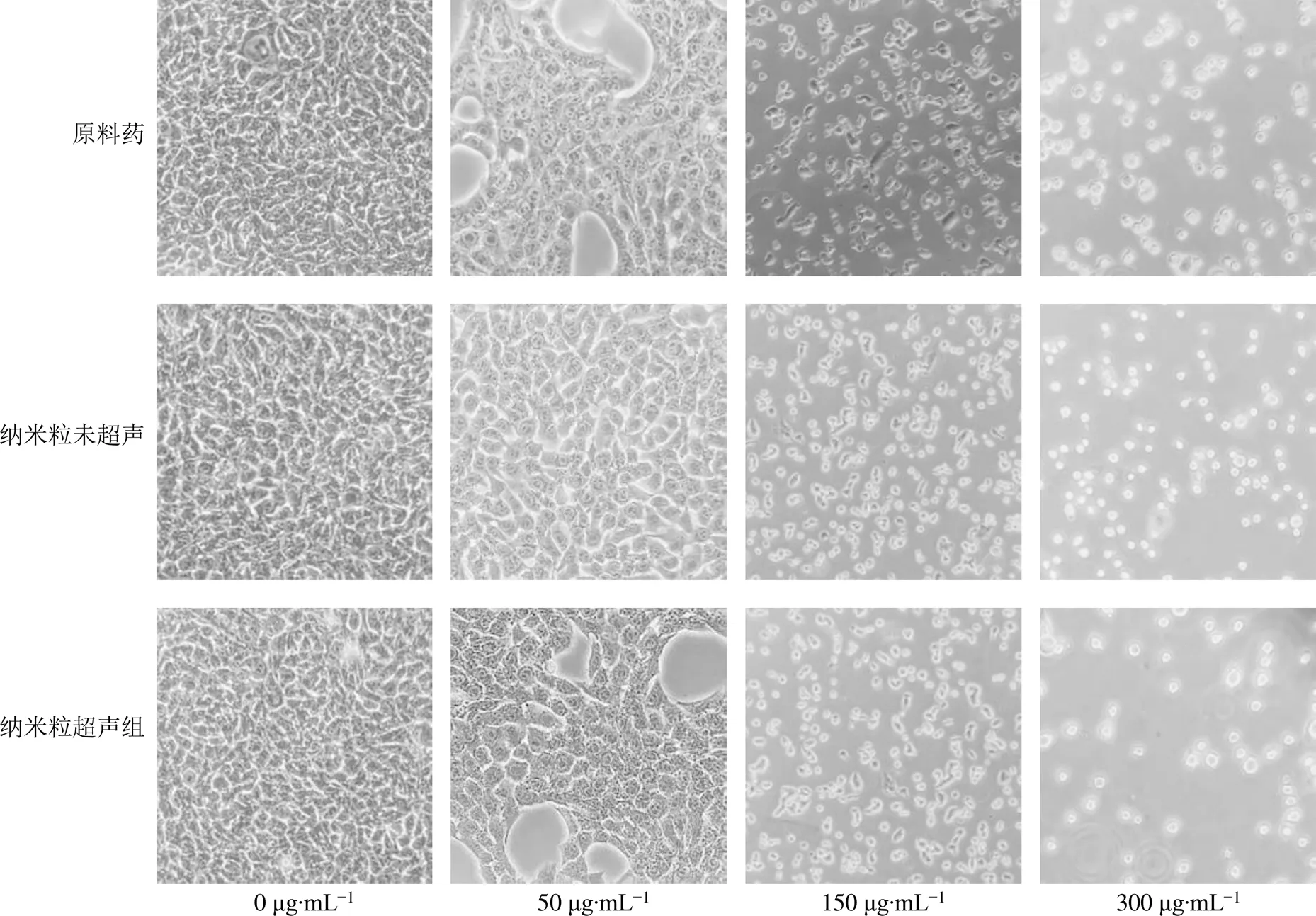
图6 不同克班宁制剂对肝癌Bel-7402细胞形态的影响(×200)
2.7.5 对肿瘤细胞迁移能力的影响 采用细胞划痕实验分析克班宁原料药和FA-Cre@PEG-PLGA NPs对肝癌Bel-7402细胞迁移能力的抑制作用。提前在6孔板底部用笔画3条均分的直线,将对数生长期的肝癌Bel-7402细胞接种于6孔板(细胞密度1×104)中。待细胞贴壁长满后,用10 μL微量移液器的枪头垂直于定位横线垂直方向均匀划线,PBS洗涤细胞2次,除去细胞碎片。将划下的细胞清洗干净后,加入不同处置的药物继续培养,分为空白组和50、150、300 μg/mL 3个不同质量浓度的原料药组、纳米粒未超声组、纳米粒超声组。将6孔板放入培养箱中,分别于0、24、48 h用倒置显微镜拍照并记录,使用Image J软件对图像进行分析,并计算划痕面积恢复率。
划痕面积恢复率=(0 h划痕面积-24 h或48 h划痕面积)/0 h划痕面积
结果见图7和表8,空白组的Bel-7402细胞迅速向“伤口”位置转移。原料药组、纳米粒未超声组、纳米粒超声组对细胞抑制效果存在差别。相比于空白组,这3个组均对Bel-7402细胞的迁移存在抑制,使Bel-7402细胞迁移“愈合”划痕的速度降低,并且均表现出剂量依赖性。同一质量浓度下各组24、48 h对Bel-7402细胞迁移抑制效果排序为纳米粒未超声组<原料药组<纳米粒超声组。表明克班宁原料药以及超声联合纳米粒处置均可显著抑制肿瘤细胞的迁移(与空白组相比<0.01);且超声联合纳米粒处置48 h迁移能力显著下降(与原料药组相比,<0.01;与纳米粒未超声组相比<0.01)。
2.7.6 细胞摄取实验 将肝癌Bel-7402细胞接种于6孔板中,孵育24 h后,加入含游离DiR或FA-Cre@ PEG-PLGA NPs的培养液,其中FA-Cre@PEG- PLGA NPs分为未超声组和超声组。再分别培养6、12 h后,用PBS洗涤细胞3次,荧光倒置显微镜进行荧光成像。结果如图8所示,仅含有培养基的Bel- 7402细胞,6、12 h后细胞均未出现红色荧光,表明无肿瘤细胞自发荧光对实验的干扰。同时,12 h游离DiR组、6 h纳米粒未超声组、6 h纳米粒超声组仅观察到Bel-7402细胞的细胞膜出现红色荧光,且6 h纳米粒超声组的红色荧光更明显。12 h纳米粒未超声组、12 h纳米粒超声组细胞内也出现红色荧光,且12 h纳米粒超声组细胞内红色荧光更明显。与游离DiR组相比,纳米粒未超声组红色荧光强度增强,推测PEG-PLGA-FA修饰纳米粒后,赋予其主动靶向功能,提高叶酸高表达的Bel-7402细胞对纳米粒的摄取能力;与纳米粒未超声组相比,纳米粒超声组红色荧光强度增强,推测经超声辐照处置后,纳米粒内DiR大量释放,被细胞摄取。表明联合超声处置可以提高Bel-7402细胞对纳米粒的摄取能力。

A-空白组 B-原料药组 C-纳米粒未超声组 D-纳米粒超声组
A-blake group B-prodrugs group C-NPs non-ultrasound group D-NPs ultrasound group
图7 细胞划痕结果(×40)
Fig. 7 Results of cell scratch assay (× 40)
表8 不同克班宁制剂对Bel-7402细胞迁移能力的影响(, n = 3)
同一时间下与空白组比较:*<0.05**<0.01;同一质量浓度,同一时间下与原料药组比较:#<0.05##<0.01;同一质量浓度,同一时间下与纳米粒未超声组比较:&<0.05&&<0.01
*< 0.05**< 0.01blank group at the same time;#< 0.05##< 0.01bulk drug group, under the same mass concentration at the same time;&< 0.05&&< 0.01nanoparticles without ultrasound group, under the same mass concentration at the same time
3 讨论
癌症是全球主要的公共卫生问题,每年造成数百万人死亡,严重威胁人们的健康。据美国癌症协会统计,恶性肿瘤已成为世界上主要的致死性疾病之一,2022年美国新增癌症病例190.1万例,新增死亡病例60.9万例,发病率与死亡率呈逐年上升趋势[23]。其中肺癌、肝癌、胃癌是我国东、中、西部各地区常见的恶性肿瘤死亡原因[24-25]。2020年肝癌虽然在我国癌症新发病类型中仅占9%,但在死亡病例中占13%,位于癌症死亡病例的第2。表明肝癌致死率较高,严重威胁我国人群健康。手术、化疗、免疫治疗等仍是临床上常用的药物治疗方法,但各类药物的不良反应及耐药性的产生也是临床亟待解决的问题。
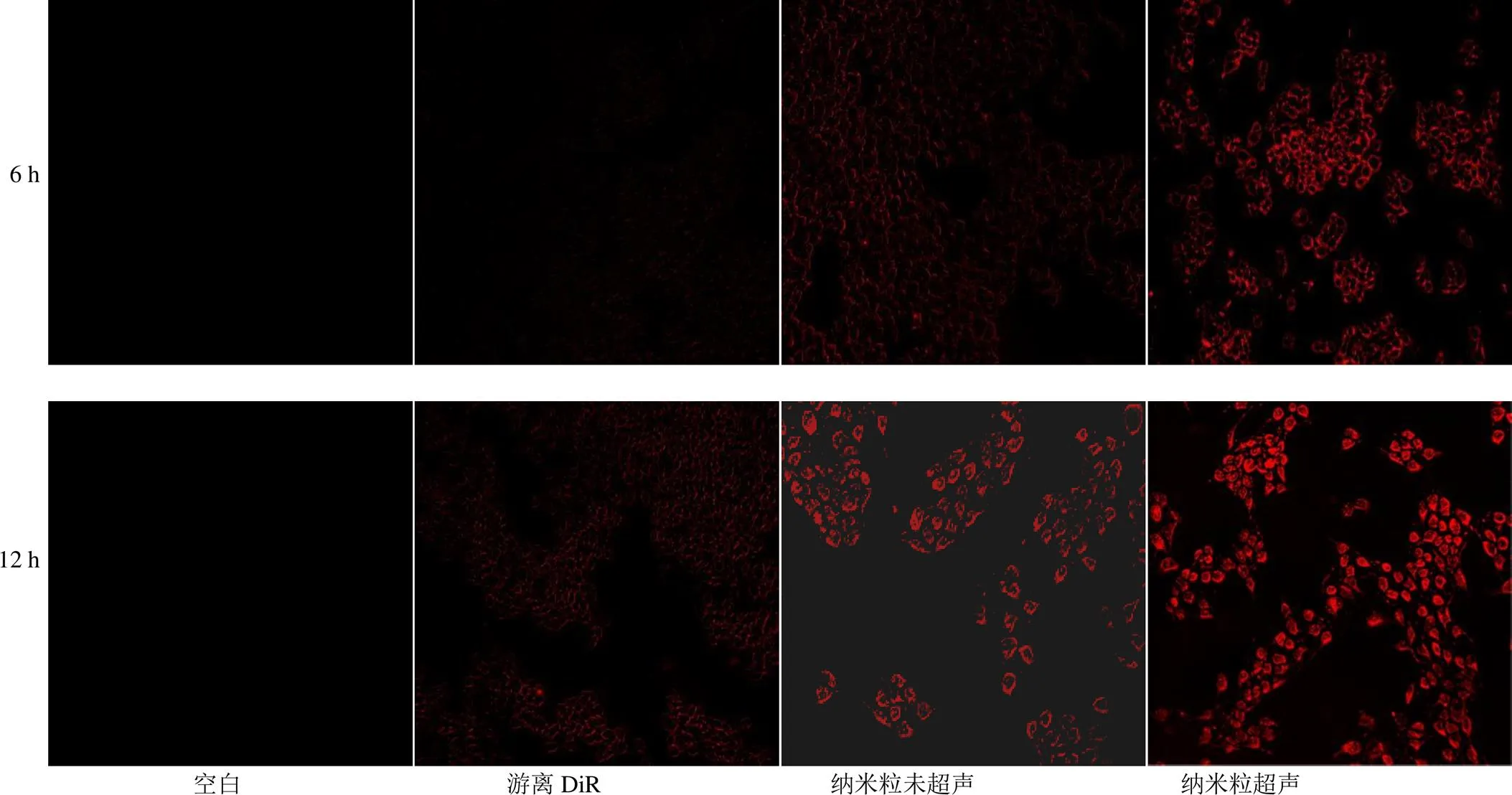
图8 6、12 h Bel-7402细胞对各组摄取的荧光图(×200)
近年来,随着分子生物学和超声成像技术的发展,应用超声微泡介导肝癌的靶向治疗成为研究的热点,并有望为肝癌患者提供一种更安全、有效的治疗方法。临床上超声检查具有实时观察、技术简单、无创等优点,可作为诊断肝脏肿瘤的第一步[26-27]。微泡是常用的超声增强显影剂,纳米级微泡如液态氟碳微泡较微米级微泡具有更强的穿透力,可以穿越血管内皮进入组织间隙,渗入到肿瘤的空隙中,使循环时间更长[28-30]。因此,超声联合纳米造影剂运载体系是一种很有前途的非侵入性靶向载药技术,有望实现深部肿瘤更好的治疗效果。
本实验采用超声乳化-溶剂挥发法制备FA- Cre@PEG-PLGA NPs。将克班宁包载于PEG-PLGA纳米粒中,并对其表面进行叶酸修饰,拟使纳米粒具有主动靶向肿瘤细胞的能力。通过对FA-Cre@ PEG-PLGA NPs进行表征,得到粒径较小,分布较均匀的纳米粒。在前期体外释放接收液的筛选上,尝试了3种接收液,在pH 6.8的磷酸盐缓冲溶液中溶解度低,累积释放率不足20%;在10%聚山梨酯80-生理盐水溶液中,聚山梨酯80在生理盐水中不稳定,使得克班宁最大吸收峰从280 nm移至272 nm,以上接收液均无法满足漏槽条件。而克班宁在生理盐水溶液中溶解度大,可达到漏槽条件。由于体内肿瘤部位为酸性微环境,选择微酸性释放液更能模拟体内肿瘤靶部位的释放特性,因此选择生理盐水(稀盐酸调pH 6.8)作为接收液。但选择的接收液中含有盐溶液,若采用高效液相色谱法测定克班宁含量对色谱柱损伤较大,故本实验采取紫外光谱法进行测定。
后续体外释放实验表明,FA-Cre@ PEG-PLGA NPs具有缓释能力,符合Ritger-Peppas模型释放规律,释放机制为Fick扩散。溶血实验表明纳米粒具有更好的生物相容性。本实验使用低强度超声,添加的超声辐照对正常肝L02细胞和肝癌Bel-7402细胞伤害小,死亡率均<3%,安全有效,可作为体外联合超声治疗来源。正常肝L02细胞体外安全性实验和肝癌Bel-7402细胞增殖抑制试验结果显示,未联合超声辐照时,克班宁原料药和FA-Cre@PEG- PLGA NPs对2种细胞均有一定的增殖抑制性,并在一定的范围内呈现浓度相关性。
但纳米粒对2种细胞的细胞毒性相较于克班宁原料药低,有一定的安全性。纳米粒分别与L02细胞、Bel-7402细胞共孵育时仍有一定的细胞增殖抑制作用,可能原因:①纳米粒用叶酸修饰,因此未超声时纳米粒也容易与叶酸高表达的肝癌细胞表面的受体结合,介导细胞内吞作用使纳米粒被细胞吞噬从而发挥毒性作用。②部分克班宁未包裹进入纳米粒内部,附着在纳米粒外壳上,在与细胞孵育过程中慢慢被细胞吞噬,产生毒性作用。当外部添加超声辐照后克班宁原料药和FA-Cre@PEG-PLGA NPs对L02细胞和Bel-7402细胞增殖抑制率均提高,在对Bel-7402细胞增殖抑制率上,尤以纳米粒提升较为显著,推测超声激发纳米粒相变释药,增加药物在肿瘤细胞内的蓄积,达到增强抗肿瘤活性的效果。细胞划痕实验可用于量化细胞迁移能力,从实验结果看出,各实验组均有一定的抑制肿瘤细胞迁移的能力,并表现出剂量依赖性。且超声联合纳米粒处置方式展现出更强的抗肿瘤迁移能力。细胞摄取实验也表明超声联合纳米粒处置方式可以提高Bel-7402细胞对纳米粒的摄取能力。
本研究结果仅限于克班宁纳米粒的制备和初步体外评价,后续将对FA-Cre@PEG-PLGA NPs超声下相变能力、细胞摄取机制、组织分布、体内安全性等进行全面研究,为其进一步的开发应用提供更完整的实验数据。本研究有望为肝癌的治疗研究提供思路,也有望为肿瘤治疗提供一种超声微泡介导靶向治疗策略。
利益冲突 所有作者均声明不存在利益冲突
[1] 马云淑, 方波, 张壮丽. 云南含克班宁的千金藤属植物资源调查研究 [J]. 云南中医学院学报, 2005, 28(1): 18-21.
[2] 贾敏如, 张艺. 中国民族药辞典 [M]. 北京: 中国医药科技出版社, 2016: 137.
[3] 张壮丽, 马云淑. 克班宁的研究进展 [J]. 云南中医学院学报, 2003, 26(4): 52-58.
[4] 朱兆仪, 冯毓秀, 何丽一, 等. 中国防己科千金藤属药用植物资源利用研究 [J]. 药学学报, 1983, (6): 460-467.
[5] He X S, Lin Q, Ma Y S,. Crebanine inhibits voltage-dependent Na+current in guinea-pig ventricular myocytes [J]., 2014, 12(1): 20-23.
[6] Intayoung P, Limtrakul P, Yodkeeree S. Antiinflammatory activities of crebanine by inhibition of NF-κB and AP-1 activation through suppressing MAPKs and Akt signaling in LPS-induced RAW264.7 macrophages [J]., 2016, 39(1): 54-61.
[7] 尚东雨. 基于拓扑异构酶抑制作用研究氧化克班宁对MCF-7细胞DNA损伤的机制 [D]. 哈尔滨: 哈尔滨商业大学, 2022.
[8] 杨德兰, 梅文莉, 戴好富. 小叶地不容块根中的细胞毒活性生物碱 [J]. 中国药物化学杂志, 2010, 20(3): 206-210.
[9] Yodkeeree S, Pompimon W, Limtrakul P. Crebanine, an aporphine alkaloid, sensitizes TNF-α-induced apoptosis and suppressed invasion of human lung adenocarcinoma cells A549 by blocking NF-κB-regulated gene products [J]., 2014, 35(9): 8615-8624.
[10] Wongsirisin P, Yodkeeree S, Pompimon W,. Induction of G1 arrest and apoptosis in human cancer cells by crebanine, an alkaloid from[J]., 2012, 60(10): 1283-1289.
[11] 梁尔光, 王玉丽, 高春生, 等. 纳米粒疗法: 一种新兴的癌症治疗方法 [J]. 国际药学研究杂志, 2009, 36(1): 71-75.
[12] 王朝辉, 刘玉玲. 抗肿瘤纳米药物的临床转化进展及展望 [J]. 药学学报, 2022, 57(1): 134-141.
[13] Nie X, Liu Y, Li M,. SP94 peptide-functionalized PEG-PLGA nanoparticle loading with cryptotanshinone for targeting therapy of hepatocellular carcinoma [J]., 2020, 21(4): 124.
[14] Sun R, Xiang J, Zhou Q,. The tumor EPR effect for cancer drug delivery: Current status, limitations, and alternatives [J]., 2022, 191: 114614.
[15] Islam W, Kimura S, Islam R,. EPR-effect enhancers strongly potentiate tumor-targeted delivery of nanomedicines to advanced cancers: Further extension to enhancement of the therapeutic effect [J]., 2021, 11(6): 487.
[16] 陈聪慧, 张佩语. 双靶向共载紫杉醇及白藜芦醇纳米系统构建及其体外抗多药耐药肿瘤研究 [J]. 中草药, 2022, 53(2): 395-402.
[17] Han M, Ji X, Li J,. Lipoprotein-inspired nanocarrier composed of folic acid-modified protein and lipids: Preparation and evaluation of tumor-targeting effect [J]., 2020, 15: 3433-3445.
[18] Movileanu C, Anghelache M, Turtoi M,. Folic acid-decorated PEGylated magnetite nanoparticles as efficient drug carriers to tumor cells overexpressing folic acid receptor [J]., 2022, 625: 122064.
[19] Wang H, Cheng X, Kong S,. Synthesis and structure-activity relationships of a series of aporphine derivatives with antiarrhythmic activities and acute toxicity [J]., 2016, 21(12): 1555.
[20] 马云淑, 商庆节, 白一岑, 等. 克班宁在大鼠体内的药动学 [J]. 中国医院药学杂志, 2010, 30(10): 819-821.
[21] 商庆节. 克班宁注射剂的非临床药物动力学研究 [D]. 昆明: 云南中医学院, 2006.
[22] 赵亮, 苏畅. 丹参酮IIA微囊的制备及其质量考察 [J]. 中成药, 2012, 34(10): 1242-1246.
[23] Siegel R L, Miller K D, Fuchs H E,. Cancer statistics, 2022 [J]., 2022, 72(1): 7-33.
[24] Suzuki R, Goto R, Kawamura N,. Efficient multiple treatments including molecular targeting agents in a case of recurrent hepatocellular carcinoma, post-living donor liver transplantation [J]., 2022, 15(4): 755-764.
[25] 孙可欣, 郑荣寿, 张思维, 等. 2015年中国分地区恶性肿瘤发病和死亡分析 [J]. 中国肿瘤, 2019, 28(1): 1-11.
[26] Chen W, Zheng R, Baade P D,. Cancer statistics in China, 2015 [J]., 2016, 66(2): 115-132.
[27] Maruyama H, Yoshikawa M, Yokosuka O. Current role of ultrasound for the management of hepatocellular carcinoma [J]., 2008, 14(11): 1710-1719.
[28] Maruyama H, Ebara M. Recent applications of ultrasound: Diagnosis and treatment of hepatocellular carcinoma [J]., 2006, 11(4): 258-267.
[29] 于姣姣, 查莉, 曾书娥. 超声微泡在肝癌治疗中的应用研究进展 [J]. 肿瘤防治研究, 2022, 49(10): 1082-1085.
[30] Ma J, Du L, Chen M,. Drug-loaded nano-microcapsules delivery system mediated by ultrasound-targeted microbubble destruction: A promising therapy method [J]., 2013, 1(4): 506-510.
Preparation and anti-tumor activity study of folic acid modified crebanine polyethylene glycol-polylactic acid hydroxyacetic acid copolymer nanoparticles
PAN Rui1, 3, 4, ZHANG Hai-liang1, 4, ZHAO Xiao-yu1, TANG Jun-ze1, WU Jian-ming1, ZHENG Yong-ren5, CHENG Xin1, 2, 4
1. College of Traditional Chinese Medicine, Yunnan University of Chinese Medicine, Kunming 650500, China 2. Key Laboratory of External Drug Delivery System and Preparation Technology in University of Yunnan Province, Kunming 650500, China 3. College of Chinese Materia Medica and Yunnan Key Laboratory of Southern Medicinal Utilization, Kunming 650500, China 4. Yunnan Key Laboratory of Dai and Yi Medicines, Kunming 650500, China 5. Science and Technology Office, Yunnan University of Chinese Medicine, Kunming 650500, China
To prepare folic acid modified crebanine polyethylene glycol-polylactic acid hydroxyacetic acid copolymer nanoparticles (FA-Cre@PEG-PLGA NPs) and investigate theirrelease and anti-tumor activity.FA-Cre@PEG- PLGA NPs were prepared by ultrasonic emulsion-solvent evaporation method with crebanine as a model drug, polyethylene glycol-polylactic acid hydroxyacetic acid (PEG-PLGA) copolymer and folic acid (FA) as materials. The particle size, potential and morphology of FA-Cre@PEG-PLGA NPs were characterized by laser particle size measurement, transmission electron microscopy and fluorescence microscope. The encapsulation rate and drug loading capacity of crebanine were determined and calculated by Ultraviolet spectroscopy. Meanwhile, therelease patterns of FA-Cre@PEG-PLGA NPs and crebanine bulk drug at 72 h were compared. The biological properties were investigated by hemolysis assay. The safety evaluation on L02 cells and the proliferation inhibition on Bel-7402 cells were investigated by CCK-8 assay. The proliferation of Bel-7402 cells was quantified by cell wound scratch assay. Finally, the uptake capacity of nanoparticles to Bel-7402 cells at different time points was observed by fluorescence microscope.The average particle size of FA-Cre@PEG-PLGA NPs was (247.67 ± 2.49) nm, with a polydispersity index (PDI) of 0.139 ± 0.027 and a ζ potential of (−9.40 ± 0.54) mV. The transmission electron microscopy revealed a core-shell structure, while the fluorescence microscopy showed blue dots in the bright field and red dots in the dark area after gasification. The encapsulation rate of crebanine in nanoparticles was 83.78% and the drug loading was 67.78%. The release of FA-Cre@PEG-PLGA NPs and crebanine bulk drug conformed to the Ritger-Peppas model. The safety evaluation showed that FA-Cre@PEG-PLGA NPs had good biocompatibility within the range of 50—300 μg/mL compared with crebanine bulk drug. The FA-Cre@PEG-PLGA NPs showed lower toxicity to L02 cells than crebanine bulk drug. The proliferation inhibition results showed dose-dependent and time-dependent effects on the proliferation of Bel-7402 cells. Moreover, the FA-Cre@PEG-PLGA NPs combined with ultrasound irradiation had stronger killing effect on Bel-7402 cells. The cell wound scratch experiments showed that both the crebanine bulk drug and FA-Cre@PEG-PLGA NPs inhibited the migration of Bel-7402 cells in a dose-dependent manner, and the nanoparticles combined with ultrasound irradiation could inhibit the migration of tumor cells more significantly. The cell uptake experiment showed that nanoparticles combined with ultrasound irradiation could effectively enhance the uptake of tumor cells at the same time.The FA-Cre@PEG-PLGA NPs were successfully prepared, and exhibited good slow-release effect and antitumor effect, providing an experimental basis for the application of FA-Cre@PEG-PLGA NPs in the treatment of liver cancer.
folic acid; polyethylene glycol-polylactic acid hydroxyacetic acid; crebanine; nanoparticles; anti-tumor activity;release; ultrasonic emulsion-solvent evaporation method
R283.6
A
0253 - 2670(2023)20 - 6643 - 14
10.7501/j.issn.0253-2670.2023.20.009
2023-04-28
云南省科技厅——云南中医药大学应用基础研究联合专项重点项目(202001AZ070001-008);云南省科技厅生物医药重大科技专项(202002AA100007);云南省科技人才平台计划(202105AG070012);云南省傣医药与彝医药重点实验室开放课题(202210SS2205);云南省傣医药与彝医药重点实验室开放课题(202210SS2206);国家中医药管理局“十二五”重点学科——傣药学
潘 蕊(1999—),硕士研究生,研究方向为药物新剂型研究。Tel: 18468224320 E-mail: 547349550@qq.com
通信作者:程 欣(1977—),博士,副教授,硕士生导师,研究方向为纳米医药、药物新剂型等研究。Tel: 15987162031
[责任编辑 郑礼胜]
