铜绿假单胞菌鞭毛基因fliI的敲除对其鞭毛形成及生物膜生成的影响
2023-10-17周静茹张旭华任海燕陈邬锦
李 琴,周静茹,张旭华,倪 萍,任海燕,陈邬锦
铜绿假单胞菌(Pseudomonasaeruginosa,PA)又称绿脓杆菌,是一种条件致病菌,常定居于正常人体的皮肤、呼吸道、消化道和黏膜等部位。因其具有迁移、定植、免疫逃逸、释放毒素及对抗生素抵抗等能力,因此该菌常引起肺、皮肤及软组织等部位的感染[1-2]。特别是病情重、病程长、免疫力低下的患者,例如烧伤、外伤、新生儿及老年患者易受其感染[3]。铜绿假单胞菌感染相关的疾病中,肺部感染引起的疾病死亡率在25%~39%,菌血症引起的死亡率在18%~61%,而多重耐药铜绿假单胞菌感染引起死亡率甚至可高达40%~70%,由此可见,铜绿假单胞菌感染不仅仅是临床感染问题,更是值得全社会关注、急需解决的公共卫生问题。
铜绿假单胞菌可分泌多糖类胞外聚合物使菌体相互缠绕、盘结生成的生物膜(bacterial biofilm,BF),导致机体无法及时清除病灶从而增强感染进程[4]。铜绿假单胞菌鞭毛的合成较为复杂,牵涉到40多个基因表达。此外,其所需的结构蛋白和其他蛋白通过鞭毛介导的Ⅲ型分泌系统(type Ⅲ secretion system,T3SS)分泌,该系统主要由6种跨膜蛋白(FlhA、FlhB、FliO、FliP、FliQ、FliR)以及细胞质溶胶蛋白(FliH、FliI、FliJ)构成[5]。其中FliI蛋白是鞭毛特异性输出的蛋白转位酶的催化亚基,属于ATP酶的一种,与FliJ和FliH的二聚体相互作用,在向T3SS提供能量方面发挥着重要作用[6]。但FliI对铜绿假单胞菌鞭毛功能和生物膜形成的影响未见报道。因此,本研究构建fliI基因缺失株,通过对比基因敲除前后菌株运动能力、生物膜形成能力及鞭毛的形成等方面进一步探讨,分析fliI对铜绿假单胞菌鞭毛相关功能的影响,为铜绿假单胞菌致病机制的研究及其所致疾病的治疗奠定基础和提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 载体和感受态 铜绿假单胞菌标准菌株(菌号:ATCC9027)为本实验室保存;大肠杆菌基因编辑型自杀质粒pEX18TC购于淼灵生物;大肠杆菌DH5a感受态细胞购于武汉技术有限公司。
1.1.2 主要试剂 LB液体、LB固体培养基购自杭州微生物试剂有限公司;DNA Ladder、琼脂糖均购自北京全式金生物技术有限公司;I-5TM2×High-Fidelity Master Mix购自北京擎科新业生物技术有限公司;EcoR I和Hind III限制性内切酶购自New England Biolabs公司;ClonExpress Ultra One Step Cloning Kit购自南京诺唯赞生物科技股份有限公司;Tet四环素抗生素购自北京索莱宝科技有限公司;质粒小提试剂盒购自天根生化科技(北京)有限公司。
1.1.3 目的片段的合成及扩增引物的设计 通过NCBI查找序列,fliI基因编码蛋白ID为NP_249795.1,合成包含片段1:606 bp 5′端侧翼序列+fliI(1~399 bp);片段2:fliI(1 081~1 356 bp)+568 bp 5′端侧翼序列,该片段由武汉淼灵生物技术有限责任公司合成。根据合成的片段1和片段2序列设计扩增引物;GM抗性盒扩增引物(以现有质粒P2322/pUCGM为模板);鉴定引物(F4位于pEX18TC自杀载体上,R4位于目的片段上),见表1。

表1 构建fliI基因缺陷特异性质粒
1.2 方 法
1.2.1 同源重组构建pEX18TC-ΔfliI含同源臂片段1、GM抗性盒、片段2及线性pEX18TC载体的纯化产物最终浓度分别为40 ng/μL、45 ng/μL、24 ng/μL及60 ng/μL。按照多片段同源重组酶的计算公式,重组反应所需DNA量=0.02×片段碱基数/浓度,最终按1∶1∶2∶4的比例分别添加含同源臂片段1、GM抗性盒、片段2及线性载体的DNA产物,50 ℃、15 min进行连接。连接产物转化感受态细胞,菌落PCR鉴定阳性转化子,质粒提取送测序,命名为pEX18Tc-△fliI。
1.2.2 铜绿假单胞菌感受态细胞制备及转化 铜绿假单胞菌感受态细胞制备,菌种在LB培养基平板划线活化,挑单菌落接入10 mL液体LB中,30 ℃、180 r/min培养14 h,按1∶100的接种量接入新鲜的液体LB中,30 ℃、180 r/min培养2~4 h至OD600为0.5左右,将菌液转移到50 mL离心管中,冰浴20 min,4 ℃、7 000×g 离心10 min 收集菌体,无菌蒸馏水洗涤菌体3次,再用75 mmol/L CaCl2溶液洗涤1次,冰浴预冷的CaCl2溶液处理菌体1 h,加入0.7 mL CaCl2和 0.3 mL 50% 甘油,重悬菌体按每管100 mL分装。转化条件:75 mmol/L CaCl2,热激 4.5 min,复苏0.5 h。均匀涂布于含Tet四环素抗生素(10 μg/mL)的LB平板上,经鉴定引物(F4位于pEX18TC自杀载体上,R4位于目的片段上)检测转化情况,经EcoR I和Hind Ⅲ双酶切检测载体与目标条带大小,构建PA YFY22的fliI的基因缺陷株。
1.2.3 菌落形态的测定 将PA-ΔfliI与对照组PA的单菌在LB琼脂平板上划线,37 ℃下分别在12 h和24 h观察菌落形态。
1.2.4 扫描电镜观察 将PA-ΔfliI与对照组PA对数生长期的新鲜菌液制备成106CFU/mL的菌液100 μL,接种至放有24 mm×24 mm无菌盖玻片及10 mL LB肉汤的平皿中培养24~48 h。取出培养皿中的盖玻片,使用无菌PBS冲洗2~3遍,将其置于2.5%戊二醛中4 ℃固定12 h。1/15 mol/L PBS(pH为7.2~7.4)漂洗3次,15 min/次;分别在50%、70%、80%、90%及100%叔丁醇梯度脱水;在样品盒中加入没过样品的100%叔丁醇,置4 ℃,待叔丁醇结冰时,置JEOL JFD-320冷冻干燥仪中干燥;将样品进行粘台:将样品置JFC-1600离子溅射镀膜仪中镀膜,上机观察。
1.2.5 运动性的测定 分别将PA-ΔfliI与对照组PA对数生长期的细菌穿刺接种于LB半固体培养基中,在37 ℃条件下静置培养36 h观察观察菌株的运动性。
1.2.6 生物膜形成能力测定 取PA-ΔfliI与对照组PA对数生长期(OD600≈0.5)的菌液100 μL加入96孔板,分别于2、6、10、12 h时弃去培养板,培养液结晶紫染色15 min后再用无菌PBS洗涤3次,自然风干,随后于33%冰乙酸中作用30 min,590 nm条件下用酶标仪测定培养孔中溶液的吸光度值(A值),平行3个重复,计算其平均值。以未接种菌的培养液作为阴性对照,A值反映生物膜与接触表面黏附的牢固程度。

2 结 果
2.1 pEX18TC-ΔfliI载体构建fliI基因融合片段连接pEX18Tc载体,1%琼脂糖凝胶电泳检测结果显示,fliI片段1、GM抗性盒、fliI片段2条带与预期位置相符,基因产物大小分别为1 045 bp、791 bp、884 bp,如图1所示。

A:M.DL5000 DNA marker;1.FliI-target product1;2.FliI-target product2。B:M.DL5000 DNA marker;1.GM抗性盒target product。
2.2 同源重组构建PA-ΔfliI将pEX18Tc-ΔfliI热转入PA YFY22感受态细胞中,经鉴定引物F4、R4(重组后产物445 bp)检测和测序后得到阳性转化子(图2A);经载体酶切结果,根据1%琼脂糖凝胶电泳检测结果显示,酶切条带与预期位置相符,载体双酶切后大小为6 321 bp(图2B)。成功构建fliI突变株并命名为PA-ΔfliI。
2.3 PA-ΔfliI菌落形态的检测 对照组PA菌在固体培养基上培养24 h、48 h后,呈现直径1.5~2 mm、圆形、粗糙、半透明、边缘不整齐、具有迁徙性的菌落(图3A、3C);PA-ΔfliI菌在固体培养基上培养24 h、48 h后,呈现直径约1 mm、圆形、光滑、半透明、边缘整齐的菌落(图3B、3D)。

A、C:PA at 24 h,48 h; B、D:PA-ΔfliI at 24 h,48 h
2.4 PA-ΔfliI运动性的测定 在半固体培养基30 ℃静置培养后,对照组PA延穿刺线扩散生长(图4A);PA-ΔfliI延穿刺线生长(图4B)。PA-ΔfliI的运动能力下降明显,敲除fliI基因后铜绿假单胞菌鞭毛的运动能力明显减弱。
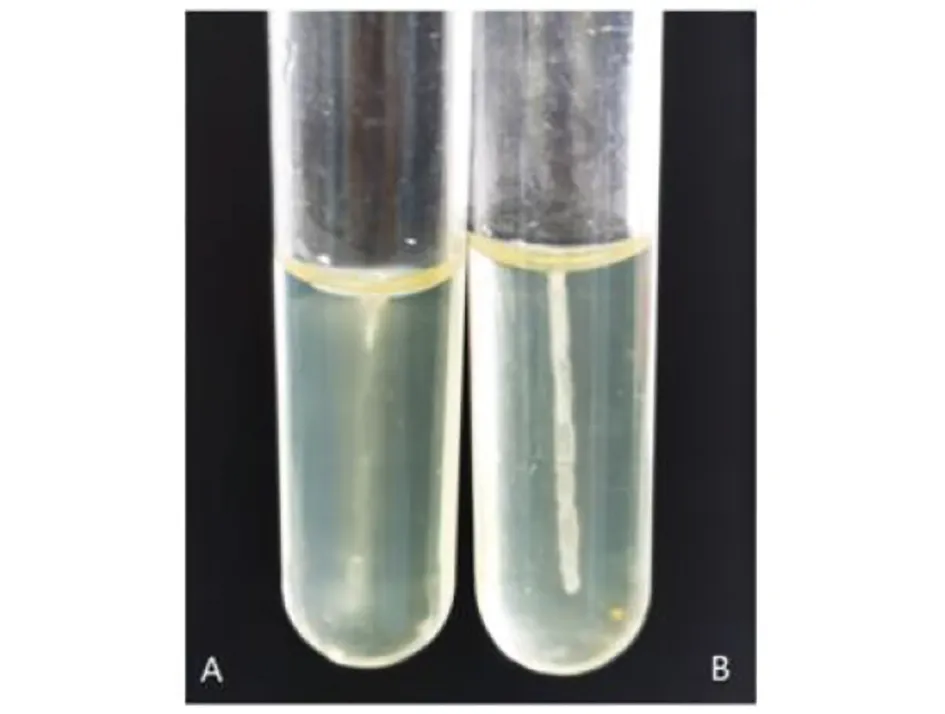
A:PA;B:PA-ΔfliI
2.5 PA-ΔfliI扫描电镜观察 经扫描电镜观察发现,对照组PA相比,PA-ΔfliI菌体表面鞭无明显减少(图5),敲除fliI基因对铜绿假单胞菌鞭毛的形成没有影响。
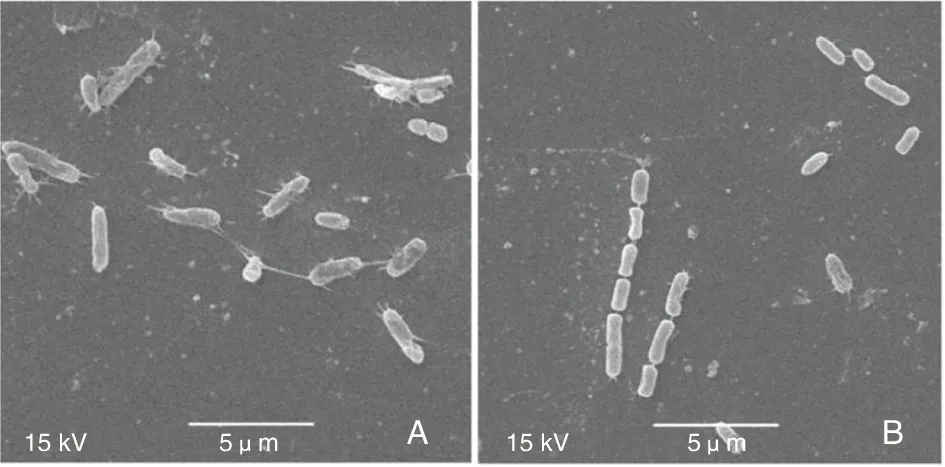
A:PA;B:PA-ΔfliI
2.6 PA-ΔfliI生物膜形成能力的形态观察 通过96孔板培养并用结晶紫染色发现,PA鞭毛相关基因fliI敲除前生物膜形成较为致密,着色较深(图6A);敲除后生物膜形成不稳定,易脱落且着色较浅(图6B)。检测吸光度值(A值)发现fliI基因敲除后生物膜形成能力在4 h、6 h、24 h时明显降低(t4 h=8.253,P=0.014;t6 h=4.554,P=0.009;t24 h=7.602,P=0.017),说明fliI基因敲除后铜绿假单胞菌生物膜形成受到影响(图7)。

A:PA;B:PA-ΔfliI
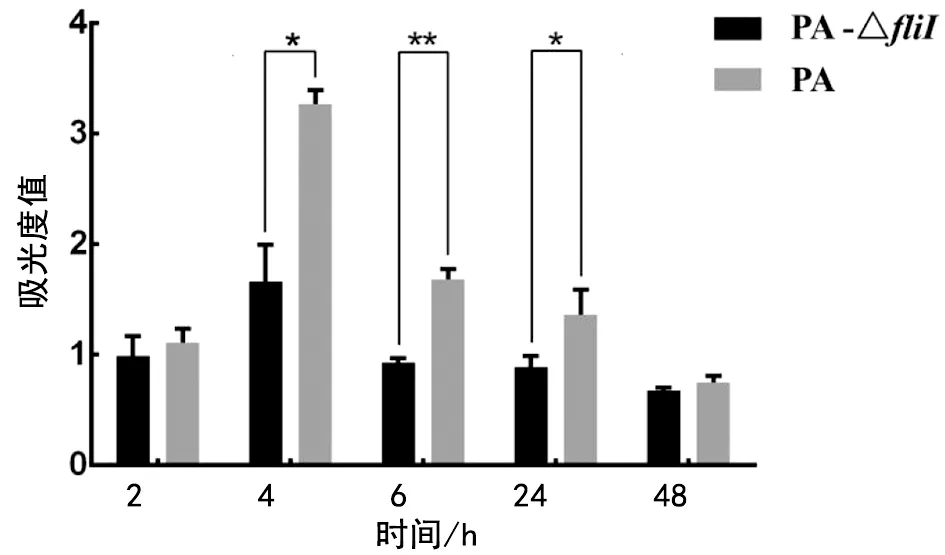
*:P<0.05;**:P<0.01
3 讨 论
研究表明,细菌可以分泌多糖类物质在体内生成生物膜等方式致病[7-9]。越来越多的研究表明鞭毛除了运动性以外,致病型菌株可以通过鞭毛的运动性增加细菌与宿主细胞之间的接触而黏附于宿主细胞,同时通过鞭毛蛋白特异性与被感染细胞的鞭毛受体结合完成细菌的黏附和侵袭[10-11]。绵羊脑炎单核细胞增生李斯特菌flaA基因的缺失,运动性降低了63.77%,对宿主的致病性显著降低[12]。缺失鞭毛的大肠杆菌对细胞的黏附能力下降,说明鞭毛对宿主细胞的黏附起重要的作用[13],铜绿假单胞菌的鞭毛相关基因f1hF缺失后,导致泳动和爬行能力缺陷。铜绿假单胞菌的鞭毛合成和调控牵涉到40多个基因参与,fliI是Ⅲ型分泌系统(Type Ⅲ secretion system,T3SS)鞭毛相关基因[14-15],为鞭毛蛋白的转运提供能量,促进细菌鞭毛蛋白的输出[16],是输出系统中唯一的ATP酶,但其作用机制尚不清楚[6]。本研究通过Red同源重组技术构建铜绿假单胞菌鞭毛相关基因fliI的缺失株。通过菌落形态观察、动力试验以及扫描电镜观察等,显示铜绿假单胞菌fliI基因缺失未影响鞭毛的形成,但相较原始株,其菌落迁徙能力减弱,运动能力显著下降,由此可判断该菌对环境的适应能力和生存能力都受到影响,提示当PA-ΔfliI进入机体后运动能力降低,则有可能被机体的免疫系统清除。
此外,鞭毛除了与细菌运动性相关,还可通过缠绕及释放粘性物质与静态及者动态的菌体发生聚集,这种运动性能在生物膜的形成中起到非常重要的作用[17]。研究表明,fliC、flaA鞭毛基因缺失分别使大肠杆菌及绵羊脑炎单核细胞增生李斯特菌体外形成生物膜的能力下降[18-19]。既往研究表明,铜绿假单胞菌能形成完整且致密的生物膜[20],该种生物膜形成后有以下作用:1) 阻滞抗生素的渗透; 2) 吸附抗生素灭活酶; 3) 使膜内包裹的细菌处于休眠状态,使其对抗生素敏感性降低; 4) 阻止机体免疫系统对该菌的清除,使其免疫逃逸和感染持续等[21-22],因此鞭毛的运动和黏附作用能够促进生物膜的形成,促进细菌致病[23]。本研究构建fliI基因缺陷株,虽然缺陷株并未完全失去生物膜形成能力,但生物膜形成不稳定,结构松散、致密性降低、易脱落,表明fliI基因缺陷菌株形成生物膜能力明显下降,生物膜明显减少可能是由于fliI缺失造成鞭毛输出能量不足,鞭毛运动能力下降,减少了细菌初始表面附着,生物膜生成受抑。
本研究结果表明,fliI基因在铜绿假单胞菌鞭毛形成、运动和生物膜形成中起着重要作用,直接或者间接影响了PA鞭毛的功能和生物膜的形成。在fliI敲除情况下,细菌运动功能基本丧失,导致铜绿假单胞菌生物膜生成显著减少。鉴于鞭毛和生物被膜在铜绿假单胞菌致病性中的重要作用,我们将通过体内试验来进一步阐明fliI的致病作用。
利益冲突:无
引用本文格式:李琴,周静茹,张旭华,等.铜绿假单胞菌鞭毛基因fliI的敲除对其鞭毛形成及生物膜生成的影响[J].中国人兽共患病学报,2023,39(9):837-842.DOI:10.3969/j.issn.1002-2694.2023.00.099
