抗菌肽在奶牛乳腺炎防治中的研究进展
2023-10-16童津津
高 爽 童津津 姚 华 张 华
(北京农学院动物科学技术学院,北京 102206)
奶牛乳腺炎是由多种因素引起奶牛乳头或乳腺组织发生炎症性反应的疾病,是规模化奶牛养殖场中的常见病和多发病之一[1]。该病可影响奶牛泌乳功能,导致牛奶产量和营养水平下降,甚至影响奶牛的繁殖能力,对奶牛养殖行业造成了严重的经济损失[2]。目前,奶牛乳腺炎主要应用抗生素进行治疗,但抗生素的使用容易造成乳汁中药物残留以及治疗效果下降等问题[3]。我国自2020年1月1日起已全面禁用抗生素作为饲料添加剂。因此,在当前养殖环境下,亟需开发绿色安全、无毒副作用、无残留、无耐药性的抗生素替代品。
抗菌肽(antimicrobial peptides,AMPs)是一类具有抗菌、抗病毒和抗真菌活性的防御性小分子肽,其广泛存在于多细胞真核生物中,目前已发现超过3 200种AMPs[4]。AMPs可通过多种机制(如破坏细胞膜、细胞内渗透压和抑制DNA复制等)发挥抗微生物活性,同时还参与机体的免疫调节[5]。由于AMPs具有广谱抗菌、不易产生耐药性、无细胞毒性等优势,近些年AMPs被逐渐应用于临床治疗、食品防腐以及畜牧业饲料添加剂等领域,被认为是“后抗生素时代”减抗替抗最有前途的候选活性物质之一。本研究拟对AMPs的来源及生物学作用进行概述,列举并归纳AMPs对奶牛乳腺炎的调节作用与机制,总结目前AMPs开发与应用方面存在的问题,并对AMPs在奶牛乳腺炎防治领域的发展趋势进行探讨。
1 AMPs的来源
目前已知AMPs在微生物、植物、无脊椎动物乃至更复杂的两栖动物和哺乳动物等物种体内均有表达。根据AMPs数据库(http://aps.unmc.edu/AP/main.php)报告,目前从各种生物中已鉴定出3 230种AMPs,其中358种来自细菌,360种来自植物,2 396种来自动物(包括一些合成肽),从真菌、古生菌以及原生生物中分别发现20、5和8种AMPs。根据AMPs的生物学作用,可将其分为抗细菌肽、抗毒素肽、抗病毒肽、抗真菌肽、抗寄生虫肽、抗癌肽、抗糖尿病肽、伤口愈合肽、抗炎肽、抗氧化肽等[6](表1)。
AMPs的发现可追溯到1939年,Dubos等[7]从土壤样本的芽孢杆菌中分离出一种抗菌剂,并将其命名为短杆菌肽。这是第1个被鉴定出的AMP,这种抗菌剂能够保护小鼠免受肺炎球菌感染。最早报道的动物来源的AMPs是吞噬细胞素(phagocytin),它于1956年分离自兔的白细胞[8]。1962年,Groves等[9]在牛奶中发现了牛乳铁蛋白(bovine lactoferrin,BLf),30年后Bellamy等[10]从BLf的N端17~41处获得牛乳铁蛋白肽(bovine lactoferricin,BLfcin)。在之后的20年中,研究人员先后从蜡虫、天蚕蛹(天蚕素,cecropins)以及非洲爪蟾(爪蟾抗菌肽,magainins)中分离出AMPs[11-12]。AMPs几乎存在于包括人类在内的所有多细胞生物中,它们是免疫系统的重要组成部分。

表1 数据库中记录的AMPs的类型和数量
2 AMPs的生物学作用和机制
2.1 抗细菌和抗真菌作用及机制
据报道,病原微生物感染是引起奶牛乳腺炎的主要原因,其中致病性病原微生物的入侵是引起乳腺炎的主要病因[10]。目前为止已发现150多种奶牛乳腺炎致病菌,研究较多的是金黄色葡萄球菌(Staphylococcusaureus,S.aureus)、大肠杆菌(Escherichiacoli,E.coli)和无乳链球菌(Streptococcusagalactiae,GBS)等病原菌[13]。AMPs具有抗菌谱广、不易产生耐药性的特点,且可清除致病菌产生的生物膜,同时对已产生耐药性的细菌也能够起到抑制作用[14]。
AMPs具有多种抗菌机制,其中之一为膜失稳机制。细菌细胞膜是大多数阳离子AMPs的主要靶点[15]。细菌细胞膜表面存在阴离子脂类、脂多糖(LPS,革兰氏阴性菌)或磷壁酸(革兰氏阳性菌),使细菌膜带负电荷。这些带负电荷的物质会与AMPs发生静电作用,从而破坏膜结构。对此,人们提出了不同的机制,即科学界最接受的3种假设——桶形壁、地毯(类洗涤剂)和环形孔机制[16]。虽然AMPs通过破坏细菌细胞膜导致细胞裂解的能力已被广泛证实,但AMPs还可能具有更复杂的抗菌机制,即细胞内损伤机制,包括对细胞壁的形成、大分子化合物的生物合成以及酶活性、代谢和翻译的抑制[17]。AMPs可在不破坏细菌细胞膜的情况下,干扰作为细胞壁和外膜主要成分的肽聚糖(PGN,革兰氏阳性菌)与LPS的生物合成。AMPs还可通过抑制一些关键的细胞内过程,如核酸和蛋白质合成、与ATP相互作用或直接抑制某些ATP依赖酶的活性,从而达到抑制细菌繁殖的效果[18]。
AMPs的抗真菌机制是以细胞内成分或细胞壁作为靶点,破坏真菌细胞膜完整性并可造成膜结构中孔的形成[19]。白色念珠菌和新型隐球菌是引起真菌性乳腺炎最常见的致病性真菌,乳头受到损伤、病原体感染以及使用被污染的抗生素溶液、导管或注射器等情况会提高环境中真菌进入乳腺组织并定植的概率[20]。棘球白素(echinocandin)家族可抑制存在于念珠菌和隐球菌中的1,3-β-葡聚糖合酶,从而导致细胞壁葡聚糖的排空、渗透压不稳定以及真菌细胞的溶解而发挥其抗真菌作用[21]。BLfcin及其相关肽与白色念珠菌细胞表面直接接触后,可引起表面气泡形成、细胞肿胀和塌陷等细胞壁的损伤[22]。
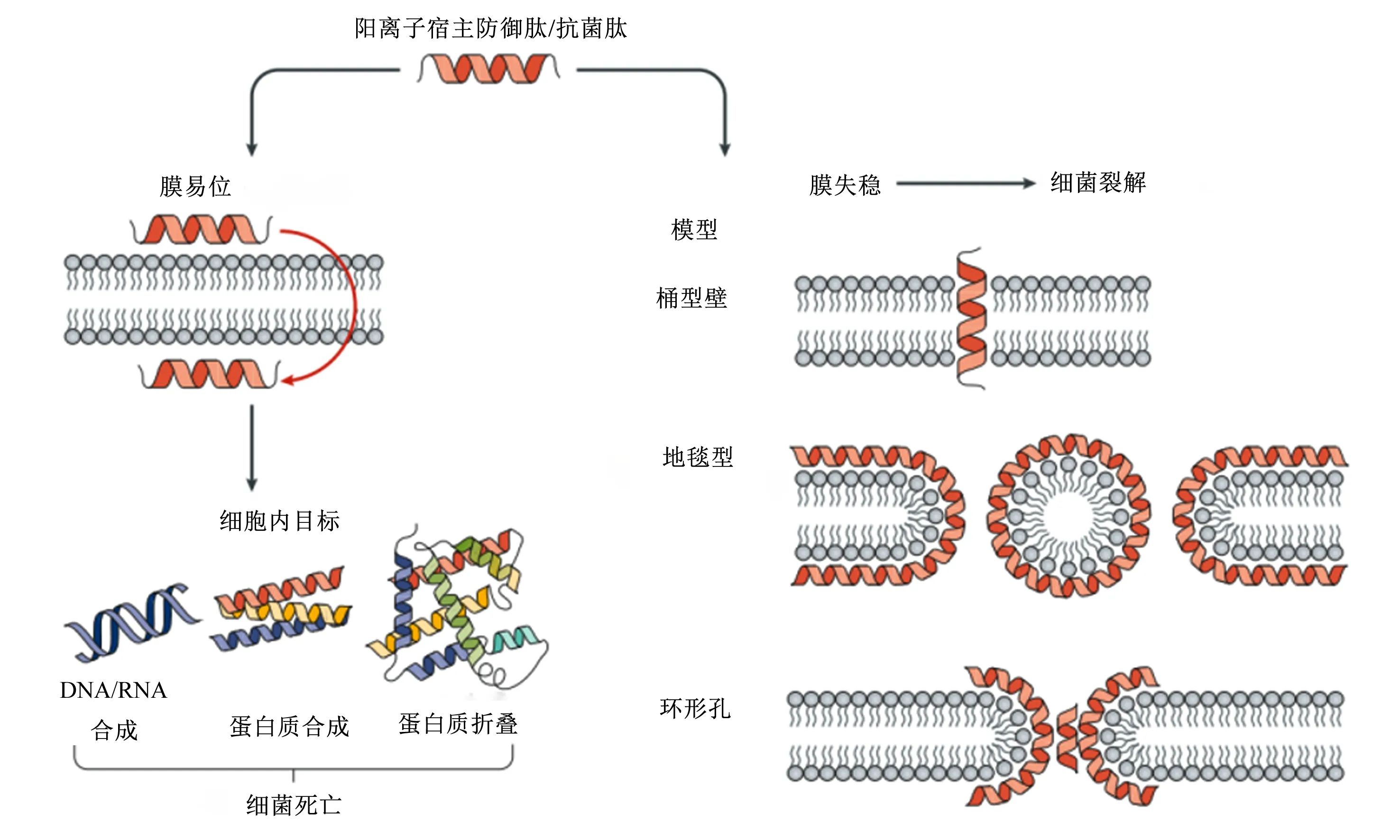
图1 AMPs的抗菌机制模型
2.2 抗病毒作用及机制
口蹄疫病毒和疱疹病毒是导致奶牛乳腺炎发生的病毒类致病微生物。AMPs主要通过3种机制发挥抗病毒作用:1)阻止病毒与细胞膜的融合;2)与病毒的膜相接触,破坏目标病毒的包膜;3)与病毒的聚合酶发生作用,抑制病毒的复制[24-25]。硫酸乙酰肝素是一种带负电荷的糖胺聚糖,其有助于单纯疱疹病毒(herpes simplex viruses,HSV)附着于在宿主细胞表面,而BLf和BLfcin可通过与硫酸乙酰肝素结合来抑制HSV与宿主细胞表面的结合[26]。Shestakov等[27]研究了与牛杆菌素十二肽有远亲关系的合成肽1080在体内外阻断单纯疱疹病毒2型(HSV-2)感染的能力,并发现其对硫酸乙酰肝素有较高的结合活性,在体外能够以剂量依赖的方式减少HSV-2的感染。当小鼠感染低剂量的病毒时,合成肽1080能够完全阻断病毒的复制,证明了其在预防小鼠HSV-2感染方面特别有效。
2.3 抗炎和免疫调节作用及机制
乳腺炎的发生会使奶牛机体产生强烈的炎症反应,从而引起免疫系统的充分激活。研究表明,患乳腺炎奶牛的乳汁和血清内肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-6(interleukin-6,IL-6)等细胞因子表达量均上调,致使乳腺组织中磷酸化的p38蛋白(p-p38)、p38蛋白激酶以及Toll样受体4(Toll-like receptor 4,TLR4)表达量增加,这说明p38-丝裂原活化蛋白激酶(mitogen-activated protein kinase,MARK)通路中相关蛋白质的磷酸化是导致奶牛乳腺炎发生的重要因素[28]。另外,MARK通路的活化会激活核因子-κB(nuclear factor-kappa B,NF-κB)通路,而奶牛乳腺上皮细胞损伤与TLR4/NF-κB信号通路的激活有关[29]。
AMPs被认为是动植物先天免疫系统的重要组成部分,也称为阳离子宿主防御肽(cationic host defense peptides,CHDP)。AMPs对先天免疫系统的保护性激活是提高感染早期清除能力的关键机制之一,其作用包括募集白细胞、调节嗜中性粒细胞的反应性以及影响抗原特异性免疫[23]。相反,在有炎症和/或病原体攻击的情况下,AMPs通过抑制TLR/NF-κB和MAPK通路从而选择性抑制特定的促炎反应,并通过增加肠道β-防御素的表达来增加机体抗病能力[30]。因此,可将AMPs定义为可通过平衡炎症来促进免疫稳态的分子。
截至目前的研究表明,AMPs选择性调节免疫反应的分子机制非常复杂,主要包括细胞内肽的摄取、与一些细胞内蛋白质伴侣或受体和多种信号通路发生相互作用以及介导不同转录因子参与免疫反应[31]。AMPs在宿主免疫系统中的作用见图2。
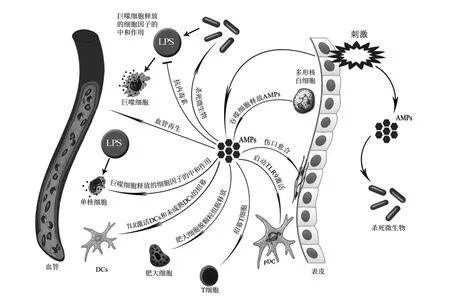
TLR:Toll样受体 Toll-like receptor;LPS:脂多糖 lipopolysaccharide;DCs:树突细胞 dendritic cells;AMPs:抗菌肽 antimicrobial peptides;pDC: 浆细胞样树突状细胞 plasmacytoid dendritic cell。
3 AMPs对奶牛乳腺炎的调节作用
3.1 AMPs在奶牛体内的分布
哺乳动物先天性免疫反应包括抗菌化合物的产生,如无机物质(即过氧化氢或一氧化氮)和抗菌蛋白(即溶菌酶、组织蛋白酶G和乳铁蛋白等)。奶牛的AMPs主要属于Cathelicidin和防御素(defensin)家族,其次还有阴离子抗菌肽及BLfcin,大部分存在于中性粒细胞以及黏膜和皮肤的上皮细胞[33]。
在牛中性粒细胞颗粒中共检测到7种Cathelicidins,包括indolicidin、牛骨髓抗菌肽(bovine myeloid antimicrobial peptides,BMAPs-27、28、34)和细菌素(bactenecins,Bac-1、5、7)[34]。防御素是哺乳动物天然免疫系统的重要组成部分,根据它们二硫键的排列、连接方式及表达位置的差异,可分为α-防御素、β-防御素和θ-防御素[35]。牛源β-防御素主要有气管抗菌肽(tracheal antimicrobial peptide,TAP)、舌抗菌肽(lingual antimicrobial peptide,LAP)、肠β-防御素(enteric β-defensin,EBD)以及牛中性粒细胞β-防御素(bovine neutrophil β-defensins,BNBD l-13)[36]。BLf是一种80 ku的铁结合糖蛋白,被认为是一种重要的宿主防御分子,在体内具有广泛的生理功能[37]。BLfcin是BLf在酸性条件下经胃蛋白酶水解产生,由25个氨基酸组成,对应于BLf的17~41残基[38]。BLfcin的抑菌效果是BLF的400倍,具有在消化道中不易被降解、耐热、无抗原性等优点,且对大多数奶牛乳腺炎致病菌均有抑制和杀灭活性,对耐抗生素的细菌也有抑制作用[39]。
3.2 奶牛乳腺炎发生时AMPs的表达量变化
当病原体侵入奶牛乳腺后,会迅速激活动物机体先天免疫系统的免疫细胞和腺体分泌AMPs,包括α-防御素、β-防御素以及牛乳腺上皮细胞分泌的BLf[40]。这些AMPs经细胞合成后分泌到牛奶中,发挥其抗菌和免疫调节活性,这在宿主机体对乳腺炎的防御中起着至关重要的作用。
有研究表明,BMAPs-27的表达量在奶牛经历第4次泌乳期时呈上调趋势,而BMAP-28的表达量在第3次和第4次泌乳期低于前2次泌乳期[41]。因此,抗菌肽在奶牛乳腺中的表达量在奶牛不同的泌乳阶段中会有所不同。LAP的浓度与体细胞计数(somatic cell count,SCC)有明显的关联性,SCC较低的奶牛,乳腺上皮细胞较完整,可产生高浓度的LAP,LAP浓度随乳腺炎的严重程度而不同。奶牛乳腺炎经抗生素治疗后SCC降低,Kawai等[42]检测到BLf的浓度也随着SCC的降低而降低,并且通过定量蛋白质组学方法鉴定了由S.aureus引起的亚临床型奶牛乳腺炎的乳清,结果发现BLf的蛋白质表达量比健康对照组高2.28倍,基因本体论(gene ontology,GO)分析揭示BLf富集于“抗菌体液反应”(GO:0019731)和“天然免疫反应的正向调节”(GO:0045089)通路;蛋白相互作用网络分析表明,BLf与indolicidin具有良好的相互作用表征,这表明它们作为AMPs和固有免疫系统关键成分可对机体起到双重保护作用[43]。另一项研究表明,BLf在健康奶牛的牛奶和乳腺中的表达水平很低,但在患有临床型乳腺炎的奶牛中表达量明显升高,且牛的BLf基因多态性与乳腺炎的耐药性或易感性密切相关[44]。
4 AMPs在奶牛乳腺炎防治中的应用现状
4.1 在奶牛乳腺炎诊断中的应用
与体细胞相比,蛋白标记物与炎症的相关性更为密切。由于AMPs的存在与SCC密切相关,因此AMPs可作为检测奶牛乳腺炎的炎性标志物之一[45]。因此,临床上已逐渐建立起以AMPs为包被物的酶联免疫吸附试验(ELISA)。ELISA不仅保持了高度的特异性,同时提高了奶牛乳腺炎检测的灵敏度。Addis等[46]开发了一种高性能的牛奶pan-cathelicidin ELISA,并发现不同的奶牛乳腺炎致病菌诱导的Cathelidin释放丰度不同,这种方法比SCC能更好地反映疾病的严重程度,并且可用于疾病的分类、研究不同病原体引起乳腺炎的能力以及监测疾病的恢复情况。Puggioni等[47]使用Cathelidin ELISA检测来自亚临床乳腺炎牛群的牛奶样本,其阳性预测值为95.24%,准确率为61.89%,证明了该方法在区分亚临床型乳腺炎、隐性乳腺炎以及奶牛健康评估方面均具有良好的特异性和较高的敏感性。
4.2 在奶牛乳腺炎防治中的应用
治疗乳腺炎最有效的方法就是向乳房内注入抗生素,但长期且大量滥用抗生素会导致一系列副作用,例如耐药菌株的产生、治疗效果的下降、易造成二次感染、在乳制品中残留等问题,残留在牛奶中的抗生素也会诱发人的超敏反应[48]。在寻找抗生素替代品的过程中,研究人员对AMPs进行了大量的开发和应用。AMPs可用于奶牛饲料添加剂,改善奶牛生产性能,提高其免疫力。同时,AMPs可制成多种剂型,用于奶牛乳腺炎的预防和治疗。有研究表明,将AMPs作为饲料添加剂添加到奶牛饲粮中可治愈奶牛的隐性乳腺炎,并通过提高产奶量和降低SCC影响奶牛的产奶性能,对控制奶牛乳腺炎的发病率有显著作用[49]。
乳酸链球菌素(nisin)是乳酸链球菌产生的一种含34个氨基酸的小分子抗菌肽,其单独使用或与溶菌酶、抗生素联合使用可清除奶牛乳腺炎临床金黄色葡萄球菌分离株产生的生物膜,具有预防或治疗与葡萄球菌生物膜相关感染的潜力[50]。此外,nisin还被制成复合型牛乳头清洗消毒剂,应用于大型牧场后能有效降低乳腺炎的发病率和牛奶中SCC;与其他消毒剂相比,该AMPs消毒剂显著降低了牧场的生产成本[51]。叶滔等[52]以菌丝霉素为原料,制备的成膜剂对奶牛隐性乳腺炎的预防率达到95%,是预防奶牛隐性乳腺炎的理想制剂。杨磊[53]从牛脾脏中分离鉴定出新型AMPs并命名为BSN-37,其富含脯氨酸和精氨酸,BSN-37其对革兰氏阴性菌有较高的抑菌活性,包括临床耐药E.coli菌株。
BLf及其衍生肽的优点是具有广谱的抗菌性,且不会引起细菌耐药性的产生,这扩大了它们在奶牛乳腺炎治疗中作为抗生素替代品的应用潜力。在体内试验中,Kawai等[54]在患有亚临床乳腺炎的奶牛乳导管内注射了BLf水解液。结果显示,乳腺组织中的细菌含量在注射后的第1天明显减少,并在注射后的第14天达到治愈的效果。此外,BLf在乳腺内注射后可显著降低奶牛乳汁中的细菌计数和LPS浓度,显现出比抗生素更理想的治疗效果[55]。在体外条件下,BLf还可显著降低凝固酶阴性葡萄球菌(CNS)在牛乳腺上皮细胞内的复制率[56]。BLf对停乳链球菌的生长也有抑制作用,并具有降低细菌内化到小鼠乳腺上皮细胞的能力[57],因此,研究人员推测BLf可能是通过与细菌结合并阻止其黏附于乳腺上皮细胞,从而限制病原菌对细胞的侵袭。此外,BLfcin在体外试验中对奶牛乳腺炎病原体——饶氏无绿藻(Protothecazopfii),以及从临床病例中分离出的引起真菌性乳腺炎的几种真菌也表现出了杀灭作用[58]。
5 AMPs的开发及应用策略
从动物体内分离抗菌肽不仅步骤繁琐,产率较低,而且需要一些特殊的设备,合成抗菌肽的价格又相当昂贵。近年来,研究人员致力于利用基因工程技术将AMPs基因转入特定生物体中,诱导内源性AMPs的表达;或者以母体肽为模板,设计并合成衍生肽,以解决AMPs来源不足、制备周期长、纯度低等问题。Pie等[59]发现BLfcin可以改变其分子结构以适应离子强度的变化和疏水作用,这种转变有利于其抗菌功能的发挥,可以考虑用于开发针对特定病原体的新型治疗剂。重组牛乳铁蛋白多肽(recombinant bovine lactoferrin polypeptide,rbLfP)是牛乳铁蛋白经基因改造后由毕赤酵母真核表达载体分泌表达的一种重造蛋白质,对动物临床常见的金黄色葡萄球菌等病原菌均有很好的抑菌活性。李海涛等[60]研究发现,rbLfP可通过改变细胞膜表面通透性,对菌体细胞膜的完整性造成损伤,导致菌体内金属离子、核酸和蛋白质泄漏,从而起到抑菌作用,且rbLfP浓度越高,抑菌作用效果越明显。王静[61]使用重叠延伸PCR技术构建了重组牛LAP-CATHL2抗菌肽,将重组牛LAP-CATHL2灌注到由细菌混合感染引起的奶牛乳腺炎动物模型中,发现重组AMPs可降低SCC,且在治疗72 h后降至正常范围,该研究结果表明,重组牛LAP-CATHL2对细菌性奶牛乳腺炎有很好的预防和治疗效果。菌丝霉素的衍生肽NZ2114和MP1102在体外能减少乳腺上皮细胞中内化金黄色葡萄球菌的数量,2种AMPs均能减少小鼠乳腺炎模型乳腺组织中S.aureus的菌落数以及TNF-α和IL-6的浓度[62];付永岩等[63]将苯丙氨酸和脯氨酸以及精氨酸引入BLfcin18-28中进行对称改造,得到的新型AMPs具有溶血率低、细胞毒性小的优点,并能通过破坏细胞外膜、改变细胞渗透压,起到杀菌或抑菌的效果。
尽管AMPs具有许多生物学功能,但静脉给药或口服无法取得理想的效果,这很可能是由于静脉注射后AMPs被血清蛋白灭活或者是口服后被胃肠道中的酶所降解。近年来,水凝胶和纳米制剂作为AMPs的递送系统受到了广泛关注,这种药物包封和递送体系可以保护肽不被血清蛋白降解、提供理想的表征、改善药物对靶组织的生物分布和选择性,从而取得更好的治疗效果[64]。Leng等[65]制备出的载BLfcin纳米胶囊可通过破坏白色念球菌的细胞壁和细胞膜导致菌体死亡,同时该制剂还增强了上皮细胞对白色念珠菌的自然杀伤特性。Manna等[66]从凝乳中提取出多肽并制成水凝胶,用含有16 μg/mL的凝乳肽-水凝胶处理S.aureus,发现S.aureus细菌死亡率为62.54%,凝乳肽-水凝胶还可显着减少S.aureus和铜绿假单胞菌(P.aeruginosa)生物膜的形成。近年来,研究人员还将纳米粒子和水凝胶的优点结合起来,形成纳米凝胶(一种由离子键或非离子键组成的三维聚合物,它能在介质中分散并能膨胀/收缩到一定的尺寸),可作为AMPs的新型药物递送系统[67]。Nordström等[68]研究了阴离子聚-丙烯酸乙酯-共-甲基丙烯酸(MAA)纳米凝胶作为阳离子抗菌肽LL-37和DPK-060的载体,发现AMPs是向内装载在纳米凝胶中,这保护了掺入的AMPs免受蛋白酶水解,同时也降低了多肽介导的细胞毒性。
由于纳米复合制剂可实现高效的AMPs包封、降低多肽毒性的同时提高其稳定性,且能防止AMPs被相关蛋白酶降解,是一种很有前途的AMPs递送系统。目前,纳米制剂、水凝胶和纳米凝胶作为抗菌肽的递送系统仅在体外和试验动物模型中进行了评估,且应用于奶牛乳腺炎防治方面的AMPs-纳米复合制剂仍然较少。未来运用基因工程技术或者化学合成方法改造制备AMPs,并将其制成稳定且低毒的AMPs-纳米复合制剂,用于奶牛乳腺炎的防治将会有广阔的应用前景。
6 小结与展望
乳腺炎是规模化奶牛养殖场中的一种高发疾病,其对奶牛健康和福利造成了严重的影响。广谱抗生素常用于乳腺炎的预防和治疗,但耐药菌株的产生、治疗效果下降以及乳汁中药物残留等问题的解决刻不容缓。因此,寻找并开发抗生素替代品已成为目前的当务之急和研究热点。AMPs是一类具有抗细菌、抗病毒、抗真菌等多种生物学活性的多肽,它在宿主先天性免疫中也扮演着重要的角色,了解AMPs在奶牛乳腺中的分布表达情况、作用机制及其与免疫系统的相互作用,有助于提高将其应用于预防、诊断和治疗奶牛乳腺炎中的可能性。目前,天然来源的AMPs有提取工艺复杂、成本高、半衰期短、对细胞有毒副作用等缺点,限制了其在临床治疗上的应用。随着生物技术的发展,研究人员利用基因工程技术和化学合成方法生产的AMPs在很大程度上降低了其毒副作用,同时提高了抗菌性能;纳米复合技术包被AMPs可以获得稳定性高、溶血活性和毒副作用更低的制剂。未来还需进一步研究AMPs在牛乳腺上皮细胞中的作用机制以及调控奶牛机体免疫反应的信号通路,并通过临床试验验证AMPs单体或复合制剂、载AMPs纳米复合制剂对奶牛乳腺炎的防治效果及安全性。
