层粘连蛋白α4亚基的功能及其与疾病关系的研究进展
2023-10-15于晶晶张丽君何春草曹亦菲杨军
于晶晶 张丽君 何春草 曹亦菲 杨军

摘要:层粘连蛋白家族是基底膜的主要成分。作为家族中的一员,层粘连蛋白α4亚基(LAMA4)广泛存在于成人组织的细胞间质中,参与细胞的固定,并可与相应的整合素受体结合,激活相关的信号转导通路,对于细胞的生长、增殖和迁移,以及人体的正常生长发育均起着重要作用。现有的研究已发现LAMA4与许多疾病的发生、发展有关;此外,还发现LAMA4与多种肿瘤细胞的迁移和侵袭有密切的联系。本文综述了当前LAMA4的研究进展,着重探讨LAMA4与疾病尤其是肿瘤发生发展的关系,以期为相关疾病的诊治提供新的思路。
关键词:层粘连蛋白;层粘连蛋白α4亚基;肿瘤;迁移;侵袭
中图分类号: Q754 文献标志码: A 文章编号:1000-503X(2023)01-0092-09
DOI:10.3881/j.issn.1000.503X.14615
Research Progress on the Role of Laminin Subunit Alpha 4 in Diseases
YU Jingjing1,ZHANG Lijun1,HE Chuncao1,CAO Yifei1,YANG Jun1,2
1Deparment of Preventive Medicine,School of Public Health,Hangzhou Normal University,Hangzhou 311121,China
2Zhejiang Provincial Research Center for Uterine Cancer Diagnosis and Therapy,Womens Hospital,School of Medicine,Zhejiang University,Hangzhou 310006,China
Correspondingauthor:YANG Jun Tel:13858098430,E-mail:gastate@zju.edu.cn
ABSTRACT:Laminin subunit alpha 4 (LAMA4),a member of the laminin family,is present in the intercellular matrix of adult tissues as a major component of basement membrane.LAMA4 is involved in the adhesion of cells and can bind to corresponding integrins to activate relevant signaling pathways,playing an essential role in the growth,proliferation,and migration of cells.It has been demonstrated that LAMA4 is associated with the occurrence and development of a variety of diseases including tumors,and the expression of LAMA4 can be used as a biomarker of tumor diagnosis and prognosis.This paper summarizes the current research progress in LAMA4 with the focus on the relationship between LAMA4 and diseases,especially tumor,with a view to provide new directions for the future research.
Key words:laminins;laminin subunit alpha 4;cancer;migration;invasion
Acta Acad Med Sin,2023,45(1):92-110
層粘连蛋白α4亚基(laminin subunit α 4,LAMA4)是层粘连蛋白家族(laminins,LM)的一员,染色体定位于6q21[1]。基底膜是由LM、Ⅳ型胶原、基底膜蛋白聚糖、聚集素以及巢蛋白等构成的片状结构,是细胞外基质(extracellular matrix,ECM)的特化结构形式,对维持细胞的结构和功能是必需的。作为基底膜的主要成分,LM在正常的细胞生理和机体生长发育过程中也发挥着重要作用,因此,在许多人类疾病中都发现了LM的表达异常,包括肿瘤。LAMA4是一条α单链,而α单链在LM中有着特殊的地位,因为LM的很多功能需要通过与其对应的整合素受体结合才能发挥作用,这种相互作用的特异性又是由α链决定的[2]。但目前国内外对于LAMA4的研究相对不足,许多结论尚不明确。尽管如此,也有关于LAMA4的异常表达参与一些疾病的发生、癌细胞的增殖和迁移等的报道。因此,本文综述了当前关于LAMA4的研究成果,围绕其分子结构、功能以及与疾病的关系展开论述,并着重探讨LAMA4与肿瘤的相互关系,为后续研究提供思路。
LM成员及分子结构
LM是一种由α、β和γ链通过二硫键连接而成的大分子糖蛋白。在该家族中,迄今为止已发现5种α链,3种β链和3种γ链,这些链通过自由组合,理论上可以形成50种以上不同的LM[2]。但由于不同的链在不同的部位表达,3种不同的链不能进行随意的组合,且由于技术水平的限制,目前已发现的LM有19种[1]。LM有2个最基本的功能:(1)是基底膜形成过程中最先出现的蛋白,当LM缺失时,即使基底膜中其他成分表达正常,也无法形成正常的基底膜结构[3]。(2) 作为细胞内外间隔的物理连接,是细胞水平上进行信号传递的关键。由于LM的多样性,决定了基底膜可以和不同的组织结合在一起,使人体各组织表现出不同的生理功能[4]。
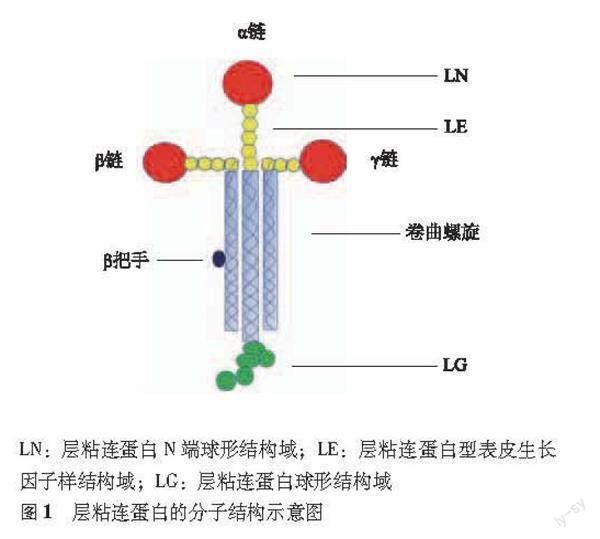
LM是根据它们的链组成来命名的,例如,LM-111的组成是α1β1γ1,LM511是α5β1γ1[5],每条链又折叠成几种特异或多个拷贝的独立结构域。其N端一般为1个球形LN(laminin N-terminal)结构,之后是多个重复的LE[laminin-type epidermal growth factor (EGF)-like]结构域形成的棒状结构(rod-like arrays of repeating LE domains),重复的LE结构域会被1~2个球形的L4/LF (laminin 4/laminin Four,原称为laminin Ⅳ)结构域打断。
C端主要为7个1组重复的非极性氨基酸折叠形成的α卷曲螺旋(α-helical coiled coil)结构,其中β链有额外的31~33个氨基酸序列形成1个“门把手”(the β knob)。α链比β和γ链长出865~900个氨基酸,形成了β三文治折叠(β-sandwich folds)的5个球形结构域(laminin globular,LG):LG1-5。
一个完整的LM是由3条链构成1个“十字架”型(cross-shaped)结构(图1):3条短臂分别由3条链的N端构成,长臂由3条链的C端构成。其中短臂与其他的ECM蛋白发生相互作用,从而完成对基底膜的组装并保证其稳定性。长臂则与细胞表面的受体分子如整合素等相互作用,通过各种信号通路诱导不同的基因表达,最终影响细胞的黏附、迁移、存活及死亡等[5]。LM是胚胎发育早期形成的第1种基底膜成分,因此关键LM的缺失会导致胚胎的死亡。随着胚胎的发育,有些家族成员的表达会逐渐降低甚至消失,但另外一些家族成员可一直广泛地存在于成人的心脏、肾脏和骨骼肌[6]等间充质来源的各种组织以及某些内皮和上皮基底膜中[7-8]。
LAMA4的结构及组织分布
与家族中其他成员相比,LAMA4比较特殊的是它的头部缺少N端的球形LN结构域,因此,LAMA4需要酶交联才能被纳入到生成的ECM中[5]。目前发现LAMA4链只与β1、β2链、γ1、γ3链进行组合,组成LM-411、LM-421和LM-423 3个LM亚型。
对LAMA4体内分布的分析发现,它主要定位于中胚层来源的组织中,如内皮、脂肪细胞、骨骼肌、平滑肌和心肌等;在一些上皮来源的基底膜中也发现了LAMA4的存在,如表皮、唾液腺、胰腺、食管及胃腺、肠隐窝以及肾髓质小管等;发育过程中的变化主要体现在骨骼肌、血管壁及肠隐窝中[9]。
LAMA4的生理学功能
由于LM存在时空表达的差异,其家族各成员的功能也存在较大差别,且由于分析技术的局限性,对特定LM分子功能的研究还不全面,因此,下面仅将LAMA4目前已比较明确的生理功能加以总结。
血管系统的构建 目前研究结果表明,LAMA4最主要的功能之一是参与血管系统的构建。大多数血管的内皮下基底膜含有LM-511和LM-411,它们的表达受到严格的发育调控:胚胎发育血管生成时LM-411是主要的形式,LM-511则在出生后才出现。LAMA4与血管内皮生长因子(vascular endothelial growth factor,VEGF)的协作对于Notch-Dll4控制血管生成的正常功能是必需的。LM-411通过与b1整合素的作用特异性诱导Dll4,进而激活Notch通路。在LAMA4缺失小鼠中,Dll4/Notch信号受到破坏,使得端细胞过度形成导致不受控制的血管形成[10-11]。
由于某些特定的组织、器官中血管对其结构的完整、功能的发挥是必需的,例如,肾小球的滤膜是由毛细血管壁构成的,因此LM在肾小球的发育过程中也是非常重要的[12-13]。研究发现LAMA4缺失小鼠会发生持久的肾小球及肾小管间质纤维化[14]。
胰腺由外分泌腺泡和胰岛构成。胰岛中存在丰富的毛细血管,血管内皮细胞与内分泌细胞也需要被基底膜分隔。在人胚胎胰腺中的基底膜仅有LM-411,成年胰岛中则是双层基底膜:含有LM-511和LM-411的内皮下层,以及仅含LM-511的近β细胞层。同时,腺泡也被基底膜包裹,而其中LAMA2和LAMA4是必需的:LAMA2和LAMA4双缺失小鼠中腺泡基底膜消失,腺泡细胞发生去极化。此外,LM-411还可以激活β1整合素信号依赖性的胰岛素合成,表明其是胰岛的重要组成成分[15]。
同时,虽然在中枢神经系统的许多部位并不存在LM,但血脑屏障是保护中枢神经系统不受血液循环和免疫系统影响的重要物理屏障,而作为血脑屏障的重要组成部分的毛细血管内皮细胞外的双层基底膜就包含了LM-411和LM-511[16]。
免疫细胞的迁移和外渗 LM对于免疫细胞的迁移并到达炎症反应部位是必需的。例如,中性粒细胞表达的LM-411与整合素α6β1和αMβ2发生相互作用,这对它们的迁移和生存非常重要[17]。而毛细血管后微静脉及其基底膜是免疫细胞外渗的主要部位,细胞是否外渗是由血管壁上允许外渗的LAMA4和限制外渗的LAMA5的比例决定的[18-19]。在LAMA4敲除小鼠中,T细胞进入大脑的能力受到了显著影响[20]。
维持外周神经系统的结构和功能 不同于中枢神经系统,外周神经系统中LM广泛存在。比如,轴突表面主要覆盖着β1型(LM-211、LM-411及LM-511);神经肌肉接头(neuromuscular junction,NMJ)则只有β2型(LM-221、LM-421及LM-521)[21-22]。此外,LAMA2和LAMA4对于施万细胞的成熟及轴突髓鞘形成是必需的,而LAMA4对于NMJ的结构完整性和功能的正常发挥至关重要[1,23]。
LAMA4与疾病
子痫前期 也称先兆子痫,是严重危害孕产妇健康的一种疾病,其发病的分子机制还不明确,但研究表明绒毛外滋养细胞(extra villous trophoblasts,EVT)的异常凋亡及降低对子宫螺旋动脉侵袭性与子痫前期的发生有关。Shan等[8]发现LAMA4在子痫前期胎盘中的表达低于正常胎盘;而干扰滋养细胞中LAMA4的表达降低了细胞的侵袭、迁移和血管生成能力。Ji等[24]的研究也表明,LAMA4的基因表达下调抑制了EVT的增殖、迁移和侵袭,并抑制了VEGF的表达而导致子痫前期的发生或发展。以上结果表明,可以以LAMA4为靶点作为治疗子癇前期的一种手段。
扩张型心肌病 扩张型心肌病(dilated cardiomyopathy,DCM)的标志性特征是1个或2个心室的增大,伴随着逐渐减弱的心肌收缩功能。研究首先发现在LAMA4缺失小鼠中存在类似的症状,斑马鱼LAMA4敲除模型也证实了其在心脏功能中的作用[25];进一步对180例严重DCM患者的检测发现,不仅LAMA4基因在整合素作用区存在突变,还存在着LM、整合素和整合素偶联激酶(integrin-linked kinase,ILK)系统性突变[26],为DCM提供了新的研究基础。最近,Abdallah等[27]还在婴儿DCM中发现了LAMA4与MYH7的双基因隐性遗传现象。
组织纤维化 研究发现在LAMA4敲除小鼠中出现进行性肾小球和肾小管间质纤维化,进一步分析表明这是由于LAMA4介导的血小板衍生生长因子活性下调的失败导致的肾脏损害。此外,LAMA4还可导致膝关节的纤维化。LAMA4过表达则上调了与成纤维细胞增殖和迁移相关的基因表达,提示LAMA4相关信号通路轴可能是预防手术引起的关节内纤维化的潜在治疗靶标[28]。
神经肌肉系统疾病 LM包括LAMA4等对于NMJ结构维持及突触囊泡的释放是至关重要的,它们通过与整合素、dystroglycan及电压门控钙离子通道等受体的结合发挥作用。对LM或LM与其受体结合的干扰都会导致神经肌肉疾病如Pierson 综合征和Lambert-Eaton 肌无力综合征等[1]。近年来研究还发现在衰老过程中NMJ神经传递能力的下降与LAMA4表达改变相关[23],更加明确了LAMA4在维持NMJ中的重要作用。
骨关节炎 在骨关节炎软骨中可以检测到LAMA4的表达[29],而抑制LAMA4还可降低基质金属蛋白酶3(martix metalloproteinase 3,MMP3)基因的表达,表明了LAMA4在人骨关节炎发病过程中的作用[30]。此外,软骨细胞簇的形成是骨关节炎的一个形态学特征,抑制LAMA4可显著降低细胞簇的形成,且可影响与细胞迁移相关基因的表达[31]。
LAMA4与肿瘤
一般情况下,LAMA4是以血管内皮细胞表達为主,但研究发现,在许多类型的肿瘤细胞中,LAMA4也发生了异常的表达。
卵巢癌 Chang等[32]通过对癌症基因图谱 (The Cancer Genome Atlas,TCGA)数据库的挖掘分析,发现LAMA4在卵巢癌患者中低表达,且与不良预后有关。Yamamoto等[33]则发现卵巢癌患者腹水中的LAMA4表达较良性囊肿或子宫内膜瘤显著降低。进一步研究发现,miR-30e-3p在卵巢癌中的高表达使得LAMA4的表达降低,而LAMA4过表达可抑制卵巢癌细胞的增殖、迁移和侵袭[34];此过程还受到了1个长非编码RNA(long non-coding RNA,lncRNA) MEG3的调控。这些研究表明,LAMA4在卵巢癌组织中表达降低,可能起到肿瘤抑制基因的作用[35]。
乳腺癌 不同于卵巢癌,在乳腺癌中LAMA4呈现高表达水平,且其表达的增加是恶变前的乳腺病变向恶性肿瘤转变的标志[36]。相对于恶性前细胞,恶性乳腺癌细胞中LAMA4的表达水平更高,并与雌激素受体(estrogen receptor,ER)阴性患者更短的无复发生存期相关[37]。在三阴性乳腺癌(triple-negative breast cancer,TNBC)的研究中也发现肿瘤组织中LAMA4 的mRNA和蛋白表达均升高,并且敲除LAMA4可抑制肿瘤细胞的增殖、迁移和侵袭[38]。此外,还发现LAMA4在乳腺癌中的表达可以受到microRNA的调控,如miR-539[38]、miR-4274[39]等。
胃癌 在针对胃癌构建的基于TNM分级和通路的风险评估模型中,LAMA4与StageⅡ患者手术加化疗后的复发有关[40]。通过对TCGA数据库的挖掘,Wang等[41]发现LAMA4的高表达与更高的肿瘤分级有关,且是不良预后的独立风险因素;对其分子机制的研究则表明敲除LAMA4基因降低胃癌细胞中MMP2的表达,从而降低胃癌细胞的迁移能力,而ZEB1(Zinc finger E-box-binding homeobox1)能够通过结合LAMA4启动子激活其在胃癌细胞中的表达。此外,LAMA4在吉西他滨、阿霉素、曲妥珠单抗、顺铂和长春新碱耐药的胃癌细胞中上调,且LAMA4的高表达与更高的病理分级和更差的生存率有关;进一步体外和体内实验结果表明,过表达LAMA4可增强胃癌细胞的顺铂耐药性,而敲减LAMA4则导致相反的结果[42],这为应对肿瘤的耐药提供了新的思路。
肾细胞癌 通过对肿瘤样本的免疫组织化学分析早已发现LAMA4蛋白在肾透明细胞癌(clear cell renal carcinoma,ccRCC)中的高表达[43],之后在mRNA水平的表达也得到了验证,并且其高表达与ccRCC的转移相关[44]。LAMA4在RCC的肿瘤血管也高表达,并与RCC患者的不良预后有关[43]。对其作用机制的研究表明LAMA4诱导整合素α5β1表达,并通过下游ILK/FAK/ERK途径促进细胞迁移,而其本身的表达则受到miR-200b的调控[43]。Xu等[45]研究还发现,RCC患者中LAMA4水平与维生素D水平负相关。
胶质瘤 Ljubimova等[46]于2001年首次使用基因芯片技术发现LM-411在胶质瘤中高表达,且与患者不良预后有关,在随后的研究中发现使用反义RNA抑制LAMA4的表达可显著抑制胶质瘤细胞的侵袭能力[10,47]。进一步分析发现在WHO分级胶质瘤和恶性程度更高的胶质母细胞瘤(glioblastoma,GBM)中都呈现高表达,且可作为预后的指标[48]。还有研究发现LAMA4与肿瘤干细胞特征基因的表达如Notch通路等相关,抑制LM-411的表达也降低了包含Notch通路在内的多种肿瘤干细胞特征基因的表达[10]。此外,在GBM患者的脑脊液中也发现LAMA4的高表达,可以将GBM患者与非脑瘤患者区分开,且与肿瘤体积大小相关[49]。以上研究结果表明LAMA4可作为胶质瘤的诊断标志物和治疗靶点。
其他肿瘤 除了上述肿瘤外,LAMA4还与其他多种肿瘤的发生发展有关(表1)。例如,在肝癌中LAMA4高表达且与肿瘤的侵袭相关,其表达则受到miR-199a-3p的调控[50]。在胰腺癌中,LAMA4表达较高的患者更容易发生肝转移,且LAMA4的表达与肿瘤的严重程度呈正相关,与生存期呈负相关[7]。在结直肠癌中,更高的LAMA4/LAMA5比值与不良预后有关[51]。在口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)中LAMA4也同样高表达[52],机制分析发现在OSCC肿瘤进展过程中发生的上皮-间质转化(epithelial-mesenchymal transition,EMT)导致细胞从表达LM-511向LM-411的转变,从而促进了肿瘤细胞的侵袭能力[53]。除了在表达上发生改变外,还有研究发现在生存期更短的神经母细胞瘤患者中存在LAMA4基因的突变[54]。
LAMA4在肿瘤研究中的应用
作为生物标志物 如前所述,鉴于LAMA4在多种肿瘤中的表达发生改变,因此可将LAMA4作为肿瘤的诊断标志物。例如,Kohata等[49]通过对脑脊液中LAMA4表达水平的检测可以区分开GBM患者和非脑瘤患者,表明了LAMA4作为肿瘤诊断标志物的可行性。
但LAMA4作为生物标志物的价值可能更表现在肿瘤预后的应用上。有研究发现在结直肠癌患者中,预后不良的患者LAMA4、LAMA5的表达率较高,且LM基因集的预后能力较单个基因更强[51]。Zhou等[40]在胃癌患者TNM分期和通路风险评分模型中发现,LAMA4 、FARP1、SGCE、SGCA和COL9A2 5基因联合可判断Ⅱ期治愈性手术加放化疗患者的复发情况。与之类似,Wang等[41]在胃癌患者中同样发现,LAMA4 高表达能够独立预测胃癌患者的生存率。此外,LAMA4高表达还可以作为肾细胞癌、卵巢癌、胶质细胞瘤等的预后标志[32,45,48,60]。
除了作为某些肿瘤的诊断和预后标志物外,LAMA4还可作为肿瘤转移的重要标志物。Zheng等[7]发现LAMA4介導的肿瘤相关成纤维细胞募集或激活可能有助于胰腺癌的肝转移潜力,因此LAMA4的上调可作为胰腺癌高度肝转移的标志物。此外,LAMA4水平的升高也是肝癌的侵袭和转移[55]、乳腺病变癌变转变[39]和肾细胞癌转移的标志[44]。
作为潜在的治疗靶点 针对LAMA4在肿瘤中的异常表达,研究者也尝试通过各种手段调控LAMA4的表达水平以达到治疗目的。如Nagato等[47]将LAMA4的反义寡核苷酸引入神经胶质瘤细胞中,结果发现可使LAMA4的表达下调,并显著抑制胶质瘤细胞的黏附和迁移能力。Zhang等[58]的研究也得到了同样的结论。近年来关于非编码RNA与LAMA4的研究结果也表明,可以通过特定的microRNA和lncRNA对LAMA4的表达进行调控,从而达到抑制肿瘤细胞增殖、转移的结果[38]。
除了在基因水平进行调控外,还可通过特异性抗体对靶蛋白的结合达到治疗目的。Ishikawa等[57]制备了10种针对LAMA4链的单克隆抗体,发现有两种单克隆抗体显著抑制了肿瘤细胞的黏附和迁移,并且抑制了LAMA4与其配体α6β1整合素和黑色素瘤细胞黏附分子(melanoma cell adhesion molecule,MCAM)的结合,因此可能具有治疗恶性肿瘤的潜力。
总结与展望
由于LAMA4链的特殊性,越来越多的学者开始关注其在疾病,尤其是肿瘤发生发展中的作用。虽然已有的研究对其相应的作用机制和信号通路有了一定的认识,但目前的研究多以肿瘤相关数据库的挖掘为基础,缺乏以LAMA4为直接目的的大规模临床样本的验证。且由于提纯技术的限制,对其单链作用的相关机制研究难以深入,因此未来的研究中应通过基因组学、蛋白组学等系统生物学手段,加强对LAMA4在肿瘤及肿瘤微环境中的作用以及如何通过分子网络进行调控等方面的研究。另外,要不断探索发现各种影响LAMA4相关转移和侵袭信号通路的因子,这将有助于人们更为精准地认识LAMA4在肿瘤中的作用,为肿瘤的诊断和治疗提供新的思路。
参 考 文 献
[1]Rogers RS,Nishimune H.The role of laminins in the organization and function of neuromuscular junctions[J].Matrix Biol,2017,57-58:86-105.DOI:10.1016/j.matbio.2016.08.008.
[2]Aumailley M.The laminin family[J].Cell Adh Migr,2013,7(1):48-55.DOI:10.4161/cam.22826.
[3]Yao Y.Laminin:loss-of-function studies[J].Cell Mol Life Sci,2017,74(6):1095-115.DOI:10.1007/s00018-016-2381-0.
[4]Yurchenco PD,Mckee KK,Reinhard JR,et al.Laminin-deficient muscular dystrophy:molecular pathogenesis and structural repair strategies[J].Matrix Biol,2018,71-72:174-187.DOI:10.1016/j.matbio.2017.11.009.
[5]Domogatskaya A,Rodin S,Tryggvason K.Functional diversity of laminins[J].Annu Rev Cell Dev Biol,2012,28:523-553.DOI:10.1146/annurev-cellbio-101011-155750.
[6]李春霞.纤维粘连蛋白和层粘连蛋白对骨骼肌卫星细胞增殖分化的影响[D].天津:天津农学院,2020.DOI:10.27717/d.cnki.gtjnx.2020.000095.
[7]Zheng B,Qu J,Ohuchida K,et al.LAMA4 upregulation is associated with high liver metastasis potential and poor survival outcome of pancreatic cancer[J].Theranostics,2020,10(22):10274-10289.DOI:10.7150/thno.47001.
[8]Shan N,Zhang X,Xiao X,et al.Laminin α4 (LAMA4) expression promotes trophoblast cell invasion,migration,and angiogenesis,and is lowered in preeclamptic placentas[J].Placenta,2015,36(8):809-920.DOI:10.1016/j.placenta.2015.04.008.
[9]PetjniemiN,Korhonen M,Kortesmaa J,et al.Localization of laminin alpha4-chain in developing and adult human tissues[J].J Histochem Cytochem,2002,50(8):1113-1130.DOI:10.1177/002215540205000813.
[10]Sun T,Patil R,Galstyan A,et al.Blockade of a laminin-411-notch axis with CRISPR/Cas9 or a nanobioconjugate inhibits glioblastoma growth through tumor-microenvironment cross-talk[J].Cancer Res,2019,79(6):1239-12351.DOI:10.1158/0008-5472.CAN-18-2725.
[11]Liu YR,Guan YY,Luan X,et al.Delta-like ligand 4-targeted nanomedicine for antiangiogenic cancer therapy[J].Biomaterials,2015,42:161-171.DOI:10.1016/j.biomaterials.2014.11.039.
[12]Naylor RW,Morais M,Lennon R.Complexities of the glomerular basement membrane[J].Nat Rev Nephrol,2021,17(2):112-127.DOI:10.1038/s41581-020-0329-y.
[13]張俊林,刘芳.肾小球基底膜与肾脏疾病[J].中华肾脏病杂志,2017,33(11):873-877.
[14]Hansen K,Abrass CK.Laminin-8/9 is synthesized by rat glomerular mesangial cells and is required for PDGF-induced mesangial cell migration[J].Kidney Int,2003,64(1):110-118.DOI:10.1046/j.1523-1755.2003.00039.x.
[15]Santini-González J,Simonovich JA,Castro-Gutiérrez R,et al.In vitro generation of peri-islet basement membrane-like structures[J].Biomaterials,2021,273:120808.DOI:10.1016/j.biomaterials.2021.120808.
[16]Galea I.The blood-brain barrier in systemic infection and inflammation[J].Cell Mol Immunol,2021,18(11):2489-2501.DOI:10.1038/s41423-021-00757-x.
[17]Filippi MD.Neutrophil transendothelial migration:updates and new perspectives[J].Blood,2019,133(20):2149-2158.DOI:10.1182/blood-2018-12-844605.
[18]Li L,Shirkey MW,Zhang T,et al.The lymph node stromal laminin α5 shapes alloimmunity[J].J Clin Invest,2020,130(5):2602-2619.DOI:10.1172/JCI135099.
[19]Xu H,Pumiglia K,Laflamme SE.Laminin-511 and α6 integrins regulate the expression of CXCR4 to promote endothelial morphogenesis[J].J Cell Sci,2020,133(11):jcs249595.DOI:10.1242/jcs.246595.
[20]Fowell DJ,Kim M.The spatio-temporal control of effector T cell migration[J].Nat Rev Immunol,2021,21(9):582-596.DOI:10.1038/s41577-021-00507-0.
[21]Zelada D,Bermedo-García F,Collao N,et al.Motor function recovery:deciphering a regenerative niche at the neuromuscular synapse[J].Biol Rev Camb Philos Soc,2021,96(2):752-766.DOI:10.1111/brv.12675.
[22]Chand KK,Lee KM,Lavidis NA,et al.Loss of laminin-α4 results in pre-and postsynaptic modifications at the neuromuscular junction[J].FASEB J,2017,31(4):1323-1336.DOI:10.1096/fj.201600899R.
[23]Lee KM,Chand KK,Hammond LA,et al.Functional decline at the aging neuromuscular junction is associated with altered laminin-α4 expression[J].Aging,2017,9(3):880-899.DOI:10.18632/aging.101198.
[24]Ji Y,Zhou L,Wang G,et al.Role of LAMA4 gene in regulating extravillous trophoblasts in pathogenesis of preeclampsia[J].Med Sci Monit,2019,25:9630-9636.DOI:10.12659/MSM.917402.
[25]Manso AM,Okada H,Sakamoto FM,et al.Loss of mouse cardiomyocyte talin-1 and talin-2 leads to β-1 integrin reduction,costameric instability,and dilated cardiomyopathy[J].Proc Natl Acad Sci USA,2017,114(30):E6250-E6259.DOI:10.1073/pnas.1701416114.
[26]Israeli-Rosenberg S,Manso AM,Okada H,et al.Integrins and integrin-associated proteins in the cardiac myocyte[J].Circ Res,2014,114(3):572-586.DOI:10.1161/CIRCRESAHA.114.301275.
[27]Abdallah AM,Carlus SJ,Al-Mazroea AH,et al.Digenic inheritance of LAMA4 and MYH7 mutations in patient with infantile dilated cardiomyopathy[J].Medicina (Kaunas),2019,55(1):17.DOI:10.3390/medicina55010017.
[28]Wan Q,Liu F,Zhang J,et al.Overexpression of laminin α4 facilitates proliferation and migration of fibroblasts in knee arthrofibrosis by targeting canonical Shh/Gli1 signaling[J].Connect Tissue Res,2021,62(4):464-474.DOI:10.1080/03008207.2020.1773451.
[29]張晓波,张杰,孙钰.未来软骨修复的热点方向:层粘连蛋白促进干细胞增殖[J].中国组织工程研究,2021,25(1):141-145.
[30]Sun Y,Wang TL,Toh WS,et al.The role of laminins in cartilaginous tissues:from development to regeneration[J].Eur Cell Mater,2017,34:40-54.DOI:10.22203/eCM.v034a03.
[31]Moazedi-Fuerst FC,Gruber G,Stradner MH,et al.Effect of laminin-A4 inhibition on cluster formation of human osteoarthritic chondrocytes[J].J Orthop Res,2016,34(3):419-426.DOI:10.1002/jor.23036.
[32]Chang PY,Liao YP,Wang HC,et al.An epigenetic signature of adhesion molecules predicts poor prognosis of ovarian cancer patients[J].Oncotarget,2017,8(32):53432-53449.DOI:10.18632/oncotarget.18515.
[33]Yamamoto CM,Oakes ML,Murakami T,et al.Comparison of benign peritoneal fluid-and ovarian cancer ascites-derived extracellular vesicle RNA biomarkers[J].J Ovarian Res,2018,11(1):20.DOI:10.1186/s13048-018-0391-2.
[34]Liu Y,Xu Y,Ding L,et al.LncRNA MEG3 suppressed the progression of ovarian cancer via sponging miR-30e-3p and regulating LAMA4 expression[J].Cancer Cell Int,2020,20:181.DOI:10.1186/s12935-020-01259-y.
[35]樹成干.LncRNA LINC00936通过吸附miR-221-3p调控LAMA3的表达参与卵巢癌的发生发展[D].苏州:苏州大学,2019.DOI:10.27351/d.cnki.gszhu.2019.001328.
[36]冯城婷,王莹,史悦,等.p-ERK1/2、CD34、层粘连蛋白在乳腺癌组织中的表达及其意义[J].实用癌症杂志,2016,31(5):697-700.
[37]Ross JB,Huh D,Noble LB,et al.Identification of molecular determinants of primary and metastatic tumour re-initiation in breast cancer[J].Nat Cell Biol,2015,17(5):651-664.DOI:10.1038/ncb3148.
[38]Yang ZX,Zhang B,Wei J,et al.MiR-539 inhibits proliferation and migration of triple-negative breast cancer cells by down-regulating LAMA4 expression[J].Cancer Cell Int,2018,18:16.DOI:10.1186/s12935-018-0512-4.
[39]Shkurnikov M,Nikulin S,Nersisyan S,et al.LAMA4-Regulating miR-4274 and its host gene SORCS2 play a role in IGFBP6-dependent effects on phenotype of basal-like breast cancer[J].Front Mol Biosci,2019,6:122.DOI:10.3389/fmolb.2019.00122.
[40]Zhou YY,Kang YT,Chen C,et al.Combination of TNM staging and pathway based risk score models in patients with gastric cancer[J].J Cell Biochem,2018,119(4):3608-3617.DOI:10.1002/jcb.26563.
[41]Wang X,Hou Q,Zhou X.LAMA4 expression is activated by zinc finger E-box-binding homeobox 1 and independently predicts poor overall survival in gastric cancer[J].Oncol Rep,2018,40(3):1725-1733.DOI:10.3892/or.2018.6564.
[42]Peng L,Li Y,Wei S,et al.LAMA4 activated by androgen receptor induces the cisplatin resistance in gastric cancer[J].Biomed Pharmacother,2020,124:109667.DOI:10.1016/j.biopha.2019.109667.
[43]Li Y,Guan B,Liu J,et al.MicroRNA-200b is downregulated and suppresses metastasis by targeting LAMA4 in renal cell carcinoma[J].E Bio Medicine,2019,44:439-451.DOI:10.1016/j.ebiom.2019.05.041.
[44]Yang H,Huo P,Hu G,et al.Identification of gene markers associated with metastasis in clear cell renal cell carcinoma[J].Oncol Lett,2017,13(6):4755-4761.DOI:10.3892/ol.2017.6084.
[45]Xu S,Song J,Zhang ZH,et al.The Vitamin D status is associated with serum C-reactive protein and adhesion molecules in patients with renal cell carcinoma[J].Sci Rep,2019,9(1):16719.DOI:10.1038/s41598-019-53395-9.
[46]Ljubimova JY,Lakhter AJ,Loksh A,et al.Overexpression of a4 chain-containing laminins in human glial tumors identified by gene microarray analysis.Cancer Pes,2001,61(14):5601-5610.
[47]Nagato S,Nakagawa K,Harada H,et al.Downregulation of laminin alpha 4 chain expression inhibits glioma invasion in vitro and in vivo[J].Int J Cancer,2005,117(1):41-50.DOI:10.1002/ijc.21102.
[48]Virga J,Bognár L,Hortobágyi T,et al.Prognostic role of the expression of invasion-related molecules in glioblastoma[J].J Neurol Surg A Cent Eur Neurosurg,2017,78(1):12-19.DOI:10.1055/s-0036-1584920.
[49]Kohata T,Ito S,Masuda T,et al.Laminin subunit alpha-4 and osteopontin are glioblastoma-selective secreted proteins that are increased in the cerebrospinal fluid of glioblastoma patients[J].J Proteome Res,2020,19(8):3542-3553.DOI:10.1021/acs.jproteome.0c00415
[50]Liu AG,Pang YY,Chen G,et al.Downregulation of miR-199a-3p in hepatocellular carcinoma and its relevant molecular mechanism via GEO,TCGA database and in silico analyses[J].Technol Cancer Res Treat,2020,19:1533033820979670.DOI:10.1177/1533033820979670.
[51]Galatenko VV,Maltseva DV,Galatenko AV,et al.Cumulative prognostic power of laminin genes in colorectal cancer[J].BMC Medgenomics,2018,11(Suppl 1):9.DOI:10.1186/s12920-018-0332-3.
[52]Franz M,Wolheim A,Richter P,et al.Stromal laminin chain distribution in normal,hyperplastic and malignant oral mucosa:relation to myofibroblast occurrence and vessel formation[J].J Oral Pathol Med,2010,39(4):290-298.DOI:10.1111/j.1600-0714.2009.00840.x.
[53]Takkunen M,Ainola M,Vainionp N,et al.Epithelial-mesenchymal transition downregulates laminin alpha5 chain and upregulates laminin alpha4 chain in oral squamous carcinoma cells[J].Histochem Cell Biol,2008,130(3):509-525.DOI:10.1007/s00418-008-0443-6.
[54]Esposito MR,Binatti A,Pantile M,et al.Somatic mutations in specific and connected subpathways are associated with short neuroblastoma patients survival and indicate proteins targetable at onset of disease[J].Int J Cancer,2018,143(10):2525-2536.DOI:10.1002/ijc.31748.
[55]Huang X,Ji G,Wu Y,et al.LAMA4,highly expressed in human hepatocellular carcinoma from Chinese patients,is a novel marker of tumor invasion and metastasis[J].J Cancer Res Clin Oncol,2008,134(6):705-714.DOI:10.1007/s00432-007-0342-6.
[56]江海燕.血清铁蛋白、转铁蛋白、层粘连蛋白水平与肝硬化Child-Pugh分级的相关性分析[J].標记免疫分析与临床,2019,26(2):285-259.
[57]Ishikawa T,Wondimu Z,Oikawa Y,et al.Laminins 411 and 421 differentially promote tumor cell migration via α6β1 integrin and MCAM (CD146)[J].Matrix Biol,2014,38:69-83.DOI:10.1016/j.matbio.2014.06.002.
[58]Zhang L,He L,Lugano R,et al.IDH mutation status is associated with distinct vascular gene expression signatures in lower-grade gliomas[J].Neuro Oncol,2018,20(11):1505-1516.DOI:10.1093/neuonc/noy088.
[59]Simonova OA,Kuznetsova EB,Poddubskaya EV,et al.DNA methylation in the promoter regions of the laminin family genes in normal and breast carcinoma tissues[J].Mol Biol (Mosk),2015,49(4):667-677.DOI:10.7868/S0026898415040163.
[60]Wragg JW,Finnity JP,Anderson JA,et al.MCAM and LAMA4 are highly enriched in tumor blood vessels of renal cell carcinoma and predict patient outcome[J].Cancer Res,2016,76(8):2314-2326.DOI:10.1158/0008-5472.CAN-15-1364.
[61]Valletti A,Gigante M,Palumbo O,et al.Genome-wide analysis of differentially expressed genes and splicing isoforms in clear cell renal cell carcinoma[J].PloS One,2013,8(10):e78452.DOI:10.1371/journal.pone.0078452.
[62]MalTseva DV,Makarova YA,Raigorodskaya MP,et al.Effects of laminins 332 and 411 on the epithelial-mesenchymal status of colorectal cancer cells[J].Bull Exp Biol Med,2019,166(3):377-382.DOI:10.1007/s10517-019-04354-x.
[63]Lugassy C,Torres-Muoz JE,Kleinman HK,et al.Overexpression of malignancy-associated laminins and laminin receptors by angiotropic human melanoma cells in a chick chorioallantoic membrane model[J].J Cutan Pathol,2009,36(12):1237-1243.DOI:10.1111/j.1600-0560.2009.01273.x.
[64]Shkurnikov MY,Maltseva DV,Knyazev EN,et al.Expression of stroma components in the lymph nodes affected by prostate cancer metastases[J].Mol Biol (Mosk),2018,52(5):810-816.DOI:10.1134/S0026898418050129.
[65]Zhang Z,Liu R,Jin R,et al.Integrating clinical and genetic analysis of perineural invasion in head and neck squamous cell carcinoma[J].Front Oncol,2019,9:434.DOI:10.3389/fonc.2019.00434.
[66]Cancer Genome Atlas Research Network.Electronic address:elizabeth.demicco@sinaihealthsystem.ca;Cancer Genome Atlas Research Network.Comprehensive and integrated genomic characterization of adult soft tissue sarcomas[J].Cell,2017,171(4):950-965.e28.DOI:10.1016/j.cell.2017.10.014.
[67]Bai C,Yang M,Fan Z,et al.Associations of chemo-and radio-resistant phenotypes with the gap junction,adhesion and extracellular matrix in a three-dimensional culture model of soft sarcoma[J].J Exp Clin Cancer Res,2015,34(1):58.DOI:10.1186/s13046-015-0175-0.
[68]Ruch RJ.Connexin 43 suppresses lung cancer stem cells[J].Cancers (Basel),2019,11(2):175.DOI:10.3390/cancers11020175.
(收稿日期:2021-10-19)
