自身免疫性肝炎、原发性胆汁性肝硬化及其重叠综合征患者白介素-17、核转录因子-κB、转化生长因子β1表达水平及意义
2023-10-13孙小媚阚丽娜崔韶轩杨昊龙
孙小媚,刘 微,阚丽娜 ,崔韶轩,杨昊龙
(1.北京大学第三医院秦皇岛医院风湿免疫科,河北 秦皇岛 066000;2.北京大学第三医院秦皇岛医院消化科,河北 秦皇岛 066000;3.秦皇岛市北戴河医院消化科,河北 秦皇岛 066000;4.齐齐哈尔医学院附属第三医院感染科,黑龙江 齐齐哈尔 161000)
自身免疫性肝病(Autoimmune liver disease,AILD)指由自身免疫介导、以高γ球蛋白血症为特征、不明原因的慢性肝病,包括自身免疫性肝炎(Autoimmune hepatitis,AIH)、原发性胆汁性肝硬化(Primary biliary cirrhosis,PBC)及其AIH-PBC重叠综合征(Overlap syndrome,OS),各种疾病均存在严重肝脏病变表现,如若不及时治疗可迅速向肝硬化进展,甚至诱发肝功能衰竭[1]。目前此三种疾病的发病机制尚未完全明确,临床多认为其发生与自身免疫异常、免疫平衡状态失衡以及遗传、环境因素有关,尤其以女性多见[2-3]。由于此病发病隐匿、进展缓慢,较多患者就诊时已处于疾病中晚期,病情控制难度较大,加之不同AILD类型的症状、病理特点有重叠,增加了临床上诊断的难度。现如今,有关辅助性T细胞亚群(Th)在AILD中的作用已得到证实,其中辅助性T 细胞17(T helper cell 17,Th17)作为新型的Th细胞亚型,因其参与介导自身免疫性疾病的发生、发展而引起了临床的广泛关注。不同于传统的Th细胞亚群,Th17细胞具有独立的分化和调节机制,可特异性产生白细胞介素-17(Interleukin-17,IL-17)、白细胞介素 -22(Interleukin-22,IL-22)等[4]。陈双平等[5]在一项动物试验中,发现免疫性肝损伤小鼠肝脏组织中IL-17呈明显高表达。核因子κB(Nuclear factor kappa-B,NF-κB)为具有转录激活功能的Rel蛋白家族成员。实验表明,NF-κB是多种炎症介质的上游信号分子,可激活炎性因子、趋化因子、转化生长因子β(Transforming growth factor-β,TGF-β)等,是炎性反应的中心环节[6]。研究发现,NF-κB信号通路参与肝纤维化的发生、发展[7]。转化生长因子β1(Transforming growth factor-β1,TGF-β1)为TGF-β的异构体,其主要的生物活性在于诱导肝细胞凋亡以及抑制肝细胞再生。研究表明[8],TGF-β1表达上调可加重小鼠急性肝衰竭和肝性脑病。结合上述文献,不难看出IL-17、NF-κB、TGF-β1与AILD的发生发展有关联,但目前尚缺乏IL-17、NF-κB、TGF-β1在AIH、PBC及AIH/PBC OS作用的相关研究。基于此,本研究检测上述三种疾病患者外周血IL-17、NF-κB、TGF-β1表达情况,探讨其临床意义。
1 资料与方法
1.1 一般资料 2020年1月至2023年1月我院收治的自身免疫性肝病(AILD)患者72例,其中AIH 28例(A组),诊断符合《2015年欧洲肝病学会临床实践指南:自身免疫性肝炎》[9];PBC 25例(B组),诊断符合《原发性胆汁性肝硬化(又名原发性胆汁性胆管炎)诊断和治疗共识(2015)》[10];重叠综合征19例(C组),诊断参考欧洲肝脏研究协会推荐的AIH/PBC OS诊断标准[11]。所有入选患者均排除其他类型的肝脏疾病、因药物、嗜酒导致的肝损伤、妊娠及哺乳女性等。另选同期健康体检者30例作为对照组,均为我院体检中心健康体检志愿者,无自身免疫性疾病以及心、肺、肝、肾等严重基础病,且近期不存在感染情况。所有受试者均签订知情同意书,本研究经医院伦理委员会批准通过。四组在性别、年龄上比较,差异无统计学意义(均P>0.05);A、B、C组性别、年龄、病程、临床表现比较,差异无统计学意义(均P>0.05),具有可比性。见表1。
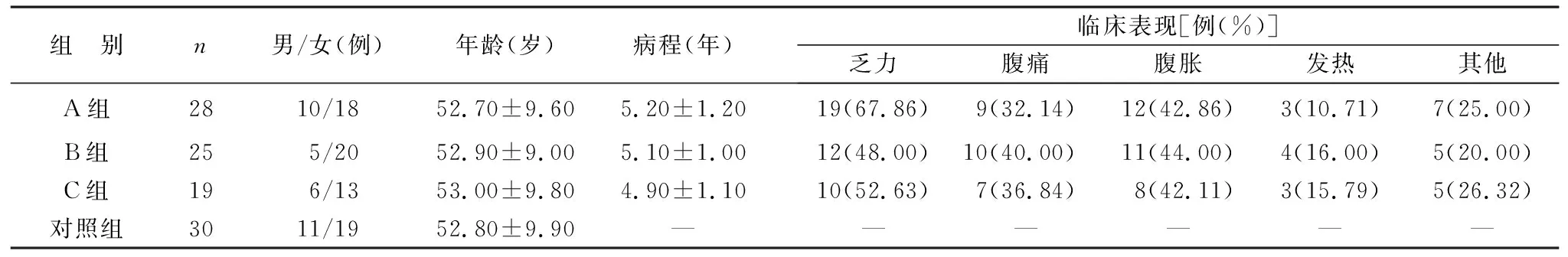
表1 四组基本资料比较
1.2 检测方法 采集所有受试者空腹静脉血 5 ml,3000 r/min离心10 min,留取血清标本,A、B、C组于入院次日清晨采集,对照组于体检当日采集。以酶联免疫吸附法(ELISA)测定IL-17(试剂盒购自上海信裕生物科技有限公司)、NF-κB及TGF-β1(试剂盒购自上海裕平生物有限公司)表达,检测均以双抗体夹心法完成;总胆红素(TBIL)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、谷氨酰转肽酶(GGT)等肝功能指标采用全自动生化分析仪进行测定。

2 结 果
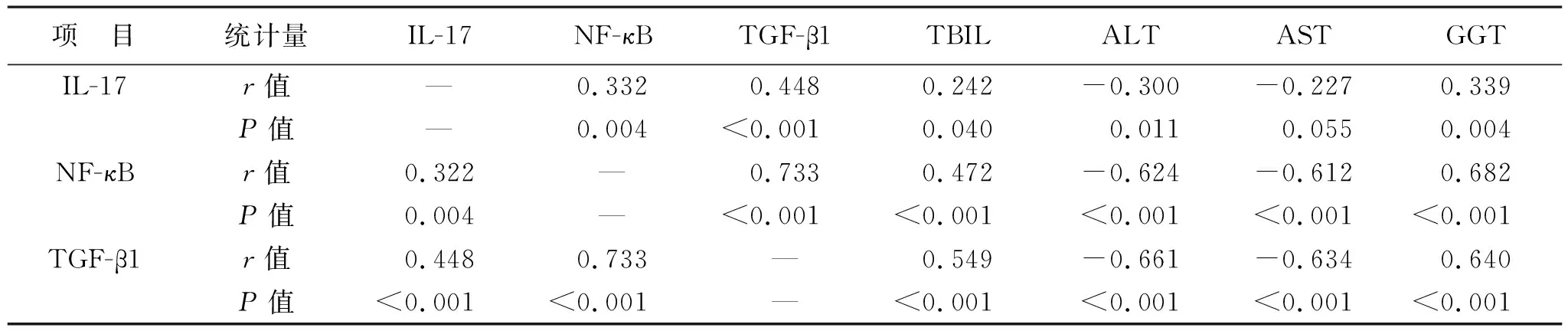
2.1 四组血清IL-17、NF-κB及TGF-β1水平比较 A、B、C组血清IL-17、NF-κB、TGF-β1水平均高于对照组,差异有统计学意义(均P<0.05);四组血清IL-17、NF-κB、TGF-β1水平比较:对照组 表2 四组血清IL-17、NF-κB及TGF-β1水平比较 2.2 四组肝功能指标比较 A、B、C组血清TBIL、ALT、AST、GGT水平均高于对照组,差异有统计学意义(均P<0.05);四组血清TBIL、GGT水平比较:对照组 表3 四组肝功能指标比较 2.3 AILD患者血清IL-17、NF-κB、TGF-β1与肝功能指标的关联性 AILD患者血清IL-17与NF-κB、TGF-β1、TBIL、GGT正相关(r=0.332、0.448、0.242、0.339,P<0.05),与ALT负相关(r=-0.300,P<0.05);NF-κB与TGF-β1、TBIL、GGT正相关(r=0.733、0.472、0.682),与ALT、AST负相关(r=-0.624、-0.612,P<0.05);TGF-β1与TBIL、GGT正相关(r=0.549、0.640,P<0.05),与ALT、AST负相关(r=-0.661、-0.634,均P<0.05)。见表4。 表4 AILD患者血清IL-17、NF-κB、TGF-β1与肝功能指标的相关性 AIDL的发病机制尚未明了,目前普遍认为环境因素、免疫因素和感染因素在AIDL的发生、发展中发挥着重要作用,这三种因素均可诱导T细胞对肝脏抗原进行免疫攻击,引起典型的AIDL组织病理学改变[12-13]。AIDL具有恶变倾向,但进展相对缓慢。研究指出,AILD患者的总体癌症风险(RR=3.64,95%CI:2.64~5.03,P<0.001)和癌症相关死亡风险(RR=2.48,95%CI:1.73~3.53,P<0.001)明显增加[14]。近年来,随着临床对AILD研究的深入,肝脏活检、自身抗体检测等技术的推广应用,我国AILD的检出率明显提高[15],在此背景下,AIDL的诊治也引起了临床医师的广泛关注。 AIDL临床常见AIH、PBC、AIH/PBC OS三种类型,其中AIH起病隐匿,大部分患者表现为嗜睡、乏力、疲劳、食欲不振、腹痛、黄疸、瘙痒等,特异性并不显著。PBC同样为关联于自身免疫的慢性炎症性肝脏疾病,好发于女性,病程呈慢性进展性,黄疸、瘙痒、乏力等慢性胆汁淤积性疾病特点为其主要临床表现,部分患者还可伴随上消化出血、骨质疏松、腹部不适等症[16]。AIH/PBC OS患者由于同时或在疾病不同阶段发生AIH、PBC,因此其临床症状与AIH、PBC相类似,既有程度不一的肝炎、肝硬化、肝性脑病等症状,亦有疲劳、乏力、瘙痒、黄疸等表现,其临床症状主要由两种疾病中哪个优势更突出而决定[17]。本研究中,A、B、C三组患者均以中老年女性为主,三组在性别、年龄、临床表现上比较差异无统计学意义,与既往报道一致。提示AIH、PBC与AIH/PBC OS患者具有相似的临床症状和体征,因此仅仅依靠体格检查进行鉴别诊断较为困难,临床应引起重视。 既往研究表明,初始CD4+T细胞可分化为Th1、Th2细胞2个亚型,前者主要作用于诱导细胞免疫反应,而后者则主要参与体液免疫反应[18]。Th17细胞主要特征为分泌IL-17等细胞因子参与肝脏损伤及再生,能对Th1、Th2细胞无法抵抗的细菌和真菌进行有效抵抗。Beringer等[19]的研究指出,IL-17可诱导免疫细胞浸润和肝脏损伤,导致肝脏炎症和纤维化,引发AILD。NF-κB为重要的炎性调节反应因子,其活化途径具有多重性,主要包括P50、P65、c-Rel和RelB等,其中研究最为广泛的是P65/P50NF-κB二聚体,主要参与NF-κB信号经典通路激活,可诱导多种促炎因子表达,加重体内炎症反应[20]。姚婷等[21]研究也显示,免疫性相关疾病可能与炎症相关信号通路的活性及炎性因子分泌异常相关。研究发现,NF-κB多种信号通路参与肝硬化、肝纤维化以及肝癌的发生、发展过程。TGF-β1是促进肝纤维化的重要因子,可同时分化启动Treg细胞与Th17细胞。本研究中,A、B、C组血清IL-17、NF-κB、TGF-β1水平均高于对照组,提示AIH、PBC、AIH/PBC OS患者可能存在不同程度IL-17、NF-κB、TGF-β1升高情况,IL-17、NF-κB、TGF-β1可能参与AIDL发生、发展。通过比较IL-17、NF-κB、TGF-β1在疾病发展不同阶段的表达水平发现,其中C组最高,其次为B组,A组次之,可见IL-17、NF-κB、TGF-β1水平随着AIDL病情进展而逐渐升高。究其原因可能是[22]:AIH患者的病理学变化主要表现为肝脏组织界面炎症,此时肝组织局部免疫增强,肝细胞与Th17细胞之间的正反馈调节导致炎症过程功能性增强,使血清IL-17、NF-κB、TGF-β1有所升高;PBC阶段时,其病理学表现以汇管区炎症为主,淋巴细胞围绕损伤胆管,并向受损胆管浸润,加快Th17细胞分化速度,使外周血IL-17水平显著升高,生成前炎症反应,并促进炎症细胞移行,此时过表达的IL-17可加重慢性胆管炎症,NF-κB、TGF-β1表达亦有大幅提升;而AIH/PBC OS兼具AIH与PBC的病理学改变,肝脏炎症损伤、肝脏纤维化程度更严重,故而血清IL-17、NF-κB、TGF-β1升高最为显著。 TBIL、ALT、AST、GGT是目前用于评价肝功能的重要指标,能够较为敏感地反映肝细胞损伤的严重程度[23]。本研究中,A、B、C三组血清TBIL、ALT、AST、GGT水平均高于对照组,其中A组患者以血清ALT、AST升高最显著,这可能与AIH的干细胞炎性破坏有关;B组患者以GGT升高为主要血清学表现,与PBC的胆管损害特征一致;而C组患者因兼具AIH、PBC生化特点,血清TBIL、ALT、AST及GGT均有所升高。另外,本研究还发现,72例ADIL患者血清IL-17、NF-κB、TGF-β1水平与上述肝功能指标呈现不同程度的相关关系,提示AIH、PBC、AIH/PBC OS患者血清IL-17、NF-κB、TGF-β1表达与肝功能关系密切,其可能在导致AIH、PBC、AIH/PBC OS的肝细胞损伤以及疾病进展中发挥了协同作用,但其具体的作用机制本研究尚未阐明,是今后研究的方向。 综上所述,IL-17、NF-κB、TGF-β1在AIH、PBC及AIH/PBC OS患者血清表达中有不同程度升高,并且与肝功能损伤程度之间有关联,极有可能参与肝脏疾病损伤-炎症及免疫损伤过程,应用其变化规律可能对提高临床诊断和治疗水平有一定帮助。

3 讨 论
