不同个体来源和低氧条件对人骨髓间充质干细胞生物学特性的影响
2023-10-13孙雪飞李静颐陈媛姜茜茜张玲玲王琳刘元波
孙雪飞,李静颐,陈媛,姜茜茜,张玲玲,王琳,刘元波
·论著·
不同个体来源和低氧条件对人骨髓间充质干细胞生物学特性的影响
孙雪飞,李静颐,陈媛,姜茜茜,张玲玲,王琳,刘元波
100070 北京,首都医科大学附属北京天坛医院血液科(孙雪飞、刘元波);102600 北京,九芝堂美科(北京)细胞技术有限公司(李静颐、陈媛、姜茜茜、张玲玲、王琳)
研究 6 株不同个体(男:M1、M2、M3;女:F1、F2、F3)来源人骨髓间充质干细胞(BM-MSC)在不同低氧条件下生物学特性的差异。流式及诱导分化实验鉴定间充质干细胞的标志物表达及三系分化能力。Transwell 法检测迁移能力。CCK8 法检测 5% 及 1% 氧气下细胞活力差异。6 株 BM-MSC 阳性标志物表达均高于 99%,阴性标志物总表达均低于 2%,且均具有三系分化能力。不同个体来源 BM-MSC 成骨、成脂分化效率和细胞活力具有差异,性别分层统计显示成脂分化差异可能与性别相关;不同低氧条件下 BM-MSC 的细胞活力和细胞迁移能力具有差异,5% 氧气条件显著优于 1% 氧气条件。同时考虑氧气和性别因素时,发现不同低氧条件下男性来源的 BM-MSC 活力相对女性均具有较高的趋势,而迁移能力则是女性来源的 BM-MSC 相对更强。提示应根据人骨髓间充质干细胞的应用目的所需特性对供者个体和扩增环境设立特定标准。
人骨髓间充质干细胞; 低氧; 性别; 细胞活力
间充质干细胞(mesenchymal stem cells,MSC)是多组织来源的一种具有多向分化潜能的干细胞,可从脐带、胎盘、羊膜、脂肪、牙髓、骨髓等组织中获取[1]。由于 MSC 具备较低的免疫原性且具有组织修复、免疫调节、炎症调节等多种特性,因此在再生与康复医学中占有重要地位[2]。骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BM-MSC)由于方便取材、易于转染、免疫原性低而广泛应用于治疗心血管病、肺病、免疫疾病、神经系统疾病等[3]。
BM-MSC 在解决医疗领域的各种严重健康问题方面显示出巨大潜力[4],推进骨髓间充质干细胞进入临床已成为趋势,目前针对 BM-MSC 的研究大多集中在疗效、机制及不良反应方面,对于有助于 BM-MSC 成品化的药学研究探讨较少。药学开发包括起始原材料控制和生产工艺的开发。但作为关键的起始原材料,骨髓来源的供者目前尚无细胞特性相关的筛选标准,培养条件对细胞特性的影响也尚需更多研究。因此本研究通过对比不同个体来源和低氧条件下 BM-MSC 的生物学特性,初步评估个体和环境因素对细胞的影响。
BM-MSC 在机体内通过多种机制发挥作用,包括免疫调节、炎症调节、旁分泌等[5],并且能够定向迁移至机体特定损伤部位。有多项研究报道,低氧条件(5%)相对常氧条件(20%)可提升 MSC 迁移能力[6-7],但很少有研究对比超低氧(1%)及低氧(5%)条件下 MSC 活力和迁移能力的差异。此外,MSC 的扩增能力直接影响干细胞药物规模化生产,因此在保证 MSC 迁移能力的基础上探索最适宜的培养条件对于 MSC 作为药品进行量产扩增至关重要。
本研究对不同个体来源的 BM-MSC 进行间充质干细胞特性鉴定,探讨不同低氧条件下不同个体来源 BM-MSC 生物学特性、细胞活力及迁移能力的差异,为 BM-MSC 的质量影响因素研究提供更多参考。
1 材料与方法
1.1 主要试剂与仪器
BM-MSC 为九芝堂美科(北京)细胞技术有限公司产品;RPMI 1640 培养基购自 Gibco 公司;胎牛血清购自 Lonsera 公司;细胞活力检测试剂盒(CCK8)购自上海碧云天生物技术有限公司;成骨分化试剂盒、成脂分化试剂盒和成软骨分化试剂盒购自 Stemcell 公司;茜素红染色试剂盒、油红染色试剂盒和阿尔新蓝染色试剂盒均购自美国 Sigma 公司;transwell 细胞培养皿购自广州洁特;DAPI 染液购自索莱宝公司;流式抗体:CD14-PE、CD19-PE、CD34-PE、CD45-PE、HLA-DR-PE、CD73-PE、CD90-PE、CD105-APC、IgG1-PE 均购自美国R&D 公司;4% 组织固定液购自北京索莱宝科技有限公司。
三气培养箱、离心机和酶标仪为美国 Thermo 公司产品;流式细胞仪为美国 Beckman公司产品;倒置荧光显微镜为 Leica 公司产品;细胞计数仪为 Countstar 公司产品;超净台为 Esco 公司产品。
1.2 方法
1.2.1 细胞培养 骨髓样本与 HBSS 混匀后加入到 1.077 kg/m3Ficoll-paque 分离液中,500 ×离心 30 min。收集单核细胞层后,于 HBSS 中洗涤 1 次。洗涤后的沉淀重悬于间充质干细胞培养基(DMEM + 10% FBS)中,在 37 ℃、5% CO2条件下培养,24 h 后更换培养基,弃去未贴壁的细胞,每隔 3 ~ 4 天换液,倒置显微镜下观察细胞生长情况。约 70% 融合度时采用 TrypLE 消化细胞。获取的细胞冻存–130 ℃及以下条件。
待获取不同供体细胞后,取出冻存的细胞在水浴锅中快速复苏后加入间充质干细胞培养基,500 ×离心 5 min。离心完成后弃上清,加入间充质干细胞培养基后混匀接种至 10 cm 细胞培养皿中培养,待培养到可供后续实验的数量时收获。
1.2.2 表面标志物检测 分别用无菌 PBS 重悬 6 个来源的 BM-MSC,按照流式检测试剂盒要求加入抗体常温孵育 1 h 后离心去上清,PBS 清洗 2 遍后加入 PBS 重悬细胞并上机进行流式检测。
1.2.3 成骨分化 将 6 株不同个体(男:M1、M2、M3;女:F1、F2、F3)来源的 BM-MSC 分别接种于六孔板,细胞长满后弃掉培养基,每孔加入 2 ml 分化试剂盒中的成骨分化培养基,每3 ~4 天更换一次培养基,分化培养 12 ~ 16 d 观察到骨基质形成,使用茜素红染色观察成骨分化情况并拍照记录。
1.2.4 成脂分化 将 6 株不同个体来源的 BM-MSC 分别接种于六孔板,细胞长满后弃掉培养基,每孔加入 2 ml 分化试剂盒中的成脂分化培养基,每 3 ~ 4 天更换一次培养基,分化培养 12 ~ 16 d 观察到脂滴形成后使用油红染色观察成脂分化情况并拍照记录。
1.2.5 成软骨分化 将 6 株不同个体来源的 BM-MSC 分别接种于 6 个 15 ml 离心管中,500 ×离心 5 min 后弃上清,将离心形成的细胞团留在离心管底部,加入 2 ml 分化试剂盒中的成软骨分化培养基进行分化培养,每 3 ~ 4 天更换一次培养基,分化培养 14 ~ 18 d 将细胞团吸出,4% PFA 固定后进行冰冻切片,使用阿尔新蓝对冰冻切片染色观察成软骨分化情况并拍照记录。
1.2.6 细胞迁移实验 在 24 孔板的实验孔中加入 500 μl 间充质干细胞培养基。取 1 × 105个 BM-MSC 细胞接种于 24 孔板的 transwell 培养板上层嵌入皿中,再加入 250 μl 间充质干细胞培养基,保证上层嵌入皿浸没于培养基中。在低氧、超低氧条件下培养 4 h 后取出细胞培养板,弃掉嵌入皿及嵌入皿下层培养孔中的培养基,在培养孔中加入 400 μl 细胞消化液,液面可触及嵌入皿底,消化细胞 8 min 后弃嵌入皿,充分吹打消化液后取 20 μl 与20 μl AOPI 染液 1:1 混合,使用细胞计数仪检测迁移的细胞数量。
1.2.7 细胞活力检测 分别取 6 个来源 BM-MSC 各 2500 个细胞接种于 96 孔板中,每孔加入 100 μl 间充质干细胞培养基。每组 BM-MSC均设 3 个平行。分别于接种后的第24、48、72 h 向实验孔中加入 10 μl CCK8 试剂,37 ℃避光孵育 2 h 后使用酶标仪读取450 nm 处的值,并根据值绘制 BM-MSC 的生长曲线。
1.3 统计学处理

2 结果
2.1 细胞标志物的表达
使用流式细胞术对 6 株 BM-MSC 进行细胞表面标记物检测,阳性标记物 CD73、CD90、CD105在所有 6 株细胞中的表达均在 95% 以上(图1)。
阴性细胞表面标志物 HLA-DR、CD14、CD19、CD34、CD45(CD14、CD19、CD34、CD45 检测结果合并用 CDM 表示),6 株 BM-MSC阴性标记物表达均在 2% 以下(图1)。

图1 BM-MSC 细胞表面标志物(M:男性;F:女性)
Figure 1 Cell surface markers of BM-MSC (M: Male; F: Female)
Figure 2 Triple differentiation potential of BM-MSC [A: Alizarin red staining for osteogenic differentiation (× 20); B: Comparison of osteogenic differentiation efficiency; C: Oil red staining of adipogenic differentiation (× 20); D: Comparison of adipogenic differentiation efficiency; E: Alcian blue staining for chondrogenic differentiation (× 20); M: Male; F: Female]
2.2 细胞多向分化潜能
2.2.1 BM-MSC 的成骨分化潜能 分别诱导 6 株 BM-MSC 成骨分化,在分化第 14 天均可被茜素红染为橘红色(图2A),表明 6 株 BM-MSC 均具有成骨分化潜能,符合间充质干细胞鉴定要求中的成骨分化。不同个体来源 BM-MSC 细胞 M1、M2、M3、F1、F2、F3 的茜素红染色面积分别为 0.542%、4.568%、8.737%、5.381%、1.270%、16.220%,显示成骨分化效率个体差异较大。男性与女性来源 BM-MSC 成骨分化茜素红染色面积(图2B)无显著差异(= 0.583)。
2.2.2 BM-MSC 的成脂分化潜能 分别诱导 6 株 BM-MSC 成脂分化,在第 14 天分化成的脂细胞中的脂滴可被油红 O 染成红色。6 株 BM-MSC 在成脂分化后均可见脂滴积累(图2C),表明 6 株 BM-MSC 均具有成脂分化潜能,符合间充质干细胞鉴定要求中的成脂分化。不同个体来源 BM-MSC 细胞 M1、M2、M3、F1、F2、F3 的油红染色面积分别为11.368%、14.284%、16.379%、11.123%、8.013%、5.702%。不同性别来源 BM-MSC 成脂分化油红染色面积统计(图2D)发现男性来源 BM-MSC 染色面积有高于女性来源的趋势(= 0.0503)。
2.2.3 BM-MSC 的成软骨分化潜能 分别诱导 6 株 BM-MSC 成软骨分化,在分化第 16 天进行阿尔新蓝染色,分化后的软骨细胞中的蛋白多糖基质可被阿尔新蓝染料染为蓝绿色。6 株 BM-MSC 在成软骨分化后均可被阿尔新蓝染为蓝绿色(图2E),表明均具有成软骨分化潜能,符合间充质干细胞鉴定要求中的成软骨分化。
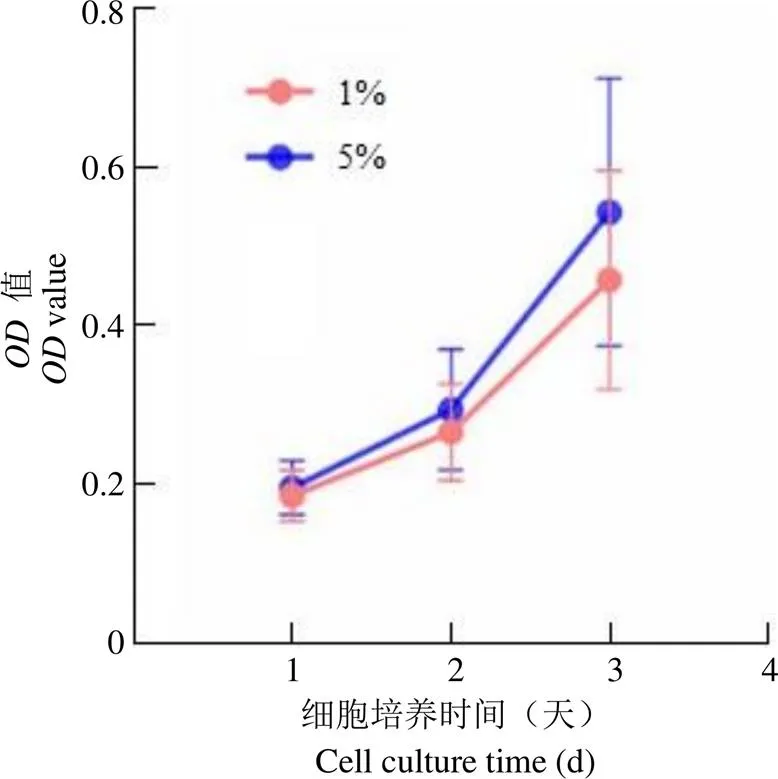
图3 不同低氧条件下 BM-MSC 细胞活力
Figure 3 Cell viability of BM-MSC under different oxygen conditions
2.3 不同低氧条件下 BM-MSC 的细胞活力
2.3.1 低氧条件对细胞活力影响 分别在超低氧(1%)、低氧(5%)条件下培养 6 株 BM-MSC,细胞接种后每 24 小时进行一次 CCK8 检测,通过值对比不同低氧条件下 BM-MSC 的生长情况(图3)。
BM-MSC 接种后前 2 天,生长曲线呈平缓上升,细胞处于缓慢生长状态,不同低氧条件下细胞活力差别不大,低氧条件下 BM-MSC 细胞活力略强。接种后第 3 天,细胞加快生长,低氧和超低氧条件下 BM-MSC 的值分别为 0.542 ± 0.169、0.457 ± 0.138,低氧培养的 BM-MSC 活力强于超低氧组。
2.3.2 性别条件对 BM-MSC 活力的影响 使用 CCK8 法在不同低氧条件下检测不同性别个体来源 BM-MSC 活力差异,结果见图4。男性来源BM-MSC 活力在不同低氧培养条件下均较女性来源的 BM-MSC 有更高的趋势。

图4 不同性别来源 BM-MSC 活力(A:低氧5%;B:超低氧1%;M:男性;F:女性)
Figure 4 Cell viability of BM-MSC from different genders (A: 5% oxygen; B: 1% oxygen; M: Male; F: Female)
2.3.3 不同个体来源细胞活力对比 使用 CCK8 法检测 6 株不同个体来源 BM-MSC 的细胞活力。6 株细胞在不同氧气条件下的生长趋势一致,均为前 2 天缓慢生长,第 3 天快速生长。比较而言,M1、M3、F3 接种后细胞活力相对较高,其中 M3 接种后细胞活力最高(图5)。
2.4 不同低氧条件对 BM-MSC 迁移能力的影响
2.4.1 低氧条件对迁移能力的影响 使用 transwell法分别在超低氧和低氧条件下对 6 株 BM-MSC 进行培养,4 h 后对穿过嵌入皿底部的细胞进行消化和计数。低氧条件下 BM-MSC 迁移数量为(32760.0 ± 14391.8)个,显著高于超低氧条件下的(18948.3 ± 6074.6)个(< 0.0001)。
2.4.2 性别对 BM-MSC 迁移能力的影响 超低氧条件下不同性别来源 BM-MSC 迁移数量无显著差异(图6A)。低氧条件下女性来源BM-MSC 迁移数量为(41046.0 ± 11021.2)个,显著高于男性来源的(24473.0 ± 12812.7)个(< 0.001)。

图5 不同个体来源 BM-MSC 在不同低氧条件下的细胞活力(A:1% 超低氧;B:5% 低氧;M:男性;F:女性;*表示与 M2 对比细胞活力具有显著性差异,*P < 0.05,**P < 0.01,***P < 0.001;#表示与 F1 对比细胞活力具有显著性差异,#P < 0.05,##P < 0.01,###P < 0.001;+表示与 F2 对比细胞活力具有显著性差异,+P < 0.05,++P < 0.01,+++P < 0.001;&表示与 F3 对比细胞活力具有显著性差异,&P < 0.05,&&P < 0.01)
Figure 5 Cell viability of BM-MSC from different individual sources under different oxygen conditions (A: 1% oxygen; B: 5% oxygen; M: Male; F: Female;*< 0.05,**<0.01,***< 0.001 versus M2;#< 0.05,##< 0.01,###< 0.001 versus F1;+< 0.05,++< 0.01,+++< 0.001 versus F2;&< 0.05,&&< 0.01 versus F3)

图6 不同低氧条件下 BM-MSC 迁移能力差别(A:性别对 BM-MSC 迁移能力的影响,**P < 0.001;B:不同个体 BM-MSC 迁移能力的差别,*表示与 M1 对比有显著差异,**P < 0.001;#表示与 M3 对比有显著差异,#P < 0.05,##P < 0.01;+表示与 F2 对比有显著差异,+P < 0.05,++P < 0.01;M:男性;F:女性)
Figure 6 Differences in migration ability of BM-MSC under different oxygen conditions (A: The impact of gender on the migration ability of BM-MSC,**< 0.001; B: Differences in migration ability of BM-MSC from different individual sources,**< 0.001 versus M1;#< 0.05,##< 0.01 versus M3;+< 0.05,++< 0.01 versus F2; M: Male; F: Female)
2.4.3 不同个体来源 BM-MSC 迁移能力的差异 超低氧条件下各组细胞迁移数量均较低,其中 M3 迁移细胞数量显著低于 M2 和 F2。低氧条件下,M2、F1、F3 的迁移细胞数量显著高于其他3 株细胞(图6B),其中 F1 迁移能力最强。以上结果说明 BM-MSC 细胞迁移能力个体差异较大。
3 讨论
MSC 是再生医学领域最常用的干细胞类型[8],易于获得,可以在体外成倍扩增,因此可为今后临床大规模应用提供足够的产量[9]。而 MSC 广泛应用于临床的挑战之一便是不同个体来源 MSC 之间的差异,细胞活力的差异可能直接影响 MSC 的生产效率和生产成本。BM-MSC 作为目前应用范围最广的 MSC 种类,有必要在大规模生产之前对不同个体来源的 BM-MSC 进行细胞特性鉴定及细胞活力检测以评估成本经济。
目前公认的 MSC 的识别标准为表达阳性表面标志物(CD73、CD105、CD90 等),不表达或极少表达阴性表面标志物(CD34、CD45、CD14 等),并且具备至少 3 个细胞谱系(成骨、成脂和成软骨)的分化潜力[10]。本研究以国际细胞疗法协会(ISCT)设定的 MSC鉴定标准为指导[11],对BM-MSC 进行细胞标志物及三系分化能力的鉴定,结果显示 6 株不同个体来源的 BM-MSC 表达间充质干细胞阳性表面标志物 CD73、CD90、CD105 的比例均在 99% 以上,表达间充质干细胞阴性表面标志物 HLA-DR、CD14、CD19、CD34、CD45 的比例均低于 2%,且均具备成骨、成脂、成软骨的三系分化能力。这些结果表明本研究使用的 6 株不同个体来源 BM-MSC 均具备最基本的 MSC 细胞特性。定量结果分析发现不同个体来源 BM-MSC 的成骨分化及成脂分化效率有差异。将性别作为比较因素,发现不同性别来源 BM-MSC 的成骨分化能力差异不大,但不同个体间的差异较为明显;男性来源 BM-MSC 的成脂分化效率较女性有更高的趋势。由于研究纳入的样本较少,这一发现需扩大样本量继续验证。总之,通过对比发现不同个体 BM-MSC 的成脂及成骨分化效率有明显差异,其中成脂分化效率的差异可能与性别因素相关。
虽然不同个体来源的 BM-MSC 具备 MSC 群体之间的形态、表型及功能的相似性,但也有报道指出 MSC 不仅存在组织来源相关的特异性[12-15],其他因素如培养条件、供体个体及供体性别、年龄等也会对 MSC 特异性产生影响[16-17],因此在建立标准化程序的 BM-MSC 生产制备过程中必须注意这些影响因素。
氧气浓度是细胞培养条件中最重要的影响因素之一,氧气培养条件对细胞活力、增殖能力、分化能力、分泌功能等均具有重要影响[18-19]。有研究发现低氧条件(5% O2)可以促进 MSC 对 VEGF、IL-8 等因子的分泌功能[20]。Rahman 等[21]研究发现低氧(2% O2)条件下脂肪来源 MSC 无法诱导形成软骨,但在常氧条件下可以自发形成软骨。Lau 等[22]的研究发现缺氧条件会延长小鼠 BM-MSC 的扩增时间,但不会对其分泌能力产生影响。以上研究表明 MSC 的特性与功能会受到氧气培养条件的影响。由于 BM-MSC 原始生长环境处于低氧状态,因此有研究表明体外培养的低氧环境有利于保留 BM-MSC 的多种细胞特性,如多能性[23]、旁分泌活性[24]以及对 BM-MSC 在机体内发挥治疗作用至关重要的迁移能力[25]。虽然已有多项研究证明低氧环境对 BM-MSC 体外培养有利,但目前尚没有在不同低氧条件下探究不同个体来源 BM-MSC 细胞活力及迁移能力的相关研究。
本研究在 MSC 细胞特性鉴定的基础上,使用不同低氧条件对 6 株不同个体来源 BM-MSC 的迁移能力进行验证,并使用 CCK8 法探究不同氧气培养条件对不同个体来源BM-MSC 细胞活力的影响。研究结果显示在细胞快速生长期低氧条件下 BM-MSC 的细胞活力高于超低氧条件,低氧条件下 BM-MSC 迁移能力显著高于超低氧条件。此外,在不同氧气条件下,男性 BM-MSC 的细胞活力均具有高于女性 BM-MSC 的趋势,而女性 BM-MSC 迁移能力较男性更强。针对不同个体 BM-MSC 的细胞活力进行分析,发现不同个体来源 BM-MSC 在不同氧气条件下的细胞活力和迁移能力均有明显差异。这些结果表明 BM-MSC 的细胞活力、迁移能力不仅受氧气培养环境影响,还具备个体差异。
我们的研究结果提示需要关注不同个体来源 BM-MSC 的细胞特性,尤其是细胞生长动力学,在起始原材料筛选阶段评估细胞系的差异对大规模生产产生的影响。氧气条件及性别差异对 BM-MSC 的生物学特性及细胞功能的影响同样值得关注,结果的确证需要更大样本量和研究的数据支持。
[1] Brown C, McKee C, Bakshi S, et al. Mesenchymal stem cells: cell therapy and regeneration potential. J Tissue Eng Regen Med, 2019, 13(9):1738-1755.
[2] Samadi P, Saki S, Manoochehri H, et al. Therapeutic applications of mesenchymal stem cells: a comprehensive review. Curr Stem Cell Res Ther, 2021, 16(3):323-353.
[3] Rodríguez-fuentes DE, Fernández-garza LE, Samia-meza JA, et al. Mesenchymal stem cells current clinical applications: a systematic review. Arch Med Res, 2021, 52(1):93-101.
[4] Wei X, Yang X, Han ZP, et al. Mesenchymal stem cells: a new trend for cell therapy. Acta Pharmacol Sin, 2013, 34(6):747-754.
[5] Pittenger MF, Discher DE, Peault BM, et al. Mesenchymal stem cell perspective: cell biology to clinical progress. NPJ Regen Med, 2019, 4:22.
[6] Rosová I, Dao M, Capoccia B, et al. Hypoxic preconditioning results in increased motility and improved therapeutic potential of human mesenchymal stem cells. Stem Cells, 2008, 26(8):2173-2182.
[7] Vertelov G, Kharazi L, Muralidhar MG, et al. High targeted migration of human mesenchymal stem cells grown in hypoxia is associated with enhanced activation of RhoA. Stem Cell Res Ther, 2013, 4(1):5.
[8] Teixeira FG, Salgado AJ. Mesenchymal stem cells secretome: current trends and future challenges. Neural Regen Res, 2020, 5(1):75-77.
[9] Musiał-Wysocka A, Kot M, Majka M. The pros and cons of mesenchymal stem cell-based therapies. Cell Transplant, 2019, 28(7): 801-812.
[10] Ullah I, Subbarao RB, Rho GJ. Human mesenchymal stem cells-current trends and future prospective. Biosci Rep, 2015, 35(2): e00191.
[11] Lv FJ, Tuan RS, Cheung KM, et al. Concise review: the surface markers and identity of human mesenchymal stem cells. Stem Cells, 2014, 32(6):1408-1419.
[12] Chen JY, Mou XZ, Du XC, et al. Comparative analysis of biological characteristics of adult mesenchymal stem cells with different tissue origins. Asian Pac J Trop Med, 2015, 8(9):739-746.
[13] Guan YT, Xie Y, Li DS, et al. Comparison of biological characteristics of mesenchymal stem cells derived from the human umbilical cord and decidua parietalis. Mol Med Rep, 2019, 20(1):633-639.
[14] Sangeetha KN, Vennila R, Secunda R, et al. Functional variations between mesenchymal stem cells of different tissue origins: a comparative gene expression profiling. Biotechnol Lett, 2020, 42(7):1287-1304.
[15] Xu L, Liu Y, Sun Y, et al. Tissue source determines the differentiation potentials of mesenchymal stem cells: a comparative study of human mesenchymal stem cells from bone marrow and adipose tissue. Stem Cell Res Ther, 2017, 8(1):275.
[16] Costa LA, Eiro N, Fraile M, et al. Functional heterogeneity of mesenchymal stem cells from natural niches to culture conditions: implications for further clinical uses. Cell Mol Life Sci, 2021, 78(2): 447-467.
[17] Wilson A, Hodgson-Garms M, Frith JE, et al. Multiplicity of mesenchymal stromal cells: finding the right route to therapy. Front Immunol, 2019, 10:1112.
[18] Nit K, Tyszka-Czochara M, Bobis-Wozowicz S. Oxygen as a master regulator of human pluripotent stem cell function and metabolism.J Pers Med, 2021, 11(9):905.
[19] Lages YM, Nascimento JM, Lemos GA, et al. Low oxygen alters mitochondrial function and response to oxidative stress in human neural progenitor cells. PeerJ, 2015, 3:e1486.
[20] Paquet J, Deschepper M, Moya A, et al. Oxygen tension regulates human mesenchymal stem cell paracrine functions. Stem Cells Transl Med, 2015, 4(7):809-821.
[21] Rahman S, Szojka ARA, Liang Y, et al. Inability of low oxygen tension to induce chondrogenesis in human infrapatellar fat pad mesenchymal stem cells. Front Cell Dev Biol, 2021, 9:703038.
[22] Lau F, Dalisson B, Zhang YL, et al. Effects of oxygen and glucose on bone marrow mesenchymal stem cell culture. Adv Biosyst, 2020, 4(11):2000094.
[23] Berniakovich I, Giorgio M. Low oxygen tension maintains multipotency, whereas normoxia increases differentiation of mouse bone marrow stromal cells. Int J Mol Sci, 2013, 14(1):2119-2134.
[24] Kusuma GD, Carthew J, Lim R, et al. Effect of the microenvironment on mesenchymal stem cell paracrine signaling: opportunities to engineer the therapeutic effect. Stem Cells Dev, 2017, 26(9):617-631.
[25] Choi JH, Lee YB, Jung J, et al. Hypoxia inducible factor-1 alpha regulates the migration of bone marrow mesenchymal stem cells via integrin alpha(4). Stem Cells Int, 2016, 2016:7932185.
Effects of different donor sources and hypoxia conditions on the biological characteristics of human bone marrow-derived mesenchymal stem cells
SUN Xue-fei, LI Jing-yi, CHEN Yuan, JIANG Qian-qian, ZHANG Ling-ling, WANG Lin, LIU Yuan-bo
Author Affilications: Hematology, Beijing Tiantan Hospital, Beijing 100070, China (SUN Xue-fei, LIU Yuan-bo); Jiuzhitang Maker (Beijing) Cell Technology Co., LTD., Beijing 102600, China (LI Jing-yi, CHEN Yuan, JIANG Qian-qian, ZHANG Ling-ling, WANG Lin)
To investigate the differences in biological properties of human bone marrow-derived mesenchymal stem cells (BM-MSCs) from six different individual donors (male: M1, M2, M3; female: F1, F2, F3) under different low oxygen concentration.Flow cytometry anddifferentiation assays were performed to identify the biomarker expressions and tri-lineage differentiation abilities of MSCs. Transwell method was performed to assess cell migration ability. Cell viability under 5% and 1% oxygen were measured by CCK8 test.All six BM-MSC strains showed a high expression level (above 99%) for positive markers and a low expression level (below 2%) for negative markers, and had the ability to differentiate into three lineages. There are differences in the osteogenic and adipogenic differentiation efficiencies as well as cell viability of BM-MSC derived from different donors. And the differences in adipogenic differentiation may be associated with gender. Both cell viability and migration ability of BM-MSC showed variations between different oxygen conditions, with 5% oxygen conditions showing significantly better outcomes than 1% oxygen conditions, When both oxygen and gender factors were considered, it was found that BM-MSC derived from male donors showed a greater tendency for higher viability under various hypoxic conditions, whereas BM-MSC derived from female donors exhibited relatively stronger migration ability.The study suggests that specific standards should be established for the individual donor and the expansion conditions based on the desired characteristics for BM-MSC applications.
human bone marrow-derived mesenchymal stem cells; hypoxia; gender; cell viability
LIU Yuan-bo, Email: yuanbol@ccmu.edu.cn
10.3969/j.issn.1673-713X.2023.05.002
刘元波,Email:yuanbol@ccmu.edu.cn
2023-04-07
