一步煅烧法制备碳/银共修饰LiFePO4 正极材料
2023-10-12陈朝尧肖清艳张邓洲张露露杨学林
陈朝尧 裴 丰 肖清艳 张邓洲 张露露 邓 华 杨学林
(1.三峡大学 电气与新能源学院, 湖北 宜昌 443002;2.湖北宜化化工科技研发有限公司, 湖北 宜昌443007;3.湖北三峡实验室, 湖北 宜昌 443007)
随着能源消费方式的转变和能源革命的加速,发展清洁有效的能源存储、转化和利用技术已成为当前的研究热点[1-2].锂离子电池(LIBs)因具有能量密度高和循环寿命长等优点,已被广泛应用于便携式和固定式能量存储系统.正极材料作为锂离子电池的关键组成部分,直接影响着锂离子电池的性能[3].自1997年John B.Goodenough 等首次将磷酸铁锂(LiFe-PO4)用作锂离子电池正极材料以来,众多研究者通过深入研究发现[4-6]:与层状钴酸锂(LiCo O2)和镍钴锰三元材料(NCM)相比,LiFePO4具有较高的理论比容量(170 m Ah·g-1)、稳定的工作电压(3.4 V vs.Li+/Li)、优异的安全性、较低的成本和环境友好性,更适合应用于大型储能电站和电动汽车领域.然而,LiFePO4的导电性差(10-9~10-7S·cm-1)[7-9].为此,研究者们通过碳包覆、离子掺杂和纳米化等方法来提高LiFePO4的导电性和锂离子扩散系数.其中,碳包覆不仅可以提高LiFePO4材料的导电性,使LiFePO4免受电解液侵蚀,也可抑制LiFePO4颗粒的过度生长和团聚,同时还可作为还原剂来防止LiFePO4材料中Fe2+的氧化.因此,碳包覆已成为改善LiFePO4倍率性能和循环寿命的最有效方法之一,在工业上得到了广泛应用[10-12].
Armand等[13-14]最早提出,在合成过程中加入导电物质后可以提高材料的离子/电子导电性,改善电化学反应动力学,从而提高LiFePO4材料倍率性能.银是导电性最好的金属,在材料里引入适量的银能快速改善电极材料的电化学性能.Park等[15]用抗坏血酸直接还原硝酸银溶液制备了银包覆的LiFePO4复合材料,该材料在C/5 时的首次放电容量高达139 m Ah·g-1,而未包覆银的材料仅为121 m Ah·g-1.Mi等[16]通过共沉淀法和溶胶-凝胶法制备了具有新型纳米碳网的LiFePO4/(Ag+C)复合材料,Ag和C共修饰降低了材料的电荷转移电阻,提高了表面电导率,电化学性能得到明显提升:该材料在0.5 C 下的首次放电容量高达162.1 m Ah·g-1,高于LiFePO4的容量(153.4 m Ah·g-1).Goktepe等[17]通过水热法制备了银和碳双涂层包覆磷酸铁锂复合材料(LFP@C@Ag),该材料在0.1 C 下的首次放电容量高达152 m Ah·g-1,明显高于纯相LFP 的放电比容量(122 m Ah·g-1).张露露团队[18]曾分别采用真空热分解和化学镀工艺制备了Ag改性的LiFePO4材料,发现与纯LiFePO4电极相比,Ag改性LiFePO4材料的比容量都有所增加,但首次不可逆容量有所降低;与化学镀工艺相比,真空热分解得到的Ag颗粒粒径较小且分布较均匀,所以由该方法制备所得材料的循环性能和倍率性能较优.上述研究表明,将Ag应用于LiFePO4材料的改性是有效的.然而,上述报道的Ag改性LiFePO4的制备工艺并不适用于大规模生产.如溶胶-凝胶法所需的原料价格比较昂贵,反应周期长,且在干燥过程中会逸出大量小分子气体;水热法需要耐高温、高压的设备,使得机械化生产难度大;真空烧结需要高温和真空环境,成本相对较高,且操作和维护难度较大,并存在一定的安全风险.
本文通过简单的一步煅烧工艺制备了碳/银共修饰LiFePO4复合材料(Ag-LiFePO4@C),与已有报道的Ag改性LiFePO4工艺相比,此方法具有操作简单、设备要求低、生产周期短及安全风险低等优势,更适合规模化生产.高温下葡萄糖热解在LiFePO4颗粒表面原位形成一层非晶碳层,同时硝酸银分解成的单质银也均匀地分散在LiFePO4颗粒表面,在两者共同作用下,材料的导电性得到显著增强,使LiFe-PO4表现出优异的容量水平和循环稳定性.该材料在0.1 C下的首次放电比容量高达161.7 m Ah·g-1,并且在1 C电流密度下循环200圈,每圈的容量衰减率仅为0.06%,可见Ag-LiFePO4@C 是一种极具应用前景的高倍率锂离子电池正极材料.
1 实验部分
1.1 样品制备
LiFePO4材料制备采用传统固相法工艺.首先将LiOH·H2O、FeC2O4·2 H2O 和NH4H2PO4按化学计量比混合,再加入质量分数为3%的葡萄糖(碳源)和2%的Ag NO3(银源),在乙醇介质中球磨6 h,以保证混合均匀.将上述混合物在80℃下干燥12 h后,在N2氛围下,以4℃·min-1的升温速率,在350℃中预烧结6 h,然后继续以4℃·min-1的升温速率升温到650℃,烧结20 h后,自然冷却至室温,即可得到Ag-LiFePO4@C复合材料.为了对比,采用相同工艺,不添加Ag NO3,制备了LiFePO4@C复合材料.
1.2 电极片的制作与电池组装
将正极材料(LiFePO4@C和Ag-LiFePO4@C)、导电剂(Super P)和黏结剂(聚偏氟乙烯,PVDF)按8∶1∶1的质量比研磨均匀后,加入一定量的N-甲基吡咯烷酮(NMP)调成黏稠度合适的浆料,利用自动涂膜仪(AFA-II,合肥科晶)将混合浆料均匀涂覆在铝箔上.干燥后,用切片机切成直径为14 mm 的圆片,经6 MPa的压力压片后,置于120℃真空烘箱中干燥12 h,制成正极片.然后,将正极片转移到充满氩气的手套箱(MIKROUNA,Super 1220/750, 质量分数w(H2O)<10-4‰,w(O2)<10-4‰)中备用.将上述制备的正极片与金属锂负极匹配组装CR2025扣式电池,并采用Celgard 2400 聚丙烯微孔膜为隔膜,1 mol·L-1LiPF6/EC:DMC (LB-301, 中国)为电解液,电池组装好后静置6~8 h,再进行电化学性能测试.
1.3 电化学性能测试
在25℃的恒温间中,采用蓝电测试系统(LAND CT2001A, 武汉金诺)对组装好的电池进行恒电流充放电测试,电压范围为2.5~4.2 V.循环伏安(CV)和交流阻抗(EIS)测试在电化学工作站(CHI614C,上海辰华)上进行.其中,CV 测试的电压范围为2.5~4.2 V,扫描速度为0.1 m V·s-1;EIS测试的频率范围为0.01 Hz~100 k Hz.
1.4 材料表征方法
采用以Cu靶Kα线为辐射源的Ultima IV X 射线衍射仪(XRD,日本理学)分析样品的物相组成,测试管电压为40 k V,管电流为40 m A,2θ扫描范围为10°~80°;采用日本Ulvac-Phi公司的PHI QuanteraⅡ型和日本岛津的AXIS Supr型X 射线光电子能谱分析样品的元素组成及原子价态;采用JSM-6360LV扫描电镜(SEM,日本电子)和JEM-F200高分辨透射电镜(TEM,日本电子)观察样品的形貌和微观结构;采用CS744型碳硫分析仪(美国力可)测定材料中的碳含量;采用Avio200电感耦合等离子体发射光谱仪(ICP-OES,美国PE)测试样品中的Ag 含量.采用FT-300I型粉末电导率测试仪(成都精新分体测试设备优先公司)测试样品的电导率.
2 结果与讨论
2.1 物相及形貌表征
图1为LiFePO4@C和Ag-LiFePO4@C两个材料的XRD 图谱.由图可以看出,两个样品的所有衍射峰都能与正交LiFePO4相(JCPDS,No.83-2092)的衍射峰一一对应,两个样品均为典型的橄榄石结构(如图2所示),其空间群为Pmnb.在两个样品XRD图谱中没有检测到Fe2O3和Li3Fe2(PO4)3等杂质峰,说明两个样品的纯度较高.在两个样品的XRD 图谱中没有观察到碳的衍射峰,是由于葡萄糖热解所得的碳是无定形的且样品中的碳含量过低导致的.通过碳硫分析可知,LiFePO4@C 样品中碳的质量分数为1.26%,Ag-LiFePO4@C中碳的质量分数为1.11%.此外,在Ag-LiFePO4@C 复合材料中也没有检测到银的相关衍射峰,这是因为样品中的Ag 含量较低(ICP-OES测试其质量分数仅为0.35%).
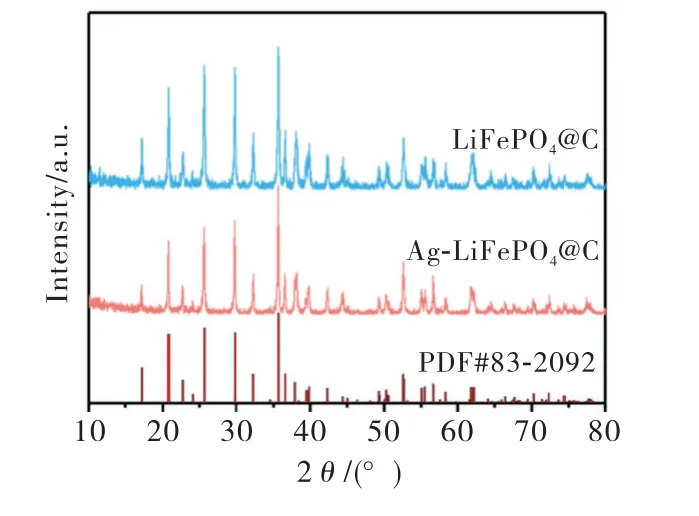
图1 LiFePO4@C和Ag-LiFePO4@C样品的XRD 图
图2 LiFePO 4 的晶体结构图
为了进一步探究LiFePO4@C和Ag-LiFePO4@C的元素组成及价态,对其进行了XPS测试.图3为LiFePO4@C 和Ag-LiFePO4@C 样品的XPS 全谱图,可以清晰地观察到两个样品中均存在Li 1s、Fe 2p、P 2p、O 1s和C 1s光电子峰,而Ag-LiFePO4@C样品还存在Ag 3d光电子峰,这应该来源于硝酸银热分解产生的单质Ag.

图3 Ag-LiFePO4@C和LiFePO4@C样品的XPS全谱
图4是样品各元素的高分辨率XPS图谱及其拟合结果.在图4(a)中分别位于284.9、285.7和288.8 e V 处 的3 个 特 征 峰 属 于C—C、C—O 和C=O键[19-20],证 明 了Ag-LiFePO4@C 和LiFePO4@C 两个样品中碳的存在.此外,图4(b)中在133.7 e V 处的一个较宽的特征峰,对应于P—O 键[21].Fe元素的高分辨图谱如图4(c)所示,其中位于710.4和723.9e V处的两个特征峰分别对应于Fe 2p3/2和Fe 2p1/2,其它两个位置的峰属于卫星峰,这证明两个样品中的Fe均为+2价[22],Ag和C 的引入并没有改变LiFe-PO4中Fe的价态.图4(d)中Ag-LiFePO4@C 样品在368.4和374.4 e V 处的两个尖锐特征峰分别对应于单质Ag的3d5/2和3d3/2,这证明了银是以单质的形态存在于Ag-LiFePO4@C样品中的[23-25].

图4 样品各元素的高分辨率XPS图谱
图5 和 图6 分 别 是Ag-LiFePO4@C 样 品 的SEM 和TEM 照片.

图5 Ag-LiFePO4@C样品的SEM 照片和能谱图
由图5(a)和6(a)可以看出Ag-LiFePO4@C 呈现出不规则的颗粒形貌,粒径约50~200 nm.由图5(b)的背散射电子像可知,白色亮点为原子序数大的单质银.由于硝酸银的分解温度较低(440℃),在700℃高温下会发生分解,其反应方程式为:2Ag NO3=2Ag+2NO2↑+O2↑.其中,NO2和O2逸出,单质银颗粒则均匀分散在LiFePO4颗粒的表面.与真空热解得到的银颗粒[17]相比,在惰性气氛中热解得到的银粒径较小,且分布更均匀.通过图6(b)可以观察到在LiFePO4颗粒表面包裹着一层完整且均匀的无定形碳层,厚度约4~5 nm.这种均匀的碳包覆层不仅可以保护LiFePO4免受电解液侵蚀,还可提高LiFePO4的导电性.通过测试两个材料的粉末电导率可知,Ag-LiFePO4@C 样品的电导率为1.13×10-6S·mm-1,而LiFePO4@C 的电导率仅为2.30×10-7S·mm-1,显然,银引入后将材料的电导率提升了一个数量级.图6(b)为Ag-LiFePO4@C 样品的晶格条纹像,图中清晰的晶格条纹说明该材料具有良好的结晶性;间距为0.301 nm 的晶格条纹对应于LiFe-PO4的(210)晶面;电子衍射花样(图6(c))进一步证实了Ag-LiFePO4@C 样品良好的结晶性.从元素EDS mapping图(图6(d))中可以看出银和碳元素的存在,且分布非常均匀.
2.2 电化学性能分析
为了研究碳和银共修饰对LiFePO4电化学性能的影响,对LiFePO4@C 和Ag-LiFePO4@C 进行了循环伏安和恒流充放电测试,研究结果如图7所示.

图7 LiFePO4@C和Ag-LiFePO4@C的电化学性能图
图7(a)是0.1 m V·s-1扫描速率下的CV 曲线.很明显,两个样品在3.50 V/3.33 V 附近有一对氧化还原峰,对应于LiFePO4中的Fe2+/Fe3+之间的氧化还原反应,涉及LiFePO4与FePO4之间的相转变.Ag-LiFePO4@C样品的两个氧化还原峰之间的峰位差为186 m V,明显低于LiFePO4@C 样品(216 m V)[26],这表明银的引入可减小电极极化,提高电极反应可逆性.此外,Ag-LiFePO4@C 的氧化还原峰峰值电流更高,这表明Ag-LiFePO4@C 样品具有更优的反应动力学.图7(b)、(c)是LiFePO4@C 和Ag-LiFePO4@C在2.5~4.2 V(vs.Li+/Li)的电压范围内0.1 C下的首次充放电曲线和循环性能曲线.由图7(b)可 以 看 出,LiFePO4@C 和Ag-LiFePO4@C 在3.45 V/3.40 V 附近有一对充放电平台,与CV 曲线中的氧化还原峰位置吻合,也对应于Fe2+/Fe3+之间的氧化还原反应.嵌图为充放电平台处的放大图,从嵌图中可以看出,Ag-LiFePO4@C 的充放电平台的电位差为44 m V,低于LiFePO4@C(50 m V),这进一步表明Ag-LiFePO4@C电极具有更好的电化学反应可逆性,也与CV 曲线结果一致.此外,由图7(b)还可看出,Ag-LiFePO4@C 在0.1 C(1 C=170 m Ah·g-1)下的放电比容量为161.7 m Ah·g-1,而LiFe-PO4@C 的放电比容量为140.4 m Ah·g-1.随着循环的进行,两个样品的放电比容量均有所增加,这与电解液逐渐渗透到电极中有关,经过几次循环后,放电容量趋于稳定.特别是,Ag-LiFePO4@C 在50 次循环过程中几乎没有观察到容量衰减,其容量和循环性能都显著优于LiFePO4@C(图7(c)).图7(d)是两个样品的倍率性能对比.在0.1、0.2、0.5、1.0、2.0、5.0 C下,Ag-LiFePO4@C样品的放电比容量分别为162.6、159.9、155.3、147.7、140.2 和124.2 m Ah·g-1;而LiFePO4@C 的分别为142.3、131.7、125.2、113.7、97.7和74.2 m Ah·g-1.当倍率从5.0 C回到0.1 C时,Ag-LiFePO4@C的放电容量恢复到160.0 m Ah·g-1,而LiFePO4@C仅为137.39 m Ah·g-1.可见,Ag-LiFePO4@C 样品具有更优的倍率性能和大电流耐受性.此外,还对比了两个样品在1 C 电流密度下的循环性能(图7(e)).可以看出,与LiFePO4@C 样品相比,Ag-LiFePO4@C在1 C下可释放出高达155.7 m Ah·g-1的首次比容量,循环200圈后仍能保持136.3 m Ah·g-1的容量,每圈容量衰减率仅0.06%;而LiFePO4@C的首次放电比容量仅为124.9 m Ah·g-1,循环200圈后的容量衰减为95.5 m Ah·g-1,每圈容量衰减率为0.12%.显然,由于完整且均匀包覆在LiFePO4颗粒表面的碳层有效避免了LiFePO4与电解液的直接接触,使其循环稳定性得到了明显提升;而且,碳包覆层和均匀分散在LiFePO4颗粒表面的银颗粒共同构成了一个良好的导电网络,使LiFePO4的导电性相比于单一碳包覆LiFePO4的导电性有了进一步提升,因此材料的倍率性能也得到了大幅度提高.
为了进一步探究碳和银共修饰对LiFePO4电极动力学行为的影响,对LiFePO4@C 和Ag-LiFePO4@C电极进行了交流阻抗谱(EIS)和不同扫描速率下的CV 测试,如图8所示.

图8 LiFePO4@C和Ag-LiFePO4@C电极交流阻抗谱(EIS)和不同扫描速率下的CV 测试结果
图8(a)是LiFePO4@C 和Ag-LiFePO4@C 的EIS图谱.通过R(Q(RW))等效电路图(图8(a)嵌图)拟合发现,Ag-LiFePO4@C 电极的内阻和电荷转移电阻(分别为5.3Ω 和83.9Ω)都明显低于LiFe-PO4@C(分别为25.1Ω 和185.1Ω),这也反映出Ag引入后样品具有更好的离子迁移环境.根据图8(b)得到的拟合斜率可以计算出材料的锂离子扩散系数[27],结果见表1.Ag-LiFePO4@C 样品的锂离子扩散系数(1.69×10-10cm2·s-1)大于LiFePO4@C(8.61×10-11cm2·s-1).图8(c)、(d)是LiFePO4@C和Ag-LiFePO4@C 电极在不同扫描速率(0.1、0.2、0.4、0.6、0.8和1.0 m V·s-1)下的CV 曲线.根据Randles-Sevcik公式[19,28],由图8(e)、(f)拟合得到的斜率分别计算了两个样品对应于氧化峰和还原峰的锂离子扩散系数,见表1.显然,不管是锂的脱出(氧化)还是嵌入(还原)过程,Ag-LiFePO4@C 的锂离子扩散系数均大于LiFePO4@C,说明碳和银共修饰使离子传输环境得到了改善.因此,锂离子在Ag-LiFe-PO4@C结构中具有更优的扩散动力学性能,从而表现出更优的电化学性能.

表1 LiFePO4@C和Ag-LiFePO4@C的锂离子扩散系数对比
3 结 论
采用一步煅烧工艺成功合成了橄榄石型LiFe-PO4@C 和Ag-LiFePO4@C 复合材料.在高温条件下,热解葡萄糖和硝酸银在LiFePO4颗粒表面原位生成了均匀的碳包覆层和银颗粒,显著提高了LiFe-PO4的导电性和离子扩散速率,从而使LiFePO4具有更高的比容量和更优的循环性能.在0.1 C的电流密度下,Ag-LiFePO4@C 电极的首次放电比容量高达161.7 m Ah·g-1,而LiFePO4@C 仅有140.4 m Ah·g-1;在1 C 下,Ag-LiFePO4@C 能释放出高达155.7 m Ah·g-1的首次比容量,循环200圈后仍能保持136.3 m Ah·g-1的比容量,而LiFePO4@C仅为95.5 m Ah·g-1.Ag-LiFePO4@C 复合材料电化学性能的提升归因于其表面均匀的碳包覆层和银颗粒对材料导电性和离子迁移环境的改善.可见,通过一步煅烧工艺可制备出极具应用前景的Ag-LiFe-PO4@C锂离子电池正极材料.
