表面活性剂胶束溶胀构筑大孔β-环糊精微球及其芦丁吸附性能
2023-10-12乔亮智周禄英杜开峰
乔亮智,周禄英,杜开峰*
(1.四川大学 化学工程学院,四川 成都 610065;2.四川聚豪锦悦农林科技有限公司,四川 达州 635000)
黄酮类化合物是植物生长过程中一种重要的次生代谢产物,其大多具有2-苯基色原酮的基本骨架[1]。现代医学研究证明,黄酮类化合物具有抗氧化[2]、抗肿瘤[3]、抗菌抗病毒[4]、抗血栓[5]等多种功效。为了满足生产和研究的需要,高效的黄酮提取分离技术成为产学界研究的重点和热点。黄酮类化合物的一般提取分离流程分为两个阶段,即上游粗提取过程和下游精制纯化过程。常用粗提取过程技术主要是在外场,如微波、超声波等强化下的水提取、有机溶剂提取以及超临界流体萃取法[6-9];精制纯化方法主要有沉淀法[10]、超滤法[11]、色谱法[12]等。随着对黄酮类化合物需求的不断增加,黄酮类化合物上游粗提取过程技术飞速发展,生产规模显著增加,百公斤以上的提取工艺已被普遍采用,提取时间缩短至分钟级,提取率普遍超过100 mg·g-1[1,13-14]。然而,与上游高产率不匹配的是,下游精制纯化过程相对滞后。主要原因在于上游大体积溶剂的使用以及高浓度黄酮提取液限制了下游纯化效率。因此,开发高效的下游精制纯化技术成为缓解上下游提取过程矛盾、提高黄酮类化合物生产效率的重要研究课题。
色谱法分离选择性高,分离条件温和,操作简单且易于连续生产,已成为大规模精制纯化黄酮类化合物重要的一个分离纯化手段[12,15-16]。色谱介质的物理化学性质直接影响分离纯化效率,理想的色谱介质具有高容量、高流速的特点。为了提高黄酮类化合物色谱的纯化性能,实现高效化生产,研究者们开发了多孔树脂[17-18]、有机聚合物[19]、氧化石墨烯[20]、无机纳米颗粒[21]等多种色谱介质。其中,以环糊精为代表的一类环状超分子化合物因其独特的“内疏水,外亲水”空腔结构得到了产学界的广泛关注[22-24]。环糊精分子中与C2、C3和 C6相连的—OH都位于外侧,构成亲水表面,每个葡萄糖残基中的糖苷氧原子和氢原子构成了疏水的内腔。基于这种独特的结构,环糊精分子可以根据尺寸、形状、极性等性质的差异对黄酮类化合物选择性结合,实现特异性分离。Zhang等[22]发现黄酮类化合物在β-环糊精(β-CD)吸附纯化后,纯度由粗提液的50.00%提高至94.38%,总黄酮浓度达到505.7 mg/g。Feng等[23]比较了β-CD、γ-CD及其衍生物对黄酮类化合物的吸附能力,结果显示磺酰醚化β-CD具有最高的黄酮吸附容量。然而,这种直接使用环糊精粉末吸附的方法使得脱附和回收过程复杂,粉末状的β-CD易导致材料在吸附过程中损失;同时,较小的尺寸也会导致色谱柱背压较大,洗脱液流动缓慢,吸附的黄酮分子难以洗脱,不能重复利用。为了方便回收和上柱,Zhao等[24]采用油水乳化法制备了β-CD微球/碳化钨复合微球,并考察其吸附热力学和动力学性质。然而,由于黄酮类化合物分子量普遍较大,提取液黏度较高,导致黄酮在微球孔内扩散阻力大,吸附速率缓慢,吸附仅仅可以发生在微球表面的环糊精分子空腔内,微球内部的环糊精空腔并未充分利用,吸附容量低。
针对以上问题,本文提出一种基于乳化法的表面活性剂胶束溶胀策略构建大孔β-CD微球,用于黄酮类化合物高效分离纯化。一方面,β-CD微球形貌相比于粉末形貌,易于脱附和实现重复利用,而且规整均一的形貌有利于在色谱分离过程中形成平推流,有益于分离纯度的提高;另一方面,大孔的构建不仅可以降低黄酮类化合物在微球内的扩散阻力,提高吸附速率,也可以提高微球内部环糊精空腔的利用率,提高吸附容量,从而实现黄酮类化合物的高效分离。本文以芦丁为模型黄酮化合物,考察大孔结构的形成以及其对β-CD微球渗透性、吸附热力学、吸附动力学性能的影响,揭示孔尺寸对芦丁分离纯化效果的影响规律,为黄酮类化合物高效分离介质的开发和应用提供参考。
1 材料与方法
1.1 材料
β-CD(99%)和芦丁(生物级,95%)购自上海源叶生物科技有限公司;26号白矿油(化妆品级)购自摩杰佐石油化工(上海)有限公司;异辛烷(分析级)、乙醇(95%)、叔丁醇(分析级)、司班85(分析级)、吐温60(分析级)、二甲亚砜(分析级)和环氧氯丙烷(分析级)购自成都市科隆化学品有限公司。
1.2 β-CD微球的制备
基于Nussstein[25]报道的油水乳化法,通过引入表面活性剂胶束,制备LCDM。在80 ℃下,将10 g β-CD溶于20 g质量浓度为25 %的氢氧化钠溶液中,并将8 mL环氧氯丙烷逐滴加入此溶液中,反应60 min,得到金黄色透明的β-CD寡聚物溶液;将温度降低至55 ℃,加入一定量的表面活性剂司班85,混合30 min,形成β-CD/司班85表面活性剂胶束混合液;取10 mL β-CD/司班85混合液加入到由80 mL 26号白矿油和20 mL异辛烷组成的油相中,加入2.5 mL 吐温60,在55 ℃下乳化3 h。随后,静置离心,采用体积浓度为50%乙醇溶液清洗获得大孔β-CD微球,命名为LCDMx,x(mL)代表表面活性剂司班85使用量。实验制备了4种LCDM,分别为LCDM3.0、LCDM6.0、LCDM9.0、LCDM12.0。为了对比,制备小孔β-CD微球,命名为SCDM,制备过程中除未使用司班85,其余步骤与制备LCDM相同。
1.3 吸附实验
采用批次摇瓶法测量微球吸附热力学性质。将0.05 g抽滤后的β-CD微球加入到20 mL不同浓度(0.005~0.050 mg/mL)的芦丁溶液中。将此溶液置于恒温摇床中,在25 ℃和170 r/min的转速下吸附3 h,采用Alpha-1860紫外分光光度计在355 nm处测量吸附后的芦丁浓度。采用Langmuir吸附平衡模型拟合,表达式如下:
式中:q为平衡浓度下的吸附剂芦丁吸附量,mg·mL-1;qm为吸附剂芦丁吸附容量,mg·mL-1;Kd为吸附平衡解离常数;c为平衡芦丁浓度,mg·mL-1。
采用作者团队自建的在线测量装置考察吸附动力学[26]。将0.2 g抽滤后的β-CD微球加入到200 mL 0.05 mg·mL-1的芦丁溶液中;然后在25 ℃和170 r/min转速下搅拌。采用汉邦NU-300 UV/VIS紫外检测器在355 nm处实时监测溶液中芦丁的浓度变化。
1.4 材料表征
所有测试β-CD微球依次被乙醇和叔丁醇以20%体积浓度梯度置换;用叔丁醇完全置换微球后,将其用液氮冷冻,而后置于冻干机(FD-1A-50,博医康Biocool)中干燥。采用扫描电子显微镜(JSM 7610F,JEOL)观察微球的微观形貌;将样品表面喷金,在5 kV的加速电压下观察样品微观形貌。采用全自动比压汞仪(9 500 AutoРoreⅣ,Micromeritic)测试样品的孔隙率和比表面积,在 0.1~61 000 Рa压力下,汞的表面张力取0.485 N·m-1,汞与样品接触角为130°;连续性进汞模式操作,通过改变注入压力,得到压力与注汞体积的关系曲线,应用Washburn 方程,得到压力与孔径特征的关系曲线[27]。采用AKTA Explorer 100 system(Amersham Biosciences)测试样品的渗透性,将样品装入HR 5/10柱中,通过改变移动相流速,记录不同流速下的样品柱背压。采用Nano Measurer 1.2 software光学显微镜测量样品的微球粒径,获得样品平均粒径和粒径分布。采用附温比重瓶法测量样品的湿密度[26]。
1.5 数据重复性
吸附实验重复3次,取平均值,平均值误差低于10%。
2 结果与讨论
2.1 大孔 β-CD微球的制备
溶液中,表面活性剂的浓度超过临界胶束浓度时,表面活性剂将聚集成为表面活性剂胶束[28]。在胶束中,表面活性剂疏水端朝内,亲水端朝外。利用这种性质,提出基于乳化法的表面活性剂胶束溶胀策略制备LCDM,如图1所示。图1中:向β-CD溶液加入超过临界胶束浓度的表面活性剂,形成β-CD/表面活性剂胶束混合液,并进一步乳化;在乳化过程中,由于表面活性剂胶束内部的疏水作用,外部油相被吸入β-CD液滴内部,形成油相通道;随着β-CD被固化交联,油相通道转变为大孔结构;大孔结构的构建不仅提供了宽阔的传质通道,加快了吸附速率,同时也缩短了吸附质与微球内部环糊精空腔的距离,提高了吸附位点利用率和吸附容量。
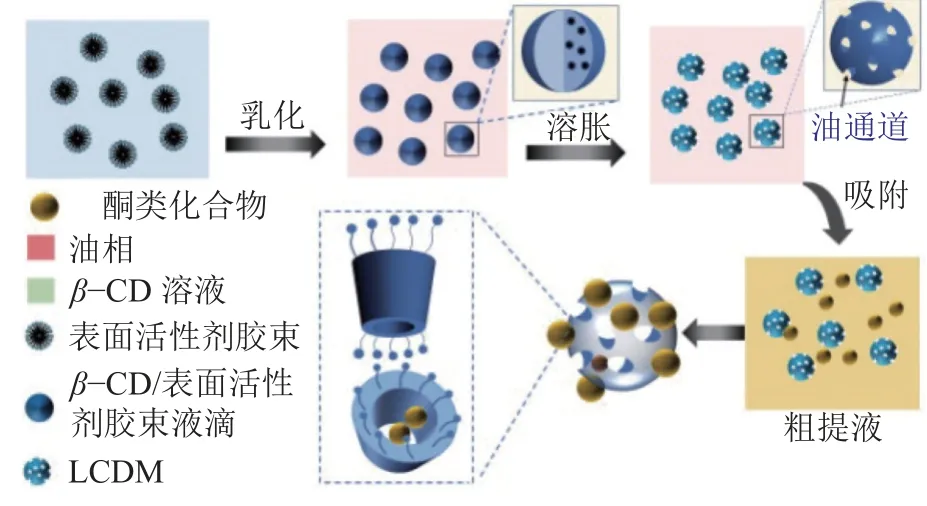
图1 LCDM制备示意图Fig.1 Schematic preparation diagram of LCDM
2.2 β-CD微球物理性质
采用光学显微镜和扫描电子显微镜观察LCDM6.0与SCDM的形貌结构,如图2所示。由图2可见:两种微球具有明显不同的光学性质,相比于SCDM,LCDM6.0表现出明显的光散射现象,说明LCDM6.0具有与SCDM不同的孔结构;SEM图显示LCDM6.0具有明显的大孔结构,孔径达到1~2 µm,SCDM则表现出相对光滑平整的无孔表面。这种结构差异印证了两者不同的光学现象,大孔造成光在孔道中多次折射形成散射,导致LCDM呈现光散射现象。

图2 LCDM6.0与SCDM的光学显微镜图和SEM图Fig.2 Optical micrographs and SEM images of LCDM6.0 and SCDM
比较不同表面活性剂用量下的β-CD微球在平均孔径、孔隙率、比表面积、平均粒径4个方面的差异,结果见表1。由表1可知:随着表面活性剂胶束浓度的增大,β-CD微球的平均孔径从SCDM的7.34 nm增加至孔LCDM12.0的178.01 nm,孔隙率从40.12%增加至82.95%,证明了大孔结构的形成是由表面活性剂胶束的引入造成的;增加司班85的使用量,则无法形成微球。β-CD微球的比表面积随表面活性剂胶束浓度增加呈现下降趋势,孔隙率则显示出增长趋势。这主要是由于比表面积主要由微介孔决定,而大孔结构的形成消耗了大量微介孔,导致比表面积随孔径增大而下降[29]。5种β-CD微球的粒径范围都在(105±4)µm范围内,没有明显差异。同时,这5种β-CD微球的湿密度保持在(1.03±0.02)mg·mL-1,证明大孔结构的引入不会影响微球粒径和湿密度。

表1 5种 β-CD微球的物理性质Tab.1 Physical properties of the five β-CD microspheres
2.3 孔径对 β-CD微球渗透性的影响
5种β-CD微球所形成的固定床在不同流速下的背压变化如图3所示。由图3可知,在相同流速下,相较SCDM,LCDM3.0、LCDM6.0和LCDM9.0表现出明显更低的背压,且随着孔径的增大,背压进一步降低。采用Darcy模型计算介质的渗透系数K(m2),表达式如式(2)所示[30]:

图3 背压-流速曲线和K值Fig.3 Back pressures as a function of flow velocity and K values
式中:µ为移动相黏度,Рa·s;u为移动相空塔流速,m·s-1;L为固定床长度,m;ΔP为固定床压降,Рa。SCDM、LCDM3.0、LCDM6.0和LCDM9.0的K值分别为0.92×10-11、1.15×10-11、1.33×10-11、1.57×10-11m2,其中,LCDM9.0的K值相比SCDM增加了70.65%。这是由于大孔提供了宽阔的传质通道,降低了移动相在孔内的传质阻力,提高了微球的渗透性[31]。随着孔径的进一步增大,LCDM12.0背压曲线表现出不同于其他3种LCDM随流速线性增长的趋势,在流速超过2 mL·min-1时,LCDM12.0背压随流速呈指数式增长。这种剧烈增加的背压是由于过多大孔结构的形成损害了LCDM12.0的机械强度,导致LCDM12.0在流速状态下结构塌陷,孔道堵塞,背压急剧上升。因此,在实际应用中,应选择合适孔结构的β-CD微球作为纯化介质,既具有高的渗透性,保证分离纯化效率,同时也具有一定耐压强度,避免因微球结构塌陷而导致的分离纯化性能下降。
2.4 吸附热力学
以芦丁作为黄酮类化合物的模型代表,考察β-CD微球对于芦丁的吸附性能,采用Langmuir模型拟合吸附曲线。考虑到所有吸附热力学曲线并没有达到平衡,通过Langmuir模型拟合获得的吸附容量qm不能代表介质对芦丁的真实吸附容量[32]。因此,采用芦丁平衡浓度为0.03 mg/mL处的吸附密度来表示介质对芦丁的吸附能力。5种β-CD微球Langmuir拟合曲线和参数分别如图4(a)及表2所示。将表2中平衡参数代入Langmuir方程,计算获得微球在0.03 mg/mL平衡浓度下的吸附密度如图4(b)所示。由图4(b)可见,相比于小孔SCDM,大孔LCDM3.0和LCDM6.0对芦丁有更高的吸附密度,其中,LCDM6.0的芦丁吸附密度达到29.62 mg·mL-1,是SCDM吸附密度(8.66 mg·mL-1)的3.42倍。这是由于大孔结构缩短了芦丁到吸附位点的传质距离,提高了微/介孔吸附位点的利用率,因此具有较高的吸附容量。随着孔径的进一步增大,芦丁吸附量呈现出下降趋势,其中,LSCM12.0的芦丁吸附量仅有5.31 mg·mL-1,甚至低于SCDM。造成此现象的原因在于过多大孔结构的构建消耗了大量微介孔,导致了吸附位点损失,因此表现出较低的吸附容量。
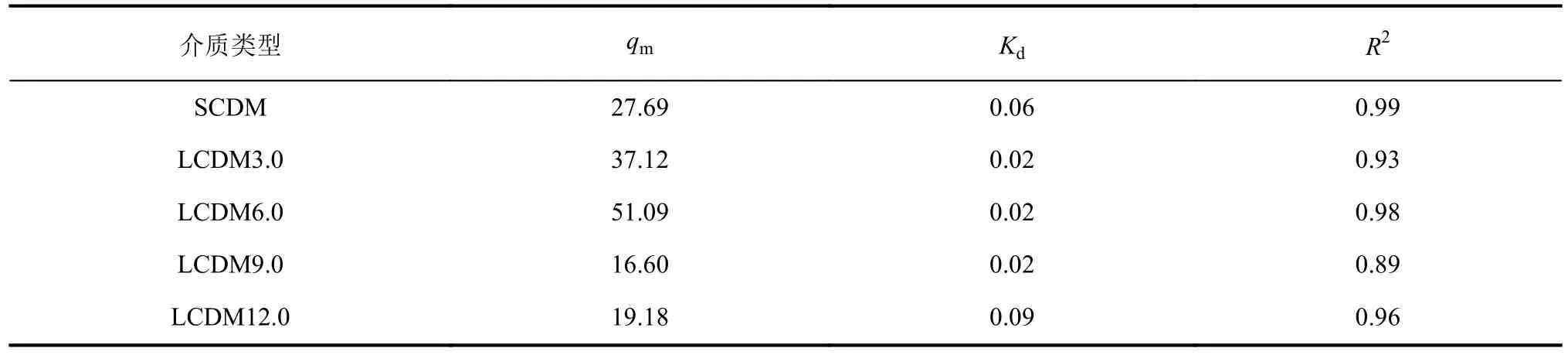
表2 芦丁吸附的Langmuir方程拟合参数Tab.2 Langmuir parameters of rutin adsorption
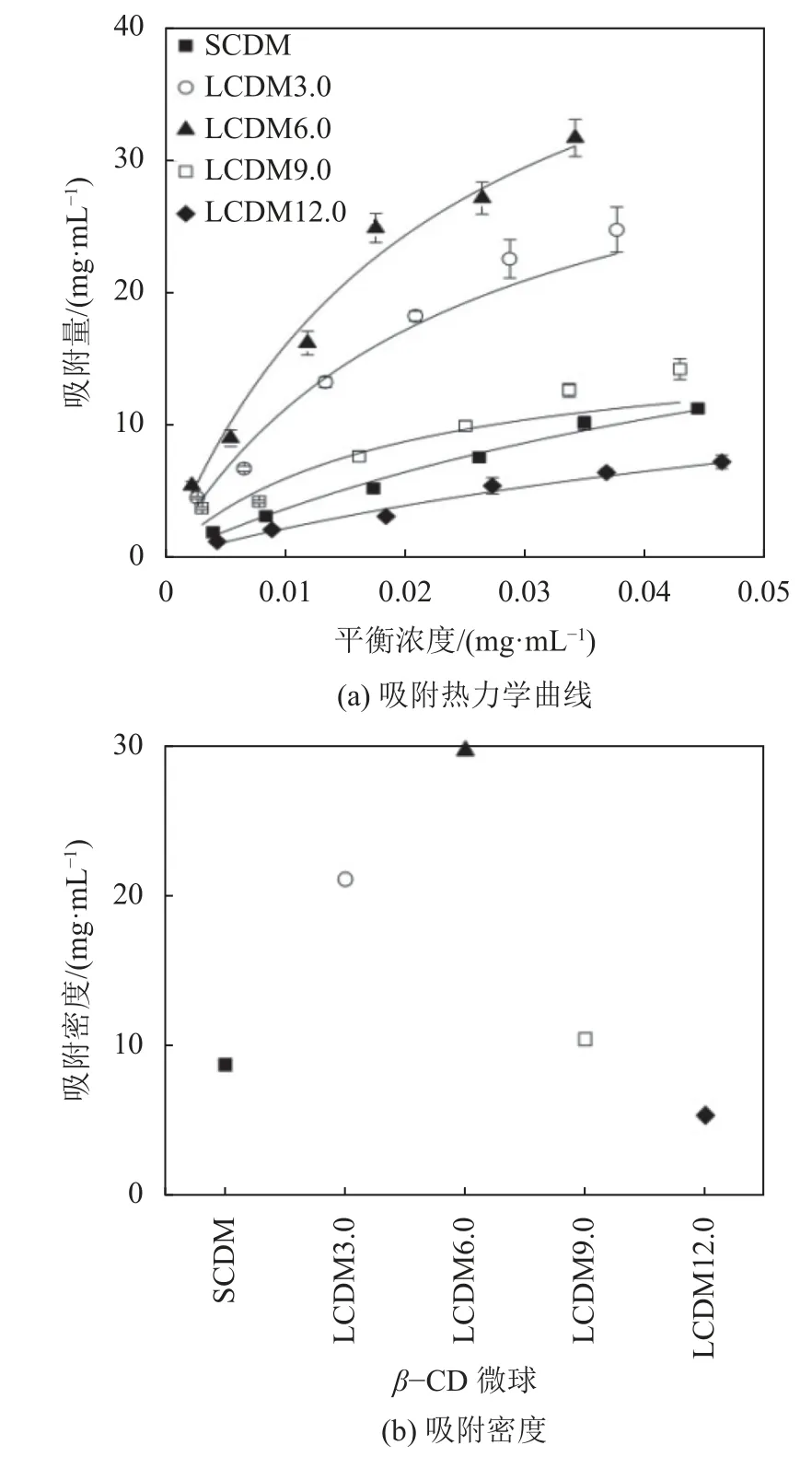
图4 5种 β-CD微球的吸附热力学曲线和吸附密度Fig.4 Adsorption thermodynamic curves and adsorption densities of five β-CD microspheres
提取液的pH是影响黄酮类化合物提取率的重要因素之一。以LCDM6.0为例,考察芦丁溶液pH值对于LCDM6.0吸附容量的影响,如图5所示。由图5可知:在酸性条件下,LCDM6.0芦丁吸附容量受pH值影响较小,保持高于29 mg/mL的吸附容量;当芦丁溶液pH值增加至溶液为碱性,LCDM6.0的芦丁吸附容量呈现出断崖式下降,最低至6.43 mg·mL-1(pH=11.1)。Shuang等[33]报道芦丁在碱性条件下,酚羟基容易去质子而离子化,离子化后的芦丁疏水性明显下降,导致芦丁与环糊精的包结平衡常数下降。降低的包结常数可能是造成芦丁在碱性条件下吸附容量下降的原因之一。此外,碱性的环境也可能导致β-CD中的C2—OH离子化而发生构象变化,造成芦丁与β-CD空腔匹配度降低[24]。
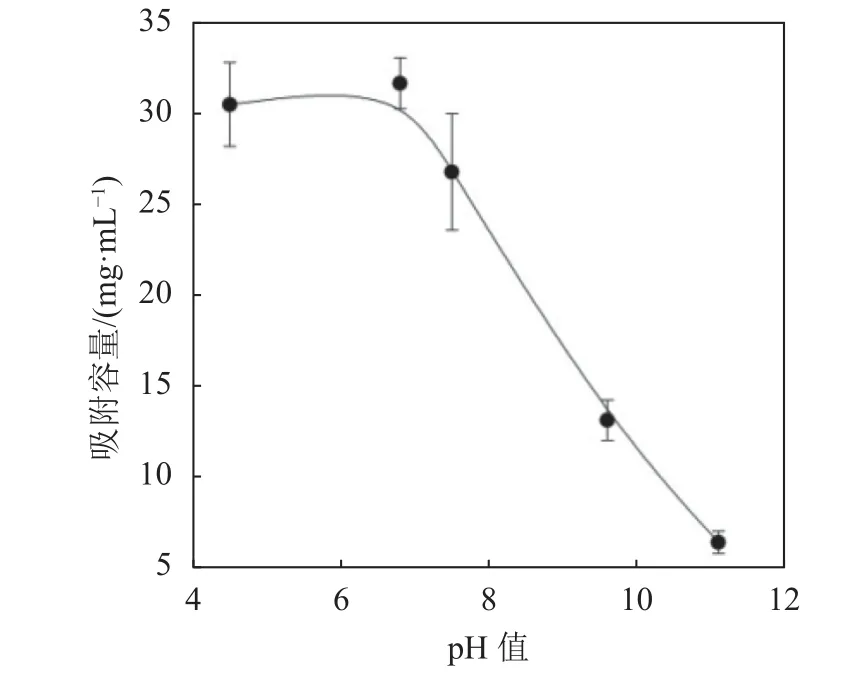
图5 pH对LCDM6.0芦丁吸附容量的影响Fig.5 pH effect on the adsorption capacity of LCDM6.0 for rutin
2.5 吸附动力学
芦丁在这5种β-CD微球介质中的吸附动力学曲线如图6所示。
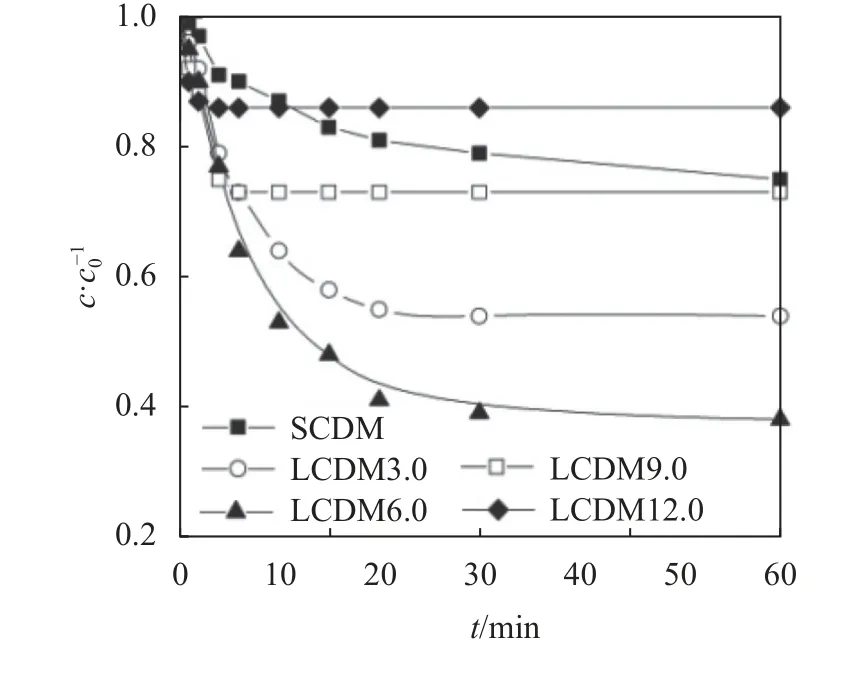
图6 5种β-CD微球的吸附动力学曲线Fig.6 Uptake kinetic curves of the five β-CD microspheres
由图6可见:LCDM3.0、LCDM6.0和LCDM9.0表现出比SCDM更快的吸附速率;LCDM12.0在吸附初期表现出最快的吸附速率,然而受限于低的吸附容量,当吸附时间超过4 min时,达到吸附饱和。利用孔扩散模型拟合吸附动力学曲线,求解芦丁在孔内的有效扩散系数,表达式如下[34]:
式中:De为有效扩散系数,m2·s-1;cp为孔道中的芦丁浓度,mg·mL-1;q为溶液中的芦丁浓度,mg·mL-1;t为吸附时间,min;εp为介质孔隙率;r为沿半径方向的径向长度,m。由于吸附体系始终处于一个搅拌状态,因此液膜扩散阻力可忽略,式(3)可简写为:
式中:F为吸附剂与芦丁溶液体积之比;R为色谱介质半径,m;c0为溶液中芦丁初始浓度,mg·mL-1;c为平衡芦丁浓度,mg·mL-1。式(3)~(4)的初始和边界条件为:
采用正交配置法在空间上离散模型,配置点数为19,得到对时间的常微分方程组,采用Matlab R2021a内置求解器ode15s求解。采用25 ℃时芦丁的自由溶液扩散系数D0(3.73×10-10m2/s)对De无量纲化处理,结果见表3;芦丁在微球内的吸附浓度轮廓如图7所示,图7中,Rp为介质半径。由表3可知:随着孔径的增大,芦丁的De/D0值也随之增加。其中,LCDM12.0的De/D0值达到1.29,相比于SCDM(0.12)提高了10.75倍。Zhao等[24]制备了1种β-CD微球/碳化钨复合微球,芦丁在该微球内的De/D0值仅有0.1×10-11m2·s-1,接近于SCDM,但远低于LCDM,证明了大孔结构可以有效促进芦丁在微球内部的传质。此外,由图7可知,所有β-CD微球对芦丁都表现出较强的优惠吸附,并且随着孔径的增大,吸附前沿也变得更加陡峭,证明了芦丁在大孔内的传质速率随孔径增加而增加。

表3 芦丁在5种 β-CD微球内的 De/D0值Tab.3 De/D0 values of ratin in the five β-CD microspheres
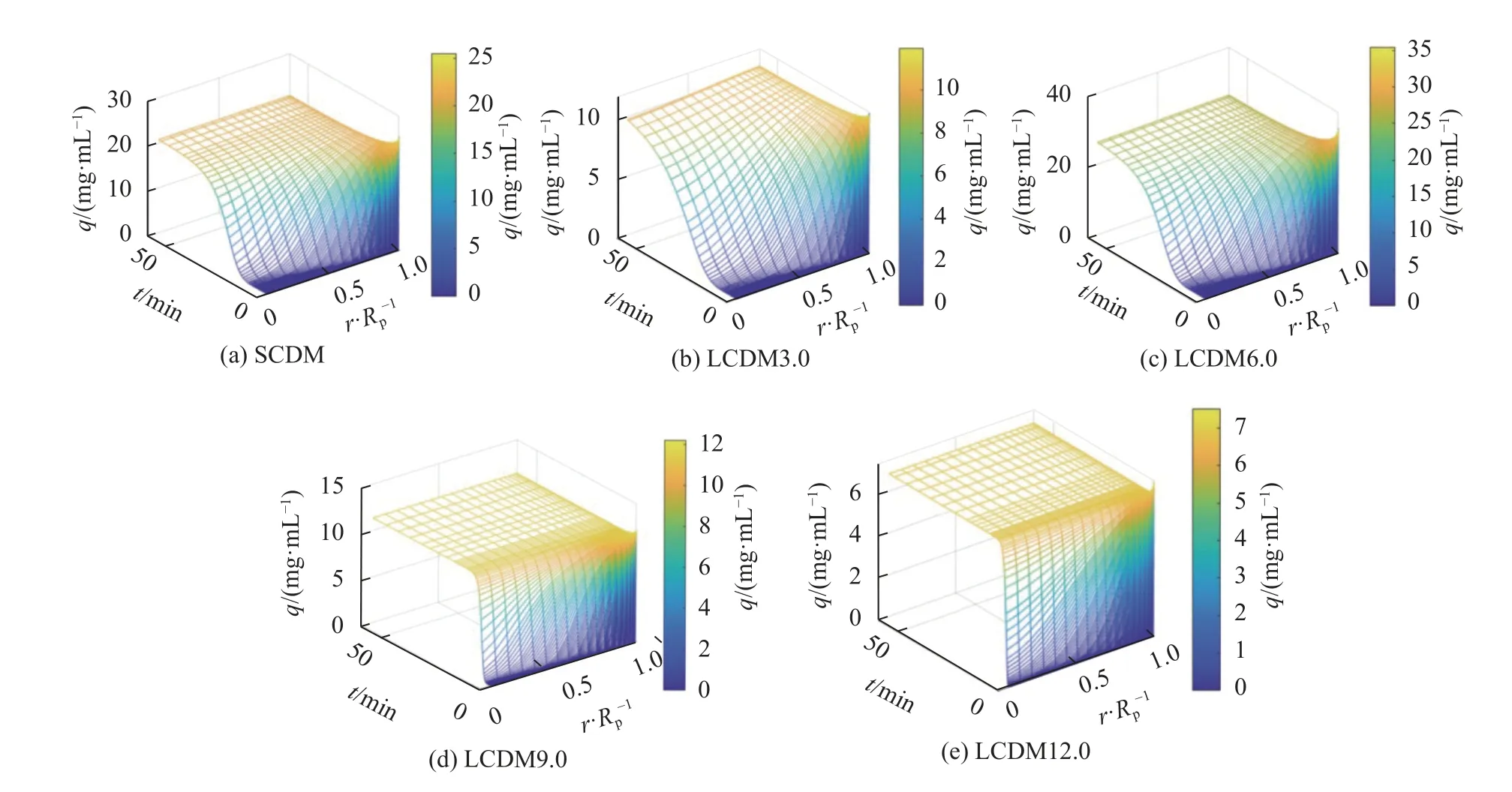
图7 5种 β-CD微球的吸附浓度轮廓图Fig.7 Intraparticle concentration profile of the five β-CD microspheres
3 结 论
采用表面活性剂溶胀策略成功制备大孔β-CD微球,平均孔径为20~200 nm,孔径随表面活性剂用量的增加而增加。大孔的构建显著提升了微球的渗透性,在相同流速下,大孔β-CD微球具有更低的背压,其中,LCDM9.0的渗透性相比SCDM增加了70.65%。在芦丁吸附实验中,LCDM6.0表现出最大的吸附容量,在0.03 mg·mL-1的芦丁浓度下,吸附密度达到29.62 mg·mL-1,是SCDM吸附密度(8.66 mg·mL-1)的3.42倍。LCDM的芦丁吸附容量受溶液pH影响较大,在碱性条件下,由于芦丁的离子化以及β-CD构象的改变,芦丁与β-CD空腔适配程度降低,导致低吸附容量。此外,相比于SCDM,芦丁在LCDM内表现出明显更快的扩散系数,其中,LCDM12.0的无量纲化有效孔扩散系数(De/D0)达到1.29,是SCDM有效扩散系数的10.75倍。以上结果证明了大孔的构建不仅提高了吸附容量,也加快了吸附速率,LCDM是一种有价值的黄酮类化合物分离纯化介质。
