杜氏肌营养不良男性患儿486份心电图特征病例系列报告
2023-10-12张琳玲谢佩环邵淑冉蔡晓唐周开宇
张琳玲 王 川 谢佩环 邵淑冉 魏 丽 周 晖 蔡晓唐 周开宇
Duchenne型肌营养不良(DMD)为临床常见的X连锁隐性遗传性肌病,由染色体Xp21上编码抗肌萎缩蛋白的基因发生突变所致[1]。在活产男婴中的发病率为1/5 000~1/3 500[2-5],以缓慢进行性加重的对称性肌无力和肌萎缩为特征,大部分DMD患儿于3~4岁开始出现步态异常,10~12岁逐渐丧失行走能力,18~20岁死于循环和呼吸衰竭[6-8]。随着DMD多学科管理的普及、类固醇激素的早期使用、夜间通气及早期康复等的应用,DMD患儿的生存年龄可延长至30岁左右[9, 10]。然而,随着DMD患儿生存时间的延长,心血管并发症变得尤为突出,且成为DMD患儿死亡的首要原因[11-13]。
利用有效手段早期发现DMD患儿心脏受累,对心肌病变范围和程度进行定量评估,及早进行标准的抗重构及抗心衰治疗,可能延缓其心脏受累进展,改善整体预后[2]。目前临床上使用的心脏检查手段包括心电图、超声心动图及心脏MR等。其中,心电图检查具有方便、快捷、费用低、易开展等优点。人群及动物研究均提示,心电图改变可能是DMD患儿心脏受累的最初表现,在心脏未出现心肌纤维化之前心电图已有异常征象,心电图可能比超声心动图甚至心脏MR更能敏感地发现DMD相关心肌受累的早期表现[14-16]。因此,解析心电图特征对于DMD患儿系统管理、早期干预及预后改善有着重要的临床意义。
1 方法
1.1 伦理 本研究遵循的程序符合四川大学伦理委员会规定,并通过该伦理委员会审查及批准(批准文号K2019056)。
1.2 病例组纳入标准 纳入基因诊断为DMD并在四川大学华西第二医院(我院)行普通心电图检查的男性患儿。
1.3 正常儿童组纳入标准 纳入在我院因常规体检或腹股沟疝行心电图检查的男性儿童或患儿。
1.4 排除标准 组共同排除合并先天性心脏病、川崎病、心肌炎、风湿性心脏病、免疫性疾病、高血压、肿瘤化疗患儿;正常儿童组还排除近半年使用过对心脏电活动存在影响的药物[如血管紧张素转化酶抑制剂(ACEI)、血管紧张素Ⅱ受体拮抗剂(ARB)、β受体阻滞剂等]者。
1.5 心电图检查及读图 经系统培训的医技人员在心电图机(北京麦迪克斯科技有限公司:MECG-200、MECG-300)上调整参数并核定电压10 mm·mV-1,走纸速度25 mm·s-1,肌电滤波40 Hz,心电图频率响应范围150~250 Hz。患儿呈仰卧位暴露胸壁及四肢,医技人员用酒精棉球擦拭患儿皮肤后准确安置心电图各导联,于安静状态获取清晰平稳的心电图,并连续记录60 s。由2位心电图科高年资主治医生在心电网络工作站(V8.0.5、MedExECG-02.001.036.000.0002)对患儿心电图结果进行诊断,若2位主治医生对诊断有异议,与第3名心电图高年资主治医师讨论后确定心电图诊断。
1.6 心电图数据采集 由对纳入儿童分组情况不知晓的研究人员收集DMD患儿及正常儿童的心电图数据,并由另一名人员对数据收集情况进行校对。心电图数据收集的内容包括:心率、PR间期、P波间期、P波振幅、QRS间期、QT间期、QTc间期、RV1振幅、SV1振幅、RV5振幅和心电图诊断。
1.7 心电图异常判断标准 参考《实用小儿心电图学》第3版[17],至少符合以下各项之一:左室高电压/左室肥厚,右室高电压/右室肥厚,双室肥厚,ST-T段改变,T波改变,病理性Q波,短PR综合征,完全性右束支传导阻滞(CRBBB),不完全性右束支传导阻滞(ICRBBB),室内传导阻滞,房性早搏,室性早搏,QT间期延长,安静状态采集到的窦性心动过速。
1.8 左室射血分数(LVEF)数据采集和判断 2018年DMD指南[18]建议7岁以上DMD患儿每年行心脏MR检查。嘱患儿仰卧位,正确安装胸前导联心电门控及呼吸门控,于呼气末屏气时采集图像;采用单次激发快速自旋回波序列进行常规横断面、冠状面及矢状面定位扫描;采用快速平衡稳态进动(FIESTA)序列,在标准的冠状面及轴位图像平行心脏长轴定位,扫描类两腔图像,并依此定位类四腔图像;根据类四腔及类两腔图像准确定位左心室短轴图像,并依此扫描标准的两腔、三腔及四腔电影图像;短轴电影扫描范围包括从基底部至心尖部,采集8~10层,逐层、全方位显示左心室壁各节段心肌厚度以及运动情况;扫描参数FIESTA序列:TR 3.9 ms,TE 1.7 ms,视野34 cm×34 cm,重建矩阵224×224,翻转角55°,层厚7 mm,层间距2 mm,每层扫描时间12~15 s。
在CVI 42软件上定义左室舒张末期及收缩末期,使用软件自动化追踪左室舒张末期心内膜和心外膜,通过目测检查所有轮廓以确保勾画的准确性,获得患儿左室舒张末期及收缩末期容积,并计算患儿LVEF。根据欧洲心力衰竭指南[19]定义LVEF<50%为左室收缩功能降低,LVEF≥50%为正常。
1.9 分组 根据DMD患儿心电图判断结果分为心电图异常组与心电图正常组;正常儿童组心电图作为标准心电图参照;根据2018年DMD多学科管理专家共识中关于DMD患儿病情进展分期(症状前期、早期独走期、晚期独走期、早期不能独走期及晚期不能独走期)及对应年龄区间[20],分为0~5岁、~7岁、~9岁、~13岁和~18岁组;正常儿童组依DMD实际年龄分组进行匹配。
1.10 统计方法 采用SPSS 22.0统计软件进行统计分析。定量资料使用均数±标准差表示,分类资料以n(%)进行描述。符合正态分布的两组定量资料之间比较采用独立样本t检验,不符合正态分布的采用非参数U检验;分类资料的比较采用卡方检验或Fisher检验;双侧P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 2018年8月至2022年8月符合本文病例组纳入和排除标准的DMD男性患儿304例,年龄1.8~17.2(8.4±3.2)岁, 收集心电图资料共486份;0~5岁组74例88份心电图,~7岁组62例84份心电图,~9岁组77例117份心电图,~13岁组72例157份心电图,~18岁19例40份心电图。正常儿童组112例(常规体检104例,腹股沟疝8例),匹配DMD患儿分组年龄,0~5岁组28例,~7岁组18例,~9岁组24例,~13岁组22例,~18岁组20例。两组在年龄、身高、体重、BMI、体表面积和血压等方面差异均无统计学意义。
2.2 DMD患儿心电图异常情况 DMD患儿心电图异常发生率为38.7%(188/486);其中,窦性心动过速和右室肥厚各59份(12.1%),左室高电压/左室肥厚50份(10.3%),ICRBBB 17份(3.5%),双室肥厚和T波改变各15份(3.1%),ST-T改变13份(2.7%),病理性Q波11份(2.3%),短PR综合征8份(1.6%),CRBBB 7份(1.4%),室内传导阻滞和房性早搏/室性早搏各3份(0.6%)。未见长QT综合征和其他类型传导阻滞。
2.3 年龄对心电图异常发生率的影响 表1显示,随着年龄增长,心电图异常的发生率逐渐升高(P<0.001),0~5岁组最低为23.9%,~18岁组最高为72.5%。7岁以下DMD患儿心电图异常主要表现为右室肥厚、窦性心动过速、左室高电压,其他类型心电图异常较少见;随着年龄增长,ST-T段改变、T波改变、病理性Q波、ICRBBB、CRBBB、室内传导阻滞、房性早搏、室性早搏及短PR综合征发生率均显著增加(P<0.05)。
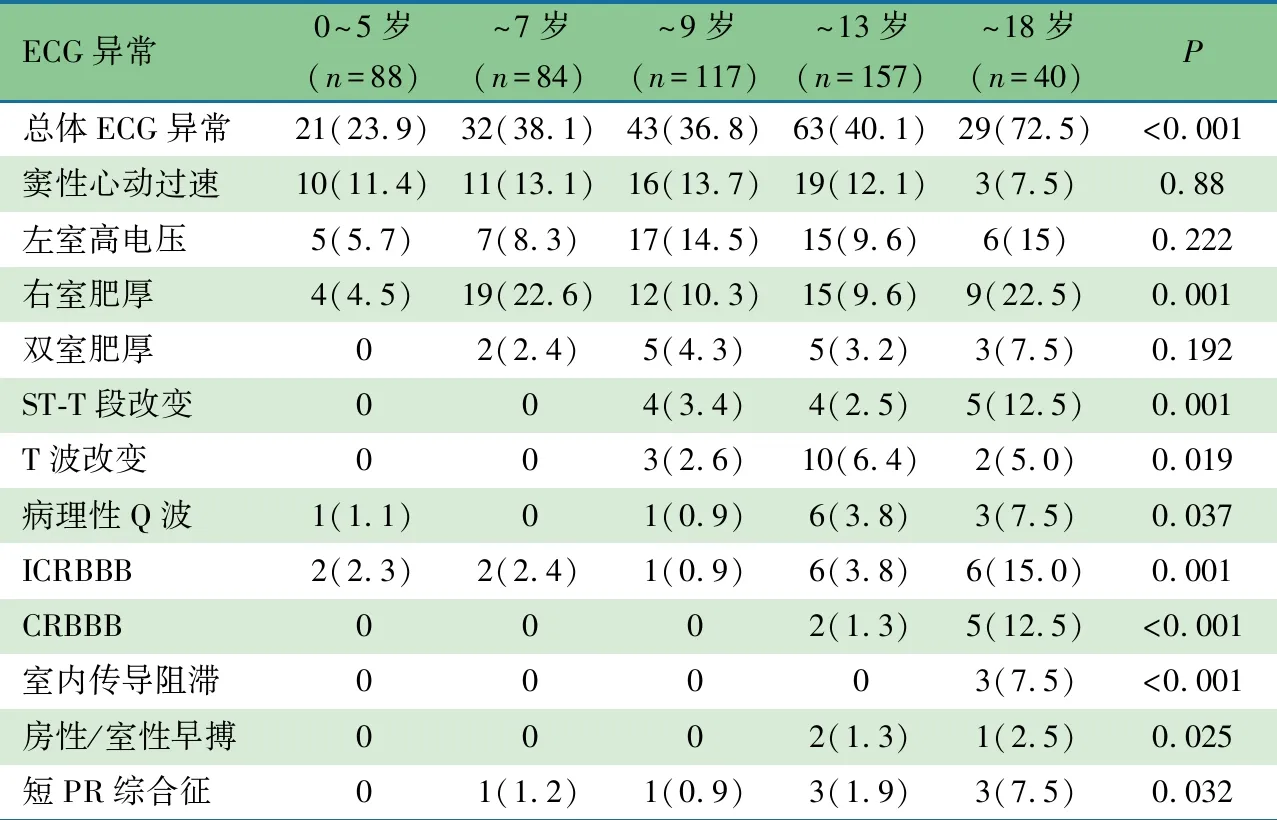
表1 不同年龄DMD患儿的心电图(ECG)异常情况[n(%)]
2.4 不同年龄段DMD患儿与正常儿童组心电图指标比较 表2显示,与正常儿童组相比:①不同年龄组DMD患儿心率(HR)均更快,差异均有统计学意义;②DMD患儿PR间期较短,除~7岁组外其他各年龄组差异均有统计学意义;③不同年龄组DMD患儿RV1振幅均增高,差异均有统计学意义;④DMD患儿RV5+SV1振幅除0~5岁组和~18岁组外,其他各年龄组均增高,差异均有统计学意义。
2.5 LVEF正常的 DMD患儿心电图异常情况 DMD患儿心脏MR检查显示LVEF正常的心电图共199份,其中心电图异常发生率为39.2%(78份);包括窦性心动过速和左室高电压/左室肥厚各21份(10.6%),右室肥厚19份(9.5%),ST-T改变10份(5%),T波改变9份(4.5%),双室肥厚和ICRBBB各7份(3.5%),病理性Q波6份(3%),短PR综合征4份(2%),房性早搏/室性早搏2份(1%),CRBBB和室内传导阻滞各1份(0.5%)。
2.6 DMD患儿心电图正常组和异常组心功能比较 图1A显示,DMD患儿心电图正常组(125份)LVEF显著高于心电图异常组(93份),(59.4%±6.1%)vs( 56.2%±8.8%),P=0.003;图1B显示,DMD患儿心电图异常组较正常组LVEF降低的发生率明显升高 (16.1%vs3.2%),P=0.001。
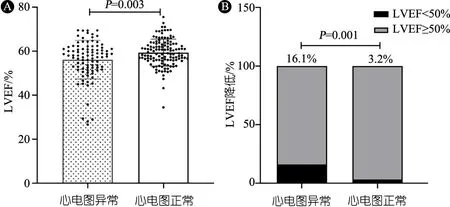
图1 DMD患儿心电图正常组与异常组心功能比较
2.7 LVEF正常的DMD患儿不同年龄段与正常儿童组心电图指标比较 表3显示,与正常组相比:LVEF正常的DMD患儿各年龄组心率更快、PR间期较短、RV1振幅增高,差异均有统计学意义;除~18岁组RV5+SV1振幅增高差异无统计学意义外,其他各组RV5+SV1振幅增高差异均有统计学意义。
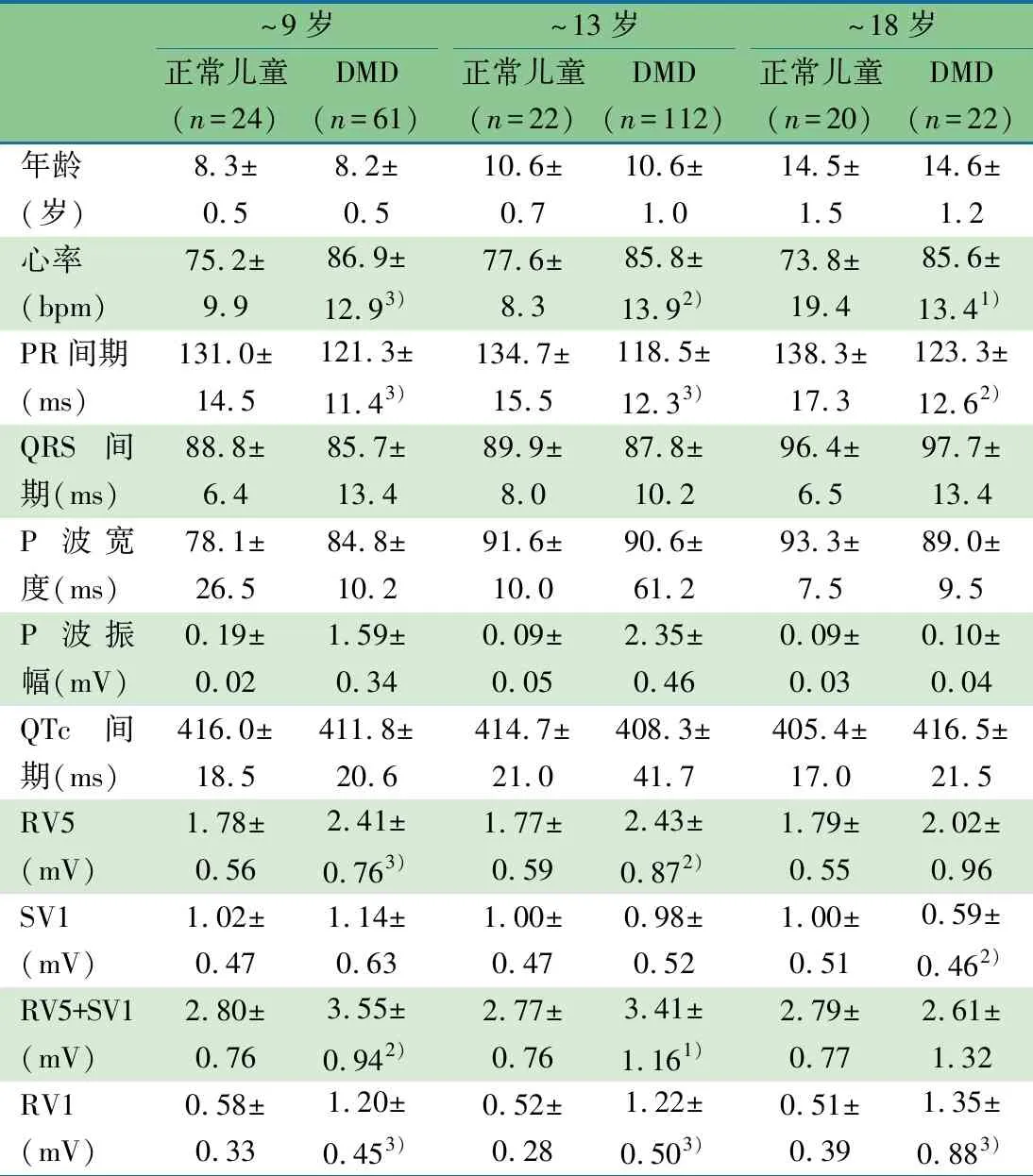
表3 不同年龄段LVEF正常的DMD患儿与正常儿童心电图指标比较(xˉ±s)
3 讨论
本研究基于西南地区DMD患儿研究队列,系统分析了不同年龄DMD男性患儿心电图特征改变,并与正常儿童心电图指标进行比较,呈现了DMD患儿心电图特征。
本研究结果反映心电图异常是DMD患儿心脏受累的早期指标,0~5岁组心电图异常发生率即有23.9%,其中窦性心动过速、PR间期缩短、RV1振幅升高是心肌受累的早期特征性改变;随着年龄增加,DMD患儿心电图异常发生率显著增高,尤其在~18岁组明显,ST-T段改变、病理性Q波、室内传导阻滞、ICRBBB、CRBBB在大年龄组患儿中较为常见;心电图异常DMD患儿的心功能异常发生率更高;同时随着年龄增长,DMD患儿心电图呈现右室肥厚-双室肥厚-右室肥厚的特征性动态改变。本研究对于了解DMD患儿心电图特征、判断DMD患儿心肌受累以及启动早期干预具有重要参考价值。
既往研究亦描述了DMD患儿心电图特点:(1)Takami等[21]分析了69例DMD患儿(4~18岁)136份心电图,91.3%(64/69)异常:深Q波最常见(55.1%),多分布于前侧壁(53.6%)及下壁导联(15.9%);V1导联R/S比值异常(37.7%)、高R波振幅(36.2%)、短PR间期(33.3%)、QRS切迹(33.3%)、RV5+SV1低振幅(24.6%)及窦性心动过速(17.9%)较常见,仅1例QT间期延长。(2)Thrush等[22]分析了115例DMD患儿(3.6~27.8岁)的心电图异常:以短PR间期为主(43%),其次为右室肥厚(37%)、T波低平或倒置(33.0%)和深Q波(10%~34%)。(3)Shah等[16]研究了150例肌病患儿(平均年龄10.1~16.9岁,DMD 86例)377份心电图,发现71%(269/377)异常:以非特异性T波改变为主(28%),右室肥厚(21%),左室肥厚(11%),下侧壁导联Q波(10%),室内阻滞(8%),电轴左偏(8%),双室肥厚(7%),下侧壁导联T波倒置(7%),ST段下移(5%),CRBBB(2%)和QT间期延长(1%)。(4)James等[14]在78例未使用激素DMD患儿(0.2~5.7岁)的心电图中,发现78%存在至少1种异常类型:左室改变(68%),以Ⅲ、V6导联Q波最常见(57%),可见V6导联R/S比值升高(19%)及高R波振幅(14%);右室改变(22%),以V1导联高R波振幅最常见(16%);双室改变(17%);病理性ST段及T波改变(3%);窦性心动过速、QT间期延长及短PR间期(均为4%)。(5)周璟娜等[23]分析了246例中国DMD患儿(2月至15岁)270份心电图, 62例异常(22.96%),左心室大/左心室高电压、V1导联S波加深及异常Q波(Ⅱ、Ⅲ、aVF、V4~V6导联为主)占总异常心电图比例66.1% (41/62),各年龄段比例依次为7.9%、10.5%、19.8%、31.2%,呈现出随年龄增加而增长的趋势;右心室大、ST-T段改变也较常见。
综上并结合本研究结果说明,DMD患儿心电图异常的发生率在不同研究间差异较大,分析可能原因为:①研究人群年龄范围不同,本研究证实随着年龄增长,DMD患儿心电图异常发生率亦随之增加;②研究人群地域、人种等存在差异性;③心电图异常诊断标准不同,部分研究将所有非特异性T波改变等均判定为心电图异常,导致高估DMD患儿心电图异常发生率。
关于DMD患儿心电图异常表现的类型及发生率,虽然不同研究之间差异较大,但是较一致的是:①Ⅰ、Ⅱ、Ⅲ、avL、avF、V4~V6导联病理性Q波,V1导联R波振幅增高伴R/S比值增大,右室肥厚,左室高电压,ST段及T波改变是DMD患儿较常见的心电图异常改变类型;②窦性心动过速及短PR间期是DMD患儿较常见且具有特征性的心电图异常表现类型;③传导阻滞包括CRBBB、CLBBB及cAVB在DMD患儿中并不常见,且大部分发生于DMD年长儿,目前文献中仅有4例DMD患儿发生cAVB的报道,分别在28、30、33和40岁被发现;④QT间期延长较罕见;⑤SVT及VT可发生,但多发生于已存在心功能降低的DMD年长患者。
基于浦肯野纤维细胞膜中缺乏肌营养不良蛋白可能是DMD患儿早期心电图异常的病理生理学基础[24-26],心电图改变可能是DMD患儿心脏受累的早期表现。2010年美国Shah等[16]研究报道,在没有扩张性心肌病(LVEDD<+2Z和/或EF≥55%)的肌病患儿中,心电图异常的发生率为44%(38/86);2011年美国James等[14]研究纳入了78例超声心功能正常且未接受激素治疗的6岁以下儿童,发现78%的儿童表现出至少1种心电图异常。本研究同样发现LVEF正常DMD患儿心电图异常发生率为39.2%;相对于正常健康儿童,LVEF正常的DMD患儿HR更快、PR间期较短、RV1和RV5+SV1振幅增高,心电图异常患儿心功能降低发生率明显升高,同样证实了心电图异常是DMD患儿心肌受累的早期临床线索。
本研究发现部分0~5岁组DMD患儿心电图已存在改变,主要表现为窦性心动过速、短PR间期及RV1振幅增高,提示这些改变可能作为DMD患儿心肌受累以及启动早期干预的早期标志,但其发生机制如何,仍有待进一步明确。Sanyal等推测传导系统dystrophin蛋白的缺失可能导致PR期间缩短[27,28],而动物实验证实在左室未出现心肌纤维化时,浦肯野纤维已经出现了明显的液泡变性[29],这可能是DMD患儿早期出现PR间期缩短的原因之一[30];窦性心动过速的发生,主要与DMD患儿心脏自主神经功能调节障碍导致交感神经兴奋性上升并抑制迷走神经和/或“营养不良”窦房结纤维化/脂肪浸润引起的房室旁路或房室传导加速有关[24,30];对于0~5岁组DMD患儿RV1振幅较正常儿童增高的现象,大量研究证实DMD患儿心肌受累最初始于左室后壁基底段,心肌组织变薄,这会导致整体电轴朝右前偏移,从而使RV1振幅升高,而并非真的“右室肥厚”[21,28,30,31]。
本研究更重要的发现是,DMD患儿随着年龄增长,心电图呈现右室肥厚-双室肥厚-右室肥厚动态改变的趋势,这可能与DMD患儿心肺功能的变化相关。如前所述,DMD患儿早期心电图表现为右室肥厚主要与左室后壁基底段发生改变导致心脏整体向量向右前偏移有关。随着疾病进展,左室广泛受累,出现纤维化,从而可能表现为双室肥厚。在疾病晚期,一方面,DMD患儿肺功能逐渐受损,缺氧导致毛细血管收缩重塑出现肺动脉压升高,引起右室肥厚;另一方面,左室广泛病变导致舒张末压增高,左心血液回流受阻,毛细血管后肺动脉高压进一步加重右心后负荷增加,加剧右室肥厚。此外,疾病晚期右心也可能出现心肌纤维化发生,这可能可以解释DMD大年龄组患儿仅表现为右室肥厚的原因。上述心电图特征性改变对于了解DMD患儿心肌受累进展具有重要的参考价值。
本研究局限性:单中心病例系列报告,不能推测心电图异常发生的危险因素,也不能预测心电图异常与DMD相关心肌病的发生以及不良预后之间的相关性。
利益冲突声明:所有作者均没有利益冲突。
