负载丹酚酸B的破骨前体细胞膜纳米颗粒对成骨细胞和破骨细胞分化的影响
2023-10-12丁海田波李想王金子张培常文举
丁海 田波 李想 王金子 张培 常文举
骨质疏松是因骨细胞介导的骨形成和破骨细胞引起的骨吸收之间的动态平衡失调,表现为骨吸收增强,骨形成减弱,临床表现为骨密度下降,骨折风险增加[1]。目前临床上关于治疗骨质疏松的药物,仅单方面抑制骨吸收或者促进骨形成,导致治疗效果有限[2]。另一方面,这些药物同时伴随着相应的副作用,如双膦酸盐类和地舒单抗常导致肌肉疼痛,严重的可导致下颌骨坏死[3];特立帕肽治疗易导致高钙血症,有引起骨肉瘤的风险[4]。目前最新一代的抗骨质疏松药物罗莫珠单抗也因为潜在的增加心血管及卒中相关事件风险,限制了其在临床的广泛应用[5-6]。
丹 酚 酸B(salvianolic acid B,SalB,分 子 式C36H30O16)是丹参中最具代表性的成分,具有较强的清除氧自由基活性,临床可利用这一特性治疗多种慢性疾病[7-8]。文献报道SalB对成骨细胞的氧化损伤具有保护作用,从而促进其成骨分化[9-12]。但SalB的化学稳定性和生物利用度较差,导致其体内治疗作用有限[13]。我们之前的研究也证实通过SalB 灌胃的方式治疗去卵巢骨质疏松小鼠模型,治疗效果欠佳[14]。细胞膜纳米颗粒作为新一代的药物载体,在增加药物循环时间、提高靶向性、增加稳定性方面具有一定的优势[15-16]。而破骨前体细胞膜纳米颗粒(NPs)不仅能躲避内皮网状系统的清除,同时也通过其表面的RANK 蛋白发挥抑制破骨细胞的作用[17]。为此,本研究拟使用NPs负载SalB,评估其在促进成骨分化、抑制破骨细胞形成方面的作用。
材料与方法
一、细胞培养
小鼠单核巨噬细胞(RAW 264.7)、小鼠胚胎成骨细胞前体细胞(MC3T3-E1)购自中国科学院上海生物科学研究所细胞资源中心。5只6~8周龄C57BL/6小鼠购买于常州卡文斯实验动物中心。RAW 264.7细胞置于DMEM 培养基(含10% FBS、100 U/mL 青霉素、100 mg/L 链霉素)培养;MC3T3-E1 细胞于α-MEM培养基(含10%FBS、100 U/mL青霉素、100 mg/L链霉素)培养,每3 天更换1 次成骨诱导培养基(含10 nmol/L 地塞米松、50 mg/mL 抗坏血酸、10 mmol/L β-甘油磷酸钠),于37 ℃、5%CO2培养箱中培养。
二、主要试剂与仪器
SalB、β甘油磷酸钠、L-抗坏血酸(上海麦克林生化科技有限公司);BCIP/NBT 碱性磷酸酯酶(ALP)显色试剂盒、茜素红S 染色液(2%,pH=4.2)、地塞米松(碧云天生物技术研究所,中国);青霉素-链霉素双抗、0.25%胰蛋白酶、低糖DMEM 培养基(Hyclone,美国);胎牛血清、α-MEM 培养基(Gibco,美国);重组小鼠M-CSF 蛋白、重组小鼠核因子-κB受体激活因子配体(RANKL)(R&D SYSTEMS,美国);RNA 提取试剂盒、逆转录试剂盒(Bio-Rad,美国);抗酒石酸酸性磷酸酶(TRAP)染色试剂盒(Sigma-Alrdich,美国);噻唑蓝(苏州阿尔法生物实验器材有限公司);引物设计由苏州金唯智生物科技有限公司完成。
场发射透射电子显微镜Tecnai G2 F20(FEI 公司,美国),共聚焦显微镜Zeiss800、荧光倒置显微镜(Carl-Zeiss,德国),多功能酶标仪Varioskan Flash、离心机Micro 21R(Thermo,美国),纳米粒度及ZETA电位仪NANO ZS90(Malvern,英国),Real-time PCR仪CFX96(Bio-Rad,美国),MicroCT Skyscan1176(Bruker,比利时),超声波细胞破碎仪LD-250T(常州零点仪器设备有限公司,中国),超微量核酸蛋白测量仪DS 11FX+(DENOVIX,美国),Ultimate 3000RS高效液相色谱仪(ThermoFisher,美国)
三、实验方法
(一)SalB-NPs的制备与表征
将1×107个RAW 264.7细胞重悬于PBS中,使用LD-250T 超声波细胞破碎仪将细胞置于冰上裂解100 s(30 个循环,Ton=3 s,Toff=7 s),4 000 rpm×10 min,收集上清,14 800 rpm×20 mim,PBS 洗2 遍,取沉淀。使用BCA试剂盒测量膜蛋白浓度,然后重悬于1 mL PBS 中,使用挤出器挤出均匀大小的膜囊泡。将5 mmol/L SalB 溶液与获得的RAW 264.7 细胞膜共孵育,获得均匀的负载SalB的纳米颗粒(SalBNPs)。将SalB-NPs 稀释后滴入碳膜涂层的铜网晾干后,滴入磷钨酸负染,然后滴入超纯水洗涤,放入场发射电镜观察纳米粒形貌;使用纳米粒度及ZETA电位仪测量SalB-NPs的粒径;采用高效液相色谱法测定SalB-NPs上SalB的负载量和药物释放率。
(二)Western Blot实验
将RAW 264.7细胞经超声破碎、离心、挤出获得均一的RAW 264.7 细胞膜,于冰上裂解40 min,15 000 rpm 离心25 min,使用BCA 法蛋白定量后,加入SDS煮沸5 min变性获得蛋白样品。使用SDS-PAGE(10%)分离蛋白后将其转移到聚偏二氟乙烯膜上。用5%脱脂乳在室温下封闭2 h,在4 ℃下与特异性一抗孵育过夜:RANK 抗体(Abmart,PK05726S,1∶1 000)。使用TBST洗涤膜3次后,在相应的二抗溶液孵育1 h。使用Image Quant LAS 4000(GE Healthcare,Silverwater,澳大利亚)和增强型化学发光底物(NCM Biotech,中国)检测抗体的化学发光信号。
(三)细胞活力检测
将RAW 264.7 细胞和MC3T3-E1 细胞以5 000个细胞/孔的密度接种于96 孔板中,每组设4 个副孔,培养24 h,然后分别使用不同浓度(0、0.5、1.5、10、15 mmol/L)的SalB 处 理RAW 264.7 细 胞 和MC3T3-E1细胞,培养24 h,每孔加入10 mL CCK8溶液,检测SalB对细胞活力的影响。
(四)破骨细胞诱导分化及TRAP染色
将小鼠安乐死后,收集双侧股骨及胫骨,冲洗髓腔,将获得的骨髓细胞接种于含有10%胎牛血清、100 U/mL 青霉素和100 mg/mL 链霉素的α-MEM 中,并在5%CO2、37 ℃培养箱中过夜。然后收集非贴壁细胞,以1×104个细胞/孔的密度接种于96 孔板中。按照处理方式不同,分为对照组、SalB 组、SalB-NPs组。其中,SalB 组培养基中加入浓度400 mg/mL SalB,SalB-NPs组培养基中加入浓度400 mg/mL SalB-NPs 处理细胞,对照组加入等体积PBS 溶液。在含巨噬细胞集落刺激因子(M-CSF)(50 ng/mL)和RANKL(100 ng/mL)的α-MEM 完全培养基中培养5天。使用TRAP 染色试剂盒检测破骨细胞,4%多聚甲醛固定细胞30 min,PBS洗涤一次。将制备好的工作溶液添加到孔板中,室温避光孵育40 min。用PBS冲洗两次后,在光学显微镜下获得图像。
(五)ALP染色
按照文献方法(18),将MC3T3-E1 细胞接种于0.1%明胶预包被的12 孔板中,接种密度为1×105个细胞/孔。分对照组、SalB组、SalB-NPs组,处理方式同上。24 h后,更换为成骨诱导培养基,隔天换液一次,诱导培养14 d,根据试剂盒配置工作液,避光孵育2 h后至显微镜下观察。
(六)茜素红染色
将MC3T3-E1细胞接种于0.1%明胶预包被的12孔板中,接种密度为1×105个细胞/孔。分对照组、SalB组、SalB-NPs组,处理方式同上。成骨诱导分化培养21 d行茜素红染色。4%多聚甲醛固定15 min,PBS 洗涤后,每孔加入500 μL 茜素红染液染色,室温避光孵育15 min,PBS 洗涤后荧光倒置显微镜下观察。
(七)Real time-PCR实验
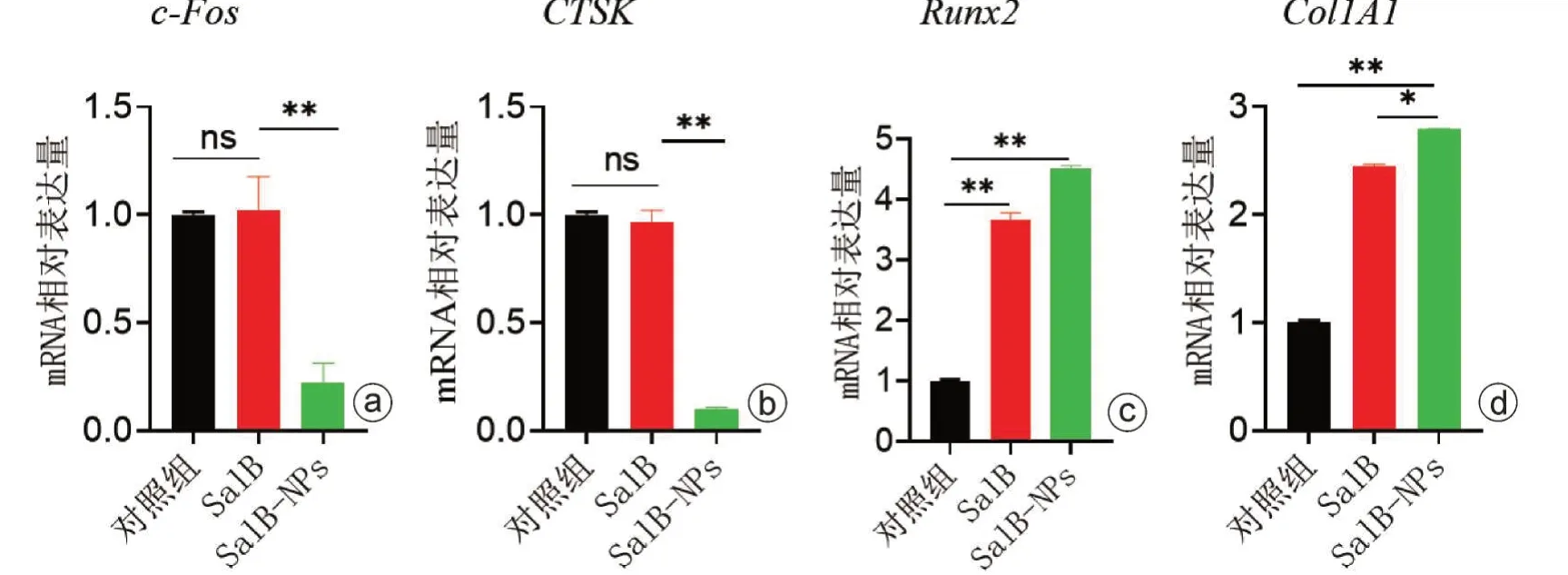
分对照组、SalB 组、SalB-NPs 组,处理方式同上。破骨细胞诱导分化培养5 d,用Trizol 提取各组样品总RNA并定量,用Real time-PCR仪和逆转录试剂盒对提取的1 μg mRNA进行逆转录为cDNA进行定量PCR。使用BioRad CFX 管理器软件获得阈值循环数。扩增程序为95 ℃×2 min的一个循环,然后是95 ℃×10 s、60 ℃×30 s 和72 ℃×30 s 的40 个循环。本研究中使用的引物序列见表1。将原癌基因(c-Fos)、Runt相关转录因子2(Runx2)、组织蛋白酶K(CTSK)、Ⅰ型胶原α1链基因(Col1A1)的相对表达量标准化为GAPDH 的表达量,然后计算出GAPDH的变化倍数。
四、统计学方法
采用GraphPad Prism 9 软件(GraphPad Software公司,美国)进行统计学分析。所有结果用均数±标准差表示,组间比较采用单因素方差分析,两两比较采用LSD检验;检验水准α值取双侧=0.05。
结 果
一、SalB-NPs表征
通过透射电镜及粒径分析,发现制备的SalB-NPs呈双层膜的球形结构,粒径在200 nm左右,同时该纳米颗粒表达RANK蛋白(图1)。

基因GAPDH c-Fos Runx2 CTSK Col1A1引物序列(5′-3′)F:5′-AACATCAAATGGGGTGAGGCC-3′R:5′-GTTGTCATGGATGACCTTGGC-3′F:5′-TTTCAACGCGGACTACGAGG-3′R:5′-GCGCAAAAGTCCTGTGTGTT-3′F:5′-GGCAGTTCCCAAGCATTTCA-3′R:5′-GGTAAAGGTGGCTGGGTAGT-3′F:5′-AGCGAACAGATTCTCAACAGC-3′R:5′-AGACAGAGCAAAGCTCACCAT-3′F:5'-GACATGTTCAGCTTTGTGGACCTC-3'R:5'-GGGACCCTTAGGCCATTGTGTA-3'
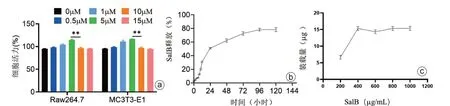
二、细胞活力
不同浓度SalB 处理RAW 264.7 细胞和MC3T3-E1 细胞,随着浓度增加,细胞活力逐渐增加,在5 mmol/L 的SalB 处理时两组细胞活力最佳,再增加SalB 浓度,细胞活力开始下降,且5 mmol/L 与10 mmol/L 之间的差异有统计学意义(P<0.05),因此选用5 mmol/L SalB浓度进行后续实验。通过高效液相色谱法检测,药物释放在96 h达到高峰并趋于稳定,对药物装载发现当SalB浓度达到400 mg/mL时,载药量最高(图2)。
三、SalB-NPs体外抑制破骨细胞形成
破骨细胞诱导分化5 d 后,可见SalB-NPs 显著抑制破骨细胞形成,使用Image J对破骨细胞数目及面积进行定量分析显示,SalB-NPs 组较对照组和单纯SalB 处理组TRAP 阳性细胞数及面积明显减少,差异有统计学意义(P<0.05,图3)。
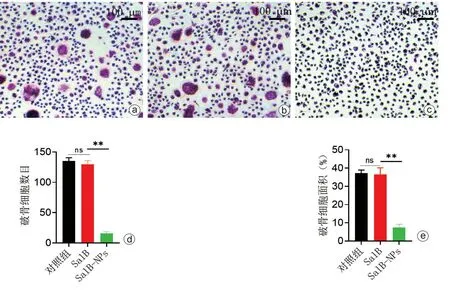
图3 TRAP 染色观察(荧光倒置显微镜×100) a:对 照组;b:SalB组;c:SalBNPs 组;d、e:各组破骨细胞数目及破骨细胞面积(ns:差异无统计学意义,**P<0.01)
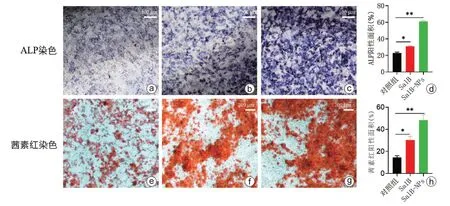
四、SalB-NPs体外促进成骨分化
对MC3T3-E1 成骨诱导分化培养14 d 进行ALP染色,发现SalB-NPs组染色较对照组及SalB组明显加深,定量分析差异有统计学意义(P<0.05);培养21 d 进行茜素红染色,发现SalB-NPs 组染色强度及矿化结节较其余各组更强,定量分析差异有统计学意义(P<0.05,图4)。

五、SalB-NPs 抑制破骨细胞分化且促进成骨分化相关基因的表达
通过对破骨细胞分化相关基因检测发现,SalBNPs 处理后,c-Fos、CTSK 表达较对照组和单纯SalB组明显下调,差异有统计学意义(P<0.05)。SalBNPs 处理后的成骨分化基因Col1A1、Runx2 表达均显著高于对照组和SalB 组,差异均有统计学意义(P<0.05,图5)。
讨 论
骨质疏松导致骨代谢稳态失衡,容易引发脆性骨折,是一种严重的公共健康问题。许多原因可破坏这种平衡状态,如衰老、雌激素下降、糖皮质激素类药物、自身免疫性疾病[17-19]。根据统计,大约50%的女性在绝经后至少经历过一次骨质疏松骨折,导致疼痛,降低病人生活质量。现有的抗骨质疏松药物仅单一促进骨形成,如特立帕肽,或者单纯抑制骨吸收[4],如地舒单抗、双磷酸盐类,临床治疗效果有限。目前关于骨质疏松药物的开发仍是一个难题[20]。为此,我们从维持骨稳态平衡的角度出发,基于细胞膜纳米颗粒技术的优势,开发了负载SalB的NPs,促进成骨活力,抑制过度活化的破骨细胞,扭转骨质疏松的骨稳态失衡问题。
细胞膜作为体内各细胞之间相互识别和调节的关键细胞结构,对其内部内容物的保留起着至关重要的作用[21]。虽然人工合成脂质体也可用于药物递送[18],但细胞膜衍生的囊泡作为细胞自身的物质,用于封装特定材料,除了增强其生物相容性和治疗效果以外,既往的研究还发现应用细胞膜作为伪装,可躲避自身免疫系统(主要是巨噬细胞)对生物材料的清除[22-23]。我们设计的SalB-NPs明显提高了SalB的稳定性,为发挥其药物活性作用提供了前提条件。体外释放实验证实,SalB-NPs 可有效延长SalB 的滞留时间,有利于进一步发挥SalB的药物疗效。与此同时,通过将SalB-NPs 加入到破骨细胞诱导培养基中,我们发现破骨细胞分化明显受到抑制,这可能与我们所使用的破骨前体细胞膜表面所携带的RANK蛋白相关。Zhou 等[17]使用RAW 264.7 细胞膜包裹聚乳酸-羟基乙酸共聚物纳米颗粒制作的一种纳米诱饵,躲避了单核巨噬细胞对材料的吞噬,进而通过材料表面的RANK 蛋白,清除血清中上调的RANKL,实现抑制破骨细胞分化的效果。我们的研究也发现了类似的现象。同时,在对破骨分化相关基因的PCR 检测中发现,SalB-NPs 较单纯SalB 明显下调c-Fos、CTSK破骨细胞分化相关基因的表达,未发现SalB 对破骨细胞分化基因有显著抑制作用。SalB 作为丹参中最主要的活性成分,其具有极强的抗氧化作用。同时,许多文献报道了SalB在促进成骨方面具有一定的效果[10-12]。我们通过ALP染色、茜素红染色证实,SalB-NPs显著增加MC3T3-E1 ALP活性和钙盐沉积,且染色深度较单纯SalB 更加明显。在成骨分化相关基因的检测中,Runx2 和Col1A1 在SalB-NPs 组中显著上调,且比SalB 组上调幅度更加明显。导致这种现象的原因除了SalB-NPs稳定性较SalB更好以外,也有文献报道,RAW 264.7细胞膜纳米颗粒能改善肿瘤坏死因子α对成骨细胞活力的抑制,发挥促成骨作用。
综上所述,我们设计的NPs 负载SalB 在体外显著促进骨形成,抑制骨吸收,具有广阔的应用前景。未来我们将在动物体内进一步研究其在骨质疏松动物模型中改善骨稳态的效果,并进一步探讨关于SalB 促进成骨分化的具体机制,以及其对破骨细胞的作用。