基于白及多糖多孔载药微球的制备与质量评价*
2023-10-12东泳杉李伟泽
陈 程,东泳杉,李伟泽,2,赵 宁,马 莉
(1.西安医学院 药学院,陕西 西安 710021;2.江苏微纳医药科技有限公司,江苏 扬中 212218)
白及为传统外伤用药,具有收敛止血、生肌消肿之功效[1]。白及多糖(BSP)是从中药白及中提取分离得到水溶性高分子多糖,具有抗氧化、抗菌、抗炎、抗纤维化、止血、组织修复等药理活性[2,3]。近几年研究表明,BSP 具有功能缓释、局部滞留、自身降解、生物安全性高、无毒无刺激等特点,它已作为新型生物医药高分子载体材料被广泛应用[4-6]。对于创伤愈合而言,药物应尽量少进入全身系统,而附着于表皮以达到表皮缓释效果,微球可原位固定,避免粒子扩散、防止突释、延长病灶部位滞留,目前,该体系在创伤愈合治疗方面显示巨大的潜力。研究表明,黄连素(BBR)局部外用可显著促进糖尿病溃疡伤口愈合,主要机制[7-11]通过恢复TrxR1/JNK 信号通路,减少氧化损伤与细胞凋亡,从而恢复糖尿病溃疡伤口的氧化还原状态,促进表皮细胞增殖,加快糖尿病溃疡伤口的愈合。据此,我们以BSP 微球包埋BBR 构建用于糖尿病溃疡的多孔生物黏附性微球(BBR-BSPMs),并对其进行质量评价,以为糖尿病溃疡治疗提供一种新制剂。
1 实验部分
1.1 材料与仪器
白及多糖(自制);D(+)-无水葡萄糖标准品(批号:B21882-100mg 上海源叶生物科技公司);黄连素(批号:SB1604 北京索莱宝科技有限公司);其他试剂均为分析纯。
QUINTIX124-TCN 型电子分析天平(赛多利斯科学仪器有限公司);ZNCL-BS 型智能磁力搅拌器(河南爱博特特科技发展有限公司);KH7200DB 型数控超声波清洗器(昆山禾创超声仪器有限公司);Cary60 型紫外可见分光光度计(美国Agilent 公司);CKX31SF 型倒置显微镜(Olympus);ZEN3600 型Malvern 纳米粒度和ZETA 电位仪(英国马尔文仪器有限公司);DZF6050 型真空干燥箱(温州顶历医疗器械有限公司);T27 型布鲁克红外光谱仪(德国bruker 公司)。
1.2 实验方法
1.2.1 BSP-Ms 的制备 在前期查阅文献的基础上,以微球得率和粒径为评价指标,分别考察BBR投料量、BSP 浓度、交联温度、交联体积分数、交联时间和搅拌速度等因素对实验结果的影响,初步得到BSP-Ms 的制备工艺参数。于50℃水浴条件下精密称定BSP 配得0.05g·mL-1水溶液作为水相,液体石蜡作为油相(水油相比为1∶5),于50℃、960r·min-1条件下将10%乳化剂(司盘-85∶吐温-80=2∶1,v/v)均匀分散于油相中;将BSP 水溶液用注射器缓慢滴加到油相中乳化成乳滴(130min),于冰箱4℃条件下冷藏30min,加11%交联剂(乙二胺∶环氧氯丙烷=1∶3),于40℃、960r·min-1条件下充分搅拌交联固化成球(70min);将得到的微球乳液冷却、静置,用石油醚洗涤3 次除去油相,异丙醇、丙酮交替洗涤3~5次,60℃真空干燥箱干燥后,得BSP-Ms。
1.2.2 BBR-BSP-Ms 的制备 按照12% BBR 投料量于水相中,参照“1.2.1”项下方法制备BBR-BSPMs。
1.2.3 BBR-BSP-Ms 外观性状、分散性观测 取少量样品均匀分散,肉眼观察微球的颗粒性。再取少量样品于表面皿中,用蒸馏水分散,观察其是否均匀分散、有无粘连性。
1.2.4 BBR-BSP-Ms 形态和粒径大小、分布及电位评价 采用光学显微镜观察其均匀性;采用扫描电镜(SEM)观察其外观形态和结构特征;采用倒置显微镜观察并标记区域内的微球粒径;采用Malvern激光粒度仪测定Zeta 电位。
1.2.5 BBR-BSP-Ms 红外光谱分析 称取2mg 干燥BBR、BSP、BSP-Ms、BBR-BSP-Ms 和物理混合物,分别与KBr 粉末于红外灯下研细,混合均匀,进行压片处理,扫描得图谱。
1.2.6 BBR 含量测定 配制系列浓度的BBR 对照品溶液,于350nm 处测吸光度,以吸光度A 为纵坐标,浓度C 为横坐标,绘制标准曲线。
1.2.7 BBR-BSP-Ms 载药量和包封率的测定 将干燥的BBR-BSP-Ms 置研钵中研细,精密称定10mg置于25mL 容量瓶中,加适量pH 值为7.4 的磷酸盐缓冲液超声15min 并定容至刻度,作为供试品溶液。以空白微球作参比,于350nm 处测定吸光度,通过BBR 标准曲线回归方程计算浓度,再按下式计算载药量和包封率。
式中 m:微球中药物量,mg;M:微球质量,mg;M0:药物投入量,mg。
1.2.8 BBR-BSP-Ms 体外释药性能研究[12]分别精密称取10mg BBR、BBR-壳聚糖(Cs)水凝胶(对照组)和BBR-BSP-Ms 置于透析袋中,加入5mL pH值7.4 的磷酸缓冲液,用封口夹扎紧透析袋,悬浮于装有100mL 相同释放介质的烧杯中,37℃、100r·min-1磁力搅拌器中水浴搅拌,于0.5、1、2、4、6、8、12、24、36、48h 定时取样5mL,每次取样后及时补足5mL 新鲜的释放介质。于350nm 波长处测定释放液的吸光度,计算BBR 浓度,按下列公式计算累积释放率。
微球第n 小时的药物累积释放率%=(Cn×100+∑Cn-1×5)/样品量×100%
2 结果与讨论
2.1 BBR-BSP-Ms 外观性状、分散性
BSP-Ms 呈浅白色粉末状,颗粒性较好;BBRBSP-Ms 呈浅黄色粉末状,颗粒性较好。取空白白及多糖微球和共载黄芪甲苷-黄连素白及微球适量于表面皿中,加入纯化水分散,微球可均匀分散,无粘连性。
2.2 BBR-BSP-Ms 形态和粒径大小、分布和电位图
由图1、2 可见,在光学显微镜下,BSP-Ms 与BBR-BSP-Ms 均可观察到大量微球且外形圆整,互不粘连。

图1 BSP-Ms 普通光学显微图(×100)Fig.1 General optical micrograph of BSP-Ms(×100)

图2 BBR-BSP-Ms 普通光学显微图(×100)Fig.2 General optical micrograph of BBR-BSP-Ms(×100)
由图3、4 可见,在倒置显微镜下,BSP-Ms 粒径大多处于60~70μm 之间、BBR-BSP-Ms 粒径均在20~30μm 之间,粒径分布均匀,形态圆整。

图3 BSP-Ms 倒置显微镜图Fig.3 Inverted microscope diagram of BSP-Ms

图4 BBR-BSP-Ms 倒置显微镜图Fig.4 Inverted microscope diagram of BBR-BSP-Ms
由图5 可见,采用SEM 观察所制备的BBRBSP-Ms,表面粗糙不平有褶皱,整体呈球状,圆整度较好,内部孔洞结构明显。

图5 BBR-BSP-Ms 扫描电镜图Fig.5 Scanning electron microscope image of BBR-BSP-Ms
由图6、7 可见,BSP-Ms 与BBR-BSP-Ms 电位经测定,均在-27.7mV 左右,表明稳定性良好。

图6 BSP-Ms 电位图Fig.6 Potential diagram of BSP-Ms
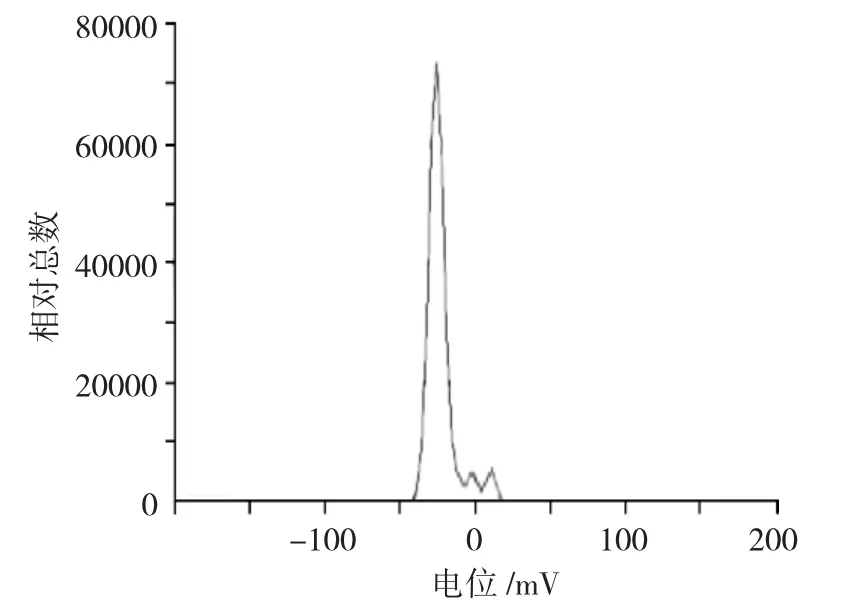
图7 BBR-BSP-Ms 电位图Fig.7 Potential diagram of BBR-BSP-Ms
2.3 BBR-BSP-Ms 布鲁克红外光谱分析
图8 为BBR、BSP、BSP-Ms、BBR-BSP-Ms 的红外光谱图。

图8 BBR、BSP、BSP-Ms、BBR-BSP-Ms 红外光谱Fig.8 Infrared spectrum of BBR、BSP、BSP-Ms、BBR-BSP-Ms
由图8 可见,BBR 粉末样品的光谱图中3344.06cm-1处的吸收峰为C-O 的倍频及芳环C-H振动峰,1505.66cm-1处的吸收峰为BBR 的芳环骨架振动峰,1272.71~1036.29cm-1为芳香脂肪醚的振动峰。
BSP 存在明显的特征吸收峰,3387.35cm-1处的吸收峰为O-H 的伸缩振动,2928.93cm-1处的吸收峰为-CH2-或-CH3中C-H 的伸缩振动,1637.55cm-1处的吸收峰为C-O 的不对称伸缩振动;1042cm-1和920cm-1处的吸收峰表示白及多糖的吡喃糖基化。
在BSP-Ms 的红外光谱中同时存在3267.33cm-1(O-H 的伸缩振动峰)、2924.50cm-1(C-H 的伸缩振动峰)、1637.16cm-1(C-O 的不对称伸缩振动峰)、1025.10cm-1和931.86cm-1等特征吸收峰,与BSP 二者图谱基本一致,表明BSP-Ms 中确实有BSP 的存在。
在BBR-BSP-Ms 红外光谱图中,3267.27cm-1处吸收峰与BSP-Ms 中3267.33cm-1处基本重合,2924.53cm-1、1025.97cm-1处的吸收峰与BSP 样品中2928.93cm-1、1025.10cm-1处吸收峰基本一致,证实BSP 的 存在,1510.22cm-1处的吸收峰与BBR 中1505.66cm-1处吸收峰基本重合,BBR 含量主要由1510cm-1附近吸收峰的峰形和峰强决定,此处的吸收峰为BBR 的芳环骨架振动峰,峰越强,峰形越细长,则混合物中BBR 的含量越高。
2.4 BBR-BSP-Ms 包封率和载药量
以吸光度A 对BBR 浓度C 进行线性回归,得标准曲线方程Y=0.056X-0.0231(R2=0.9995),结果表明,BBR 在4~14μg·mL-1浓度范围内与其吸光度有良好的线性关系。经测定计算得出,该方法回收率为96.99~101.22%,精密度、稳定性和重复性实验RSD 均小于1.69%。分别对3 批BBR-BSP-Ms(每批5g)进行测定,包封率为(86.92±0.03)%,载药量为(19.78±0.08)%,BBR-BSP-Ms 质量可控,载药性能较好,制备工艺可行。
2.5 BBR-BSP-Ms 体外释放实验
由图9 可见,在pH 值为7.4 的磷酸缓冲液条件下,BBR 原料药0.5h 内释药达45.76%,存在明显突释行为,4h 累积释放的药物达93.37%,后释放曲线趋于平缓;对比组BBR-Cs 水凝胶有一定缓释作用,12h 内累计释药量近90%;BBR 从BSP-Ms 中随时间缓慢释放,12h 时,BBR 在pH 值为7.4 的磷酸缓冲液中的累积释药量为12.30%,48h 内的累积释放率达82.12%,实验数据表明,药物包载于BSP-Ms后,具有明显的缓释作用效果,有利于创伤愈合、防止突释、延长病灶部位滞留发挥长效作用。

图9 体外释药曲线图Fig.9 Curve of drug release in vitro
3 结论
本文以BSP 微球包埋BBR 构建多孔生物粘附性微球,可发挥物理粘附、释药控制双重作用。采用乳化-交联法制备得到BBR-BSP-Ms,制备工艺稳定可行,微球分散性、悬浮性良好,生物相容性良好,载药量大,缓释效果明显,达到预期性能目标。