小麦新品系的赤霉病抗性及分子标记分析
2023-10-11王紫檀李浩阳赵文莎宋鹏博孙道杰张玲丽
王紫檀,李浩阳,赵文莎,宋鹏博,孙道杰,冯 毅,张玲丽
(西北农林科技大学农学院,陕西杨凌 712100)
小麦赤霉病(Fusarium head blight, FHB)是由禾谷镰孢菌(FusariumgraminearumSchw.)等引起的一种真菌病害。禾谷镰孢菌在小麦开花期侵染穗部小花,在籽粒灌浆成熟过程中沿穗轴扩展,产生并积累脱氧雪腐镰孢菌烯醇(deoxynivalenol, DON)等毒素,致使籽粒干瘪,严重时整穗死亡,对小麦的产量和品质造成负面影响;被毒素污染的籽粒还严重威胁人畜健康[1-4]。小麦赤霉病的高发区过去主要集中在长江中下游冬麦区和东北春麦区,近年来伴随气候变化和耕作方式的改变,发病区域逐步延伸至黄淮麦区[5]。生产上,防治赤霉病主要采用化学防治和种植抗病品种的方法,化学防治会造成严重的环境污染,因此种植抗病品种是防治小麦赤霉病最经济有效的措施[3]。在生产上,能直接利用的抗赤霉病小麦品种较少,选育抗赤霉病品种是当前黄淮麦区小麦育种的重要任务之一[6]。
小麦赤霉病抗性是由多基因控制的数量性状,目前正式命名的抗病基因有Fhb1~Fhb7,只有Fhb1[7]和Fhb7[8]被克隆,其中Fhb1被证实是效应最强且最稳定的抗病基因,在不同遗传背景下均可大幅减轻赤霉病病害[9]。Fhb1最早在我国地方小麦品种苏麦3号及其衍生品系宁7840中被发掘,已被国内外广泛用于小麦抗赤霉病育种[10-12]。苏麦3号是全球普遍公认的高抗赤霉病品种[12],已发现其携带有多个抗赤霉病基因/QTLs,其3BS染色体臂上的基因Fhb1既抗赤霉病菌扩展又抗赤霉毒素DON的积累[13],其6BS染色体臂上的基因Fhb2是一个抗扩展的主效基因[14],其5AS染色体臂上的基因Fhb5是一个抗侵染的主效位点[15],其2DL染色体臂上的QFhs.crc-2DL也具有一定的抗病贡献率[16]。苏麦3号赤霉病抗性强、稳定且持久,但其春性较强,易遭冻害,植株较高且茎秆纤细易倒伏,重感条锈病、叶锈病和白粉病等病害,产量水平较低,籽粒小且呈粉质,品质较差,对黄淮南部冬麦区的生态环境适应性较差,作为育种亲本材料在黄淮南部冬麦区很难被直接利用[17]。当前,我国黄淮南部冬麦区的小麦生产上急需兼抗赤霉病和条锈病的新品种,育种上迫切需要兼抗赤霉病和条锈病的优异亲本材料。小麦新品系979-5是本课题组从黄淮南部冬麦区大面积推广种植的品种西农979中系选而成,属弱冬性,株高较低(75 cm左右),茎秆粗壮,抗倒伏能力强,中抗条锈病和叶锈病,籽粒大长呈角质,为优质强筋高产类型,但中感赤霉病[18]。为创制适宜黄淮南部冬麦区育种亲本材料,本课题组于2012年组配了苏麦3号与979-5的杂交组合,利用分子标记辅助选择和田间接种鉴定等技术,创制出20个携带有Fhb1、Fhb2及Fhb5基因的优异育种亲本材料[19]。2016年起,利用这些优异亲本材料,分别与本课题组育成的高产优质新品种西农235、西农282和西农226组配杂交组合,从其后代中选育出13个遗传稳定的抗赤霉病新品系。目前部分新品系正在参加黄淮南部冬麦区的多点适应性试验。本研究以这些小麦新品系为材料,在鉴定其赤霉病和条锈病抗性及主要农艺性状的基础上,分析其抗赤霉病的遗传基础,为小麦新品系的研究和利用提供理论依据。
1 材料与方法
1.1 试验材料
参试的13个抗赤霉病的小麦新品系(表1),是本课题组前期以高抗赤霉病的亲本材料k10、k12和k13[19]为母本,分别与优质高产新品种西农235、西农282和西农226杂交,综合利用SSR分子标记辅助选择、赤霉病麦粒菌地表接种和单花滴注法接种鉴定、条锈病菌田间接种鉴定、大群体系谱选择等技术选育而成。对照材料分别为矮抗58(高感赤霉病,高感条锈病)、979-5(中感赤霉病,中抗条锈病)和苏麦3号(高抗赤霉病,高感条锈病)。
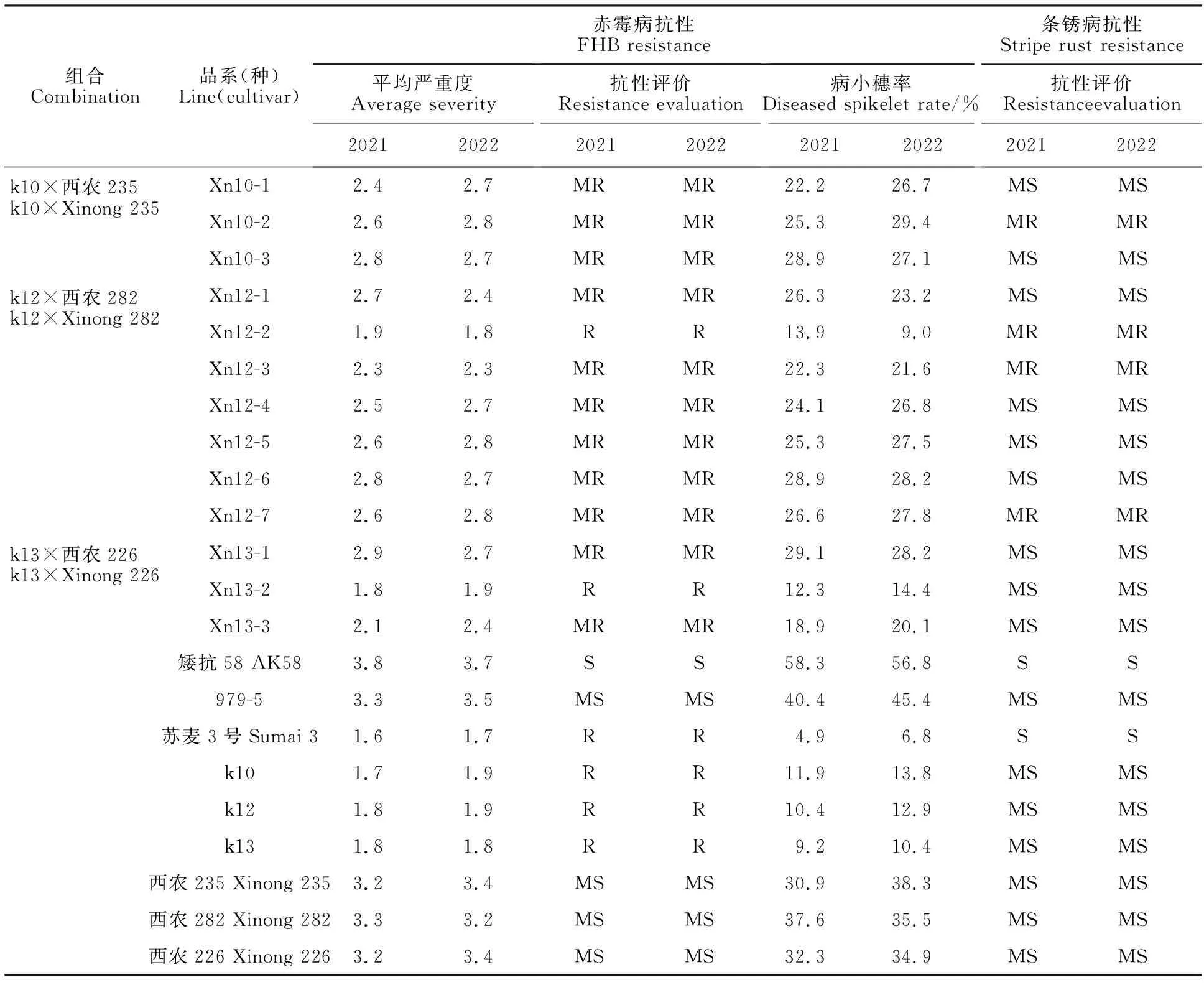
表1 参试材料的赤霉病和条锈病抗性Table 1 Resistance to FHB and stripe rust in tested materials
所有参试材料均进行连续两年的试验,分别于2020年10月12日和2021年10月11日播种于西北农林科技大学小麦育种试验田。每个品系(种)种植3行,株距0.07 m,行距0.27 m,行长2.0 m。在小麦整个生长期间除不进行病害防治外,其余管理措施同当地大田。
1.2 小麦赤霉病田间接种和鉴定
试验所用的赤霉病4个强致病力菌株(F0980、F1312、F0609和F0301)与国家小麦新品种区域试验鉴定所用相同,由河南农业大学殷贵鸿研究员惠赠。采用单花滴注法接种:将预先培养的4个菌株孢子液混合并稀释孢子浓度为1×105·mL-1,在小麦扬花期取10 μL的悬浮液注入小麦穗中上部第4个小穗最外侧的小花内,随即喷湿接种穗,并套袋保湿72 h。每个品系接种20个单穗,两个重复。
在接种21 d后调查每个接种穗的发病小穗数和总小穗数,计算平均病小穗率和平均严重度。病小穗率=发病小穗数/总小穗数×100%。记载标准参照《中华人民共和国农业行业标准NY/T 2954-2016:小麦区域试验品种抗赤霉病鉴定技术规程》[20],依据平均严重度划分抗病等级:抗病(R)(0<平均严重度<2.0),中抗(MR)(2.0≤平均严重度<3.0),中感(MS)(3.0≤平均严重度<3.5),感病(S)(平均严重度≥3.5)。
1.3 小麦条锈病田间接种和鉴定
分别于2020年3月20日和2021年3月15日接种条锈病菌,所用3个条锈病强致病力菌株CYR32、CYR33和CYR34,与国家小麦新品种区域试验鉴定所用相同,由甘肃省农科院提供。于田间空气湿度较大的傍晚进行接种,将条锈菌混合小种与淀粉以1∶1 000比例混匀,采用小麦叶心抖粉法,于每个材料的第一行接种20株。当条锈病进入盛发期时,即感病对照品种的病害最大严重度达到90%~100%,对发病情况进行田间调查,参照《小麦抗条锈病评价技术规范》[21]分级为:抗病(R,叶片有坏死斑,有零星的孢子),中抗(MR,叶片褪绿,有中等大小的孢子堆),中感(MS,叶片大片褪绿,有大片孢子堆),感病(S,叶片不褪绿,且出现大片孢子堆)。
1.4 农艺性状调查
在小麦生长发育的关键时期,按农艺性状的记载标准,分别调查幼苗的耐寒性、开花期、株高、穗长、穗粒数、籽粒大小(包括千粒重、粒长、粒宽)等主要农艺性状。除抗寒性和开花期按群体性状记载外,其余性状每个材料调查10个单株,取其平均值。
1.5 抗性基因检测
采用CTAB法[22]提取苗期小麦鲜叶基因组DNA。
选用已报道的与苏麦3号抗赤霉病基因Fhb1、Fhb2、Fhb5和QFhs.crc-2DL分别紧密连锁的分子标记进行检测,引物及扩增程序同相应的参考文献(表2)。引物由陕西中科羽瞳生物科技有限公司合成。PCR反应体系为20 μL:10 μL 2×Taq Master Mix for PAGE(诺唯赞,南京),上、下游引物各1 μL(10 μmol·L-1),1 μL模板(50 ng·μL-1),7 μL ddH2O。除标记TaHRC-GSM的PCR扩增产物用2.0 %琼脂糖凝胶外,其余标记的PCR扩增产物均用8 %非变性聚丙烯酰胺凝胶电泳分析。

表2 选用的抗赤霉病基因/QTL连锁的分子标记Table 2 Selected molecular markers linked to FHB resistance genes/QTL
1.6 数据处理与分析
所有数据为2年平均值,使用SPSS 20.0对数据进行分析。
2 结果与分析
2.1 参试品系的赤霉病抗性分析
由表1可知,13个参试新品系的赤霉病抗性水平均高于对照中感品种西农979-5,其中2个品系(Xn12-2和Xn13-2)的表现为抗,平均病小穗率为11.5%、13.4%;平均严重度均为1.9,抗性水平同苏麦3号;其余11个品系的赤霉病抗性表现均为中抗,平均病小穗率均小于30%。
2.2 参试品系的条锈病抗性分析
13个参试品系中4个品系表现为中抗条锈病,其余9个品系表现为中感条锈病。其中,Xn12-2抗赤霉病,中抗条锈病;Xn10-2、Xn12-3和Xn12-7中抗赤霉病,中抗条锈病(表1)。这些兼抗赤霉病和条锈病的新品系可作为黄淮麦区优异育种亲本材料。
2.3 参试品系的主要农艺性状分析
从表3可以看出,参试品系均具有耐寒、矮秆、长穗、高粒重的特点。其中,株高为67~82 cm;除品系Xn10-3开花期特别早外(与苏麦3号相同),其余参试品系的开花期基本与西农979相同。在籽粒性状中,参试品系的千粒重为39.2~50.2 g,显著高于苏麦3号;粒宽3.40~3.64 mm,粒长在6.44~7.53 mm之间,品系间差异较为名显(图1)。以上结果表明,参试部分品系不仅具有良好的赤霉病和条锈病抗性,其主要农艺性状能满足育种目标要求。
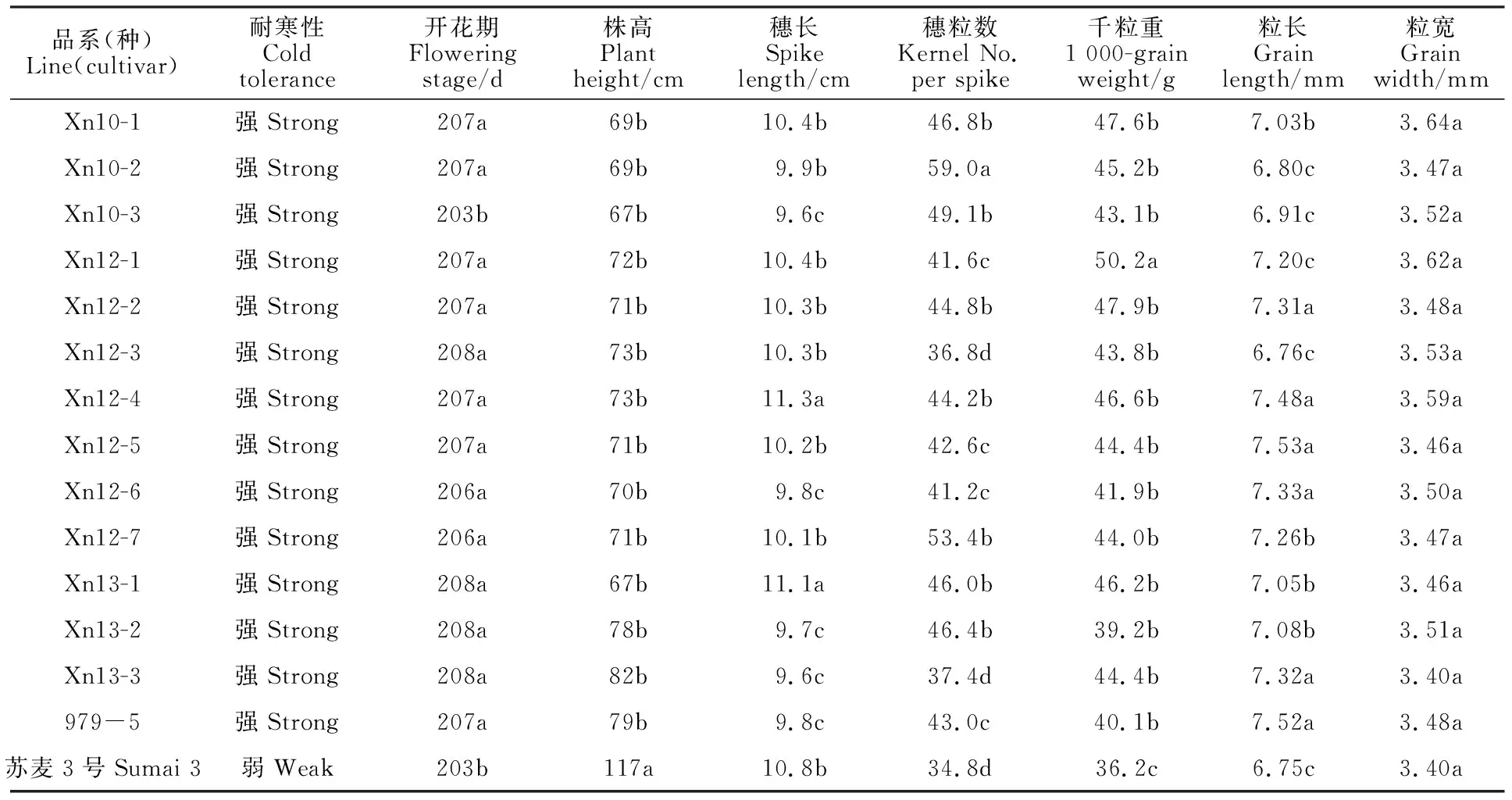
表3 新品系的主要农艺性状Table 3 Main agronomic traits of the new lines

a和b图分别为部分材料10个粒籽的长度和宽度。a and b show the length and width of 10 grains of partial lines, respectively.图1 部分材料的籽粒大小Fig.1 Grain size of the partial lines
2.4 参试品系Fhb1基因分析
利用已报道的与抗赤霉病基因Fhb1紧密关联的5个分子标记TaHRC-GSM、Xgwm493、Xgwm533、Xbarc133和Xbarc147对参试品系的亲本进行了多态性分析发现,亲本材料k10、k12和k13与亲本材料西农235、西农282和西农226在Xgwm493位点扩增片段大小一致,表现为单态,其余4个标记表现为多态。利用4个具有多态性的标记对参试品系进行分析发现,在TaHRC-GSM标记位点,11个品系检测到苏麦3号的特异条带,Xn10-3和Xn12-1两个品系中未检测到苏麦3号的特异条带(表4,图2a);在Xbarc147标记位点,10个品系中检测到苏麦3号的特异条带;在Xbarc133标记位点,3个品系中检测到苏麦3号的特异条带;在Xgwm533标记位点,6个品系中检测到苏麦3号的特异条带。这表明,这些抗赤霉病新品系中,84.6%具有苏麦3号Fhb1基因的TaHRC-GSM标记,76.9%具有苏麦3号Xbarc147标记位点,9个品系同时具有苏麦3号TaHRC-GSM和Xbarc147标记位点。
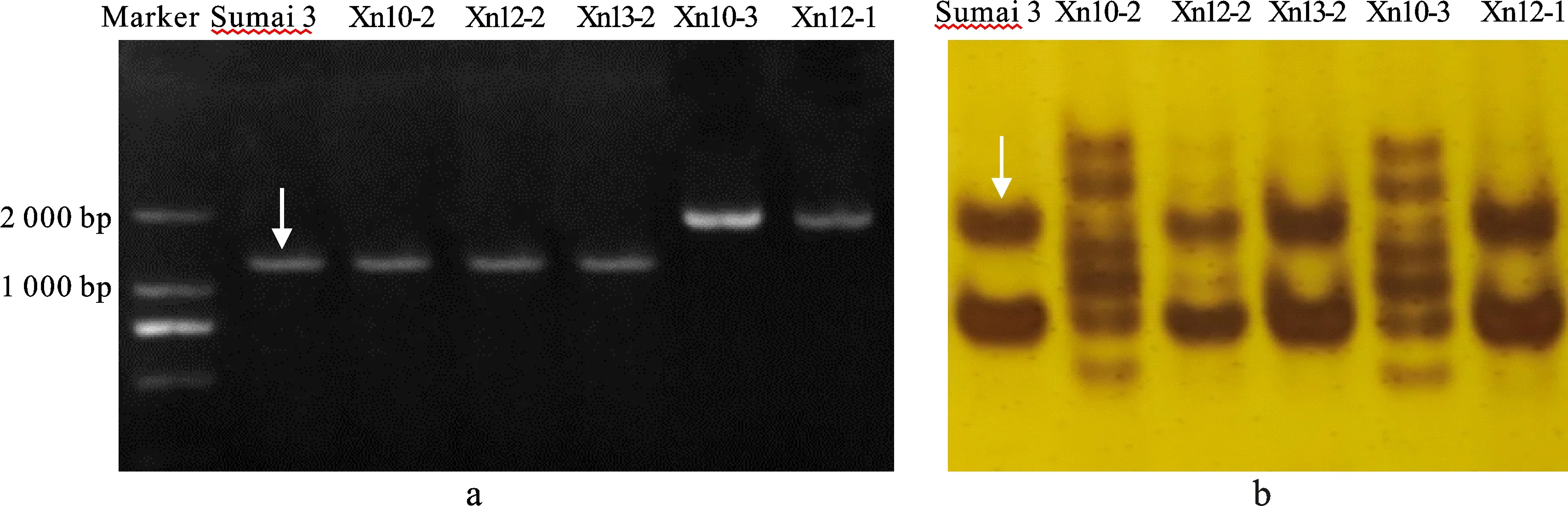
a和b图分别为分子标记TaHRC-GSM和Xbarc147的检测结果;箭头指示苏麦3号的特征条带。a and b show the detection results of molecular marker TaHRC-GSM and Xbarc147, respectively. Arrows indicate the specific bands for Sumai 3.图2 部分参试材料3BS染色体臂上的分子标记检测结果Fig.2 Molecular marker detection on 3BS chromosome of some test materials
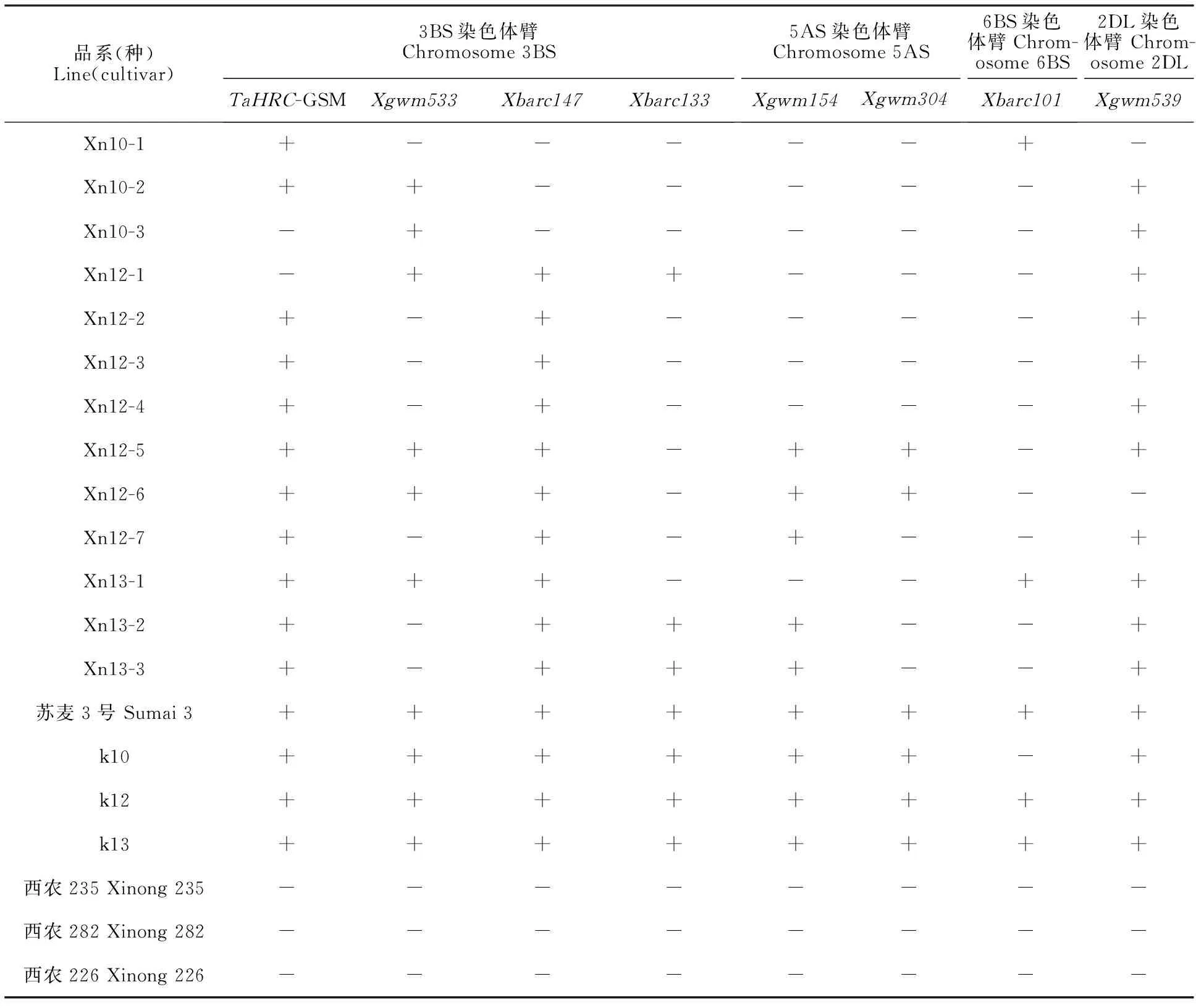
表4 参试材料的抗赤霉病基因/QTL连锁分子标记检测结果Table 4 Detection results of gene/QTL linked molecular markers for FHB resistance in the tested materials
2.5 参试品系Fhb2基因位点的标记分析
利用与抗赤霉病基因Fhb2紧密连锁的3个分子标记分析发现,亲本材料k10、k12和k13与西农235、西农282和西农226在Xgwm133和Xgwm644位点扩增片段大小一致,表现为单态,在标记Xbarc101位点表现为多态。在Xbarc101位点,2个品系(Xn10-1和Xn13-1)检测到苏麦3号的特异条带(表4,图3a),其余品系中未检测到苏麦3号的特征带谱。

a、b和c图分别为分子标记Xbarc101、Xgwm154和Xgwm539的检测结果。箭头指示苏麦3号的特征条带。a, b and c show the detection results of molecular marker Xbarc101, Xgwm154 and Xgwm539, respectively. Arrows indicate the specific bands for Sumai 3.图3 部分参试材料分子标记检测结果Fig.3 Molecular marker detection results of some test materials
2.6 参试品系Fhb5基因位点的标记分析
利用与抗赤霉病基因Fhb5紧密连锁的4个分子标记分析发现,亲本材料k10、k12和k13与西农235、西农282和西农226在Xgwm293和Xbarc186位点扩增片段大小一致,表现为单态,在Xgwm304和Xgwm154位点表现为多态。进一步分析发现,在Xgwm304标记位点,Xn12-5、Xn12-6两个品系中检测到苏麦3号的特异条带;在Xgwm154标记位点,5个品系中检测到苏麦3号的特异条带(表4,图3b)。
2.7 参试品系QFhs.crc-2DL基因位点的标记分析
利用与抗赤霉病基因QFhs.crc-2DL紧密关联的2个分子标记分析发现,亲本材料k10、k12和k13与西农235、西农282和西农226在Xwmc41位点扩增片段大小一致,表现为单态,在Xgwm539位点表现为多态。进一步分析发现,在Xgwm539位点,11个品系中检测到苏麦3号的特异条带(表4,图3c)。
3 讨论
缺乏适于在我国黄淮南部麦区大面积推广的抗赤霉病品种,是小麦赤霉病在黄淮南部麦区发病逐年加重的重要原因[30],培育抗赤霉病品种已成为该区小麦育种的主要目标之一[31-32]。苏麦3号是世界公认的抗赤霉病品种,具有多个抗赤霉病基因/QTLs,其中Fhb1、Fhb2、Fhb5和QFhs.crc-2DL等受到广泛应用[2]。本课题组以苏麦3号为抗源,采用分子标记辅助选择和病原菌接种鉴定的方法,创制出适应黄淮南部麦区生态条件的、携带有Fhb1抗病基因位点的抗赤霉病育种亲本材料[19],2016年以这些亲本材料为基础,分别与我国黄淮南部冬麦区的高产优质广适新品种西农226、西农282和西农235等组配杂交组合,采用系谱选择法,自F2~F6代持续进行赤霉病抗性基因分子标记辅助选择、病原菌田间土表接种和单花滴注法鉴定,育成赤霉病抗性优异且主要农艺性状优良的13个新品系。
综合赤霉病和条锈病抗性鉴定、分子标记检测和主要农艺性状分析,参试的13个新品系不仅具有较好的农艺性状、优异的条锈病抗性,且赤霉病抗性水平达抗或中抗。其中,11个品系含有苏麦3号的TaHRC-GSM位点,可能携带抗性基因Fhb1,其中2个品系(Xn12-2和Xn13-2)赤霉病抗性同苏麦3号,表现为抗。这也进一步证明,TaHRC-GSM是抗性基因Fhb1的可靠有效选择标记[7]。这11个品系同时还具有苏麦3号其它位点的优异等位变异,如Xn12-2具有QFhs.crc-2DL的优异等位变异,Xn13-2具有Fhb5和QFhs.crc-2DL的优异等位变异,Xn13-1具有Fhb2和QFhs.crc-2DL的优异等位变异。但中抗赤霉病的品系Xn10-3和Xn12-1却没有苏麦3号的TaHRC-GSM标记位点,仅携带苏麦3号的Xgwm533和Xgwm539位点的标记,其抗性来源有待进一步研究。本研究选用的参试新品系,其赤霉病抗性水平表现好且主要农艺性状较好的根本原因,可能与本课题组近10余年来一直坚持“自主创新亲本材料、强化早代大群体多途径赤霉病抗性鉴选技术”的应用密不可分:(1)创制适宜黄淮冬麦区的优异抗赤霉病k系列亲本材料[19],并选用赤霉病田间抗性较好的育成品种(西农235、西农282、西农226等)组配杂交组合,为优良抗赤霉病新品系(种)选育奠定良好的遗传基础;(2)F2大群体(每个组合2 000~3 000株)利用麦粒菌及玉米秸秆结合进行地表接种,苗期条锈病菌接种鉴定,开花期选优株单花滴注法接种,综合赤霉病和条锈病抗性进行优良单株选择;(3)中选单株的F3-5株系群,根据收获的种子量尽可能保证较大的群体,继续上述的抗性鉴选,中选单株继续赤霉病抗性基因/QTLs的分子标记分析,了解其抗性遗传背景。持续两年的田间种植观察发现,个别参试品系还中抗叶锈病(田间自然发病下),但叶尖枯现象较重,可能影响籽粒产量,因此还需要多年多点产量比较试验以进一步改良。
