小鼠诱导多能干细胞向雄性生殖细胞样细胞诱导分化的研究〔1〕
2023-10-10赵振理胡少华万智盛卜威振陈松强韩天红陆毅群
赵振理,胡少华,万智盛,卜威振,陈松强,韩天红,陆毅群
(1.海南省妇女儿童医学中心,海南 海口 570206;2.复旦大学附属儿科医院,上海 201102)
不孕症是世界范围内育龄夫妇常见的公共卫生问题之一。研究[1]指出,全球8%~12%的育龄夫妇受此问题困扰。在不孕的育龄夫妇中,男性因素占50%左右,因无精症所导致的不育占10%~50%[2-4]。通过对干细胞进行诱导培养获取精子细胞可以使男性不育患者成功生育具有自身遗传物质的后代。由于诱导多能干细胞(iPSCs)具有分化为体内所有类型细胞的可能,所以它向生殖细胞的转化成为了研究热点。本研究拟通过对小鼠iPSCs进行诱导培养,从而获取原始生殖细胞样细胞(PGCLCs),探讨其向生殖细胞转化的潜能,并为后续精子细胞的获得奠定基础。
1 材料与方法
1.1 材料
1.1.1 小鼠iPSCs细胞株
小鼠iPSCs细胞株购买于美国赛默飞世尔科技公司。
1.1.2 主要试剂与仪器
高糖型改良依格尔(DMEM)培养基、胎牛血清(SH30070.03)(Hyclone,北美);白血病抑制因子(LIF)(美国默克);睾酮(T5411)(美国Sigma);彩色预染蛋白标记(10-200 kDa)(M227-01)(北京康润诚业生物公司);蛋白印迹膜再生液(ZN1923,北京博奥通公司);PCR引物均由上海生工合成;RNA提取试剂(日本Takara);iScript cDNA合成试剂盒(1708891EDU)(美国伯乐);3K15型低温高速离心机(Sigma公司);蛋白质印迹系统(型号:CriterionTM电泳槽,Trans-Blot@转印槽)(美国伯乐公司);ABI 7500实时荧光定量聚合酶链式反应仪(美国ABI公司)。
1.2 实验方法
1.2.1 iPSCs细胞传代培养
在高糖DMEM培养基中对小鼠iPSCs进行传代培养。当细胞融合至90%时,弃去旧培养基,用2 mL磷酸缓冲盐溶液(PBS)洗涤细胞2次,弃去PBS后加入2 mL 0.25%胰蛋白酶-0.02%乙二胺四乙酸(EDTA)混合消化液,置显微镜下观察,约30 s,当细胞变圆后迅速加入2 mL完全培养基终止消化,轻轻吹打,收集细胞。用胰蛋白酶-EDTA消化后,将约1×106个iPSCs细胞转移到10 cm培养皿中,添加含有10 mL不含LIF的培养基孵育。在第5天换含睾酮(1 μmol/L)的完全培养基继续孵育,48 h后更换培养基,每2天更换一次培养基,将细胞继续培养两周。
1.2.2 蛋白质印迹法
采用蛋白质印迹法(Western blot)对蛋白水平进行鉴定。细胞总蛋白提取:将制备的细胞悬液接种于6孔板中,待细胞融合至90%时,弃上清,用预冷的PBS洗涤细胞样本后加入1 mL细胞组织快速裂解液(RIPA)充分裂解、离心,吸取上清至一预冷的Eppendorf管中,即为抽提得到的细胞蛋白。通过二辛可酸法(BCA)进行蛋白定量。凝胶电泳及转膜:根据待测蛋白分子量的不同配制压缩胶,灌制十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)。将细胞内总蛋白加入泳道进行电泳,放入转膜缓冲液中浸泡后恒压转膜,观察膜上蛋白。显影:用三羟甲基氨基甲烷盐缓冲液(TBST)清洗膜上残余液体,加入一抗(一抗及稀释比见表1),封口过夜后加入适当浓度二抗(二抗及稀释比见表1),封口孵育。蛋白表达量使用Image Pro Plus 6.0软件对光密度值进行分析,蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值。
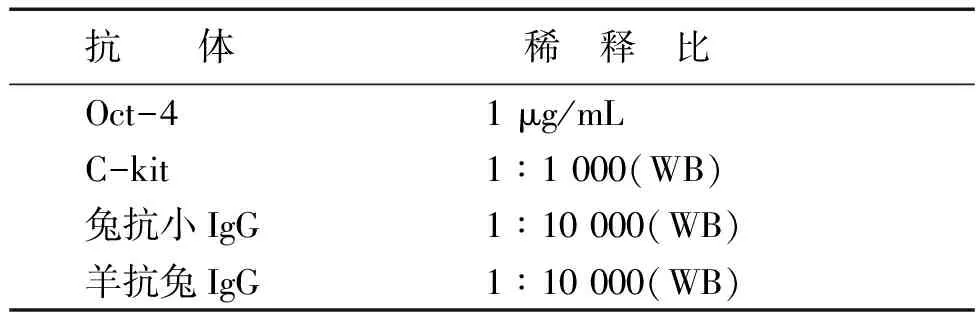
表1 抗体及稀释比
1.2.3 实时定量PCR
将制备的细胞悬液接种于6孔板中,每孔细胞数为5×105,待细胞融合至90%时,弃上清,每孔加入0.5 mL总RNA提取剂(Trizol),反复吹打至澄清,并转移至Eppendorf管。用焦碳酸二乙酯水(DEPC)10 μL溶解RNA,吹打混匀,得到总RNA溶液,取2 μL样品,使用Nanodrop 2000测定mRNA浓度和纯度。cDNA合成及实时定量PCR采用20 μL体系,扩增后结果采用2-ΔΔCt进行计算,所用引物见下表2。
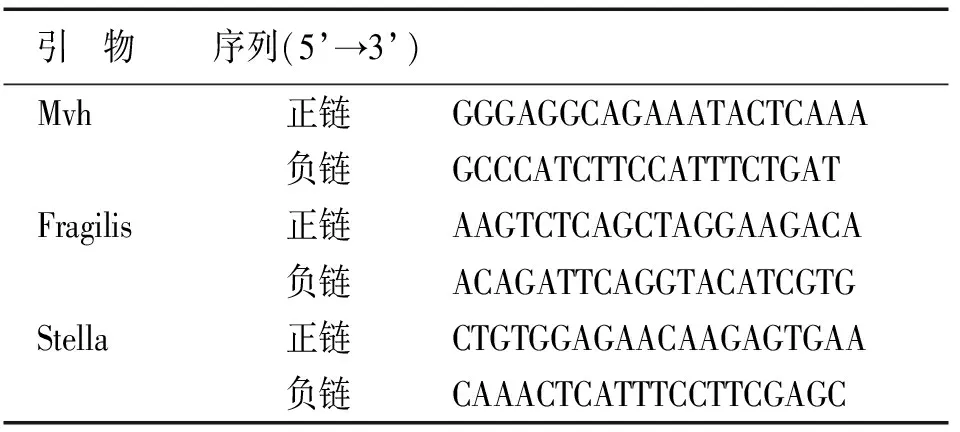
表2 RT-PCR引物
2 结 果
2.1 Western blot对iPSCs鉴定结果
Western blot结果显示,由iPSCs体外诱导分化获得的生殖细胞样细胞特异性表达Oct-4和C-ki蛋白(见图1)。

图1 Western blot检测iPSCs细胞Oct-4和C-ki蛋白的表达
2.2 实时定量PCR对iPSCs进行鉴定
实时定量PCR结果显示,由iPSCs体外诱导分化获得的生殖细胞样细胞特异性表达Mvh和Fragilis及Stella mRNA(见图2)。
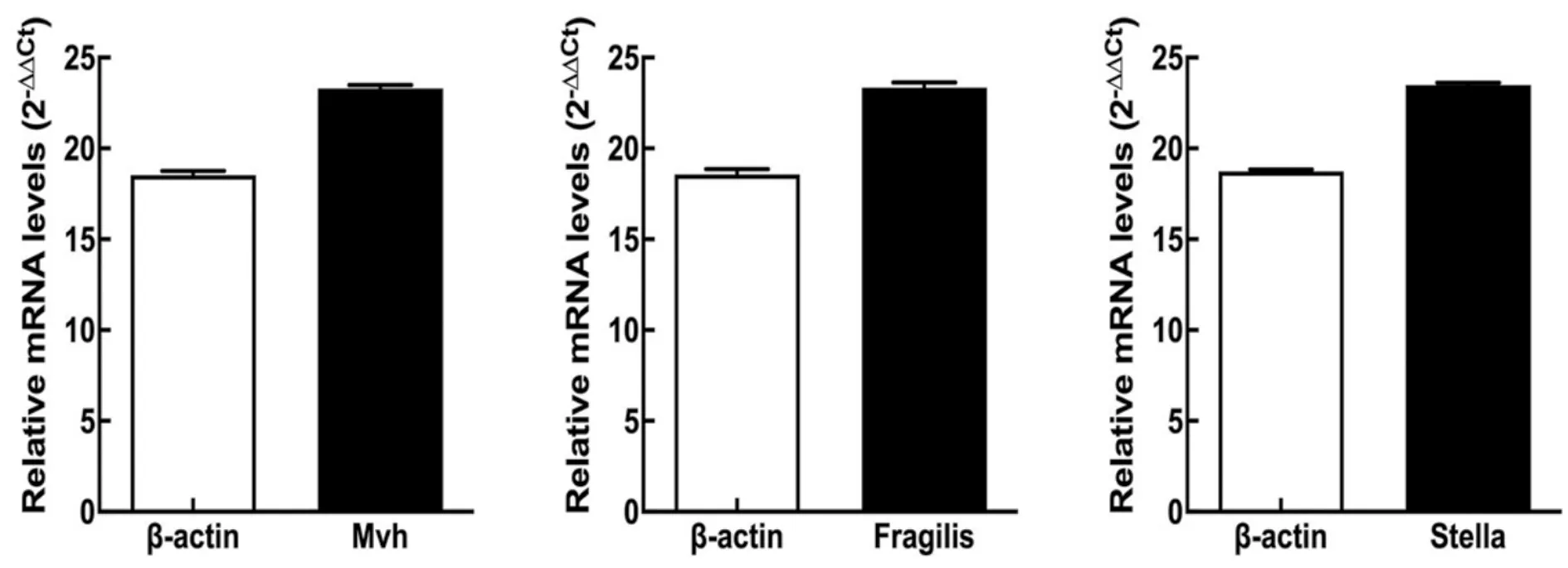
Relative mRNA levels为mRNA相对表达水平
3 讨 论
生殖健康是人类社会持续发展的重要因素,在不孕症中占主要因素的男性不育是急需解决的一大问题。遗传疾病、泌尿生殖道感染、性腺功能减退、隐睾、精索静脉曲张、射精障碍、免疫因素和全身性疾病等均可导致男性不育[5]。无精症分为梗阻性无精症和非梗阻性无精症,其中非梗阻性无精症患者占所有男性不育症患者的10%~15%[6]。目前梗阻性无精症患者通过外科手术治疗可以获得成熟精子并成功受孕,非梗阻性无精症患者无法通过手术治疗,而需采用供精人工授精或供精试管婴儿技术,但所生育的后代中不含有父亲自身的遗传物质,大部分患者不能接受。如何解决这一难题,目前仍处于实验阶段。近年来,新兴的干细胞治疗领域迅速成为再生医学的新时代,干细胞的多种潜能成为各个医学领域研究的重点[7]。干细胞在不孕症方面的相关研究主要集中在通过对干细胞诱导培养而获取精子细胞,并采用卵泡浆内单精子显微注射技术(ICSI)获得胚胎,此方式可以成功获得具有父亲自身遗传物质的后代[8-9]。
在人体组织发现的几种类型的干细胞中,骨髓间充质干细胞(BMSC)因其具有多系分化潜能、低免疫原性等受到了较多的关注。Nayernia等[10]于2006年提取小鼠的BMSC并对其进行诱导培养,发现部分BMSC表达有PGCLCs的标志物。首次证实了BMSC可以分化为生殖细胞,但并未进一步分化为精母细胞和精子细胞。有学者[11-13]同样发现,对BMSC进行诱导培养,虽然可以获得表达生殖细胞标志物的干细胞,但最终无法成功获得单倍体精子细胞,而且随着年龄的增长,BMSC的数量、分化潜能和生存能力会逐渐降低。根据现有研究结果,通过对BMSC进行诱导培养可能无法获得单倍体的精子细胞,而BMSC主要存在于骨髓中,获取比较困难,进一步限制了它在向生殖细胞转化方面的应用。
多能干细胞(PSCs)包括胚胎干细胞(ESCs)和iPSCs,它具有分化为成体内所有类型细胞的可能。但临床上非梗阻性不育患者自身的ESCs已不可能重新获得,并且ESCs的应用存在相关伦理问题,因此无法通过患者自身ESCs诱导培养获取成熟精子。
Takahashi等[14-15]于2006年将四种转录因子(OCT3/4,c-MYC,SOX2和KLF4)诱导到小鼠成纤维细胞中,首次产生了小鼠iPSCs,并于第二年使用同样的转录因子诱导产生了人诱导多能干细胞(hiPSCs),转化效率为0.01%~0.02%。随着技术的发展,目前iPSC可以通过多种方法从多种细胞来源高效生成[16-18]。通过不同来源的细胞诱导分化而来的iPSCs同样具有ESCs的特性,并且可分化为不同类型的细胞[19-21]。由于iPSCs具有无限增殖和分化为三个胚层的能力,Eguizabal等[22]体外诱导培养hiPSCs,结果显示其具有完整和强大的减数分裂能力,但需要进一步的分析来评估减数分裂细胞的发育能力。
本实验对小鼠来源的iPSCs进行诱导培养,对获得的细胞进行Western blot鉴定发现其可特异性表达Oct-4及C-kit蛋白;另外,通过实时定量PCR鉴定发现其可特异性表达Mvh,Fragilis及Stella mRNA。结果提示通过对小鼠iPSCs的诱导培养,成功获得了PGCLCs,这为进一步的实验奠定了良好的基础。
