葵花籽粕绿原酸的提取与纯化工艺研究
2023-10-10李祎熊犍崔春
李祎,熊犍,崔春
(华南理工大学 食品科学与工程学院,广州 510641)
葵花籽经过压榨或直接浸提法榨取油脂后所剩残渣称为葵花籽粕,它是继豆粕、双低菜籽粕和棉籽粕之后的第四大油粕。目前,我国对葵花籽的精深加工仅限于提取油脂,加工副产物葵花籽粕仅少部分用作动物饲料,其余直接抛弃,未能得到充分和有效的利用[1]。
葵花籽粕中含有2%~4%(取决于含壳量)的绿原酸。绿原酸是一种重要的生物活性膳食多酚,具有抗氧化、抗菌、降血脂、降血压、降血糖等多种重要的药理作用,在食品、药品和化妆品领域有一定应用价值[2-4]。目前工业生产绿原酸主要以价格昂贵的金银花(绿原酸含量为4.29%~6.07%)和杜仲(绿原酸含量为2%~5%)为原料[5-6],与之相比,葵花籽粕价格低廉且产量高,以葵花籽粕为原料可降低绿原酸的生产成本。
提取绿原酸的方法主要为溶剂浸提法,提取剂为水或者有机溶剂[7]。溶剂浸提法的工艺简单,但在浸提过程中,原料中的多糖、蛋白质等杂质也会溶出,导致产物的纯度降低,需要进一步纯化[8]。绿原酸的纯化方法包括有机溶剂萃取法[9-10]、大孔树脂柱层析法[11-13]、膜分离法等[14-15]。大孔树脂柱层析法和膜分离法均对提取液预处理要求高、工艺耗时长,且膜和树脂清洗困难,因此对于大规模生产而言,有机溶剂萃取法是最合理的方法。
本文选择乙醇浸提法作为提取葵花籽粕绿原酸的方法,通过单因素实验和响应面设计实验优化工艺条件。为了提高绿原酸的纯度,对粗提绿原酸进行乙酸乙酯萃取,采用高效液相色谱法鉴定最终产物的纯度,对比了常规乙酸乙酯萃取法与逆流乙酸乙酯萃取法的纯化效果。本文确定了提取与纯化葵花籽粕绿原酸的最佳工艺,提高了葵花籽粕的综合利用价值,为我国葵花籽粕深加工及综合利用提供了理论支撑。
1 材料与方法
1.1 材料与试剂
葵花籽粕(含壳)。 绿原酸标准品(≥98%):购自上海源叶生物科技有限公司;甲醇、乙腈(均为色谱纯):购自RCI Labscan Ltd.;其他试剂均为市售分析纯。
1.2 主要仪器与设备
AL204型万分之一天平 梅特勒-托利多国际股份有限公司;pH-3E型 pH计 上海雷磁仪器厂;UV-754型紫外分光光度计 淄博森源电气有限公司;Spectra Max 190型全波长酶标仪 美国Molecular Devices公司;RE-52A型旋转蒸发仪 上海申生科技有限公司;SCIENTZ-18N型冷冻干燥机 上海医用分析仪器厂;HYP-308型消化炉、KDN-103F型自动定氮仪 上海纤检仪器有限公司;GL-21M型高速冷冻离心机 长沙湘智离心机仪器有限公司;LC100型高效液相色谱仪 上海伍丰科学仪器有限公司。
1.3 实验方法
1.3.1 原料预处理
将葵花籽粕原料经高速粉碎机粉碎,过40目筛,按照料液比1∶3加入正己烷脱脂8 h后在通风橱内过夜风干。
1.3.2 葵花籽粕绿原酸提取与纯化工艺流程
葵花籽粕→粉碎→过40目筛→乙醇溶液浸提→离心,保留上清液→浓缩→乙酸乙酯萃取→浓缩、冷冻干燥→葵花籽粕绿原酸。
1.3.3 提取绿原酸工艺优化
在控制其他因素相同的条件下,分别考察料液比(1∶5、1∶10、1∶15、1∶20、1∶25)、浸提时间(1,2,3,4,5,6 h)、浸提温度(30,40,50,60,70 ℃)、乙醇溶液浓度(0%、20%、30%、40%、50%、60%、70%)和浸提次数(1,2,3次)各单因素对绿原酸得率的影响。每组做3次平行。
在单因素实验结果的基础上,运用Design-Expert 12.0.3.0进行响应面优化实验设计,以浸提温度、浸提时间和料液比为自变量,以绿原酸得率为响应值,采用三因素三水平响应面分析法设计实验进行组合优化。响应面设计因素与水平见表1。

表1 响应面实验因素与水平
1.3.4 纯化绿原酸工艺优化
对比常规乙酸乙酯萃取和乙酸乙酯逆流萃取这两种工艺的纯化效果。为了节省乙酸乙酯的用量,先将提取液浓缩至原体积的1/5,再进行萃取。具体操作步骤如下。
常规乙酸乙酯萃取:将浓缩后的提取液pH调至4.0,加入等体积的乙酸乙酯,室温下使用磁力搅拌器搅拌一定时间,然后将混合液置于分液漏斗中,静置分层后分离上下层,上层(乙酸乙酯相)保存,下层(水相)再次萃取,共进行3次,每次的萃取时间分别为0.5,1,1.5 h。3次萃取后保留乙酸乙酯相,用旋转蒸发仪除去乙酸乙酯相中大部分乙酸乙酯,加水稀释,冷冻干燥后得到绿原酸粗品。
乙酸乙酯逆流萃取:基于上述乙酸乙酯萃取方法的乙酸乙酯用量较大,为了在工业生产中节约成本,探索了逆流萃取工艺进行纯化,将乙酸乙酯循环使用,其余操作与常规乙酸乙酯萃取一致,流程见图1。用旋转蒸发仪除去乙酸乙酯相中大部分乙酸乙酯,加水稀释,冷冻干燥后得到绿原酸粗品。

图1 葵花籽粕绿原酸纯化工艺流程
1.3.5 检测与分析方法
绿原酸含量采用高效液相色谱法测定[16]。蛋白质含量采用凯氏定氮法测定[17]。总糖含量采用苯酚-硫酸法测定[18]。
根据公式(1)、公式(2)和公式(3)计算绿原酸得率、提取率和萃取率。

(1)

(2)

(3)
式中:c为测得的稀释液中绿原酸浓度,μg/mL;v为浸提液体积,mL;m为原料质量,g;AU为乙酸乙酯相溶液中绿原酸的含量,g;AL为原浸提液中绿原酸的含量,g。
1.4 数据处理
采用Excel、Origin 2021 及SPSS 22 等进行数据的整理、分析和作图,组间比较采用单因素方差分析(One-Way ANOVA)和Duncan 检验,P<0.05 表示有统计学差异。
2 结果与分析
2.1 提取绿原酸单因素实验
料液比、浸提时间、浸提温度和乙醇浓度是对绿原酸提取率影响最大的4个因素,这4个因素若控制得当可提高绿原酸的提取率,并在一定程度上减少成本、缩短工艺时长、节约能耗。分别考察料液比(1∶5、1∶10、1∶15、1∶20、1∶25)、浸提时间(1,2,3,4,5,6 h)、浸提温度(30,40,50,60,70 ℃)、乙醇溶液浓度(0%、20%、30%、40%、50%、60%、70%)和浸提次数(1,2,3次)各单因素对绿原酸得率的影响,结果见图2。

图2 不同因素对绿原酸得率及提取率的影响
由图2中A可知,随着料液比的增大,绿原酸得率先增大后趋于平稳。当料液比达到1∶15时绿原酸得率达到平稳期,为(2.28±0.05)%,提取率为(77.32±1.80)%。料液比增大虽有利于绿原酸溶出,但料液比过高会大大增加浓缩过程中的能耗。综上考量,选择料液比为1∶15进行下一步优化。
由图2中B可知,随着浸提时间的增加,绿原酸得率先快速增长后趋于平稳。当提取时间为3 h时绿原酸得率达到平稳期,为(2.23±0.02)%,提取率为(75.7±0.79)%。因此,选择浸提时间为3 h进行下一步优化。
由图2中C可知,随着浸提温度的升高,绿原酸得率先增大后减小。当提取温度为60 ℃时绿原酸得率最大,为(2.29±0.08)%,提取率为(77.79±2.69)%。因此,选择浸提温度为60 ℃进行下一步优化。
由图2中D可知,在水中添加乙醇更利于提取绿原酸,当浸提液中乙醇浓度为0%~50%时,随着乙醇浓度的增加,绿原酸得率增大。乙醇浓度为50%时,绿原酸得率最大,为(2.30±0.05)%,提取率为(77.90±1.78)%。但当乙醇浓度大于50%时,继续增加乙醇浓度无法提高绿原酸得率。因此,选择50%乙醇浓度进行下一步优化。
由图2中E可知,采用50%乙醇溶液浸提1次时提取率为(77.90±1.78)%,在浸提2次时达到最大提取率(85.90±0.83)%,涨幅并不大。多次浸提不仅操作复杂、耗时较长,而且因反复添加浸提液、升温、离心等过程增加了能耗和成本。从工时、能耗和成本3个方面综合考虑,决定浸提1次。
2.2 提取绿原酸响应面实验设计及结果
2.2.1 设计方案及结果
采用中心组合Box-Behnken设计方案,共有17组实验,相应的响应面设计方案及实验结果见表2。

表2 响应面设计方案及实验结果
2.2.2 模型建立与数据分析
运用 Design-Expert 软件对实验数据进行多元回归拟合,得到绿原酸得率(Y)对自变量浸提温度(A)、浸提时间(B)和料液比(C)的二次多项回归模型方程:Y=2.09+0.043 8A+0.048 8B+0.200 0C+0.047 5AB-0.120 0BC-0.210 3A2-0.060 3B2-0.157 7C2。
回归方程方差分析结果见表3。回归模型的参数F=52.41,P<0.000 1,表明响应面的模型与实验数据非常吻合。R2=0.985 4,表明模型具有可靠性,RAdj2=0.966 6,表明模型可以较好地反映响应值的变化。失拟项的F=5.22,P=0.072 1>0.05,不显著,表明模型与预测值之间的拟合度较好。变异系数较低(C.V.<5%),表明实验数据的准确性和可靠性较高,此模型可以分析和预测葵花籽粕绿原酸的提取结果。

表3 回归模型方差分析表
模型一次项C的影响极显著(P<0.01),A和B的影响显著(P<0.05);二次项A2、C2的影响极显著(P<0.01),B2的影响显著(P<0.05);交互项BC的影响极显著(P<0.01),AB的影响显著(P<0.05),AC的影响不显著(P>0.05)。对比A、B、C的F值可知,3个因素对绿原酸得率的影响主次顺序为C(料液比)>B(浸提时间)>A(浸提温度)。
浸提温度和浸提时间、浸提温度和料液比、浸提时间和料液比这3组因素之间存在交互作用,对其进行响应面分析,探究各因素之间的交互作用对绿原酸得率的影响,所得响应面图和等高线图见图3。
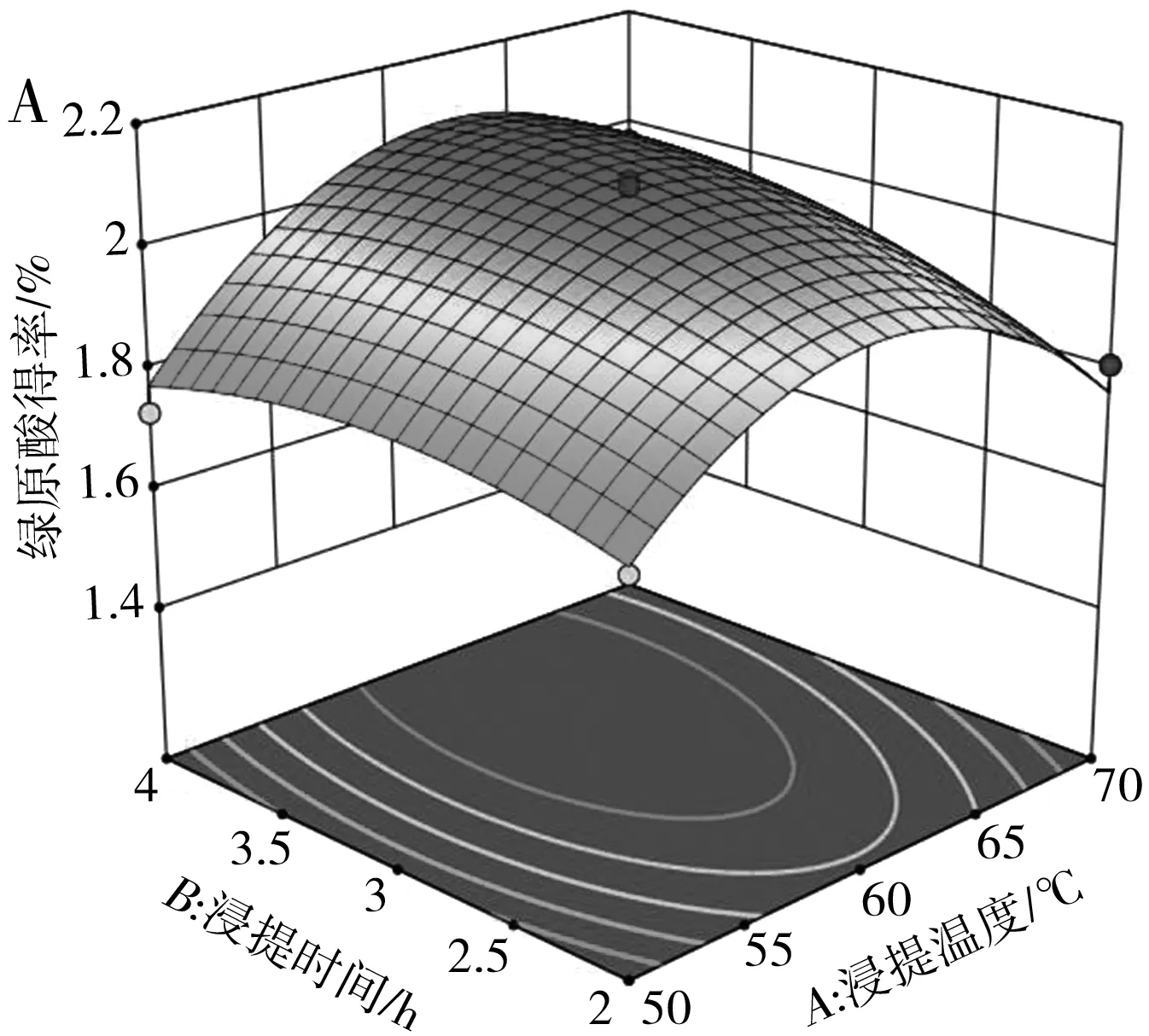
图3 各因素交互作用对绿原酸得率影响的响应面和等高线图
2.2.3 验证实验
采用软件优化分析得出最佳提取条件:浸提温度60.678 ℃、浸提时间2.678 h、料液比1∶18.775 (g/mL)。在此条件下,模型预测葵花籽粕绿原酸得率为2.157%。为便于控制葵花籽粕绿原酸的提取条件,将提取参数设置为浸提温度60 ℃、浸提时间2.5 h、料液比1∶18 (g/mL)。在此条件下开展绿原酸提取的3次平行验证实验,结果显示葵花籽粕绿原酸得率平均值为(2.12±0.02)%,实际值与模型预测值比较相近,说明模型对葵花籽粕绿原酸提取工艺条件参数优化可靠可行,具有一定实用价值。
2.3 纯化绿原酸结果分析
2.3.1 乙酸乙酯萃取率分析
有研究选取了3种极性不同的代表溶剂,石油醚、乙酸乙酯和正丁醇萃取绿咖啡豆绿原酸[10],研究结果表明石油醚的极性太小,几乎无法萃取到绿原酸;正丁醇的极性较大,可以萃取得到较多绿原酸,但同时也萃取到比绿原酸极性大的杂质,无法达到纯化的目的;乙酸乙酯能够萃取绿原酸,但每次萃取的量不高,若想要富集绿原酸需要多次萃取。该研究表明,水相为酸性时,乙酸乙酯对绿原酸的萃取率有所增加,可能是因为酸性条件下绿原酸减少电离,从而在有机相中溶解度提高。本实验选用乙酸乙酯作为萃取剂,并在萃取前将水相的pH调整至4.0,以提高绿原酸的萃取率。实验考察了萃取次数对绿原酸萃取率的影响,结果见图4。

图4 不同萃取次数下的萃取率
由图4可知,随着萃取次数的增加,单次萃取率逐渐下降,当萃取次数为3次时,单次萃取率比较小,为11.22%,累计萃取率为69.96%。郭佩佩[9]在提取杜仲叶绿原酸的研究中也发现相同规律,并且继续增加萃取次数也无法使累计萃取率显著提高,且会增加成本和工作量。因此,本实验最终选定萃取次数为3次。
2.3.2 纯化前后产物主要成分
采用最佳提取工艺条件对葵花籽粕进行乙醇浸提,得到未纯化绿原酸,再分别使用两种萃取方法纯化3次,得到常规乙酸乙酯萃取的绿原酸和乙酸乙酯逆流萃取的绿原酸。对比原料与以上3种产物的主要成分,评估绿原酸的提取和纯化效果,结果见表4。
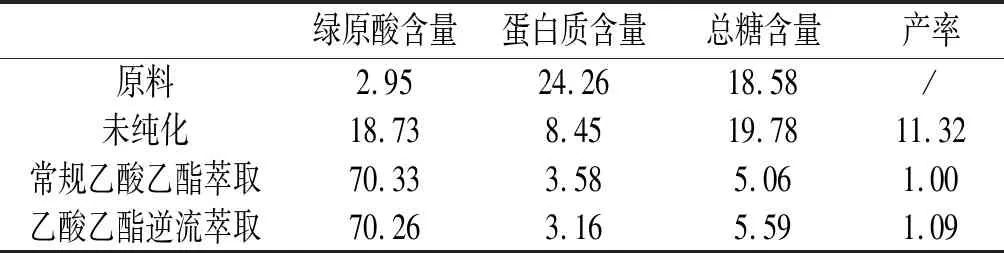
表4 纯化前后产物主要成分比较
由表4可知,与原料相比,经乙醇浸提得到的未纯化绿原酸的含量明显提高,蛋白质含量明显减少,总糖含量基本不变;经常规乙酸乙酯萃取和乙酸乙酯逆流萃取后,绿原酸含量由18.73%提高至70.26%,蛋白质和总糖含量均减少。可见,两种乙酸乙酯萃取方法均能显著提高绿原酸的纯度,且二者的纯化效果基本一致。由于乙酸乙酯逆流萃取的乙酸乙酯用量仅为常规乙酸乙酯萃取的1/3,因此,选定乙酸乙酯逆流萃取为最佳纯化工艺。
2.3.3 产物鉴定
通过上述实验可确定葵花籽粕绿原酸的最佳提取与纯化工艺,方法的重复性良好,将所得3种产物通过高效液相色谱仪进行鉴定,并与绿原酸标品(≥98%)对比,色谱条件:C18色谱柱(250 mm×4.6 mm,5 μm),流动相乙腈-0.1% TFA水溶液,流速0.8 mL/min,柱温30 ℃,检测波长327 nm,进样量10 μL。梯度洗脱条件见表5,色谱图见图5。

表5 梯度洗脱条件
由图5可知,3种产物的主要成分均为绿原酸;与未纯化的绿原酸的谱图相比,常规乙酸乙酯萃取的绿原酸和乙酸乙酯逆流萃取的绿原酸的谱图中绿原酸峰的峰高增加、峰面积增大、杂质峰数量减少,说明两种萃取方法可以达到较好的纯化效果。
3 结论
本实验通过单因素实验和响应面分析法对葵花籽粕绿原酸的提取工艺进行了优化,确定了提取绿原酸的最佳工艺条件为料液比1∶18 (g/mL)、浸提温度60 ℃、浸提时间2.5 h,在此条件下绿原酸得率为(2.12±0.02)%。用乙酸乙酯逆流萃取技术对粗提绿原酸进行纯化,经高效液相色谱仪鉴定,所得绿原酸杂质较少,纯度由18.73%提高至70.26%。
