MTHFR基因多态性与糖尿病周围神经病发生风险的meta分析
2023-10-10薛飞肖李琼阁王海峰
薛飞肖,李琼阁,宁 可,王 威,王海峰
(1.西安市第三医院检验科,西安 710018;2.西安市人民医院/西安市第四医院药剂科,西安 710004)
糖尿病周围神经病(diabetic peripheral neuropathy,DPN)是糖尿病的一种慢性、严重的微血管并发症,其症状包括麻木、感觉减退,甚至出现感染、坏疽、死亡[1]。DPN发病原因被认为是多因素的代谢过程,现有机制包括微血管说、一氧化氮减少、过量的活性氧及高同型半胱氨酸血症(homocysteine,Hcy)等假说[2]。
亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)是叶酸代谢通路关键酶,MTHFR C677T (rs1801133)基因变异引起酶活性降低,导致Hcy引发周围神经功能损伤[3-4],等位基因T可能是糖尿病患者DPN发生的危险因素[5],然而KAKAVAND HAMIDI等[6]认为MTHFR C677T的等位基因C基因可能为DPN发生的危险因素,与前面的研究结果存在不一致,同时不同地区、种族之间MTHFR C677T分布具有特异性[7-8]。鉴于此,本研究采用Meta分析的方法,评价MTHFR C677T基因多态性与DPN发生风险的潜在关系,并探讨不同国家之间存在的区别,以期为临床诊疗提供参考。
1 材料与方法
1.1 资料来源
1.1.1 文献来源:计算机检索PubMed,Cochrane library,Embase,中国知网和万方医学网等数据库,筛选从建库~2021年11月MTHFR C677T基因多态性与DPN发病风险相关的文献。
1.1.2 文献纳入与排除:纳入标准:①病例-对照研究; ②患者符合DPN诊断标准; ③研究内容包括MTHFR C677T基因多态性与DPN发病关系。排除标准:①重复文献、综述、系统评价及meta分析等; ②动物、细胞等基础研究; ③会议、成果报告、信件摘要; ④个案报道;⑤非中英文文献、数据不完整无法提取文献等。
1.2 方法
1.2.1 检索方式:以“亚甲基四氢叶酸还原酶”“周围神经病”“糖尿病周围神经病”“Methylenetetrahydrofolate reductase”“Diabetic Neuropathies”“Peripheral Nervous System Diseases”为主题词/摘要/关键词进行文献检索,如Cochrane library检索。见表1。

表1 Cochrane library检索流程
由两位研究者独立进行文献检索、初筛,阅读全文,纳入MTHFR C677T多态性与DPN关系文献,如有分歧,与第三位参与者讨论决定。同时提取文献资料包括:第一作者、出版年份、样本量、国家、病程、检测方法、基因频率等。
1.2.2 文献质量评价:由两位研究者对纳入文献采用纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)从研究对象选择、组间可比性、暴露因素测量三个部分进行质量评价[9]。
1.3 统计学分析 采用RevMan5.3软件对不同遗传模型(T/C,TC+TT/CC,TT/CC,TC/CC,CC+CT/TT)进行Meta分析,以合并数据的比值比(odds ratio,OR)为效应指标,并包括95%置信区间(confidence interval,CI)为指标。采用Q检验及I2评估组间异质性,当I2≤50%或异质性P>0.05时,表示各组间异质性较好,采用固定效应模型进行分析;否则采用随机效应模型。同时根据研究国家的不同进行亚组分析。Meta分析的检验水准为α=0.05。对纳入研究的发表偏倚采用漏斗图分析。
2 结果
2.1 文献检索流程及结果 计算机初步检索到53篇文献,通过纳入排除标准筛选,其中1篇文献为队列研究,且以新生儿为对照,无法评价组间可比性及暴露因素同质性被排除[10],最终纳入8篇文献[3,5-6,11-15]进行Meta分析,具体见图1。
图1 Meta分析文献筛选流程图
2.2 纳入文献基本特征及质量评价 见表2。纳入的8篇文献中,1篇文献[14]包含2项研究,最终对9项病例对照研究进行分析,包括751例病例组及854例对照组。意大利笔者RUSSO等[11]研究仅提供CC和TT+TC值,未见TT和TC值,无法计算T和C值,仅进行TT+TC vs CC模型比较。所纳入文献质量的分在5~8分之间,质量较好。

表2 纳入研究的基本信息及方法学研究
2.3 Meta分析结果
2.3.1 T vs C 等位基因模型分析:异质性检验结果表明各组间存在统计学差异(I2>50%,P<0.05),采用随机效应模型对T vs C等位基因与DPN发病风险进行Meta分析:见图2。T等位基因与DPN发病风险相关,差异有统计学意义(Z=2.41,P=0.02)。亚组分析发现,中国、土耳其T等位基因与DPN风险有关,差异有统计学意义(Z=2.68,3.20;P=0.007,0.001),而伊朗、德国与DPN风险未见相关性,差异无统计学意义(Z=1.13,0.21,P=0.26,0.84)。

图2 T vs C 等位基因模型Meta分析
2.3.2 TT vs CC共显性模型分析:异质性检验结果表明各研究间存在统计学差异(I2>50%,P<0.05),采用随机效应模型对TT vs CC基因型与DPN发病风险进行Meta分析:见图3。TT基因型与DPN发病风险未见相关性,差异无统计学意义(Z=1.82,P=0.07)。亚组分析发现,中国、土耳其TT基因型与DPN风险有关,差异有统计学意义(Z=2.72,3.09,P=0.006,0.002),而伊朗、德国与DPN风险未见相关性,差异无统计学意义(Z=1.91,0.58,P=0.06,0.56)。

图3 TT vs CC共显性模型Meta分析
2.3.3 TC vs CC共显性模型:异质性检验结果表明各研究间无统计学差异(I2<50%,P>0.05),采用固定效应模型对TC vs CC基因型与DPN发病风险进行Meta分析:见图4。TC基因型与DPN发病风险相关,差异有统计学意义(Z=2.54,P=0.01)。亚组分析发现,仅中国TC基因型与DPN发病风险相关,差异有统计学意义(Z=2.21,P=0.03)。

图4 TC vs CC共显性模型Meta分析
2.3.4 TT+TC vs CC显性模型分析:异质性检验结果表明各研究间存在统计学差异(I2>50%,P<0.05),采用随机效应模型对TT+TC vs CC基因型与DPN发病风险进行Meta分析:见图5。TT+TC基因型与DPN发病风险未见相关性,差异无统计学意义(Z=1.90,P=0.06)。亚组分析发现,中国、土耳其TT+TC基因型与DPN发病风险相关,差异有统计学意义(Z=2.03,2.50,P=0.04,0.01),而伊朗、德国、意大利地区与DPN风险无相关性,差异无统计学意义(均P>0.05)。
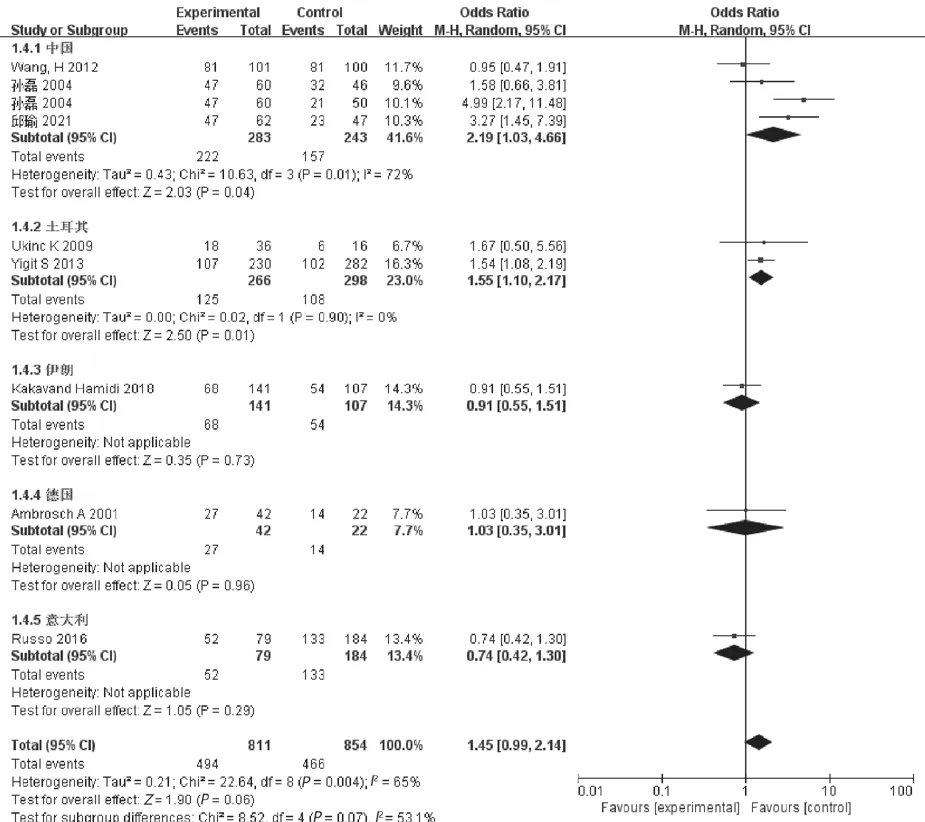
图5 TT+TC vs CC显性模型Meta分析
2.3.5 CC+TC vs TT隐性模型:异质性检验结果表明各研究组间差异有统计学意义(I2>50%,P<0.05),采用随机效应模型对CC+TC vs TT基因型与DPN发病风险进行Meta分析:见图6。CC+TC基因型与DPN发病风险未见相关性,差异无统计学意义(Z=1.76,P=0.08)。亚组分析发现,中国、土耳其、伊朗CC+TC基因型与DPN发病风险相关,差异有统计学意义(Z=3.12,2.87,2.02,均P<0.05)。
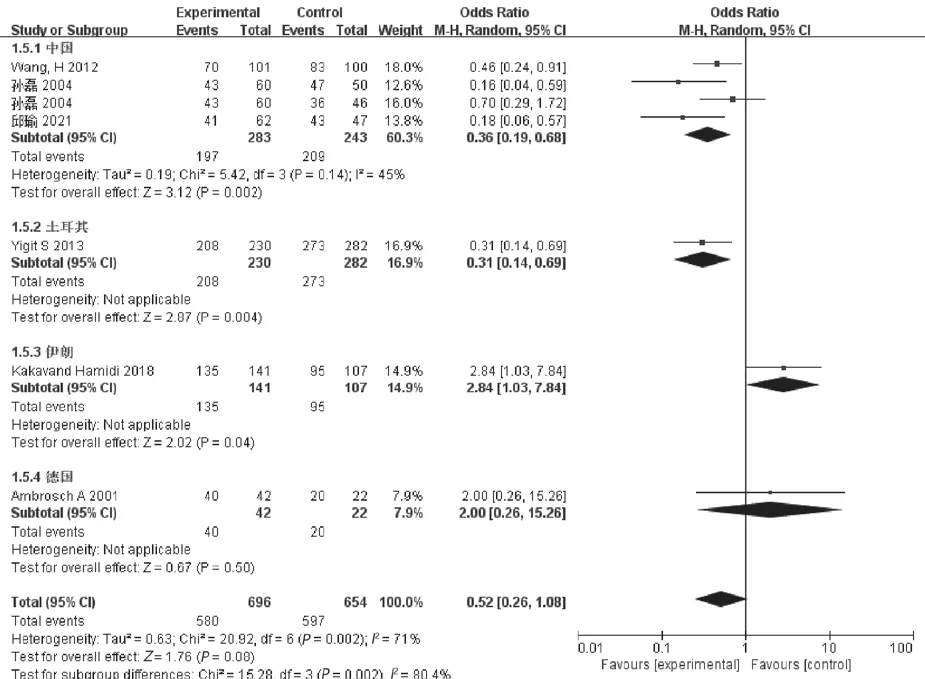
图6 CC+TC vs TT隐性模型Meta分析
2.4 发表偏倚 见图7。MTHFR C677T基因多态性与DPN易感性Meta分析的发表偏倚采用漏斗图表示,其中共显性模型TT vs CC漏斗图较为对称,发表偏倚较小,其余模型发表偏倚相对较大。

图7 显性模型TT/CC vs DPN 易感性Meta分析漏斗图
3 讨论
DPN是糖尿病患者常见的并发症,是导致大量死亡率和发病率以及生活质量恶化的原因,其发生原因包括慢性高血糖、饮食、遗传等其他因素。该Meta分析发现 MTHFR C677T T等位基因与DPN发生风险相关,同时亚组分析表明T等位基因在中国、土耳其人群发生DPN的风险较C等位基因高。进一步研究发现,TT基因型、TC基因型中国人群发生风险均显著高于CC型人群,且TT型>TC型,而土耳其人群仅TT型患者显著增高。最近研究发现,中国淄博地区TT型患者达43.61%,T等位基因携带率达87.51%[7],土耳其携带T亚型正常人群达到49.8%,其中TT型6.4%,低于中国人群,而在土耳其糖尿病患者中TT型患者比例显著增加,且TT+TC基因型与DPN发病风险显著相关[16]。同时亚组分析亦指出CC+CT型伊朗人群患DPN的发病风险显著增加,德国、意大利人群MTHFR C677T基因多态性与DPN发病风险未见相关性,这可能与MTHFR C677T基因分布频率受地理位置和种族影响,如T等位基因发生频率地中海/西班牙裔> 高加索人>非洲人/非裔美国人[2,17]。KAKAVAND HAMIDI等[6]发现携带C等位基因的伊朗2型糖尿病患者则倾向于发展为DPN,同时T等位基因呈现出保护患者避免发展为DPN。欧美人群中,意大利TT基因型比例为16%,是荷兰、爱尔兰的三倍,2型糖尿病意大利人群携带T基因人群比例达70.3%,但T基因携带与DPN发生无相关性,这可能与意大利人携带T基因与叶酸、Hcy,维生素B12水平变化未见相关性有关[11,18]。
尽管MTHFR基因变异与DPN发展机制尚未明确,但这种变异是高Hcy的主要遗传因素。MTHFR是一种在叶酸和Hcy代谢中起主要作用的酶,MTHFR C677T基因多态性与心血管、肿瘤、神经疾病、糖尿病等各种疾病相关,C677T基因变异可引发叶酸浓度降低,Hcy浓度升高,高诱发胰岛素抵抗,易引发神经功能损伤,导致糖尿病血管并发症[3,17,19]。当MTHFR C677T基因发生变异后,携带TT型基因MTHFR活性为CC型的30%,而TC型则为65%[20];与CC型人群相比,TT型人群具有较高的Hcy,而TC型则轻度升高[17]。有研究指出Hcy浓度的变化受糖化血红蛋白、年龄、性别等因素影响,当血清Hcy水平升高时,等位基因T为DPN发生的可能危险因素[5,21-22]。同时患者使用药物对DPN发生存在影响,如二甲双胍作为治疗糖尿病的一线药物,可能会增加DPN风险,而DPN患者每日补充1mg叶酸,持续16周可增加C677T多态性患者血清叶酸水平,降低Hcy,从而改善DPN可能症状的发生[17,23]。
然而,该Meta分析亦存在一定局限性。首先,纳入研究之间缺乏临床同质性,可能是因国家、对照人群等导致,尽管我们根据国家进行讨论分析,但不能消除健康对照等因素对研究结果的影响。其次,研究仅纳入中英文论文,也不能排除出版物相关偏倚。再次,本研究中观察到MTHFR C677T与DPN的关联,可能是基因、国家地区、治疗药物等因素相互作用的综合影响,如服用叶酸、二甲双胍等药物。
综上所述,MTHFR C677T 基因多态性与DPN发生风险差异可能与国家、种族、遗传背景等因素有关,检测该基因有助于中国、土耳其、伊朗地区人群DPN发病风险的预判,而补充叶酸有可能降低基因突变所增加的风险。鉴于未考虑基因、地区、药物治疗的综合作用,大样本量、多因素、严谨的病例对照研究被开展,以期进一步验证本研究的结论。
