慢性乙型肝炎患者接受核苷(酸)类似物治疗后发生低病毒血症的危险因素及机制研究
2023-10-10吕承秀王纪传张琨婷孙晓琳
吕承秀,陈 梅,王纪传,李 庆,张琨婷,孙晓琳
(淄博市第一医院 a.检验科;b.感染性疾病科;c.分子免疫检验医学重点实验室,山东淄博 255200)
慢性乙型肝炎(chronic hepatitis B,CHB)是由乙型肝炎病毒(hepatitis B virus,HBV)感染引起的肝脏慢性炎症性疾病。CHB患者接受核苷(酸)类似物[nucleos(t)ide analogues,NAs]抗病毒治疗可减轻肝脏炎症、逆转或延缓纤维化进程,降低肝细胞癌的发生风险。近年来研究发现[1],尽管CHB患者长期接受NAs抗病毒治疗,仍有约30%的患者发生低病毒血症(low-level viremia,LLV)。SUN等[2-3]研究发现LLV是CHB患者抗病毒治疗后患者纤维化进展及肝癌发生的重要危险因素。目前关于LLV发生的危险因素及机制尚不明确。本研究旨在分析CHB患者长期接受NAs治疗后发生LLV的危险因素,探究LLV发生的机制。
1 材料与方法
1.1 研究对象 选取2021年5月~2023年3月淄博市第一医院感染科门诊就诊的115例CHB患者。纳入标准:①所有CHB患者符合《慢性乙型肝炎防治指南(2022版)》;②患者经NAs治疗时间大于48周;③高敏HBV DNA连续检测至少2次,每次间隔至少3个月,高敏HBV DNA<2 000IU/ml或阴性。排除标准:①并发甲、丙、丁型肝炎病毒或其他嗜肝病毒感染者;②并发肝衰竭或急性乙型肝炎者;③并发恶性肿瘤;④酒精、免疫或其他原因引发的肝脏损伤者;⑤用药依从性差的患者。本研究获得医院伦理委员会批准。
1.2 仪器与试剂 SLAN 96P全自动荧光定量PCR仪(上海宏石医疗科技有限公司),EZ Bead全自动核酸提取仪及高敏HBV DNA定量检测试剂盒(山东见微生物科技有限公司),i2000SR化学发光仪及乙型肝炎五项定量检测试剂盒(美国雅培公司),AU5821全自动生化分析仪及肝功能检测试剂盒(美国贝克曼公司),乙型肝炎病毒前基因组RNA(hepatitis B virus pregenomic RNA,HBV pgRNA)定量检测试剂盒(圣湘生物科技股份有限公司),乙型肝炎病毒双链松弛环状DNA (hepatitis B virus double-strand relaxed circular DNA,HBV rcDNA)引物及荧光探针(通用生物股份有限公司合成)。
1.3 方法
1.3.1 实验分组:根据CHB患者NAs治疗后的高敏HBV DNA定量结果,将患者分为持续LLV组、间歇LLV组和持续病毒学应答(sustained virologic response,SVR)组。持续LLV组定义为接受NAs治疗至少48周以后,患者连续检测高敏HBV DNA至少2次,每次间隔3~6个月,HBV DNA均阳性,但<2 000 IU/ml;间歇LLV组定义为接受NAs治疗至少48周以后,患者连续检测高敏HBV DNA至少3次,每次间隔3~6个月,HBV DNA间歇阳性,但<2 000 IU/ml; SVR组定义为接受NAs治疗至少48周以后,患者连续检测高敏HBV DNA至少2次,每次间隔3~6个月,HBV DNA均阴性。
1.3.2 患者NAs治疗前临床特征及实验室指标:医院信息化系统收集患者治疗前临床特征及实验室指标。实验室指标包括乙型肝炎e抗原(hepatitis B e antigen,HBeAg)、乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)、乙型肝炎核心抗体(antibody to hepatitis B core antigen,HBcAb)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBil)、γ-谷氨酰基转移酶(γ-glutamyl transpeptidase,GGT)、清蛋白 (albumin,Alb)、总胆汁酸(total biliary acid,TBA)和血小板计数(platelet count,PLT)。
1.3.3 患者NAs治疗后肝功能、高敏HBV DNA,HBV rcDNA及HBV pgRNA检测:抽取患者NAs治疗后全血,离心分离血清分别进行肝功能(ALT,AST,TBil,GGT,Alb,TBA)检测、高敏HBV DNA,HBV rcDNA和HBV pgRNA检测。其中高敏HBV DNA检测(检出限10 IU/ml)采用TaqMan实时荧光定量法,HBV pgRNA检测(检出限50copies/ml)采用TaqMan实时荧光定量法,HBV rcDNA(检出限20 IU/ml)采用TaqMan实时荧光法,HBV rcDNA检测参见文献报道[4]。
1.4 统计学方析 采用SPSS23.0进行数据统计处理,计数资料多组间比较用卡方(χ2)检验,组间进一步两两比较采用Bonferroni检验;正态分布的计量资料用均数±标准差(±s)表示,多组间比较采用独立样本方差分析,组间进一步两两比较采用LSD-t检验;非正态分布的计量资料用中位数(四分位间距)[M(P25,P75)]表示,多组间比较用Kruskal-WallisH检验,组间进一步两两比较采用Nemenyi检验;多因素Logistic回归分析CHB患者NAs治疗后发生LLV的独立危险因素;P<0.05为差异有统计学意义。
2 结果
2.1 患者NAs治疗后发生LLV的危险因素分析
2.1.1 患者NAs治疗后发生LLV的单因素分析:见表1。本研究共纳入CHB患者115例,其中持续性LLV组34例、间歇性LLV组32例和SVR组49例。持续性LLV组、间歇性LLV组及SVR组患者NAs治疗前的临床特征和实验室指标进行比较发现,三组间在年龄、性别构成、HBcAb定量结果、肝功能指标及血小板计数之间差异均无统计学意义(χ2/F/Z=0.027,5.386,0.275,0.406,1.308,2.442,1.064,0.030,1.344,1.151,均P>0.05);HBeAg阳性率在三组间的差异有统计学意义(χ2=33.678,P<0.001),组间进一步两两比较发现,间歇性LLV组和持续性LLV组HBeAg阳性率均高于SVR组(χ2=14.005,27.192,均P<0.001); HBsAg(lgIU/ml) 结果在三组间的差异有统计学意义(Z=12.314,P=0.002),组间进一步两两比较发现,持续性LLV组HBsAg(lgIU/ml)值高于SVR组(Z=-3.375,P=0.001)。
表1 患者NAs治疗后发生LLV的单因素分析[±s,n(%),M(P25,P75)]
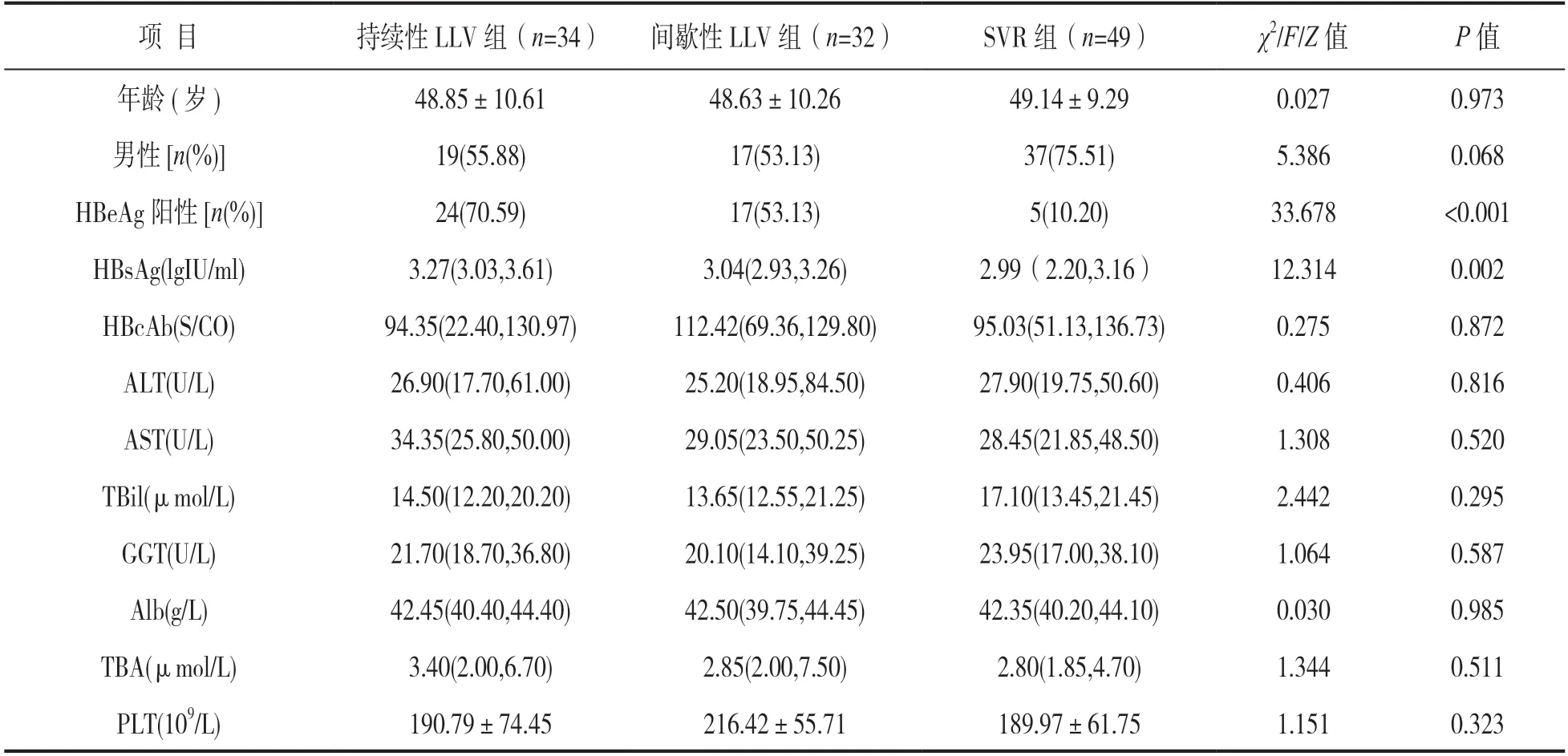
表1 患者NAs治疗后发生LLV的单因素分析[±s,n(%),M(P25,P75)]
项 目持续性LLV组(n=34)间歇性LLV组(n=32)SVR组(n=49)χ2/F/Z值P值年龄(岁)48.85±10.6148.63±10.2649.14±9.290.0270.973男性[n(%)]19(55.88)17(53.13)37(75.51)5.3860.068 HBeAg阳性[n(%)]24(70.59)17(53.13) 5(10.20)33.678<0.001 HBsAg(lgIU/ml)3.27(3.03,3.61)3.04(2.93,3.26)2.99(2.20,3.16)12.3140.002 HBcAb(S/CO)94.35(22.40,130.97)112.42(69.36,129.80)95.03(51.13,136.73)0.2750.872 ALT(U/L)26.90(17.70,61.00)25.20(18.95,84.50)27.90(19.75,50.60)0.4060.816 AST(U/L)34.35(25.80,50.00)29.05(23.50,50.25)28.45(21.85,48.50)1.3080.520 TBil(μmol/L)14.50(12.20,20.20)13.65(12.55,21.25)17.10(13.45,21.45)2.4420.295 GGT(U/L)21.70(18.70,36.80)20.10(14.10,39.25)23.95(17.00,38.10)1.0640.587 Alb(g/L)42.45(40.40,44.40)42.50(39.75,44.45)42.35(40.20,44.10)0.0300.985 TBA(μmol/L)3.40(2.00,6.70)2.85(2.00,7.50)2.80(1.85,4.70)1.3440.511 PLT(109/L)190.79±74.45216.42±55.71189.97±61.751.1510.323
2.1.2 患者NAs治疗后发生LLV的多因素Logistic回归分析:见表2。66例LLV患者(34例持续性LLV患者及32例间歇性LLV患者)与49例SVR患者以是否发生LLV作因变量,HBeAg阳性率、HBsAg(lgIU/ml)作为自变量进行Logistic回归分析发现,患者治疗前HBeAg阳性(OR:8.660,95%CI:2.865~26.183)是患者NAs治疗后发生LLV的独立危险因素。
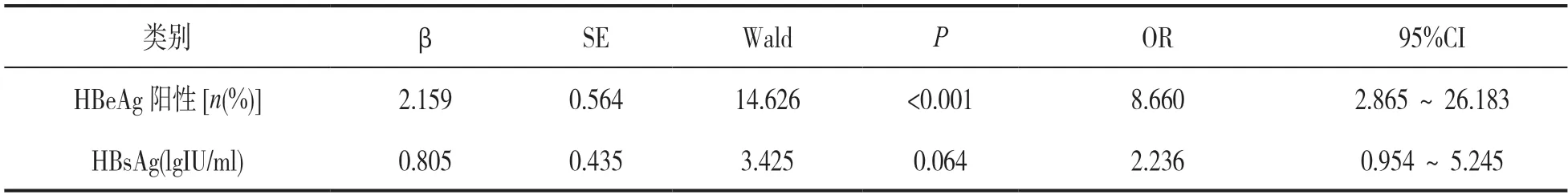
表2 患者NAs治疗后发生LLV的多因素Logistic回归分析
2.2 患者发生LLV与NAs治疗后肝功能、HBV rcDNA,HBV pgRNA的相关性
2.2.1 患者NAs治疗后肝功能指标比较:见表3。持续性LLV组、间歇性LLV组及SVR组患者在NAs治疗后的肝功能指标比较发现,三组之间的差异无统计学意义(Z=1.405,0.297,0.996,1.471,0.172,0.979,均P>0.05)。

表3 患者NAs治疗后肝功能指标比较 [M(P25,P75)]
2.2.2 患者NAs治疗后HBV rcDNA检测结果比较:115例患者中HBV rcDNA阳性共22例,其中持续性LLV组20例,间歇性LLV组2例,SVR组0例,三组间HBV rcDNA阳性率分别为58.82%,6.25%,0.00%,差异有统计学意义(χ2=49.649,P<0.001),组间进一步两两比较发现,持续性LLV组HBV rcDNA阳性率高于SVR组和间歇性LLV组,差异均有统计学意义(χ2=20.504,37.974,均P<0.001)。
2.2.3 患者NAs治疗后HBV pgRNA检测结果比较:115例患者中HBV pgRNA阳性共26例,其中持续性LLV组18例,间歇性LLV组6例,SVR组2例,三组间HBV pgRNA阳性率分别为52.94%,18.75%和4.08%,差异有统计学意义(χ2=27.763,P<0.001);三组间HBV pgRNA(lg copies/ml)定量结果分别为5.56±1.02,4.29±0.84和3.42±0.34,差异有统计学意义(F=7.211,P=0.004);组间进一步两两比较发现,持续性LLV组HBV pgRNA阳性率高于间歇性LLV组和SVR组,差异有统计学意义(χ2=8.328,26.199;P=0.005,<0.001);持续性LLV组HBV pgRNA定量结果高于间歇性LLV组和SVR组,差异有统计学意义(t=2.728,3.080,P=0.013,0.007)。
3 讨论
随着HBV DNA检测试剂灵敏度的提高,约有20%~30%长期接受NAs治疗的患者血清中存在低水平的HBV DNA,国内外专家将这种情况定义为低病毒血症(LLV)[5-6]。目前,LLV的定义国内外尚无相关标准,鲁凤民等[7]专家建议将CHB患者接受恩替卡韦、富马酸替诺福韦酯或富马酸丙酚替诺福韦等一线药物治疗至少48周以上,血清HBV DNA采用高灵敏TaqMan实时荧光定量法(real-time quantitative PCR detecting system,qPCR)仍可检测到,但<2 000 IU/ml,在排除依从性问题及病毒耐药突变后,定义为LLV;LLV可以分为两类:持续性LLV和间歇性LLV。CHB患者接受NAs药物治疗后发生LLV成为目前HBV抗病毒治疗的难点和热点。本研究根据LLV的定义及分类对纳入研究的115例患者分为持续性LLV组、间歇性LLV组和SVR组,并对患者NAs治疗前临床特征及实验室指标比较发现,持续性LLV组及间歇性LLV组HBeAg阳性率明显高于SVR组,持续性LLV组HBsAg(lgIU/ml)结果明显高于SVR组,与程齐齐等[8]的研究结果一致。多因素Logistic回归分析发现,患者NAs治疗前HBeAg阳性是LLV发生的独立危险因素。
HBV病毒颗粒进入肝细胞,病毒颗粒内的rcDNA被释放到细胞核中并形成cccDNA;病毒pgRNA从cccDNA转录并翻译成病毒蛋白,在细胞质中,病毒聚合酶与pgRNA结合并被核心蛋白包裹;在核衣壳内,pgRNA经逆转录酶和病毒聚合酶形成rcDNA;成熟衣壳被包裹并通过多囊泡体(multivesicular body,MVB)分泌途径作为子代病毒颗粒分泌,完成HBV 的复制周期[4,9]。NAs是一种直接口服抗病毒药物,通过竞争性抑制病毒聚合酶和逆转录酶来抑制pgRNA逆转录为rcDNA,从而形成无感染能力的基因组缺陷子代病毒颗粒[10-11]。王雷婕等[12-13]认为CHB患者接受NAs抗病毒治疗后发生LLV的可能机制为患者较弱的免疫应答状态和NAs竞争性抑制病毒复制所特有的局限性。
近年来研究发现[12],ALT水平能够反映机体自身免疫应答状态,NAs治疗后ALT水平可能与LLV的发生有关;ALT水平低,机体免疫应答较弱,不利于感染HBV的肝细胞清除和cccDNA的丢失,因此,ALT水平低的患者可能易发生LLV。然而,也有研究发现ALT水平与LLV的发生无相关性[14]。本研究发现,NAs治疗后ALT,AST等肝功能指标在持续性LLV组、间歇性LLV组以及SVR组间差异无统计学意义。
NAs竞争性抑制病毒复制所特有的一种局限性为患者细胞内大量dNTP存在的情况下,NAs无法完全阻断HBV pgRNA逆转录rcDNA的合成,未被阻断的含rcDNA的病毒颗粒分泌入血液可继续感染患者肝细胞完成HBV的复制周期[12]。本研究对持续性LLV组、间歇性LLV组和SVR组患者进行HBV rcDNA检测发现,持续性LLV组rcDNA阳性率明显高于间歇性LLV组和SVR组。持续性LLV组患者血液中含rcDNA的病毒颗粒导致血清中HBV DNA采用高灵敏qPCR法仍可检测到,从而导致患者NAs治疗后发生LLV。血液中含rcDNA的病毒颗粒可继续感染患者肝细胞完成HBV的复制周期,导致LLV患者纤维化进展及肝癌发生[15-16]。
NAs竞争性抑制病毒复制所特有的另一种局限性为NAs竞争性抑制HBV pgRNA逆转录为rcDNA,但对共价闭合环状DNA(covalently closed circular DNA,cccDNA)的影响较小,cccDNA的长期存在是HBV慢性感染的重要原因[17-18]。理论上,cccDNA水平应该是预测预后的最直接指标;然而,由于其分布不均和侵入性检查造成的损伤,cccDNA的应用受到限制[19]。研究发现,pgRNA是cccDNA的直接转录产物,pgRNA与cccDNA呈正相关且反映cccDNA的转录活性[20-22]。本研究对持续性LLV组、间歇性LLV组及SVR组患者进行pgRNA检测发现,持续性LLV组pgRNA阳性率明显高于间歇性LLV组和SVR组,持续性LLV组pgRNA定量结果明显高于间歇性LLV组和SVR组。因此,持续性LLV患者pgRNA阳性率高及定量水平高,反映cccDNA的转录活性强,rcDNA维持在较高的合成水平,NAs无法完成抑制rcDNA的合成,rcDNA可被成熟衣壳包裹并通过MVB分泌途径作为子代病毒颗粒分泌入血液中,导致血清中HBV DNA采用高灵敏qPCR法仍可检测到,从而导致患者NAs治疗后发生LLV。
综上所述,治疗前HBeAg阳性是CHB患者NAs治疗后发生LLV的独立危险因素;CHB患者NAs治疗后部分LLV患者(特别是持续性LLV患者)pgRNA阳性且定量水平高,cccDNA转录活性强,rcDNA维持在较高的合成水平,NAs无法完成抑制rcDNA的合成,rcDNA可被成熟衣壳包裹并通过MVB分泌途径作为子代病毒颗粒分泌入血液中,导致血清中HBV DNA采用高灵敏qPCR法仍可检测到,从而导致患者NAs治疗后发生LLV,由于血液中rcDNA的存在,HBV可继续感染肝细胞完成HBV的复制周期,从而导致发生LLV患者纤维化进展及肝癌发生。本研究存在以下几点不足之处:①因部分患者NAs治疗前HBV DNA定量结果缺失,未进行基线 HBV DNA 水平对48周后 NAs 治疗效果的影响评估;②未考虑药物与药物、药物与食物的相互作用对一线 NAs 抗病毒作用的可能影响;③样本量相对较少,研究结果可能存在偏倚。因此,CHB患者接受NAs治疗后发生低病毒血症的危险因素及机制还需要大样本和多中心的进一步研究。
