HPV阳性宫颈癌组织中IGF2BP2和RPRD1B的表达水平及临床价值研究
2023-10-10盛晓鹃南通市海门区人民医院妇产科江苏南通226100
沈 华,盛晓鹃(南通市海门区人民医院妇产科,江苏南通 226100)
宫颈癌是女性常见恶性肿瘤,全球每年新发患者例数达52万例,死亡达26万例[1]。高危型人乳头瘤病毒(human papilloma virus,HPV)DNA能整合入宿主细胞染色体,是导致宫颈上皮内瘤变及宫颈癌发病的重要病因[2]。胰岛素样生长因子2结合蛋白2(insulin-like growth factor2 binding protein 2,IGF2BP2)是一种能够结合胰岛素样生长因子2 mRNA并调节其翻译的蛋白质,在新陈代谢中起着重要作用。研究发现,结直肠癌[3]、肝癌[4]等肿瘤中存在IGF2BP2表达上调,其能够激活癌基因MYC的表达,促进肿瘤细胞增殖及转移。细胞核前mRNA结构域调节因子1B(regulation of nuclear pre-mRNA domain containing 1B,RPRD1B)能够结合RNA聚合酶II复合物,参与细胞周期的调控[5]。JIA等[6]发现,RPRD1B能够上调胆固醇调节元件结合蛋白1的表达,促进肿瘤细胞转移,导致胃癌等恶性肿瘤患者不良预后。目前HPV阳性宫颈癌中IGF2BP2,RPRD1B的表达及临床意义研究较少。本研究通过检测HPV阳性宫颈癌组织中IGF2BP2,RPRD1B的表达,探讨两者的临床预后意义。
1 材料与方法
1.1 研究对象 收集2018年1月~2019年1月于南通市海门区人民医院诊治的82例HPV阳性宫颈癌患者。纳入标准:①经病理检查确诊为宫颈癌,且HPV检测阳性持续一年以上;②初次诊治,既往无放化疗治疗;③临床资料完整,患者及家属对本研究知情同意并签字。排除标准:①并发泌尿生殖系统感染性疾病;②并发其他系统恶性肿瘤;③并发严重肝肾等脏器功能衰竭。年龄31~68(53.3±7.1)岁;病理类型:鳞癌48例,腺癌34例;肿瘤分化程度:高中分化39例,低分化43例;国际妇科联合会(the international federation of gynecology and obstetrics,FIGO)分期:ⅠA~ⅠB期36例,ⅡA期46例;肌层浸润:浅肌层41例,深肌层41例;并发淋巴结转移32例。选取同期诊治的41例HPV阴性宫颈癌患者为对照组,年龄30~69(52.7±6.9)岁。两组年龄之间无明显差异(t=0.446,P>0.05)。本研究经本院伦理委员会审核批准通过。
1.2 仪器与试剂 IGF2BP2兔单克隆抗体(Abcam公司,货号ab124930),RPRD1B兔单克隆抗体(美国CST公司,货号#74693),PV6000免疫组化染色试剂盒(北京中杉金桥公司),石蜡切片机(德国徕卡公司),DM500光学显微镜(日本奥林巴斯公司)。
1.3 方法
1.3.1 免疫组织化学检测IGF2BP2,RPRD1B表达:留取HPV阳性组患者癌组织及癌旁组织,HPV阴性组癌组织,按照免疫组化染色试剂盒说明进行操作。IGF2BP2,RPRD1B一抗稀释比均为1∶50。镜下观察染色强度和范围,以染色强度评分(0:无染色,1:浅黄色,2:棕褐色)和染色面积评分(0:≤25%,1:25%~50%,2:≥50%)的乘积作为最终免疫组化染色评分,<2分为阴性,≥2分为阳性。
1.3.2 随访:所有患者自病理确诊后开始随访,随访三年,第1年3个月随访一次,第2~3年6个月随访一次,随访方式为门诊或电话随访。随访内容为患者生存状态及生存时间。随访截止至2022年2月1日,随访终点为患者死亡或随访时间结束。
1.4 统计学分析 利用SPSS23.0软件进行统计分析。计数资料以率(百分比)[n(%)]表示,组间比较采用卡方检验。Spearman秩相关分析HPV阳性宫颈癌组织中IGF2BP2,RPRD1B蛋白表达的相关性。Kaplan-Meier生存分析IGF2BP2,RPRD1B蛋白表达对HPV阳性宫颈癌患者生存预后的影响。COX比例风险模型分析影响HPV阳性宫颈癌患者生存预后的因素。P<0.05为差异有统计学意义。
2 结果
2.1 组织中IGF2BP2,RPRD1B蛋白表达 IGF2BP2蛋白棕褐色阳性染色主要位于细胞膜和细胞浆,RPRD1B蛋白棕褐色阳性染色主要位于细胞核。见图1。HPV阳性癌组织IGF2BP2蛋白阳性率为67.07%(55/82),高于HPV阴性癌组织9.76%(4/41)及癌旁正常组织6.10%(5/82),差异具有统计学意义(χ2=35.978,65.705,均P<0.05)。HPV阳性癌组织RPRD1B蛋白阳性率为70.73%(58/82),高于HPV阴性癌组织17.07%(7/41)及癌旁正常组织7.32%(6/82),差异具有统计学意义(χ2=31.582,69.290,均P<0.05)。
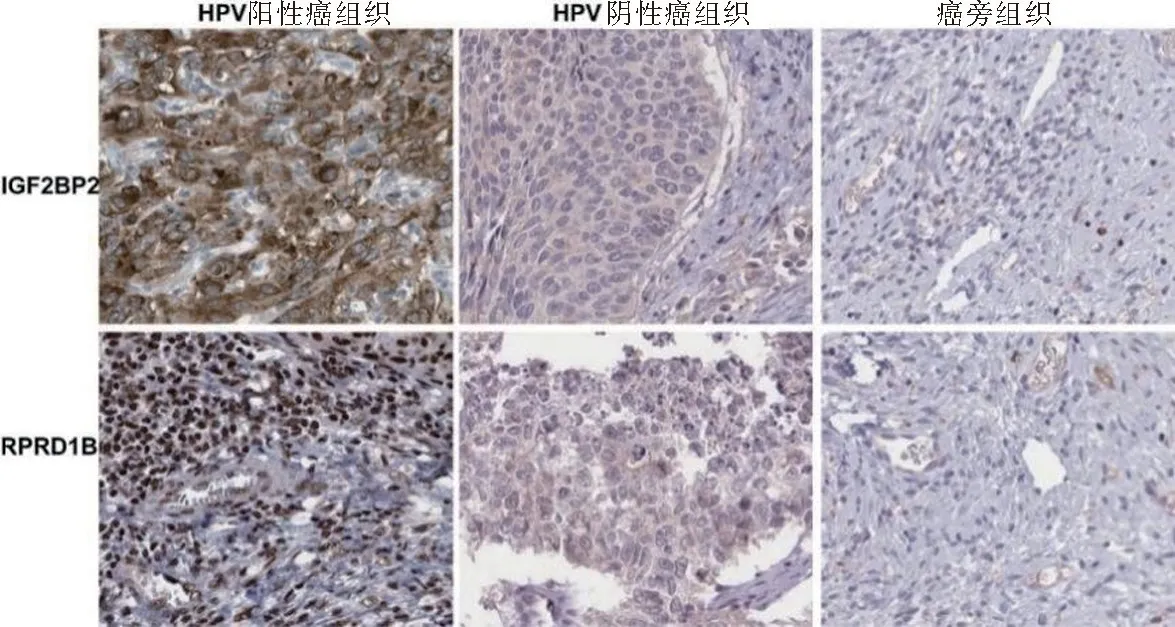
图1 组织中IGF2BP2,RPRD1B蛋白表达(免疫组化,200×)
2.2 HPV阳性癌组织中IGF2BP2与RPRD1B蛋白表达相关性 HPV阳性癌组织中IGF2BP2与RPRD1B蛋白表达呈显著正相关(r=0.717,P<0.05)。
2.3 IGF2BP2,RPRD1B蛋白表达与HPV阳性宫颈癌临床病理参数的关系 见表1。肿瘤FIGO分期ⅡA期、伴淋巴结转移HPV阳性宫颈癌组织中IGF2BP2,RPRD1B蛋白阳性率高于ⅠA~ⅠB期、无淋巴结转移组织,差异具有统计学意义(均P<0.05)。

表1 IGF2BP2,RPRD1B蛋白表达与临床病理参数的关系[n(%)]
2.4 IGF2BP2,RPRD1B蛋白表达与HPV阳性宫颈癌患者生存预后的关系 见图2。随访中,死亡22例,失访1例,三年生存率为73.17%(60/82)。IGF2BP2阳性组和阴性组患者的三年生存率分别为65.45%(36/55),88.89%(24/27)。RPRD1B阳性组和阴性组患者的三年生存率分别为65.52%(38/58),91.67%(22/24)。IGF2BP2阳性组和RPRD1B阳性组患者三年累积生存率分别低于IGF2BP2阴性组和RPRD1B阴性组,差异具有统计学意义(Log Rankχ2=6.487,5.192,P<0.05)。

图2 Kaplan-Meier生存曲线分析HPV阳性宫颈癌组织IGF2BP2,RPRD1B蛋白表达与预后的关系
2.5 单因素及多因素COX比例风险回归分析影响HPV阳性宫颈癌患者生存预后的因素 见表2,3。以HPV阳性宫颈癌患者预后作为因变量(0=存活,1=死亡,t=时间),单因素及多因素COX比例风险模型分析结果,FIGO分期ⅡA期、并发淋巴结转移、IGF2BP2阳性、RPRD1B阳性是影响HPV阳性宫颈癌患者预后的独立危险因素。
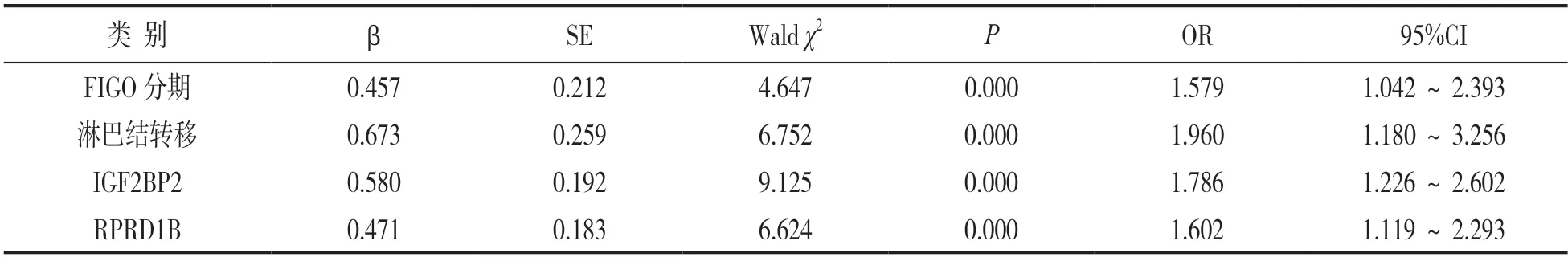
表3 多因素COX比例风险模型
3 讨论
宫颈癌是我国女性常见恶性肿瘤,近年来其发病有年轻化的趋势,严重威胁女性健康。HPV感染是宫颈癌发病的重要危险因素,我国女性HPV感染亚型多为16,18,52和53[7]。持续的高危型HPV感染能够导致宫颈癌前病变的发生,最终发展为宫颈癌。深入研究HPV阳性宫颈癌发生发展的分子机制,寻找新的肿瘤标志物,对疾病早期诊治,具有较大的临床意义。
胰岛素样生长因子2结合蛋白2(IGF2BP2)是胰岛素生长因子2 mRNA结合蛋白家族成员,参与调节mRNA亚细胞定位、稳定性和翻译[8]。研究表明,IGF2BP2在胰腺癌[9]、前列腺癌[10]等癌症中过度表达,其作为N6甲基腺苷阅读器,通过K同源性结构域识别具有GGC序列,调控基因表达,促进肿瘤恶性进展。本研究中,HPV阳性宫颈癌中IGF2BP2表达升高,与FIGO分期、淋巴结转移有关,提示IGF2BP2参与HPV阳性宫颈癌的疾病发生发展。IGF2BP2的表达上调与HPV病毒感染有关。HU等[11]学者报道,HPV DNA编码E6/E7蛋白能够在转录水平上调宫颈癌细胞中IGF2BP2的表达,IGF2BP2促进癌基因MYC mRNA的N6甲基腺苷修饰及蛋白表达,促进肿瘤细胞糖酵解的发生,导致肿瘤过度增殖和转移。研究发现,结直肠癌等恶性肿瘤中IGF2BP2作为一种促癌基因,通过促进受体酪氨酸激酶2 mRNA的N6甲基腺苷修饰,增加ErbB2 mRNA的稳定性及蛋白表达,促进肿瘤细胞增殖、侵袭,抑制肿瘤细胞的凋亡发生[12]。因此,IGF2BP2作为一种促癌因子,参与促进宫颈癌肿瘤恶性进展。本研究中,IGF2BP2阳性表达患者生存预后较差,表明检测IGF2BP2表达有助于评估HPV阳性宫颈癌患者临床预后。笔者分析,IGF2BP2的表达可能是通过影响化疗治疗的敏感性,导致患者不良预后。JIANG等[10,13]报道,IGF2BP2能够上调肿瘤细胞中转录因子c-myc的表达,c-myc通过增强乳酸脱氢酶A的活性,促进肿瘤细胞对多西他赛、顺铂等化疗药耐药性形成,肿瘤易发生复发和转移,导致不良预后。尚有学者在T细胞急性淋巴细胞白血病中发现,应用IGF2BP2的小分子抑制剂JX5或敲除肿瘤细胞中IGFBP2的表达后,能够显著抑制肿瘤细胞的增殖,增强肿瘤对化疗治疗的敏感性,以IGF2BP2为靶点的临床治疗有助于逆转肿瘤耐药,改善患者临床预后,是潜在的新的肿瘤治疗方案[14]。
细胞核前mRNA结构域调节因子1B(RPRD1B)编码基因位于人类20号染色体,能结合并激活RNA聚合酶II复合物,参与DNA损伤修复,RNA转录及蛋白质翻译等生物学过程[15]。研究表明,RPRD1B作为一种致癌因子,能够促进细胞周期素D1的表达,加速肿瘤细胞G1期向S期的转换,导致肿瘤过度增殖[16]。本研究中,HPV阳性宫颈癌组织中RPRD1B表达升高,并与FIGO分期、淋巴结转移有关,提示RPRD1B参与HPV阳性宫颈癌的疾病发生发展。WEN等[17]学者报道,HPV DNA编码产生的E6/E7蛋白能够诱导宫颈癌细胞中RPRD1B的表达,并在宫颈癌组织标本中证实E6/E7蛋白与RPRD1B蛋白表达具有较强的正相关性。肿瘤中RPRD1B的表达升高能够促进肿瘤的增殖和侵袭,导致肿瘤恶性进展。研究发现,RPRD1B能够促进肿瘤细胞中信号转导子和转录激活子3的磷酸化激活,招募p300结合到细胞周期素D1的启动子区域,促进细胞周期素D1的表达,诱导肿瘤过度增殖[18]。另外,肿瘤中RPRD1B的表达上调还能够促进β-连环蛋白/转录因子4转录复合体的形成,激活下游Wnt/β-连环蛋白信号通路,诱导肿瘤细胞由上皮性表型向间质性表型转化,增强肿瘤细胞的迁移和侵袭能力,导致肿瘤转移[19]。本研究中,RPRD1B阳性表达的HPV阳性宫颈癌患者生存预后较差,是影响患者不良生存预后的独立危险因素。分析其原因,一方面是RPRD1B阳性表达的HPV阳性宫颈癌肿瘤恶性程度高,肿瘤增殖及侵袭能力强,术中肉眼难以分辨的微小转移灶不易被彻底手术切除,肿瘤术后复发转移风险较高,患者临床预后较差。另一方面,有学者在胰腺癌中发现,RPRD1B能够增强肿瘤细胞对吉西他滨等化疗药的耐药性,导致患者较差的总体生存和无进展生存预后,而敲除肿瘤细胞中RPRD1B 的表达后,肿瘤细胞重新恢复了其对化疗药物治疗的敏感性[20]。因此,RPRD1B是新的HPV阳性宫颈癌患者预后相关肿瘤标志物,以RPRD1B为靶点的治疗是一种潜在的抑制肿瘤增殖、侵袭,增强肿瘤化疗敏感性的治疗方案,值得临床和基础进行深入研究。本研究中,HPV阳性宫颈癌组织中IGF2BP2与RPRD1B蛋白表达呈明显正相关,提示两者在HPV阳性宫颈癌中可能存在协同的作用关系。笔者认为,宫颈癌中IGF2BP2与RPRD1B均受到HPV病毒编码产生的E6/E7蛋白的表达调控,IGF2BP2主要在转录水平调控下游癌基因如c-myc mRNA稳定性,而RPRD1B蛋白主要在蛋白水平调控RNA 翻译和蛋白表达,两者通过激活下游细胞信号传导,促进宫颈癌细胞的恶性增殖和转移[11,17]。但HPV阳性宫颈癌中IGF2BP2与RPRD1B的具体相互作用机制尚不清楚,有待深入的实验研究进一步探索。
综上所述,HPV阳性宫颈癌中IGF2BP2,RPRD1B蛋白表达升高,两者与肿瘤FIGO分期、淋巴结转移有关,共同促进HPV阳性宫颈癌的肿瘤进展。IGF2BP2阳性,RPRD1B阳性是影响HPV阳性宫颈癌患者预后的独立危险因素。临床上,医生可根据IGF2BP2,RPRD1B蛋白表达,对HPV阳性宫颈癌患者的预后进行预测,对于不良预后的高危患者予以积极诊治及随访,改善临床预后,实现肿瘤的个体化治疗。但本研究也有不足之处,本研究是单中心研究,纳入的样本含量较小,结果可能存在一定的偏倚,有待今后设计多中心、多地区的临床实验,进一步研究IGF2BP2,RPRD1B的临床应用价值。
