信迪利单抗致中毒性表皮坏死松解症1例及处理对策
2023-10-10查伟锋温伟为单筠筠
查伟锋,温伟为,王 颖,单筠筠
0 引言
随着科学技术的发展,抑制肿瘤生长的新型药物正在被广泛应用于临床,其中最受欢迎的是细胞毒性T淋巴细胞相关抗原-4(Cytotoxic T lymphocyte associated antigen-4,CTLA-4)抑制剂、程序性死亡蛋白-1(PD-1)抑制剂和程序性死亡蛋白配体-1(PD-L1)抑制剂。这些药物可以有效地控制肿瘤增长,从而大大提高患者的存活率。信迪利单抗具备抗IgG4单克隆特异性,能够与PD-1结合形成稳定的络合物,阻断PD-1与其配体(PD-L1、PD-L2)相互作用而发挥抗肿瘤作用。尽管信迪利单抗抗肿瘤效果明显,但其可能引起T淋巴细胞失衡,从而引发一系列的免疫相关不良反应(Immune-related adverse events,irAEs),甚至会对机体健康造成不可逆转的影响。irAEs可发生于任何组织和器官,不良反应谱广泛,常累及的器官和系统是皮肤(34%~45%)、肝脏(5%)、胃肠道(<19%)、肺(5%~53%)、骨骼肌/结缔组织(15%)及内分泌系统(5%~10%)[1-2]。皮肤是人体最大的器官,受到的影响往往也是最多的。皮肤毒性通常是早期表现,然而,一些患者会在治疗结束后出现皮肤副作用[3]。多数情况下,与免疫相关的皮肤副作用较轻,严重的副作用少见,其表现形式包括从伴嗜酸性粒细胞增多和系统症状的药物性皮炎(Drug rash with eosinophilia and systemic symptoms,DRESS)、急性发热性嗜中性皮炎(Acute febrile neutrophilic dermatosis,Sweet病)、斯蒂文斯-约翰逊综合征(Stevens-Johnson Syndrome,SJS)和中毒性表皮坏死松解症(Toxic epidermal necrolysis,TEN)[4-7]。笔者全程管理救治1例食管癌伴肾转移使用信迪利单抗6个月后出现中毒性表皮坏死松解症的患者,经过对患者病史、用药史以及药物作用机制的全面分析,发现信迪利单抗可能会导致严重的药物相关的皮肤副作用,需要引起临床关注,现报道如下。
1 病例资料
患者,男,58岁,2021年4月3日因“全身皮肤红斑丘疹伴痒半月余”入院。患者半月余前无明显诱因全身皮肤出现大小不等的瘙痒性红斑、丘疹,部分红斑中央呈虹膜样改变,无水疱、大疱、脓疱等损害,2021年3月19日至当地医院住院治疗,诊断为“多形性红斑”,予“甲泼尼龙针40 mg qd静脉滴注”等治疗,2021年3月24日好转出院。出院后口服甲泼尼龙片(16 mg,bid,服用3 d;16 mg,qd,服用4 d)等治疗,停用甲泼尼龙后皮疹再次加重,瘙痒加剧。2021年3月31日和2021年4月2日先后2次至当地医院门诊就诊,以“多磺酸粘多糖乳膏及哈西奈德溶液外用,非索非那定片和雷公藤片口服”治疗,皮疹持续增多。患者21个月前因食管癌行手术治疗,8个月余前因左肾转移行左肾切除,7个月前开始行信迪利单抗治疗(200 mg,每3周1次,共10个周期),在第8个周期时加用紫杉醇和奈达铂,末次治疗时间是2021年3月18日。信迪利单抗治疗3周后,患者面部、颈部间断出现小片状淡红斑,伴有皮屑,外用糖皮质激素药膏可消退。患者既往有乙型病毒性肝炎病史10年,每日口服恩替卡韦治疗,乙肝病毒DNA拷贝在正常低限。否认高血压、糖尿病、冠心病等慢性病,否认外伤史、输血史,否认药物、食物过敏史。入院查体:36.7 ℃,浅表淋巴结未及肿大。颈部、耳、躯干、四肢皮肤散在大小不等的红斑、丘疹,压之褪色,边界尚清,部分皮疹融合成片,背部少许丘疱疹,手足、肘可见绿豆、黄豆大水疱,全身散在抓痕及结痂,无大疱、血疱、脓疱,无糜烂、溃疡。眼、唇、口腔、生殖器及肛周黏膜未累及。入院诊断:多形性红斑。暂予“复方甘草酸苷注射液80 ml qd静滴,抗组胺药口服等”治疗。
入院后病情变化及治疗调整:血常规:白细胞4.9×109/L,红细胞3.31×1012/L,血红蛋白110 g/L,血小板84×109/L,嗜酸性粒细胞百分比4.3%,嗜酸性粒细胞绝对值0.12×109/L;淋巴细胞分型:CD45+淋巴细胞数800×106/L,CD3+T淋巴细胞600×106/L,CD19+B淋巴细胞85×106/L,CD4+辅助性T淋巴细胞311×106/L;CRP 10.9 mg/L;PCT 0.048 ng/ml;白蛋白31.6 g/L;肿瘤指标、抗核抗体、肝肾功能正常。4月4日,患者出现发热,最高体温38.6 ℃,手足部位新发皮疹继续增多,累及唇黏膜,皮损受累面积小于10%的体表面积,修改诊断为重症型多形红斑,停复方甘草酸苷注射液,加用甲泼尼龙注射剂(40 mg,qd)静脉滴注。4月6日,患者发热,最高体温37.8 ℃,皮疹继续增多,累及生殖器黏膜,病情有进一步进展趋势,增加甲泼尼龙剂量至60 mg,加用人免疫球蛋白(22.5 g,qd)静滴治疗5 d;4月7日,患者体温正常,无新发皮疹,皮肤摩擦无松解。4月8日,患者发热,最高体温39.0 ℃,无明显新发皮疹,背部部分红斑摩擦后出现表皮松解。4月9日,患者发热,最高体温38.7 ℃,躯干、上肢表皮松弛,四肢较多水泡,足底大疱,皮损受累面积<10%,诊断调整为SJS。4月10日,患者发热,最高体温38.4 ℃,躯干、四周松弛剥脱面扩大,出现渗出,受累皮肤面积占体表面积的10%~30%,诊断调整为SJS/TEN重叠。4月11-12日,患者体温正常,皮损范围及松解、剥脱面积无变化。4月13日,患者体温正常,背、四肢皮肤出现明显的松解,剥脱糜烂面显著增大,受累面积大于体表面积的30%(图1),诊断调整为TEN,转皮肤重症监护室层流病房。

图1 患者下肢(a)及背部(b)大片皮肤松解剥脱
4月13日,给予患者第1次血液灌流,纳米银辅料覆盖剥脱面。4月15日,给予患者第2次血液灌流,皮疹颜色转暗,水疱有吸收。4月16日,患者水疱继续收干,糜烂面缩小且有新生皮岛。4月17日,给予患者第3次血液灌流,水疱基本吸收,剥脱糜烂面继续缩小,渗出减少。4月18-21日,患者水泡收干,剥脱糜烂面趋向干燥,大片新生皮岛。
4月21日将患者转回普通病房,将甲泼尼龙剂量减为40 mg,静滴至5月13日,以甲泼尼龙片12 mg qd口服出院,此时患者全身皮肤剥脱面基本愈合,仅肘、踝等关节处留有少许创面(图2)。患者在普通病房期间体温正常,转氨酶轻度升高,白蛋白低于30 g/L,予多烯磷脂酰胆碱护肝、白蛋白补充治疗。
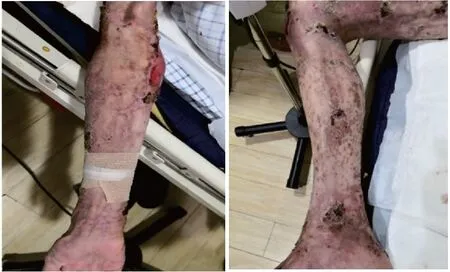
图2 患者治疗后四肢皮疹
2 讨论
2.1 药物不良反应关联性评价 免疫检查点抑制剂(Immune checkpoint inhibitor,ICIs)治疗过程中,皮肤毒性作为一种与药物不良反应有关的免疫反应,其发生率高达30%~50%[8],这一比例在临床实践中极具代表性。本例患者在信迪利单抗治疗早期即发生皮肤毒性反应,表现为面部、颈部间断出现的小片状淡红斑,外用糖皮质激素药膏后消退。在信迪利单抗治疗的第9个周期结束后,出现严重的皮肤免疫毒性反应,经糖皮质激素、静注人免疫球蛋白、血液灌流等治疗后,皮疹愈合。从时间顺序看,符合药物致敏后再次接触发生严重不良反应的一般规律。有文献报道,免疫相关皮肤反应一般在开始治疗的几周内发生,但延迟发生也不少见,甚至在免疫治疗几个月之后发生[9]。该患者存在特殊性,即第8个治疗周期时加用化疗药奈达铂和紫杉醇,是否可能为化疗药物引发的不良反应?根据文献及药品说明书可知,奈达铂的不良反应以骨髓抑制为主,紫杉醇以骨髓抑制和消化系统反应为主,但也有紫杉醇引发SJS的报道[10]。有学者认为,与化疗相关的一般皮肤变化通常是直接毒性作用引起的,并且大多数案例都支持这一观点[10],而SJS/TEN是明确的免疫反应。经过严格的不良反应关联性评估,结果显示,信迪利单抗治疗6个月后,发生TEN是很有可能的[11]。
2.2 药物不良反应发生的可能机制 信迪利单抗已获得国家药品监督管理局批准,适用于复杂的经典型霍奇金淋巴瘤患者接受长期的治疗,直至无效或出现药物引起的严重不良反应时停药。目前,ICIs所致irAEs的具体机制仍不明确,但是已经发现,交叉抗原的共享、免疫系统的非特异性调控、T细胞的多元化是其作用的重要因素[12]。信迪利单抗是一个完整的IgG4单克隆抗体,本身可以被免疫系统视为一种抗原而具有免疫原性,从而产生抗药物抗体(ADA),这种抗体的存在影响药物的清除,增加不良反应的同时降低疗效[13]。该患者在接受信迪利单抗治疗早期即出现1级皮肤免疫反应,第8~10个治疗周期时加用紫杉醇和奈达铂,最终引发了4级皮肤免疫反应,据此推测,这2种药物的骨髓抑制作用对免疫系统造成破坏,与信迪利单抗激活T细胞对肿瘤的免疫监视、增强抗肿瘤免疫反应相抵触。随着抗药抗体的产生,免疫耐受的平衡被破坏,作用于正常皮肤时,表现出自身免疫样的炎性反应。
2.3 药物不良反应防治措施 中华医学会皮肤性病学分会药品不良反应研发管理中心提出了一项重要的药品异常反应预警,以帮助患者更好地应对SJS/TEN[14]。
2.3.1 询问病史 针对患者病情,需询问病史,判断可能的诱发药物,若进一步证实致敏药物,可采取以下检测措施,如斑贴试验、药物诱导的T细胞增殖试验或淋巴细胞因子产生试验。
2.3.2 评估患者的病情进展 评估患者病情符合SCORTEN(Score of toxic epidermal necrolysis)的SJS/TEN进展期评分体系[15],即经过7项指标的测量,预测出患者的死亡率:①年龄超过40岁;②伴有恶性肿瘤;③心率超过120次/min;④入院时表皮松解面积超过10%体表面积;⑤血尿素氮超过10 mmol/L;⑥血葡萄糖超过14 mmol/L;⑦血碳酸氢根小于20 mmol/L。每项1分,分值越高,死亡风险越大,0~7分对应的死亡率分别为1.2%、3.9%、12.2%、32.4%、62.2%、85.0%、95.1%和98.5%。Guégan等[16]的研究表明,入院前5 d的SCORTEN评分的准确性较高,第3天的评估结果更具价值。该患者58岁、伴恶性肿瘤,各计1分,入院时表皮未松解,其余指标正常,总分2分,对应的死亡率为12.2%;若在诊断SJS时评估,则分值为3分,死亡率为32.4%。
2.3.3 管理和治疗 SJS/TEN患者大面积表皮松解剥脱导致体温调节失常、电解质失衡、体液丢失、血容量变化及重要脏器损伤等,且皮肤屏障破坏易引起皮肤感染,甚至败血症、感染性休克等严重并发症。为了确保患者的安全,单独隔离治疗或层流病房很有必要,密切监测生命体征,清洁皮肤,关注预后相关指标,如肌酐、血糖、血清尿素氮、降钙素原、转氨酶等。临床上常将糖皮质激素、静注人免疫球蛋白、环孢素及TNF-α抑制剂作为SJS/TEN的系统治疗方案[14]。早期采取适当的治疗方案,有助于改善患者预后。尽早使用大剂量糖皮质激素可有效抑制炎症反应,降低患者的预测死亡率[17]。人免疫球蛋白能够抑制Fas-FasL的作用和细胞凋亡,联合糖皮质激素,可缩短患者的恢复期,降低死亡率[18],从而达到更好的治疗效果。环孢素具有显著的免疫抑制作用,能够有效缓解炎症。TNF-α抑制剂可阻断TNF-α和细胞表面受体结合,降低炎症反应强度。SJS/TEN的预防可通过检测高风险HLA基因,如针对卡马西平可筛查HLA-B*1502,针对别嘌醇可筛查HLA-B*5801,对某些药物诱发的SJS/TEN进行预测。
3 小结
ICIs的正确使用是决定患者预后的关键因素,必须警惕其中潜藏的irAEs危害,特别是重症皮肤病。信迪利单抗是一种具有潜力的抗癌药物,已经被广泛应用于多种癌症的临床试验中,包括非小细胞肺癌、食道癌等。信迪利单抗所引起的irAEs症状通常轻微,甚至不需要处理,然而,一旦发生严重反应,可危及生命,需高度重视。本例患者从中等剂量糖皮质激素到大剂量,再联合静注人免疫球蛋白,最后给予血液灌流治疗,最终病情控制,痊愈出院。及早识别irAEs并大剂量使用糖皮质激素,早期联合包括静注人免疫球蛋白、TNF-α抑制剂在内的药物,必要时予血液灌流或血浆置换治疗,可改善预后。
