大耳白兔骨髓间充质干细胞的分离培养与生物学鉴定
2023-10-10周世莹刘晏辰张洋杨雪松关伟军高扬
周世莹, 刘晏辰, 张洋, 杨雪松, 关伟军, 高扬*
(1.首都体育学院体育教育训练学院,北京 100191; 2.中国农业科学院北京畜牧兽医研究所,北京 100193)
干细胞的应用前景不断扩大,其体外多向分化潜力、造血功能、促进移植、免疫调节和自我复制的优势也引起了人们的重视[1-2]。间充质干细胞最初在骨髓中分离鉴定出来,骨髓间充质干细胞(bone mesenchymal stem cells, BMSCs)是干细胞家族的重要成员,来源于发育早期的中胚层和外胚层[3-6],具有自我复制和多向分化潜能。间充质干细胞可以在体内或体外的特定环境中被诱导分化成脂肪、骨骼、软骨、肌肉、肌腱、韧带、神经、肝脏、心脏、皮肤等多种细胞,即使是经过长期的培养和冷冻保存,依然具备多向分化的潜力,可以作为一种优质的种子细胞,用来治疗、修复、补充受损或缺损的肝、肌肉、以及衰老和病变所致的组织器官损伤[7-9]。随着干细胞技术越来越成熟,其能够再造一种全新的、正常的甚至更年轻的的细胞、组织和器官[10-11]。由于间充质干细胞来源广泛,易于分离培养,并且具有较强的分化潜能和自体移植等优点,研究者认为其是不久即将被引入临床治疗的最优干细胞[12-14]。日本大耳白兔是常用的试验动物,其BMSCs 方便采集,易于培养,适合生物学特性研究和应用[5,15-17]。本研究以日本大耳白兔BMSCs为材料,采用全骨髓贴壁法进行分离培养和多功能分化研究,建立日本大耳白兔BMSCs 细胞系及鉴定技术平台,为利用BMSCs 进行组织工程研究和动物遗传资源的保存提供参考,同时也为干细胞疗法和干细胞应用技术奠定基础。
1 材料与方法
1.1 试验材料
1.1.1试验动物 日本大耳白胎兔1 周龄,由中国农业科学院北京畜牧兽医研究所实验基地提供。
1.1.2主要试剂与仪器 DMEM/F12、L-DMEM、胎牛血清FBS、磷酸盐缓冲液(phosphate buffered saline,PBS)、地塞米松、DAPI染色液、ITS均购自美国Gibco 公司;抗坏血盐酸、β-甘油磷酸、L-脯氨酸、吲哚美辛、Ⅰ胰岛素、IBMX、油红O、V 型胶原酶、胰蛋白酶、Triton X-100 均购自美国Sigma 公司;HGF、Bfgf 均购自美国Peprotech 公司;RNA PCR Kit (AMV) Ver.3.0 购自TaKaRa 公司;茜素红染液、冰醋酸、无水甲醇、多聚甲醛均购自北京化学试剂公司;山羊封闭血清、FITC标记山羊抗兔二抗均购自武汉博士德生物工程有限公司;阿利新蓝购自北京中衫金桥生物有限公司;Trizol 购自美国invitrogen公司;100×青霉素、100×链霉素均购自北京索莱宝公司;CD29、CD44、CD73、CD90、CD105、CD166、CD45 抗体均购自北京博奥森生物技术有限公司;Giemsa染液购自北京佳辰科技有限公司。HF100 37.5 ℃ 5% CO2培养箱,德国Heraeus公司;DL-CJ-2N 高性能无菌实验台,中国哈尔滨东联电子技术开发有限公司;TDZS-WS 多管架自动平衡离心机,中国上海精宏实验仪器设备有限公司;1-15K 高速离心机,美国Sigma 公司;电子分析天平BS124S,德国赛多利斯;IX-71 倒置显微镜、CX31 生物显微镜、体视显微镜OLYMPUS SZ61,日本Olympus公司。
1.2 日本大耳白兔BMSCs的体外分离培养
1.2.1细胞分离 胎兔全身用75%乙醇消毒,放置在无菌操作台解剖,取其脊椎放置于含有1×青霉素、链霉素的PBS中,浸泡1 min后转移至超净工作台拿出脊椎,用含5×双抗的PBS 连续清洗5~10 次,放入60 mm 的无菌培养皿,用无菌镊子和眼科剪将脊椎周围的结缔组织、肌肉等剔除干净,用微型注射器将脊椎椎体的骨髓腔冲至无菌培养皿中,然后将冲出的骨髓液用离心管收集,1 2000 r·min-1下离心5 min,弃上清液。
1.2.2细胞培养 将上述分离的细胞用完全培养基(DMEM/F12 培养基、14% FBS、10 ng·mL-1Bfgf)重悬,接种于60 mm 细胞培养皿中,将余下的脊椎椎体用眼科剪剪碎,采用全骨髓贴壁法置于37 ℃、5% CO2培养箱中培养[11]。接种1 周后细胞密度在80%~85%时进行换液传代,用PBS 连续清洗1~2 次,0.25%胰酶消化,在倒置显微镜下观察细胞是否脱落,可以轻轻拍打,之后用完全培养基终止消化,以1∶2 传代至新的60 mm 无菌培养皿,标记为P1 代,培养4 代细胞逐渐纯化。
1.3 日本大耳白兔BMSCs的细胞冻存与复苏
细胞冻存:用显微镜观察法测定,当细胞生长密度在90%~95%时进行消化,2 min后加入1 mL终止消化液(DMEM/F12培养基、15% FBS),把15 mL离心管置于水平离心机,1 200 r·min-1离心8 min,用细胞计数板计算细胞总数,使用完全培养基稀释调整细胞密度为1×105cell·mL-1,加入1 mL 细胞冻存液(DMEM/F12 培养基、10% DMSO、40% FBS)至冻存管中,梯度降温存储(4 ℃ 1 h,-80 ℃ 24 h,液氮长期)。
细胞复苏:从液氮中取出需要的细胞冻存管,快速在37 ℃水浴锅解冻,1~2 min 后用75%乙醇消毒,然后在超净工作台中操作,加入4~5倍完全培养基,1 200 r·min-1离心10 min,弃掉上清液,加入DMEM/F12 完全培养基重悬细胞,根据细胞数量和活力调整细胞密度,接种培养至60 mm 无菌培养皿中[16]。在倒置式显微镜下,观察培养传代BMSCs细胞形态、贴壁状况并记录拍照。
1.4 日本大耳白兔BMSCs 不同代次的生长动力学检测
分别选取代次为5(P5)、10(P10)、15(P15)的细胞,用显微镜观察法测定,当密度达到80%~90%时常规消化收集细胞于15 mL 离心管,绘制生长曲线。①用血球计数板计数,使用完全培养基稀释调整每孔的细胞密度在1.0×104cell·mL-1;②把细胞接种于24 孔板,2 mL 完全培养基,放置培养箱培养;③培养24 h后随机选取3孔P5、P10、P15 细胞用血球计数板计算细胞数,为防止数值偏差每次取3 个孔取其平均值,连续7 d 计算细胞数量、根据数值绘制曲线,用公式(1)计算群体倍增时间(pupolation doubling time, PDT)[16]。
式中,to为起始时间;t为终止时间;N0为初始细胞个数;Nt为终止细胞个数。
1.5 日本大耳白兔BMSCs 划痕试验及克隆形成能力检测
为研究细胞的迁移运动和修复能力,采集P5代细胞,待细胞密度至90%~99%时,用200 µL 的枪头尖在细胞皿中快速从左到右垂直划3 次痕,枪头保持垂直于培养皿,PBS 清洗3 次除去被划去的细胞,加入3 mL 完全培养基,拍照后放置于培养箱,每3 h 观察并拍照,直到细胞再次覆盖终止试验,以此模拟细胞修复“划痕伤口”,也称伤口愈合试验。
取P3、P9、P15 代的BMSCs,用0.25%胰蛋白酶消化收集细胞,分别以100·孔-1的细胞密度接种于六孔板中,放置于饱和湿度培养箱进行培养;当出现多数形状呈团状的克隆团时,弃培养基,PBS 清洗2~3 次,加入2 mL 4%多聚甲醛30 min,加入3 mL Giemsa 染液染色30 min;然后用蒸馏水缓慢冲洗,加入1~2 mL PBS,通过倒置式显微镜对克隆团的形态和数量进行观察,并用公式(2)计算克隆形成率[12]。
1.6 日本大耳白兔BMSCs 的免疫荧光检测
取密度在90%左右的P5 代细胞,常规消化,分置在6 孔板中,转入培养箱培养,24 h 后用新配的4%多聚甲醛固定细胞25 min;PBS 缓慢冲洗2 次,每孔加入1 mL 0.1% Triton X-100 通透细胞,PBS 缓慢冲洗2 次,加入1 mL PBS 稀释的10%山羊血清封闭30 min,吸出后直接加入PBS 按1∶10稀释的山羊抗鼠一抗CD29、CD44、CD73、CD105,4 ℃孵育过夜,PBS 缓慢冲洗3 次,加入0.99 mL PBS、0.01 mL FITC 标记山羊抗鼠二抗,37 ℃避光1 h,PBS 缓慢冲洗2 次,加入DAPI 染液,37 ℃避光 15 min,PBS 缓慢冲洗1 次,加入1 mL PBS,在激光共聚焦显微镜下观察拍照并记录。以造血干细胞表面分子标记CD45进行免疫荧光鉴定。
1.7 日本大耳白兔BMSCs RT-PCR检测
用Trizol 法提取P5 代细胞总RNA,提取成功后进行反转录,用TaKaRa 反转录试剂盒合成cDNA,反转录体系容量为20 µL。从NCBI 查找间充质干细胞特异性基因(GAPDH、CD29、CD44、CD73、CD105)、造血干细胞分子基因CD45、成骨特异性基因(collage typeⅠ、osteopontin)、成脂特异性基因(PPAR-γ,LPL)成软骨特异性基因(GAPDH、ACAN、SOX9)序列,通过Primer premier 5.0 软件设计引物(表1),引物均由上海生物工程技术服务有限公司合成。PCR 反应体系50 µL:2×TaqPCR Mix 25 µL,Rnase Free H2O 19 µL, 模板cDNA 2µL,上、下游引物各2 µL。PCR反应条件:94 ℃预变性4 min,94 ℃变性30 s,60 ℃退火30 min,72 ℃延伸30 s,25 个循环;72 ℃终延伸5 min。反应结束后,用1.7%琼脂多糖凝胶电泳30~35 min后凝胶成像系统下拍照。

表1 引物信息Table 1 Primer information
1.8 日本大耳白兔BMSCs诱导分化能力鉴定
1.8.1成骨诱导 取P3 代大耳白兔BMSCs,当细胞密度至60%~70%时加入成骨诱导液(DMEM/F12 培养基+5% FBS+100 µg·mL-1青、链霉素+0.5µmol·L-1地塞米松+10 mmol·L-1β-甘油磷酸钠+50 µg·mL-1抗坏血酸),每3 d 换液1 次,诱导培养2周左右,参照说明书进行茜素红染色鉴定。
1.8.2成软骨诱导 取P3 代大耳白兔BMSCs,当细胞密度为60% 左右时加入成软骨诱导液(DMEM/F12 培养基+2.5%FBS+ 0.1 µmol·L-1地塞米松+50 µg·mL-1抗坏血酸+0.9 mmol·L-1丙酮酸钠+1%ITS+50 µg·mL-1脯氨酸+100 µg·mL-1青、链霉素+10 ng·mL-1TGF-β3)进行诱导。在2~3 周的时间里,每2~3 d 换液1 次,每天观察细胞是否向软骨细胞形态转变,参照说明书加入阿利新蓝染液进行染色并拍照。
1.8.3成脂诱导 取P3 代大耳白兔BMSCs,当细胞密度至60%时弃原培养基,加入成脂诱导液(DMEM/F12 培养基+10%FBS+1.1 µmol·L-1地塞米松+10 mg·L-1胰岛素+0.5 mol·L-1IBMX+100 µg·mL-1青链霉素+200 µmol·L-1吲哚美辛)。在3 周左右的诱导时间内,每2~3 d 给细胞换液1 次,当发现细胞出现较多脂滴形态后,加入2 mL 4%多聚甲醛 20 min,用PBS 清洗2~3 次,参照说明书使用油红O染色液染色并拍照。
2 结果与分析
2.1 日本大耳白兔BMSCs形态学分析
采用全骨髓贴壁法在培养箱培养1 周后,合适的组织块周围开始不断有呈长梭形、小弓箭型、漩涡形排列的细胞长出(图1):P1 代细胞除了间充质细胞外,可能还存在其他成纤维性细胞,细胞纯度会随着代次增加而提高,在换代的过程中逐渐弃掉其他细胞;P3 代间充质细胞纯度较高,细胞呈对数期增长,1~2 d 传代1 次;至P28 代时,细胞颜色浑浊,排列混乱,细胞黑斑出现,细胞密度在50%~60%,空泡较多,传代后增殖缓慢,没有活力,甚至不再增殖,细胞开始脱落,传代时间达到4~5 d,这些都是细胞衰老的特征,说明BMSCs 的增殖能力是有限的,随着传代次数增加衰老特征逐渐明显,符合细胞生长正常规律。

图1 日本大耳白兔骨髓间充质干细胞形态Fig. 1 BMSCs morphology of Japanese large ear white rabbits
2.2 日本大耳白兔BMSCs复苏前后活力形态
在细胞培养的过程中,P10 代之前细胞的生长速度和增殖活力强,按1 传2 的比例进行传代,为了实现更有效的细胞资源合理配置,遵循可持续发展原则,在传代的过程中对细胞进行冷冻保存。在试验过程中,将P7 代冻存的细胞进行复苏,对比观察复苏前和复苏后的细胞发现, 复苏前后细胞状态变化不明显,仍具有很强的生命活力(图2)。
图2 日本大耳白兔骨髓间充质干细胞复苏前后形态Fig. 2 Resuscitation morphology of Japanese large ear white rabbits BMSCs before and after recovery
2.3 日本大耳白兔BMSCs 不同代次生长曲线及群体倍增时间
将日本大耳白兔BMSCs 以1×104cell·mL-1接种于24 孔板培养,选取P5、P10、P15 代细胞进行生长曲线测定与绘制(图3),日本大耳白兔BMSCs低、中、高代次的生长曲线和增值时间大致相似,都呈“S”形,第1~2 天增殖缓慢,为潜伏期;第3~4天增殖加快,代次越低,增殖越快,第4~5 天为细胞对数生长期;第6~7 天趋于平缓,为平台期。P5、P10、P15 代间充质干细胞的群体倍增时间分别是47.37、52.06、56.10 h。
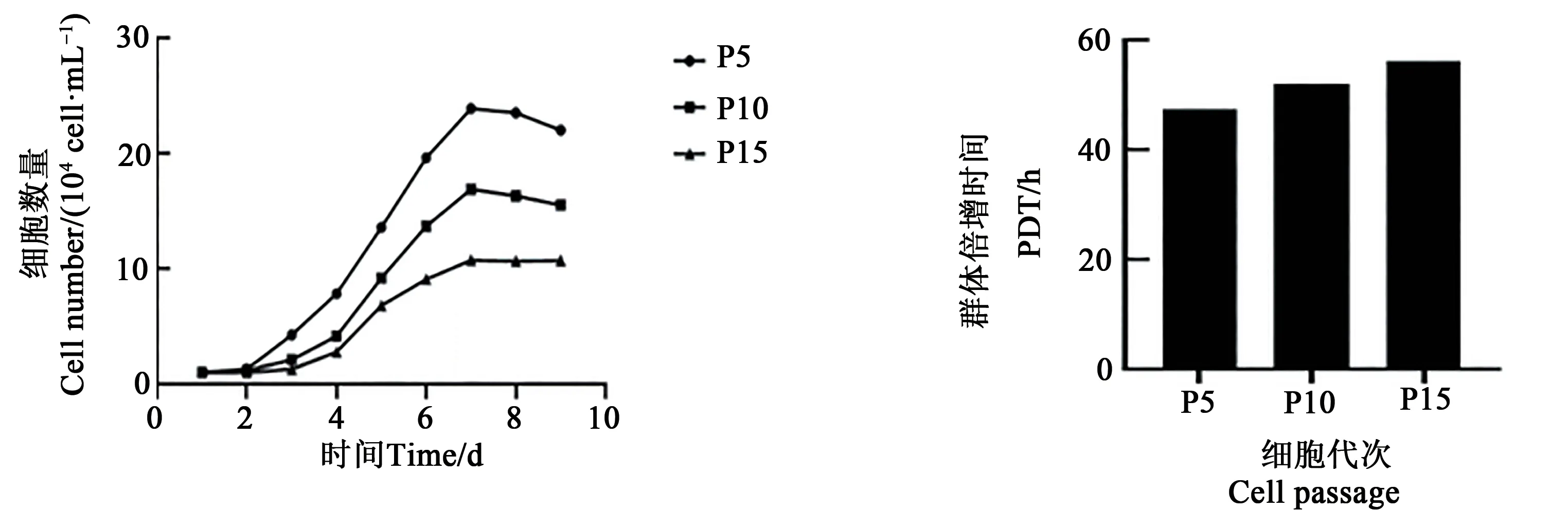
图3 日本大耳白兔骨髓间充质干细胞生长曲线及群体倍增时间Fig. 3 Growth curve, population doubling time of BMSCs in Japanese large ear white rabbits
2.4 日本大耳白兔BMSCs 细胞迁移及克隆形成率
划痕后,每3 h观察拍照1次,6 h内细胞已完全覆盖(图4A)。克隆铺板2周后,对不同代次大耳白兔BMSCs 进行Giemsa 染色,观察克隆染色形成情况,P3、P9、P15克隆形成率分别是(31.50%±1.57%)、(26.70%±2.00%)和(29.15%±1.97%)(图4B)。
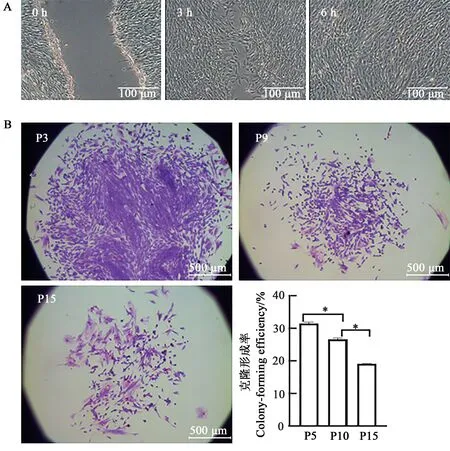
图4 日本大耳白兔骨髓间充质干细胞划痕试验及不同代次克隆形成能力Fig. 4 Scratching experiment and clonogenic ability of Japanese large ear white rabbits BMSCs
2.5 日本大耳白兔BMSCs 相关表面标记物鉴定分析
基于间充质干细胞特异性标记基因CD29、CD44、CD73、CD105,检测P4 代日本大耳白兔BMSCs免疫荧光表面标记物,均呈阳性表达。造血细胞表面分子标记CD45呈阴性表达(图5)。对日本大耳白兔BMSCs进行RT-PCR检测结果显示,除了不表达CD45外,CD29、CD44、CD73、CD105均呈阳性表达,符合间充质干细胞生物学特性(图6)。
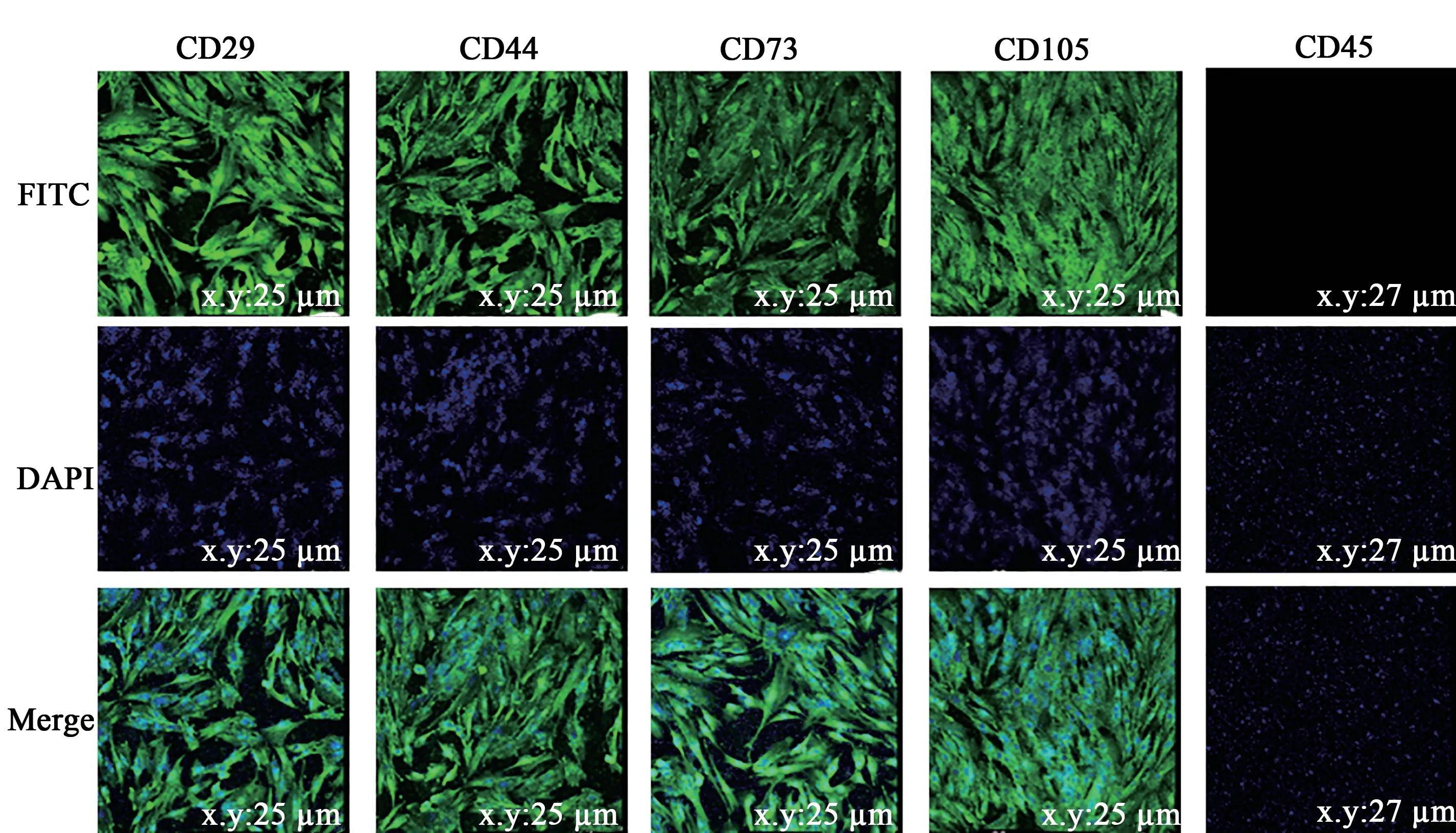
图5 日本大耳白兔骨髓间充质干细胞免疫荧光Fig. 5 Immunofluorescence of Japanese large ear white rabbits BMSCs
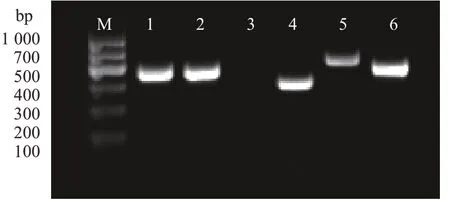
图6 表面标记物RT-PCR检测Fig. 6 RT-PCR result of marker genes
2.6 日本大耳白兔BMSCs成骨诱导分化
第4 代细胞开始采用成骨诱导液培养21 d后,细胞不再是长梭形,开始逐渐形成不规则的骨结节形态;经茜素红染液染色后,骨结节呈现鲜艳深红色(图7)。RT-PCR 结果显示,Ⅰ型胶原蛋白(collage type Ⅰ)和骨桥蛋白(osteopontin, OPN)基因均呈阳性表达。
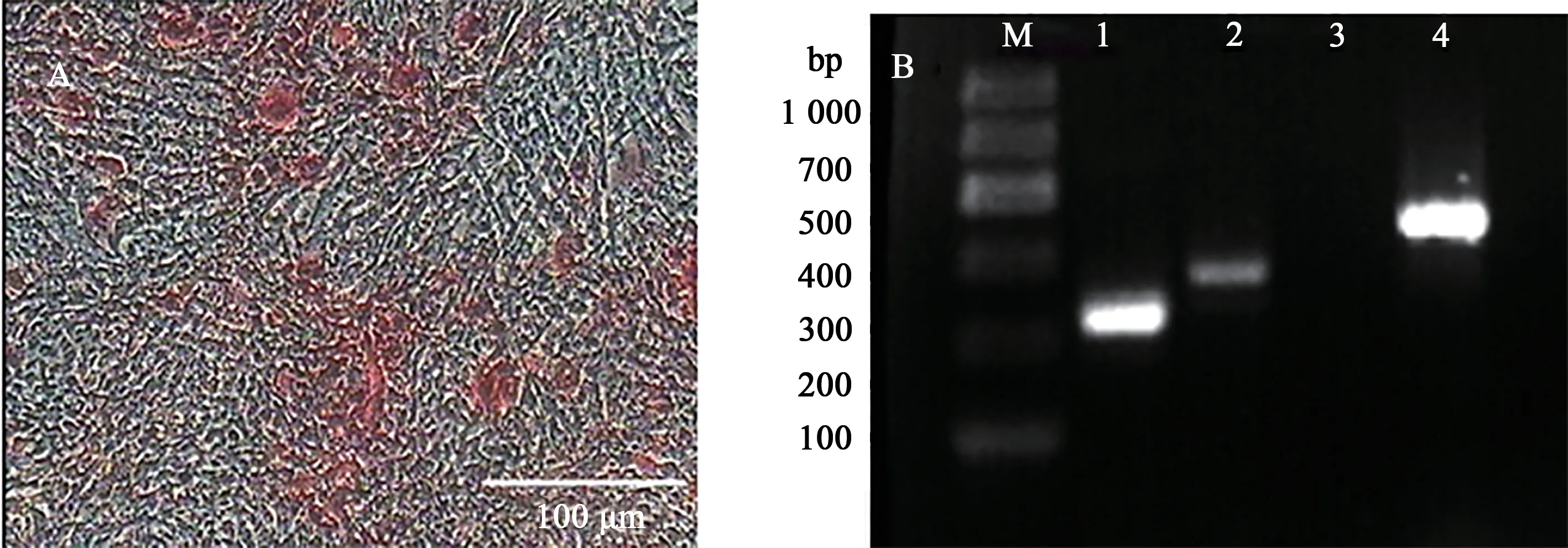
图7 日本大耳白兔骨髓间充质干细胞成骨分化钙沉积茜素红染色和RT-PCR检测Fig. 7 Detection of calcium deposition in osteoblastic differentiation of Japanese large ear white rabbits BMSCs using alizarin red and RT-PCR
2.7 日本大耳白兔BMSCs成软骨诱导分化
P4 代细胞经软骨诱导液诱导,其形态并未发生明显变化,随着诱导时间延长软骨结节才慢慢凸显,14 d后经阿利新蓝染液染色后,周围形态和排列发生改变,软骨结节呈蓝色。提取RNA 后经RT-PCR 鉴定,该细胞表达ACAN 和SOX9 基因(图8)。
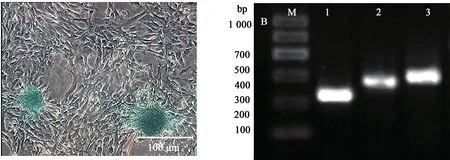
图8 日本大耳白兔骨髓间充质干细胞成软骨分化阿利新蓝染色和RT-PCR检测Fig. 8 Detection of chondrogenic differentiation of Japanese large ear white rabbits BMSCs using Alixin blue and RT-PCR
2.8 日本大耳白兔BMSCs成脂诱导分化
传代至P4 代细胞时,采用成脂诱导液培养14 d 后,细胞质内出现数量不等、大小不一、透亮的脂滴,均呈环样分布;经油红O 染色后,脂滴呈现鲜艳深红色。提取RNA 后,RT-PCR 鉴定结果显示,成脂特性基因LPL 和PPAR-γ 呈阳性表达(图9)。

图9 日本大耳白兔骨髓间充质干细胞成脂分化油红O染色和RT-PCR检测Fig.9 Oil red O staining and RT-PCR detection of adipogenic differentiation of Japanese large ear white rabbits BMSCs
3 讨 论
本研究采用全骨髓贴壁法获取日本大耳白兔BMSCs,考虑到细胞生长所需和材料设备有限等因素,以及在本试验中发现含有12%胎牛血清的培养基可使细胞达到最优生长状态,符合细胞生长规律,因此选出大耳白兔BMSCs 最佳培养体系为217.5 mL 基础培养基+32.5 mL 胎牛血清(FBS)+100 µL 10 ng·mL-1Bfgf+50 µL 20 ng·mL-1EGF+1%谷氨酰胺+1%双抗。其中Bfgf、EGF 是促进细胞生长的因子,具有联合促进细胞生长的作用,谷氨酰胺是必需氨基酸,能够维持细胞正常的生长和代谢,但极不稳定,所以试验过程中需要及时换液[18-21]。在传代消化过程中,要严格把控时间,尽量减少胰蛋白酶对细胞活性的影响,在量的使用和消化时间的把控方面需要严格控制,以延长细胞的寿命[22]。细胞增殖数量呈“S”形,经过潜伏期,细胞能达到最快生长阶段即对数期,随即进入平台期和衰败期。在划痕试验中,人为制造“划痕/伤口”,该细胞在6 h 内再次长满,说明细胞迁移能力和增殖能力较强,随着细胞代次更迭,以及胰酶、离心等操作对细胞造成了一定伤害,在P10代之后细胞迁移能力下降,修复能力减弱,划痕试验可能在免疫、炎症、肿瘤转移、损伤修复及胚胎发育中都会涉及、参与和相互影响[23-24],因此用干细胞治疗损伤,最好选取代次低的细胞,从而保证修复效果。克隆能力检测试验中,细胞从单个均匀分散的状态,经过快速增殖,变成单个克隆团,说明细胞具有较强的增殖能力。在免疫荧光试验中,需要注意细胞密度不宜过大,以免影响细胞正常形态,在此前提下进行后续操作,可提高试验的成功率和完成度。利用CD29、CD44、CD73、CD105这4 种细胞表面标记物基因,对大耳白兔BMSCs 进行RT-PCR 鉴定,除了阴性对照CD45外,其他都呈阳性表达,鉴定该细胞就是日本大耳白兔BMSCs。CD45是造血干细胞/祖细胞的标志,在造血干细胞中表达,造血干细胞主要存在于造血组织,骨髓中分布最多,其次是脐带[25],因此该阴性对照对大耳白兔BMSCs 的生物学鉴定有重要作用和意义。在检测细胞多潜能分化能力试验中,在细胞中加入成骨、成软骨、成脂肪诱导液[26],经2~3 周诱导,通过观察判断细胞诱导程度,本试验中成骨诱导时间快于成软骨诱导快于成脂肪诱导,该细胞成功分化出了成骨、成软骨和成脂细胞,说明细胞具有多向分化的潜能,与Liu等[28]对诱导分化时间的研究结果一致。
本研究通过全骨髓贴壁法成功获取大耳白兔BMSCs,从细胞形态学进行观察,并进行了分子生物学相关鉴定,该细胞在一定的诱导条件下能够分化为骨骼、软骨、脂肪细胞,具有良好的体外增殖能力和多向分化潜能;可为治疗运动损伤提供优质的种子细胞[29-30],也为利用BMSCs 进行组织与工程学研究和动物遗传资源的保存研究奠定理论基础。
