响应面法改良牟氏角毛藻培养基
2023-10-10李琦张树林张达娟贾滢暄王泽斌
李琦, 张树林, 张达娟, 贾滢暄, 王泽斌
(天津农学院水产学院,天津市水产生态及养殖重点实验室,天津 300392)
微藻是水生态系统初级生产力的主要贡献者,含有丰富的蛋白质、多不饱和脂肪酸、类胡萝卜素、维生素等营养物质,不仅是水生动物的优质天然饵料,而且在保健食品、药物、饲料、化妆品、生物农药、废水治理等方面具有较广泛的应用前景,亦可用于改善水质[1-5],进行水质调控。牟氏角毛藻(Chaetoceros muelleri)是一种海洋硅藻,隶属硅藻门(Bacillariophyta),其营养丰富、生长迅速、大小适宜,便于对虾早期幼体摄食,是对虾育苗中常用的饵料微藻,其规模化培养一直是研究的热点之一。
朱昔恩等[6]研究表明,NaNO3效果优于CO(NH2)2且NaNO3在25~100 mg·L-1时效果最好,磷和硅分别在2.5 和30 mg·L-1时有利于牟氏角毛藻生长;林权卓等[7]、张贵杰等[8]研究不同的氮源对牟氏角毛藻增殖的影响,均认为CO(NH2)2效果优于NaNO3;于瑾等[9]通过单因素试验研究表明,氮、磷和铁对牟氏角毛藻生长影响显著,在正交试验中,当氮和磷质量浓度分别为35和1.5 mg·L-1时,牟氏角毛藻生长最快,此时受氮的影响,铁对牟氏角毛藻的生长影响不显著。以上研究表明,营养盐的不同种类和含量水平对牟氏角毛藻的生长有显著影响,但各研究结果之间存在一定的差异,归其原因是培养基成分种类繁多,关系错综复杂。单因素法仅考虑单一因素的影响,缺乏因素间的交互性,正交试验法虽能同时考虑多种因素,但不能得出因素和响应值之间明确的函数表达式(即回归方程),进而无法求得整个区域中因素的最佳组合和最优值[10]。因此选用高效的方法尤为重要,数学统计中的优化方法已广泛应用于微生物发酵培养基的优化,其中以响应面法的效果最显著[11]。响应面法克服正交试验法不能给出直观图像的缺点,弥补传统方法中非线性关系的深度不足并且考虑误差,建立多项数学模型,对模型进行显著性检验并得出最优值。本研究用响应面法优化牟氏角毛藻培养基,筛选营养盐最佳质量浓度,为其高密度培养提供参考。
1 材料与方法
1.1 试验材料
牟氏角毛藻购自上海光语生物科技有限公司,在f/2 培养基上于光照培养箱(MLR352-PC,日本三洋有限公司)中进行培养,盐度29,培养温度为(22±1)℃,光照强度为50 µmol·m-2·s-1,光照/黑暗时间为12 h/12 h,每天摇瓶3次,防止沉淀。
1.2 试验设计
1.2.1单因素试验设计 采用单因素试验法对f/2培养基的各营养盐浓度进行筛选,氮(NaNO3)、磷(NaH2PO4·H2O)、硅(Na2SiO3)、铁(C6H8FeNO7),每种营养盐均设置1 个对照组(0 mg·L-1)和6 个试验组(表1),每个试验组分别设置3 次重复。取对数生长期的牟氏角毛藻离心(5 000 r·min-1,5 min,4 ℃)并去上清液,将藻泥加入经高温灭菌的上述各试验组的培养基中,藻细胞初始密度均为1×106cell·mL-1。试验进行14 d,培养条件同1.1 藻种培养,在第8 天使用血球计数板进行藻细胞计数,确定4 种营养盐的最适质量浓度范围。
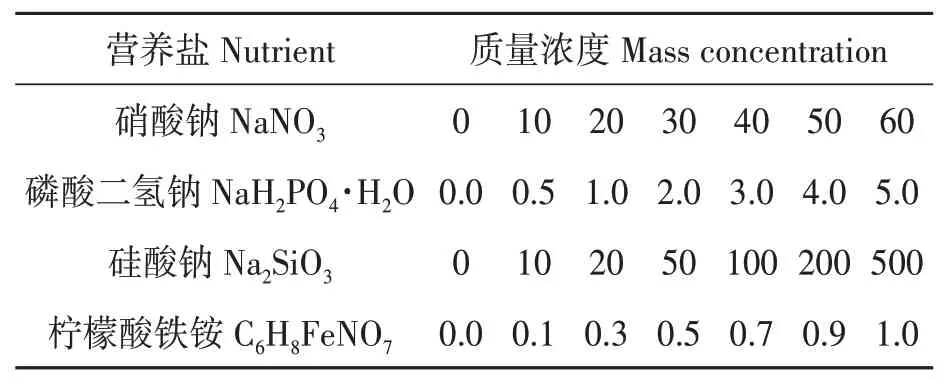
表1 营养盐单因素水平Table 1 Single factor level of nutrients (mg·L-1)
1.2.2响应面法试验设计 以A、B、C 和D 分别代表NaNO3、NaH2PO4·H2O、Na2SiO3和C6H8FeNO7,经单因素试验法筛选出的A、B、C 和D 的适宜质量浓度,以此为基础分别设置3 个水平(表2),以密度(Y)为响应值,采用Design Expert 11.0 统计分析软件的响应面分析法优化试验[11-15],每组设置3 次重复,共设计29 个试验点(中心点重复5 次,用于估计试验误差),以获取最佳营养盐质量浓度。
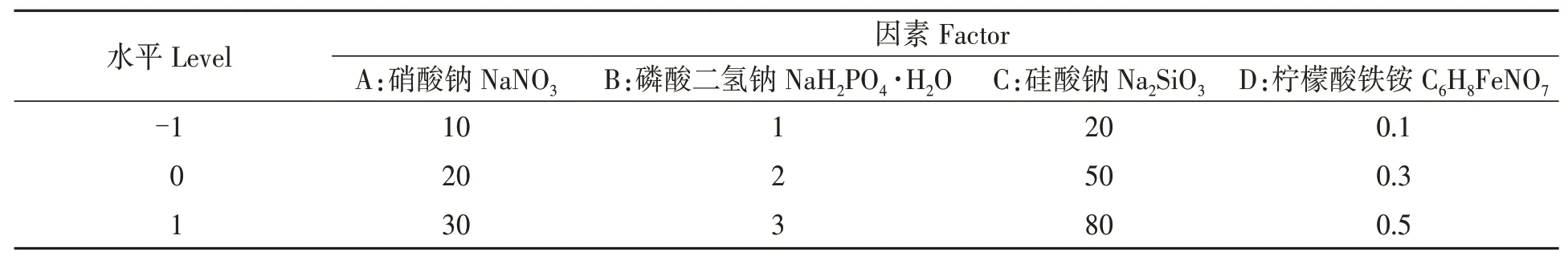
表2 Box-Behnken 试验因素水平Table 2 Box Behnken experimental factor level(mg·L-1)
1.3 数据处理
数据使用平均值±标准差表示,使用Design-Expert11.0 软件绘制等高线和响应曲面图。利用SPSS 17.0 统计软件对数据进行单因素方差分析,使用Original绘图制表。
2 结果与分析
2.1 营养盐单因素试验结果分析
不同质量浓度的单一营养盐对牟氏角毛藻生长的影响如图1 所示,在培养至第8 天时,牟氏角毛藻密度分别在NaNO3质量浓度为20 mg·L-1、NaH2PO4·H2O质量浓度为2 mg·L-1、Na2SiO3质量浓度为50 mg·L-1、C6H8FeNO7质量浓度为0.3 mg·L-1时达到最大值,分别为6.90×106,6.07×106,5.15×106,5.12×106cell·mL-1,均显著高于对照组和其他试验组(P<0.05),根据牟氏角毛藻生长情况初步选择10~30 mg·L-1的NaNO3、1.0~3.0 mg·L-1的NaH2PO4·H2O、20~80 mg·L-1的Na2SiO3和0.1~0.5 mg·L-1的C6H8FeNO7进行响应优化。
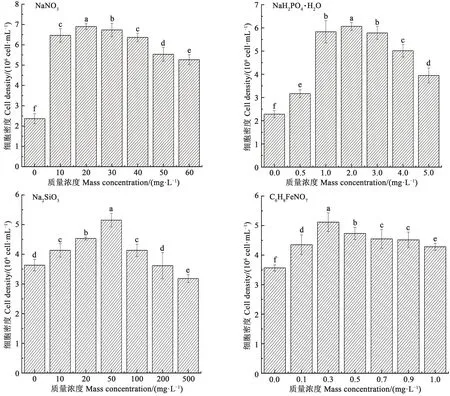
图1 不同营养盐对牟氏角毛藻生长的影响Fig. 1 Growth of Chaetoceros muelleri with different nutrient species
2.2 响应面法试验结果分析
2.2.1回归分析 响应面法结果见表3,将数据通过Design-Expert 11.0 软件拟合,得到细胞密度(Y)和NaNO3(A)、NaH2PO4·H2O(B)、Na2SiO3(C)和C6H8FeNO7(D)的回归方程如下。
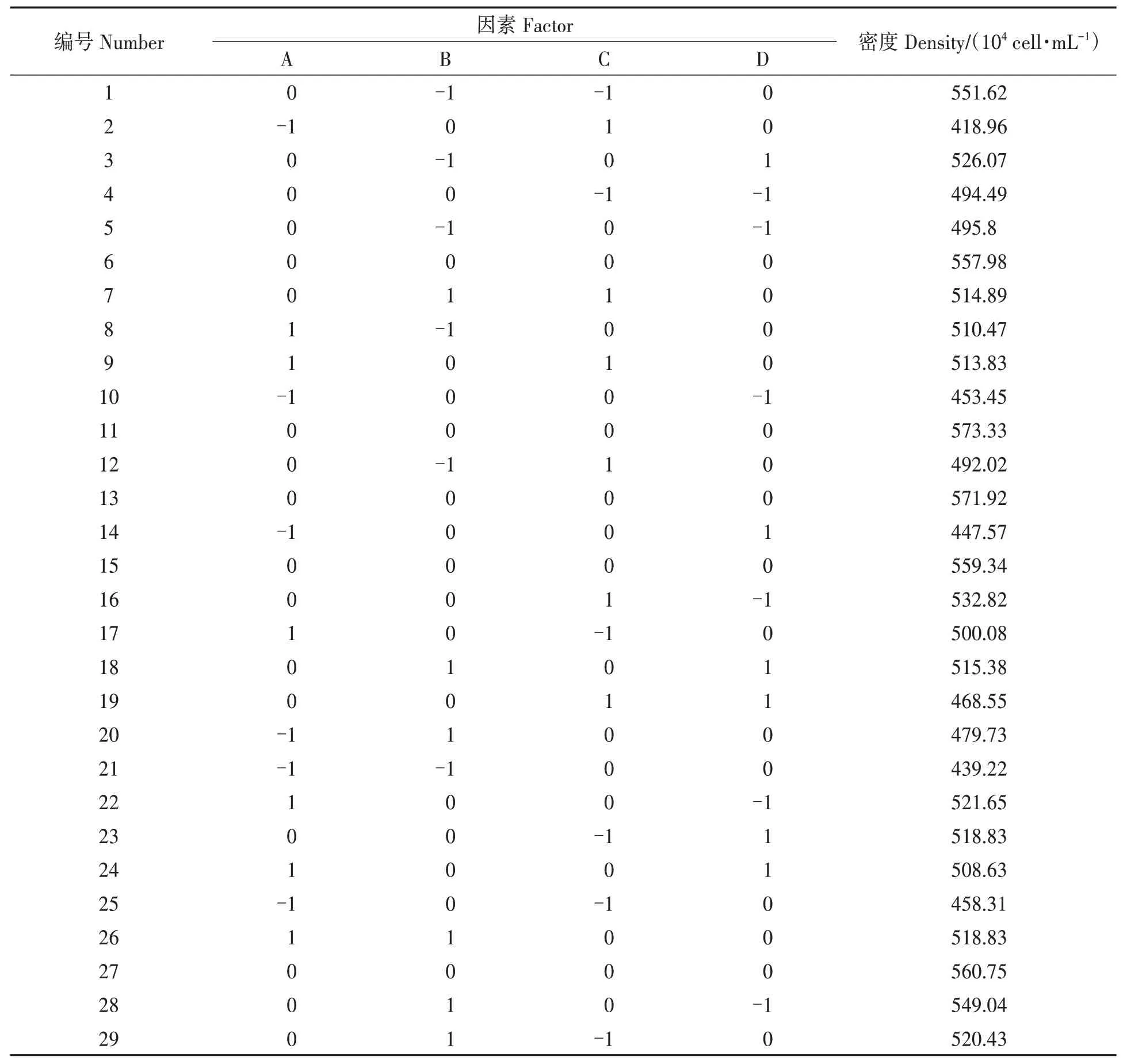
表3 响应面法试验结果Table 3 Experimental results of response surface method
2.2.2方差及残差分析 对上述模型进行方差分析,结果如表4 所示,该回归方程的F值为29.89,P<0.000 1,模型极显著;由显著性水平检验可知,A、B、C、AC、BC、BD、CD、A2、B2、C2和D2项对细胞密度影响显著(P<0.05);其中决定系数R2=0.967 6,矫正系数R2=0.935 3;该模型中精密度值测量精度为19.407 7,当精密度值测量精度大于4 时可用;通过残差分析,残差的正态概率分布图和预测值与试验实际值的分布图(图2~4)可以看出,图里的各个散点都靠近同一条直线。综上所述,该模型中细胞密度对NaNO3、NaH2PO4·H2O、Na2SiO3和C6H8FeNO7有较好的拟合性。
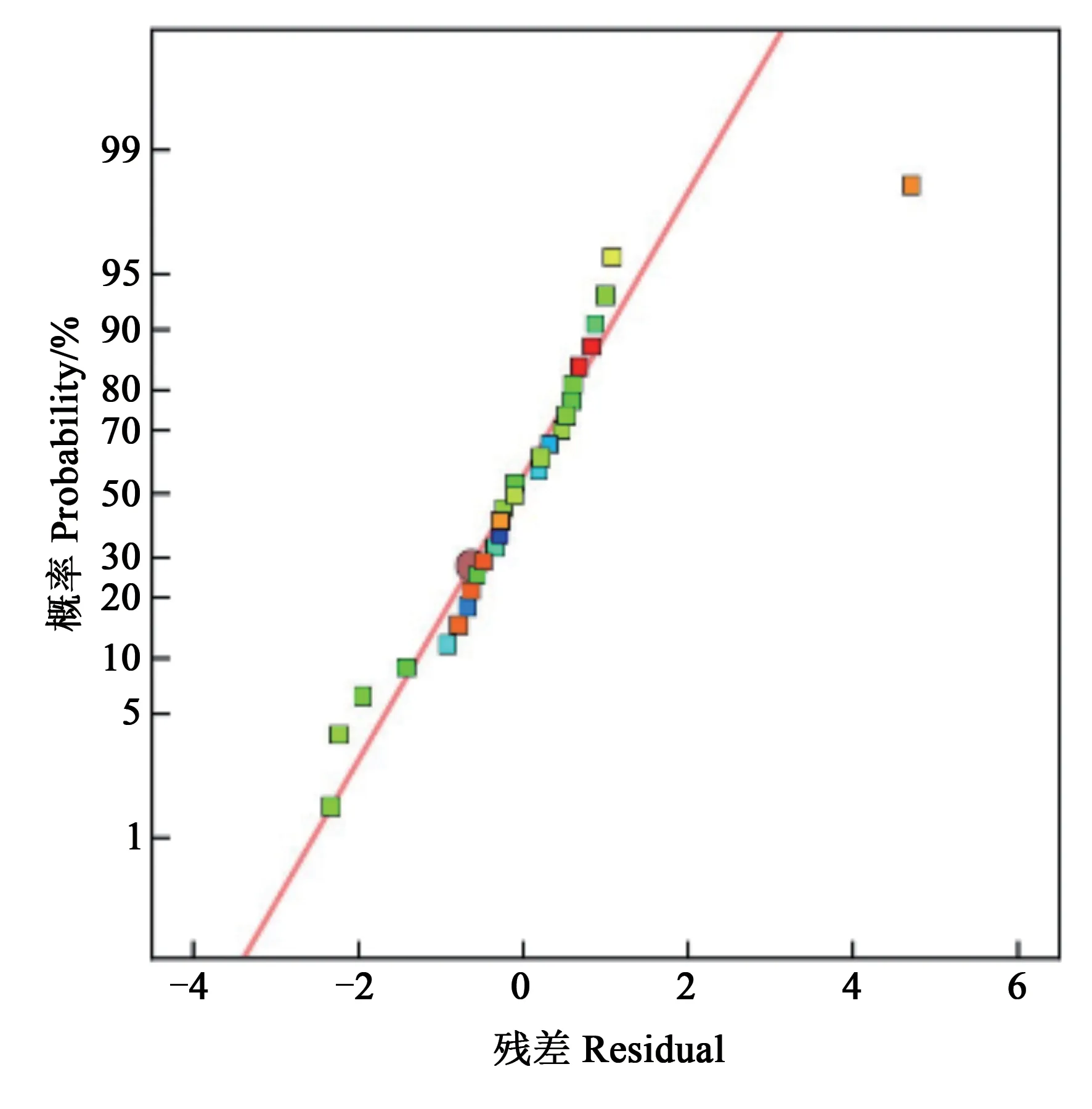
图2 残差的正态概率分布Fig. 2 Normal probability distribution of residuals

图3 残差与方程预测值分布Fig. 3 Residual error and predicted value distribution of the equation

图4 预测值与试验实际值分布Fig. 4 Distribution diagram of predicted value and actual value in experiment
2.2.3响应面法交互作用分析 NaNO3、NaH2PO4·H2O、Na2SiO3、C6H8FeNO7间交互作用的响应面分析见图5,当NaH2PO4·H2O(B)和C6H8FeNO7(D)分别为2 和0.3 mg·L-1时,NaNO3(A)和Na2SiO3(C)的交互作用对牟氏角毛藻密度的影响,结合方差分析表可知P<0.05,等高线呈椭圆形且密集,说明这2 个因素有较强的交互作用;随着NaNO3和Na2SiO3质量浓度的增加,藻细胞密度先上升后下降,NaNO3的幅度大于Na2SiO3的幅度,表明NaNO3在两者之间的交互影响大于Na2SiO3;同时质量浓度适当的NaNO3和Na2SiO3可在一定程度上提高藻细胞密度。由图5 结合表4可知,等高线明显呈椭圆形且较密集,说明各因素间交互作用强,对密度影响极显著;随着质量浓度的增加,曲面呈先升后降趋势,在水平靠近0时,藻密度(Y)最大。Na2SiO3(C)和C6H8FeNO7(D)分别为50 和0.3 mg·L-1时,NaNO3(A)和NaH2PO4·H2O(B)的交互作用对牟氏角毛藻密度的影响,等高线呈椭圆形,说明NaNO3和NaH2PO4·H2O 有交互作用,结合方差分析可知P>0.05,表明这2 个因素交互作用较弱;随着NaNO3和NaH2PO4·H2O 质量浓度的增加,细胞密度分别在水平0右侧和靠近水平1的地方达到最大密度。NaNO3和C6H8FeNO7等高线呈椭圆特征,说明 NaNO3和C6H8FeNO7有交互作用,在表4中2因素表现为P>0.1,密度影响不显著,交互作用较弱。

图5 各因素交互作用对细胞密度的等高线和响应面图Fig. 5 Contour line and response surface diagram of interaction of various factors on cell density
2.3 验证试验分析
通过响应面软件Design-Expert 11.0对数据进一步的拟合分析,得到NaNO3、NaH2PO4·H2O、Na2SiO3和C6H8FeNO7的最佳质量浓度分别为21.8、2.93、54.2 和0.158 mg·L-1时,藻细胞密度达到最大值。
将牟氏角毛藻接种于优化后的培养基,NaNO3、NaH2PO4·H2O、Na2SiO3和C6H8FeNO7的最佳质量浓度分别为21.8、2.93、54.2 和0.158 mg·L-1,其余营养盐以f/2 培养基为标准。牟氏角毛藻生长曲线见图6,在培养12 d 时藻密度达到最大值,为10.62×106cell·mL-1,显著高于对照组(8.3×106cell·mL-1),藻细胞密度提高27.95%。从图7 可以看出,试验组与对照组中都具有一定的光合活性。试验组中光合系统PSⅡ最大光能转换效率的值逐渐上升,一直在较高的范围内浮动,而对照组在第8天后开始缓慢下降。
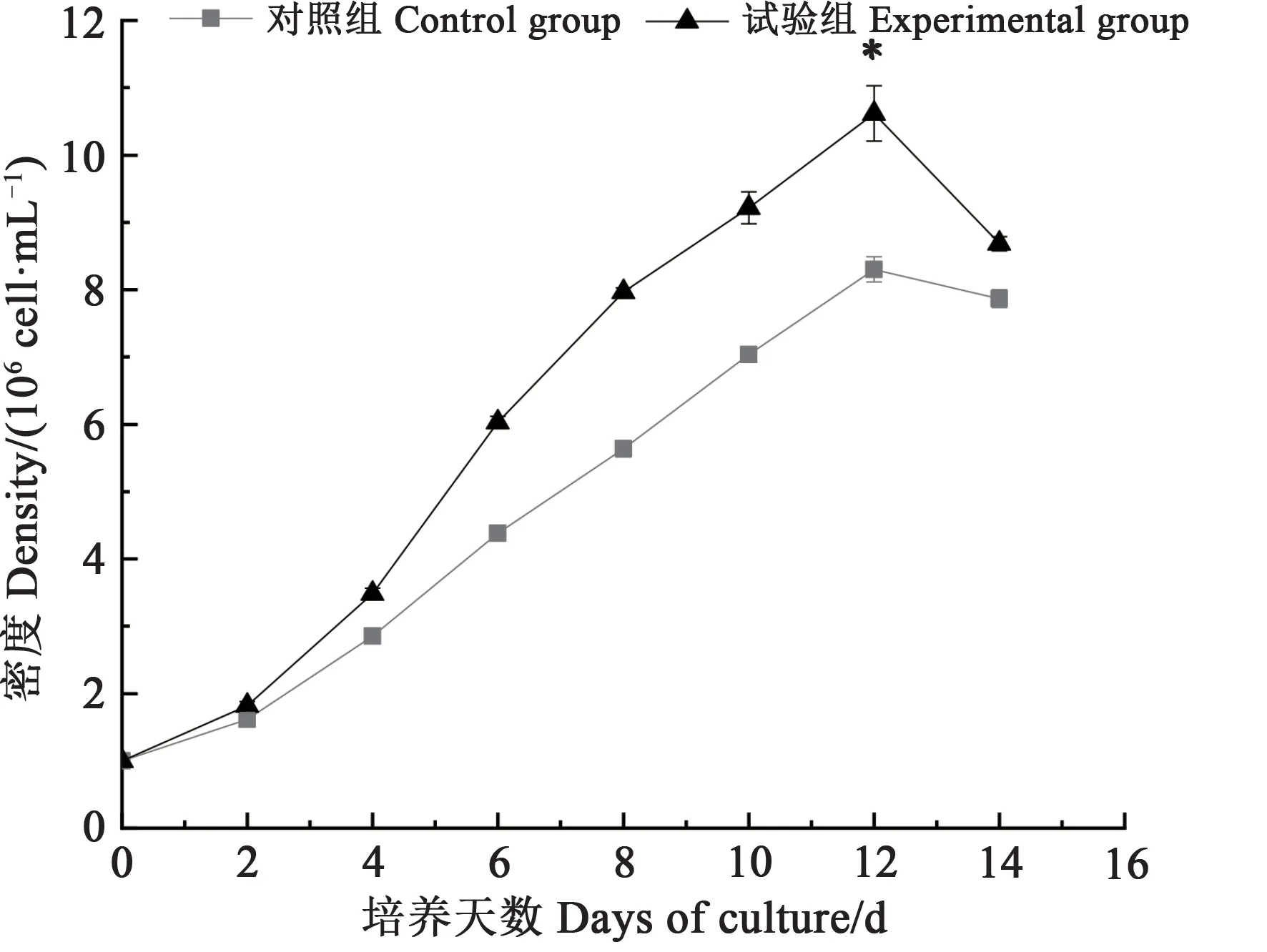
图6 试验组与对照组的生长曲线Fig. 6 Growth curves of experimental and control group
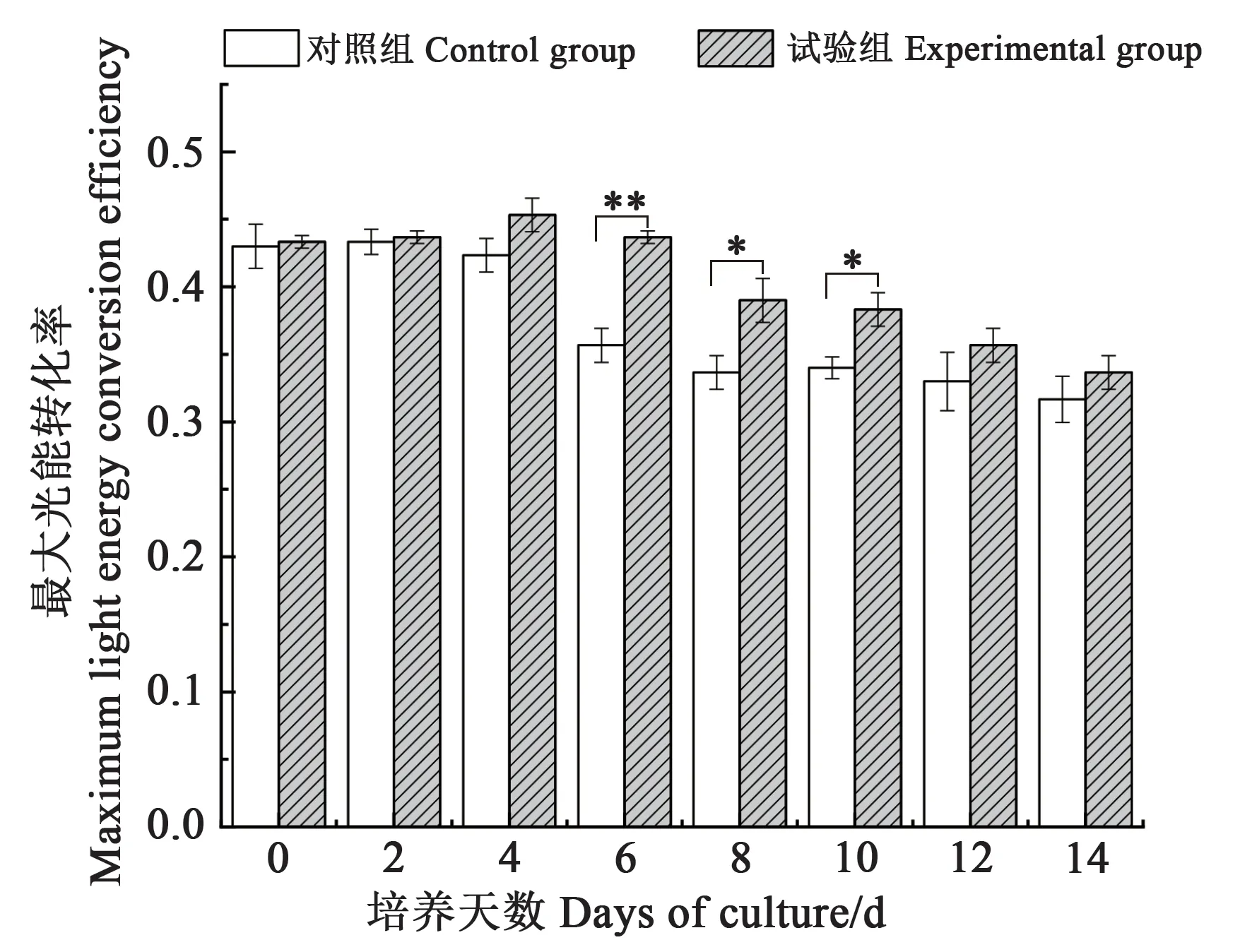
图7 试验组与对照组的最大光能转化效率Fig. 7 Maximum light energy conversion efficiency of experimental group and control group
3 讨论
氮、磷、硅和铁是藻类生长所必需的营养元素,在硅藻培养过程中发挥不可替代的作用。其中,氮可以让藻类大量繁殖,促进细胞生长、成熟和分裂;磷是细胞膜的重要组成成分,在细胞中起传递能量的作用,还可以通过调节酸碱度对培养基起缓冲作用;硅不仅是硅藻细胞壁的主要组成成分,而且还是生长发育所必需的营养元素,参与细胞的多种生长代谢过程;铁是底栖硅藻重要的电子传递体,也是细胞内某些还原酶系的组成成分,铁源缺乏会降低硝态氮的还原水平,同时会抑制藻类细胞的生长[16]。
研究表明,氮、磷、硅和铁均对藻类的生长有显著性影响,其中氮的影响最显著。张国庆等[17]研究表明,氮、磷、硅和铁浓度分别在30、2、10、0.2 mg·L-1时细胞密度最大。本研究中,当氮为20 mg·L-1时,细胞密度达到6.93×106cell·mL-1,显著高于对照组和其他试验组(P<0.05),随着氮质量浓度的升高,牟氏角毛藻可能通过增加细胞内蛋白质和叶绿素的合成,提高光合系统PSⅡ最大光能转换效率,促进藻类的生长。通过对比发现,张国庆等[17]试验周期和选用药品与本研究不同,可能是周期较短,藻类生长速率较低,故造成密度上的差异;NaH2PO4·H2O 培养液呈酸性,牟氏角毛藻在消耗硝酸盐并进行光合作用的过程中pH会逐渐上升,酸性NaH2PO4·H2O培养液可维持相对稳定的pH,为牟氏角毛藻创造良好的生长和增殖环境。硅是微型硅藻合成细胞壁的必需元素,缺硅则无法形成外壳并完成其正常生长周期[6]。Shifrin等[18]研究发现,微藻在缺硅的条件下1 周,细胞就会停止分裂甚至死亡。本研究中硅源的最适质量浓度为50 mg·L-1,藻细胞密度可达5.15×106cell·mL-1,培养温度及光强分别为(22±1)℃和50 µmol·m-2·s-1,明显低于张国庆等[17]培养条件,由此可见牟氏角毛藻对温度和光照比较敏感,培养液中添加C6H8FeNO7后,牟氏角毛藻的密度试验组显著高于对照组,印证了铁是硅藻生长中必需的微量元素,由单因素试验结果可知在0.1~0.5 mg·L-1时最适宜牟氏角毛藻生长。
综合上述研究发现,前人试验大多集中在筛选营养盐的种类并使用单因素试验得出各最适水平。本研究采用响应面法进行优化,考虑到多种营养盐种类并结合起来优化对比分析,更系统地得到牟氏角毛藻最佳的营养盐水平,对局部最具特征的点进行研究试验,又在点的基础上对整体的“面”进行精准地预测,回归拟合整体范围内各因素之间的双方的关系[19-21]。结合方差分析和等高线图得到各营养盐间存在交互作用,进而得出4因素对提升牟氏角毛藻细胞密度的最优值,平衡各营养盐,提高藻的生长速率。从回归模型方差分析中可以看出NaNO3、NaH2PO4·H2O、Na2SiO3、NaNO3和Na2SiO3、NaH2PO4·H2O和Na2SiO3、NaH2PO4·H2O和C6H8FeNO7、Na2SiO3和C6H8FeNO7均对牟氏角毛藻生长有显著性影响,而NaNO3和NaH2PO4·H2O 与C6H8FeNO7影响不显著,可能磷和铁的水平较低,氮起主导性作用会对磷和铁有一定的抑制。于瑾等[9]表明,当氮质量浓度为35 mg·L-1时,显著抑制牟氏角毛藻对铁的吸收。响应面反映的是NaNO3、NaH2PO4·H2O、Na2SiO3和C6H8FeNO74 个因素中任意2个取零水平时,剩余2个因素相互作用对牟氏角毛藻密度的影响。通过软件对数据进一步拟合分析,给出最佳反应条件,得到最优值,即在NaNO3为21.8 mg·L-1、NaH2PO4·H2O 为2.93 mg·L-1、Na2SiO3为54.2 mg·L-1、C6H8FeNO7为0.158 mg·L-1时藻细胞密度达到最大值,对比原培养基,藻细胞密度提高了27.95%。
