不同形式运动锻炼老年人运动皮层突触可塑性的差异:来自TMS的研究证据*
2023-10-09孟海江
孟海江 陈 蕾 王 刚 张 剑
不同形式运动锻炼老年人运动皮层突触可塑性的差异:来自TMS的研究证据*
孟海江1陈 蕾1王 刚1张 剑2
(1安庆师范大学体育学院, 安徽 安庆 246133) (2上海体育大学心理学院, 上海 200438)
尽管研究发现运动锻炼会导致大脑运动皮层可塑性改变, 但对不同形式运动锻炼老年人初级运动皮层突触可塑性变化的差异性却知之甚少。研究采用经颅磁刺激技术, 横向比较了乒乓球锻炼老年人、太极拳锻炼老年人和久坐老年人在配对联合刺激(PAS25)前、后动作诱发电位和短时程皮层内抑制的变化。结果发现, 经常参与乒乓球和太极拳运动锻炼老年人PAS25后的动作诱发电位振幅持续增强, 且乒乓球锻炼老年人增强的幅度显著高于太极拳锻炼老年人。三组老年人PAS25后各个时间点的短时程皮层内抑制均没有差异性。提示不同形式运动锻炼老年人初级运动皮层突触可塑性增强存在运动项目差异性。
运动锻炼, 老年人, 经颅磁刺激, 动作诱发电位, 运动皮层
1 前言
与大脑认知功能一样, 伴随着年龄增长, 老年人的动作控制能力逐渐衰退(Ward, 2006), 并干扰着日常生活, 甚至影响独立生活能力。人脑运动皮层在运动控制中起着主要作用, 运动皮层突触可塑性受损为动作控制能力退化提供了理论解释(Morgante et al., 2006; Okano et al., 2015)。运动皮层有效的神经激活是人类迅速和稳定地完成外部运动行为的前提, 但是运动皮层神经激活水平会随着年龄的增长而出现不同程度的下降(Ni et al., 2015)。因此, 对老年人动作控制能力的认识离不开对大脑运动皮层突触可塑性的研究。人类运动皮层能够发生短暂或持续的可塑性变化, 最广为人知的大脑皮层可塑性神经机制是长时程增强(long term potential, LTP)和长时程抑制(Malenka & Bear, 2004)。帕金森病患者的脑可塑性研究表明, 帕金森病患者的运动障碍与运动皮层突触可塑性受损有关, 主要体现在运动皮层类似LTP效应减弱(Morgante et al., 2006)。对优秀运动员的研究发现, 他们对运动技能精确控制与运动皮层类似LTP效应增强密切相关(Okano et al., 2015)。
人类大脑具有极强的可塑性, 其结构和功能随着环境的变化而产生适应性的改变(Pascual-Leone et al., 2005)。最近越来越多研究发现, 大脑可塑性变化可能与运动锻炼也有关, 比如, 运动锻炼能够增加灰质体积和白质完整性(白学军等, 2020; 吴殷等, 2015), 并对内在的大脑网络神经可塑性和连接性产生积极影响(Erickson & Kramer, 2009; Rogge et al., 2018)。尽管已有研究发现了运动锻炼对大脑结构和功能的积极效应, 但是人们对经常参与不同形式运动锻炼老年人初级运动皮层(primary motor cortex, M1)突触可塑性变化的差异却知之甚少。M1是对运动行为输出和运动行为控制至关重要的脑区, 它是在不断变化的环境中通过皮层内兴奋环路和抑制环路的平衡和相互作用调节神经可塑性和最终运动输出(Ni et al., 2011)。因此, 采用经颅磁刺激技术(transcranial magnetic stimulation, TMS)探讨经常参与不同形式运动锻炼老年人运动皮层兴奋性和皮层内抑制的变化可能对我们深入了解规律运动锻炼老年人神经可塑性变化特征以及与运动控制能力关系具有重要意义。
长期运动后动作诱发电位(motor evoked potential, MEP)振幅增加可能与突触可塑性增强有关, 也可能与皮层内神经元结构的功能性改变、运动神经元募集个数以及运动神经元放电率增长等有关(Jones, 2000; Daoudal & Debanne, 2003)。为了排除上述其它因素的影响且更纯粹考察不同形式运动锻炼老年人运动皮层突触可塑性的差异, 低频的、非侵入式的配对联合刺激(paired associative stimulation, PAS)将是一种诱发人类M1发生突触可塑性变化的较佳技术。研究表明(Stefan et al., 2000), PAS能够改变M1中特定区域突触效能, 突触效能变化与LTP或长时程抑制有相似的特征, 故称PAS诱发人类M1发生类似于LTP或长时程抑制的突触可塑性。外周正中神经给予一个电刺激, 间隔25 ms之后, 再给予对侧M1的手部肌肉表征区域一个TMS,这两种刺激大约同时到达M1, 可以诱发运动皮层兴奋性持续增强, 该范式被称为PAS25。单脉冲TMS以足够的刺激强度刺激M1时, 能够在目标肌肉记录到反映皮层兴奋性水平的MEP (Hallett, 2007)。双脉冲TMS能够用于测试M1的皮层内抑制性环路。当一个阈下的条件刺激与一个紧跟着的阈上测试刺激之间的时间间隔为1~5 ms时, 运动皮层内能够诱发出短时程皮层内抑制(short interval intracortical inhibition, SICI)。SICI是研究M1的皮层内环路最常用的方法, 代表M1的主要抑制性环路(Kujirai et al., 1993)。
为了探讨不同形式运动锻炼对老年人M1的突触可塑性, 本研究筛选出经常参与乒乓球运动锻炼老年人、经常参与太极拳运动锻炼老年人和长期久坐老年人作为调查对象。三个组别的设置主要基于以下原因:1)考虑到PAS25诱发人类M1突触可塑性变化效应特定于拇短展肌(abductor pollicis brevis, APB)的皮层表征区(Stefan et al., 2000), 以及采用TMS技术考察M1突触可塑性变化只能通过手部特定肌肉记录的MEP进行评价, 研究中经常参与运动锻炼的调查对象主要选取乒乓球运动锻炼或太极拳运动锻炼的老年人。乒乓球运动主要使用手部小肌肉群(比如APB、第一背侧骨间肌等)的参与实现动作的精细控制, 或搓或削, 或打或拉(戴雯等, 2017), 而太极拳运动则需要这些手部小肌肉的力量、灵活性和协调性完成握捏、按压、托起、钳紧等精细动作, 以上这些动作的重复将会引起参与运动肌肉的皮层表征区发生特异性功能变化; 2)最近一项研究表明, 不同形式运动锻炼的身心效益差别较大(Chekroud et al., 2018)。仅仅从乒乓球运动的身心效益推及到整个体育运动显得证据不足, 对多种运动锻炼方式的身心效益进行比较的研究可能更加有价值(Milkman et al., 2021)。因此,本研究中增加一个非球类运动组(太极拳组)作为对照, 拟探讨不同形式的运动锻炼对老年人M1突触可塑性的差异。
基于此, 研究提出了2个假设:1)与久坐老年人相比, 经常参与乒乓球或太极拳运动锻炼的老年人手部肌肉APB的运动皮层表征区突触可塑性增强; 2)不同形式运动锻炼老年人的运动皮层突触可塑性变化存在差异性。
2 方法
2.1 调查对象
54名年龄范围为60~70岁的健康老年人参加了本研究。所有调查对象均为右利手, 并使用Oldfield左右利手偏侧化测试确认。该研究获得上海体育大学人类研究伦理委员会批准(102772019RT012), 并按照《赫尔辛基宣言》确立的标准进行实验。所有调查对象的入选标准和排除标准见表1。

表1 本研究调查对象入选标准和排除标准一览表
在参照国际体力活动量表的基础上, 本研究自行设计了有关老年人参与乒乓球或太极拳运动锻炼以及久坐情况的调查问卷。问卷包括12个条目, 主要涉及老年人久坐时间以及参与乒乓球或太极拳运动锻炼的时间、强度和频率等, 8位相关领域专家评价该问卷内容效度较好。为了更准确地反映出老年人参与运动锻炼的程度, 要求老年人长期专注于闲暇时间的运动锻炼, 重点是具有中等以上强度的乒乓球运动或太极拳运动。此外, 没有调查对象报告长期专门使用双手, 比如演奏乐器等。
调查对象分组标准是按照参与乒乓球或太极拳运动锻炼的运动时间、运动强度、运动频率和久坐时间等来确定。当同时满足以下4个条件时, 可将调查对象划为乒乓球运动锻炼组(18名)和太极拳运动锻炼组(18名):1)经常参与乒乓球或太极拳运动锻炼; 2)运动强度为中等及以上; 3)运动频率≥ 3次/每周; 4)运动时间≥ 60分钟/每次。对于不满足以上4个条件且无运动锻炼习惯、久坐时间≥ 360分钟/每天(Patterson et al., 2018)的调查对象划为久坐组(18名)。三组调查对象平均年龄[(2, 51) = 0.64,= 0.533]、简易精神状态得分[(2, 51) = 0.31,= 0.736]、教育年限[(2, 51) = 0.68,= 0.513]和性别比例(χ2= 1.04,= 0.595)均无显著性差异。三组调查对象的基本情况见表2。

表2 三组调查对象基本情况一览表(M ± SD)
2.2 实验设计
实验采用3 (组别) × 4 (时间点)的两因素混合设计, 组别(乒乓球锻炼组、太极拳锻炼组、久坐组)、时间点(基线、刺激后0、30、60分钟)均为自变量, MEP振幅、SICI为因变量。
2.3 经颅磁刺激及肌电记录
两个Magstim 200刺激器(Magstim, Whitland, Dyfed, UK)通过一个BISTIM模块连接到同一个“8”字型线圈(每个线圈外部直径9.5 cm), 线圈作用于调查对象的左侧M1进行磁刺激。线圈相切于颅骨, 手柄朝向后方, 并与大脑矢状面呈45°夹角, 电流流向由后向前。APB受正中神经支配且是乒乓球和太极拳运动的主要参与肌肉, 因此该肌肉被选为目标肌肉。右手APB脑部激活的最佳位置用专用笔标记作为运动热点。TMS刺激右手APB的最佳头皮位置是通过每次移动线圈1 cm直到找到最大的MEP来确定。
直径9 mm的Ag-AgCl表面电极用于记录调查对象右手APB的表面肌电。活动电极放置在肌腹, 参考电极放在掌指关节处, 接地电极放置在右腕处。原始信号被放大器放大(1000倍)、带通滤波过滤(20 Hz~2.5 kHz)、由5 kHz的数字转换接口数字化(Micro 1401, Cambridge Electronics Design, Cambridge, UK), 并存储在计算机上, 通过Signal 6.0软件进行离线分析。
2.4 配对联合刺激方案
本研究中左侧M1突触可塑性诱发采用了Stefan等人(2000)设计的PAS范式。PAS25范式是首先在调查对象右手腕部的正中神经处给予一个刺激强度相当于3倍感觉阈限的电刺激, 25 ms后在左侧M1给予一个单脉冲TMS (刺激强度为诱发1 mV MEP时的强度)。给予PAS25的频率为0.1 Hz, 总共90次, 持续时间为15分钟。正中神经电刺激采用标准的棒电极(负极近心端), 电刺激设备为一个数字转换的DS7A恒定电流(0.2 ms方波脉冲)刺激器。PAS25范式见图1。
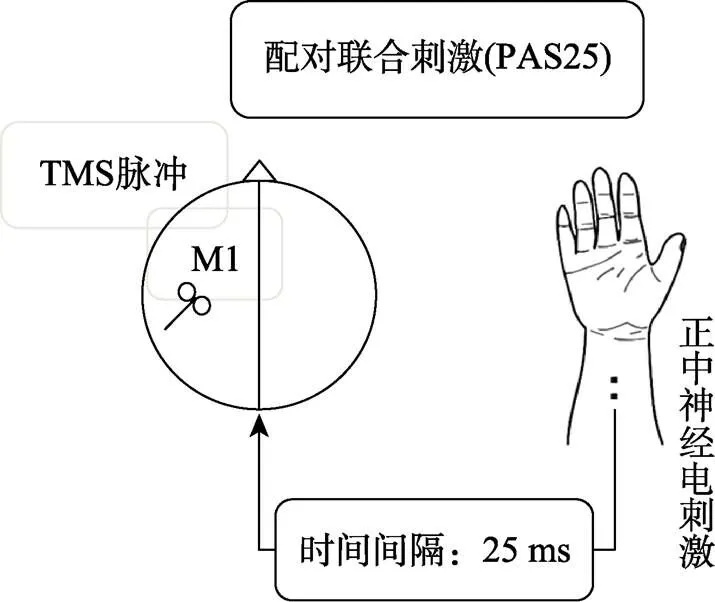
图1 两个刺激间间隔为25 ms配对联合刺激示意图
经常参与乒乓球运动锻炼老年人、太极拳运动锻炼老年人和久坐老年人均接受PAS25方案刺激, 并在刺激前(基线)、刺激后即刻、30、60分钟(T0~T60)分别测量运动皮层兴奋性和抑制性, 探究三组调查对象运动皮层突触可塑性的变化。所有的实验都是在下午2点至5点之间进行, 以尽量减少皮质醇的变化对突触可塑性诱发的影响, 并要求调查对象在实验前(当天)不要进行运动锻炼, 但可以在实验完成后进行运动锻炼。
2.5 皮层兴奋性和皮层内抑制测量
采用TMS测量运动皮层兴奋性和皮层内抑制的主要参数包括静息动作阈值(resting motor threshold, RMT)、MEP振幅和SICI。RMT定义为APB放松状态下连续给予10次TMS刺激中至少有5次诱发的MEP大于50 μV所需的最小的磁刺激强度。1 mV刺激强度为APB放松状态下连续给予10次TMS刺激中有5次诱发的MEP大于1 mV所需的最小的磁刺激强度。RMT、1 mV强度采用磁刺激器最大输出功率的百分比表示。
在施加PAS25前, 每个调查对象需要确定诱发MEP振幅为1 mV所需的磁刺激强度, 并在PAS25后不同时间点采用该刺激强度测量MEP振幅, 考察运动皮层兴奋性变化。MEP振幅通过波峰与波谷间值测量。
对于SICI, 条件刺激强度设置为70%RMT, 测试刺激强度设置为1 mV, 刺激间间隔为2 ms。测试刺激强度随着每个时间点需要设置成为调整后1 mV。SICI采用配对脉冲刺激诱发的MEP振幅占单独测试刺激诱发的平均MEP振幅的百分比表示, 值<100%表示皮层内抑制, 值>100%表示皮层内易化。SICI值越大, 表明皮层内抑制作用越弱(Kujirai et al., 1993)。
2.6 数据分析与处理
采用两因素重复测量方差分析评价组别和时间对MEP振幅和SICI的影响。如果两因素方差分析显示出显著主效应或交互效应, 采用独立样本检验进行事后多重比较, 考察哪个时间点测量MEP振幅和SICI在三组老年人之间存在差异性。
采用SPSS 17.0统计软件(IBM, Armonk, NY, USA)进行统计分析。显著性水平设置为< 0.05。结果用平均数±标准误表示。
3 研究结果
3.1 三组调查对象参与运动锻炼情况及刺激前基线特征
表3显示了三组调查对象参与闲暇时间运动锻炼情况及刺激前基线特征。乒乓球运动组和太极拳运动组在运动时间[(34) = 1.01,= 0.32, Cohen's= 0.34, 差异的95% CI为(−11.81, 35.15)]、运动频率[(34) = −1.34,= 0.19, Cohen's= −0.45, 差异的95% CI为(−1.26, 0.26)]和运动强度(χ2= 0.12,= 0.729)上均没有差异性。从三组调查对象参与闲暇时间运动锻炼的运动强度、运动频率和每次运动时间上看, 久坐组没有参与乒乓球或太极拳运动锻炼的经历, 且每周久坐时间大于乒乓球运动组[(34) = −7.46,< 0.001, Cohen's= −2.49, 差异的95% CI为(−400.80, −229.20)]和太极拳运动组[(34) = −8.83,< 0.001, Cohen's= −2.94, 差异的95% CI为(−399.81, −250.19)]。
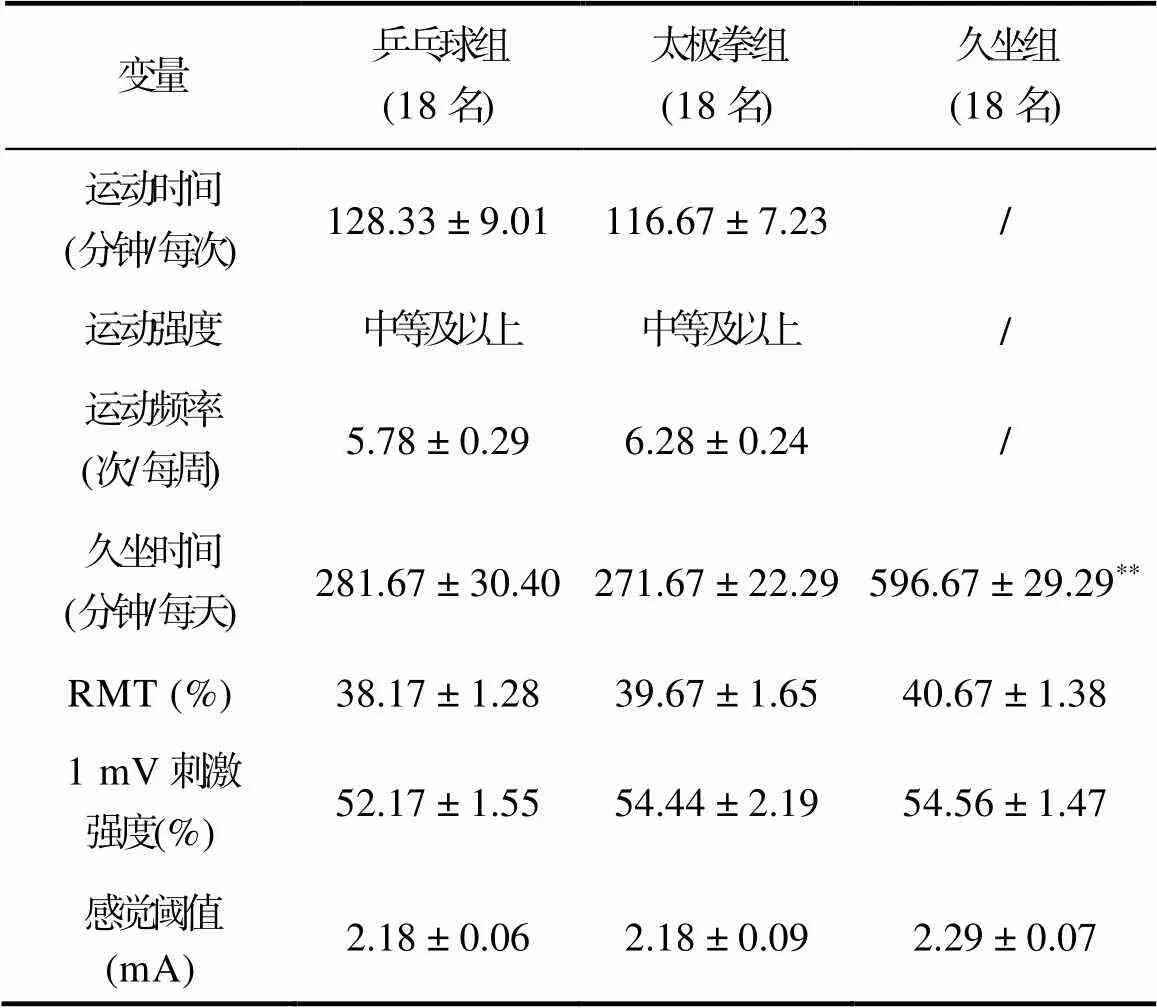
表3 三组调查对象参与运动锻炼情况及刺激前基线特征
注:乒乓球组、太极拳组与久坐组相比,**< 0.001
所有调查对象对TMS无不良反应。在施加PAS25之前, 采用TMS测量的RMT [(2, 51) = 0.76,= 0.474]、诱发1 mV的MEP振幅所需的刺激强度[(2, 51) = 0.58,= 0.562]、感觉阈值[(2, 51) = 0.79,= 0.46]等在乒乓球组老年人、太极拳组老年人和久坐组老年人之间没有差异性。
3.2 不同形式运动锻炼老年人运动皮层兴奋性的差异
图2显示的是以一名久坐老年人、一名太极拳运动锻炼老年人和一名乒乓球运动锻炼老年人为例在PAS25前、PAS25后即刻、30分钟、60分钟的平均MEP振幅。对于久坐老年人, PAS25后右侧APB记录的MEP有微小变化。相比之下, 经常参与乒乓球或太极拳运动锻炼老年人在PAS25后即刻、30分钟和60分钟三个时间点MEP都有显著增大。
图3显示了乒乓球运动锻炼组、太极拳运动锻炼组和久坐组老年人PAS25前、后右侧APB记录的平均MEP振幅变化。两因素重复测量方差分析表明, 组别主效应[(2, 51) = 17.76,< 0.001]、时间主效应[(3, 153) = 5.11,= 0.002]以及组别和时间的交互效应非常显著[(6, 153) = 4.64,< 0.001]。事后多重比较的分析结果表明, 经常参与乒乓球(T0~T60:< 0.001)或太极拳(T0:= 0.037; T30:= 0.012)运动锻炼的老年人在PAS25后的平均MEP振幅显著高于久坐组老年人, 而经常参与乒乓球运动锻炼的老年人在PAS25后的平均MEP振幅显著高于太极拳运动锻炼的老年人(T0:= 0.043; T30:= 0.043; T60:= 0.001)。

图2 一名久坐老年人和两名不同形式运动锻炼老年人在PAS25前、后的平均MEP振幅

图3 乒乓球组、太极拳组和久坐组老年人PAS25前、后平均MEP振幅的变化
注:乒乓球组与太极拳组相比,*< 0.05,**< 0.01; 太极拳组与久坐组相比,#< 0.05。
3.3 不同形式运动锻炼老年人短时程皮层内抑制的差异
图4显示了乒乓球运动锻炼组、太极拳运动锻炼组和久坐组老年人PAS25前、后SICI的变化。两因素的重复测量方差分析显示, 时间主效应[(3, 150) = 1.64,= 0.189]、组别主效应[(2, 50) = 2.38,= 0.103]以及组别和时间的交互效应均不显著[(6, 150) = 1.09,= 0.371]。
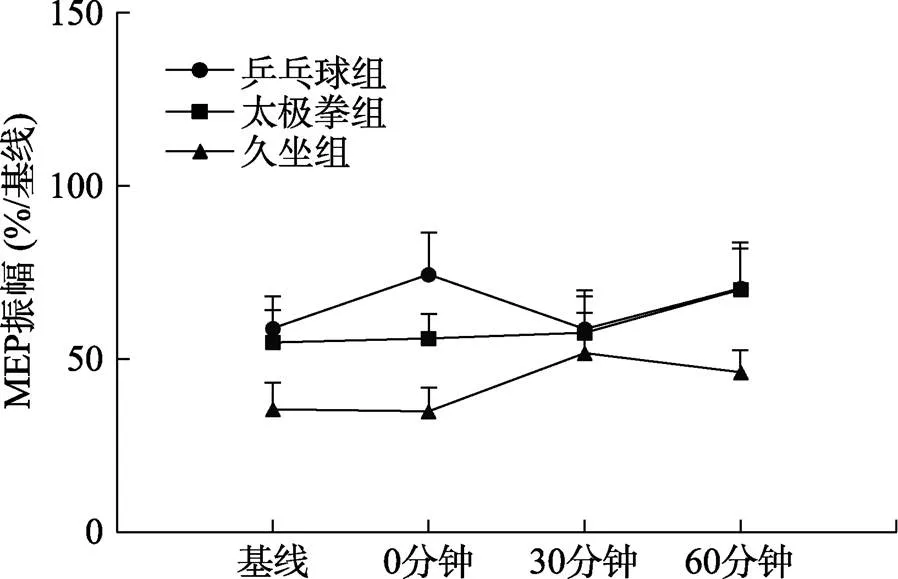
图4 乒乓球组、太极拳组和久坐组老年人PAS25前、后SICI变化
4 讨论
本研究主要采用TMS技术, 比较了经常参与乒乓球运动锻炼老年人、经常参与太极拳运动锻炼老年人和久坐老年人在PAS25前、后运动皮层兴奋性和皮层内抑制的变化, 以探讨经常参与不同形式运动锻炼对老年人M1突触可塑性的差异。与假设一致的是, 经常参与乒乓球或太极拳运动锻炼老年人相比于久坐老年人, 运动皮层兴奋性发生了显著变化, 主要表现为PAS25在运动皮层特定区域诱发的MEP振幅显著增强, 且增强的持续时间大于30分钟。同时, 研究还发现, 经常参与乒乓球运动锻炼老年人PAS25后MEP振幅增强幅度显著大于太极拳运动锻炼老年人。基于此, 我们认为, 以上这些变化反映了对长期规律运动锻炼的适应, 且这种适应性变化存在运动项目差异性。
4.1 不同形式运动锻炼老年人运动皮层兴奋性的差异
长期运动能够诱发人类大脑皮质功能性重组。有关神经影像学研究表明, 经过长期的运动训练, 优秀的篮球运动员在观察和预测罚球时, 他们的下顶叶和下额叶额下回的激活水平比那些预测能力更强的新手要高(Wu et al., 2013)。TMS研究表明, 长期运动训练能够促进运动皮层的兴奋性增强(Maruyama et al., 2008)。本研究也发现, 经常参与乒乓球或太极拳运动锻炼老年人目标肌肉APB记录的MEP振幅显著高于久坐老年人。这一结果说明, 经常参与规律运动锻炼老年人的运动皮层兴奋性更强, 皮质内神经元募集水平更高, 预示了长期规律运动锻炼所造成的老年人皮层可塑性变化主要体现在M1功能上的重组。
在本研究中, 久坐组和乒乓球组、太极拳组老年人在年龄、性别、受教育年限和认知状况等方面均相匹配(见表2), 但根据自行设计的运动锻炼情况及久坐情况调查问卷的调查结果可以发现, 久坐组与乒乓球组、太极拳组老年人在运动强度、运动频率、每次运动持续时间以及久坐时间上均存在显著差异性。基于以上结果, 我们认为经常参与乒乓球或太极拳运动锻炼老年人运动皮层特定区域兴奋性增强可能与长期运动锻炼有关。已有研究表明, 长期运动锻炼能够增加M1的血流量和神经营养因子, 为神经元的存活和分化提供了一个更加有利的神经环境(Vaynman & Gomez-Pinilla, 2005; Adkins et al., 2006)。因此, 随着长期规律运动锻炼, 改善的大脑皮层环境可能促进M1内神经元的存活和神经密度增加, 从而导致那些长期参与运动锻炼的个体皮质脊髓功能和兴奋性的改变。
长期运动锻炼可以在人类皮质脊髓和脊髓运动神经元中产生功能适应。比如, 高水平网球运动员参与运动的肌肉记录的MEP振幅显著增大(Pearce et al., 2000); 长期演奏器乐的音乐家的运动皮层兴奋性更高(Rosenkranz et al., 2007)。以上这些皮层兴奋性的变化都是在参与运动的主动肌群上进行了评估, 体现出了运动肌肉在 M1表征区对特定任务的适应性。基于以上的观点, 在本研究中, 我们选择的调查对象的锻炼项目为乒乓球和太极拳, 这些项目在我国有着深厚的群众基础, 是适合老年人参与的健身活动。另一方面, 乒乓球技术关键在于腕关节连接的小臂和手指瞬时发力, 从而实现击球的快和准以及球路多变(戴雯等, 2017; Iino & Kojima, 2011), 而太极拳需要综合运用手指、手腕部肌肉的力量、灵活性和协调性, 从而达到攻守兼备、内外兼修的目的。APB受腕关节和大拇指支配, 是乒乓球和太极拳运动模式中的主动肌肉, 为我们探讨特定的运动项目诱发与运动任务相关的神经可塑性提供了机会。本研究发现, 经常参与乒乓球运动锻炼和太极拳运动锻炼老年人APB的运动皮层表征区兴奋性均显著增强, 再次证实了参与运动的肌肉在M1表征区兴奋性变化对特定任务适应性的观点。参与乒乓球或太极拳运动的老年人经过长期运动锻炼, 运动肌肉的功能将会增强, 这些肌肉在M1表征区域的兴奋性也相应增强, 以适应特定任务需求。
更有趣的发现是, 相对于太极拳运动锻炼老年人, 经常参与乒乓球运动锻炼老年人APB的运动皮层表征区兴奋性更强。这一研究结果从神经电生理(基于TMS技术)的角度再次支持了不同形式运动锻炼的身心效益差别较大(Chekroud et al., 2018)的研究结论。在乒乓球和太极拳运动锻炼过程中, 对手部肌肉APB的使用频率、使用强度的不同可能是导致这一结果的主要原因:乒乓球需要频繁地使用APB发力、控制球拍和球的运动方向, 以实现球路多变、快速和准确的进攻, 对APB的力量控制、使用频率的要求相对较高, 而太极拳注重慢、柔、缓、圆, 需要APB和手部其它小肌肉群协同完成精细的手势和各种动作, 对APB的使用相对较少且强度较低。
此外, 长期专门使用双手习惯可能对结果也有潜在的影响。首先, 在研究设计中, 我们已经排除了既有长期专门使用双手(比如演奏乐器)又有乒乓球或太极拳运动锻炼习惯的调查对象。其次, 乒乓球运动和太极拳运动对双手使用情况截然不同, 乒乓球运动大部分的活动在于单手, 而太极拳运动则双手均有使用。基于这一事实, 可能有一种推测, 乒乓球运动锻炼老年人特定皮层区域兴奋性强于太极拳运动锻炼老年人可能是由于太极拳运动中左手使用阻碍了右手使用诱发的M1兴奋性增强。然而, 事实并非如此, 已有大量TMS研究证据表明, 单侧手部肌肉激活增强同侧M1的兴奋性(Muellbacher et al., 2000; Stinear et al., 2001; Morishita et al., 2011)。因此, 我们的研究认为, 长期专门使用双手习惯对结果潜在影响的可能性较小。
长期运动老年人的皮层兴奋性增强可能有利于外部动作控制。已有研究认为, MEP振幅的增加可能与大脑运动皮层突触连接增强有关。长期运动老年人MEP振幅的持续增加意味着运动皮层内突触连接的加强, 突触连接的增强在一定程度上可以加速大脑对运动信息的编码以及对相关技能的提取, 帮助个体在复杂多变的环境下更加快速和准确地做出所需要的运动反应, 从而更精确地控制运动技能(戴雯等, 2017)。由此可见, 运动皮层有效的神经连接可能是长期运动老年人迅速和稳定地完成外部运动行为的基础。同时, 我们的研究结果可能为长期运动老年人的动作控制能力优于久坐老年人提供了神经生理的解释。
4.2 经常参与运动锻炼老年人运动皮层突触可塑性增强
配对联合刺激是神经生理学研究中诱发人类大脑皮层神经可塑性变化的常用方法(Stefan et al., 2000; Cirillo et al., 2009)。以往的研究表明, 施加在运动皮层的PAS25能够诱发皮层兴奋性的持续增强, 且持续增强时间大约为30~60分钟, 这种兴奋性的增加被认为主要反映了人类M1发生类似于LTP的突触可塑性变化(Stefan et al., 2000)。在本研究中, 我们的结果表明, PAS25在长期参与乒乓球或太极拳运动锻炼老年人的运动皮层诱发的皮层兴奋性持续增强, 提示了这种兴奋性持续增强可能是因为运动皮层发生了类似于LTP效应的突触可塑性变化。人脑运动皮层突触可塑性变化在运动控制中起着重要作用, 这一认识已经得到了大量研究证据支撑。比如, 帕金森病患者的运动障碍与运动皮层发生类似LTP效应减弱有关(Morgante et al., 2006), 而优秀运动员对运动技能精确控制与运动皮层发生类似LTP效应增强密切相关(Okano et al., 2015)。由此可见, 长期运动锻炼老年人运动皮层发生类似LTP效应的增强可能为他们在长期运动锻炼过程中较好完成动作技能提供了生理保障。
皮层内抑制在运动皮层兴奋性和可塑性调节过程中起着至关重要作用(Ni et al., 2014)。药理学研究表明, SICI是由γ-氨基丁酸A受体介导的(Di Lazzaro et al., 2005)。对人类进行药理研究发现, 增强γ-氨基丁酸A受体传递的安定降低了PAS25诱发的运动皮层可塑性(Heidegger et al., 2010)。非药理手段的TMS技术研究也表明, γ-氨基丁酸A受体调节的SICI阻碍了PAS25诱发的运动皮层可塑性(Elahi et al., 2012)。基于以上研究结果, PAS25方案诱发乒乓球运动锻炼老年人、太极拳运动锻炼老年人和久坐老年人运动皮层可塑性的差异性可能与SICI有关。然而, 在本研究中, 我们考察了经常参与运动锻炼老年人(乒乓球组和太极拳组)和久坐老年人的SICI变化情况, 结果发现, 三组老年人的SICI在不同时间点并没有差异性。我们推测, γ-氨基丁酸A受体调节的抑制环路的变化并不是PAS25诱导经常参与运动锻炼老年人运动皮层突触可塑性增强的唯一原因, 可能还存在与其它皮层内环路的相互调节作用, 最终决定了运动皮层的输出, 这一推测有待进一步实验验证。
本研究采用横断面的研究设计考察经常参与乒乓球或太极拳运动锻炼对老年人运动皮层突触的可塑性, 可能存在一些潜在混杂因素影响PAS25方案在运动锻炼老年人的运动皮层诱发的皮层兴奋性增强。首先, 经常参与乒乓球运动锻炼或太极拳运动锻炼老年人相比于久坐老年人的运动皮层突触可塑性增强可能与受试者年龄、对程序的关注程度以及实验时间等因素有关。然而, 在本研究中, 这些相关干扰因素在久坐和经常运动锻炼的老年人之间是相似的。因此, 我们排除了这些因素影响我们研究结果的可能性。其次, 近期的运动锻炼情况。已经确定的是, 当聚焦于同一肌肉群时, 先前的运动学习会与随后的PAS25诱导的可塑性产生内稳态的相互作用(Ziemann et al., 2004; Stefan et al., 2006), 但目前尚不清楚近期运动肢体活动是否会与对运动肌肉皮层表征区进行的PAS25诱发可塑性产生体内平衡作用。由于大量研究证实PAS25诱发运动皮层突触可塑性效应持续时间较短, 且实验前已经告知调查对象实验当天不能进行运动锻炼, 我们认为, 这一因素的作用效应可能很小, 不会影响到我们的研究结果。
5 结论
经常参与乒乓球或太极拳运动锻炼能够诱发老年人初级运动皮层兴奋性的持续增强, 且这种增强效应存在运动项目差异性。运动皮层突触可塑性增强可能对老年人运动锻炼过程中技能获得和促进起着重要作用。
Adkins, D. L., Boychuk, J., Remple, M. S., & Kleim, J. A. (2006). Motor training induces experience-specific patterns of plasticity across motor cortex and spinal cord.,(6), 1776−1782.
Bai, X. J., Shao, M. L., Liu, T., Yin, J. Z., & Jin, H. (2020). Altered structural plasticity in early adulthood after badminton training.,(2), 173−183.
[白学军, 邵梦灵, 刘婷, 尹建忠, 金花. (2020). 羽毛球运动重塑成年早期的大脑灰质和白质结构.(2), 173−183.]
Chekroud, S. R., Gueorguieva, R., Zheutlin, A. B., Paulus, M., Krumholz, H. M., Krystal, J. H., & Chekroud, A. M. (2018). Association between physical exercise and mental health in 1.2 million individuals in the USA between 2011 and 2015: A cross-sectional study.,(9), 739−746.
Cirillo, J., Lavender, A. P., Ridding, M. C., & Semmler, J. G. (2009). Motor cortex plasticity induced by paired associative stimulation is enhanced in physically active individuals.,(24), 5831−5842.
Dai, W., Zhang, J., & Tan, X. Y. (2017). Comparison of brain plasticity between table tennis and badminton athletes.,(6), 127−132.
[戴雯, 张剑, 谭晓缨. (2017). 乒乓球和羽毛球运动员大脑可塑性差异比较.(6), 127−132.]
Daoudal, G., & Debanne, D. (2003). Long-term plasticity of intrinsic excitability: Learning rules and mechanisms.,(6), 456−465.
Di Lazzaro, V., Oliviero, A., Saturno, E., Dileone. M., Pilato, F., Nardone, R., ... Tonali, P. (2005). Effects of lorazepam onshort latency afferent inhibition and short latency intracortical inhibition in humans.,(2), 661−668.
Elahi, B., Gunraj, C., & Chen, R. (2012). Short-interval intracortical inhibition blocks long-term potentiation induced by paired associative stimulation.,(7), 1935−1941.
Erickson, K. I., & Kramer, A. F. (2009). Aerobic exercise effects on cognitive and neural plasticity in older adults.,(1), 22−24.
Hallett, M. (2007). Transcranial magnetic stimulation: A primer.,(2), 187−199.
Heidegger, T., Krakow, K., & Ziemann, U. (2010). Effects of antiepileptic drugs on associative LTP-like plasticity in human motor cortex.,(7), 1215−1222.
Iino, Y., & Kojima, T. (2011). Kinetics of the upper limb during table tennis topspin forehands in advanced and intermediate players.,(4), 361−377.
Jones, E. G. (2000). Cortical and subcortical contributions to activity-dependent plasticity in primate somatosensory cortex.,1−37.
Kujirai, T., Caramia, M. D., Rothwell, J. C., Day, B. L., Thompson, P. D., Ferbert, A., ... Marsden, C. D. (1993). Corticocortical inhibition in human motor cortex.,, 501−519.
Malenka, R. C., & Bear, M. F. (2004). LTP and LTD: An embarrassment of riches.,(1), 5−21.
Maruyama, A., Takahashi, K., Eto, S., Kawahira, K., & Rothwell, J. C. (2008). Sensory-motor intracortical excitability and imagery of grip touch in racket players.,(3), 245.
Milkman, K. L., Gromet, D., Ho, H., Kay, J. S., Lee, T. W., Pandiloski, P., ... Duckworth, A. L. (2021). Megastudies improve the impact of applied behavioural science.,(7889), 478−483.
Morgante, F., Espay, A. J., Gunraj, C., Lang, A. E., & Chen, R. (2006). Motor cortex plasticity in Parkinson's disease and levodopa-induced dyskinesias.,(4), 1059−1069.
Morishita, T., Ninomiya, M., Uehara, K., & Funase, K. (2011). Increased excitability and reduced intracortical inhibition in the ipsilateral primary motor cortex during a fine-motor manipulation task., 65−73.
Muellbacher, W., Facchini, S., Boroojerdi, B., & Hallett, M. (2000). Changes in motor cortex excitability during ipsilateralhand muscle activation in humans.(2), 344−349.
Ni, Z., Gunraj, C., Kailey, P., Cash, R. F. H., & Chen, R. (2014). Heterosynaptic modulation of motor cortical plasticity in human.,(21), 7314−7321.
Ni, Z., Isayama, R., Castillo, G., Gunraj, C., Saha, U., & Chen, R. (2015). Reduced dorsal premotor cortex and primary motor cortex connectivity in older adults.,(1), 301−303.
Ni, Z., Müller-Dahlhaus, F., Chen, R., & Ziemann, U. (2011). Triple-pulse TMS to study interactions between neural circuits in human cortex.,(4), 281−293.
Okano, A. H., Fontes, E. B., Montenegro, R. A., Farinatti, P. T. V., Cyrino, E. S., Li, L. M., Bikson, M., & Noakes, T. D. (2015). Brain stimulation modulates the autonomic nervous system, rating of perceived exertion and performance during maximal exercise.,(18), 1213−1218.
Pascual-Leone, A., Amedi, A., Fregni, F., & Merabet, L. B. (2005). The plastic human brain cortex.,, 377−401.
Patterson, R., McNamara, E., Tainio, M., Hérick de Sá, T., Smith, A. D., Sharp, S. J., Edwards, P., Woodcock, J., Brage, S., & Wijndaele, K. (2018). Sedentary behaviour and risk of all-cause, cardiovascular and cancer mortality, and incident type 2 diabetes: A systematic review and dose response meta-analysis.,(9), 811−829.
Pearce, A. J., Thickbroom, G. W., Byrnes, M. L., & Mastaglia, F. L. (2000). Functional reorganisation of the corticomotor projection to the hand in skilled racquet players.,(2), 238−243.
Rogge, A. K., Röder, B., Zech, A., & Hötting, K. (2018). Exercise-induced neuroplasticity: Balance training increases cortical thickness in visual and vestibular cortical regions., 471−479.
Rosenkranz, K., Williamon, A., & Rothwell, J. C. (2007). Motorcortical excitability and synaptic plasticity is enhanced in professional musicians.,(19), 5200−5206.
Stefan, K., Kunesch, E., Cohen, L. G., Benecke, R., & Classen, J. (2000). Induction of plasticity in the human motor cortex by paired associative stimulation.,(3), 572−584.
Stefan, K., Wycislo, M., Gentner, R., Schramm, A., Naumann, M., Reiners, K., & Classen, J. (2006). Temporary occlusion of associative motor cortical plasticity by prior dynamic motor training.,(3), 376−385.
Stinear, C. M., Walker, K. S., & Byblow, W. D. (2001). Symmetric facilitation between motor cortices during contraction of ipsilateral hand muscles.(1), 101−105.
Vaynman, S., & Gomez-Pinilla, F. (2005). License to run: Exercise impacts functional plasticity in the intact and injured central nervous system by using neurotrophins.(4), 283−295.
Ward, N. S. (2006). Compensatory mechanisms in the aging motor system.,(3), 239−254.
Wu, Y., Zeng, Y., Zhang, L., Wang, S., Wang, D., Tan, X., Zhu, X., Zhang, J., & Zhang, J. (2013). The role of visual perception in action anticipation in basketball athletes., 29−41.
Wu, Y., Zhang, J., Zeng, Y., & Shen, C. (2015). Structural brain plasticity change in athletes associated with different sports.,(4), 52−57.
[吴殷, 张剑, 曾雨雯, 沈城. (2015). 不同类型运动项目对运动员大脑结构可塑性变化研究.(4), 52−57.]
Ziemann, U., Iliać, T. V., Pauli, C., Meintzschel, F., & Ruge, D. (2004). Learning modifies subsequent induction of long-term potentiation-like and long-term depression-like plasticity in human motor cortex.,(7), 1666−1672.
Differences in motor cortex synaptic plasticity associated with two forms of exercise in older adults: Evidence from TMS studies
MENG Haijiang1, CHEN Lei1, WANG Gang1, ZHANG Jian2
(1School of Sports, Anqing Normal University, Anqing 246133, China)(2Department of Psychology, Shanghai University of Sport, Shanghai 200438, China)
Although studies have found that exercise can lead to changes in the plasticity of the motor cortex, little is known about the changes in primary motor cortex synaptic plasticity associated with different forms of exercise among older adults. The purpose of this study was to compare the differences in motor cortex synaptic plasticity associated with a small hand muscle among older adults who regularly participated in table tennis or tai chi or who were sedentary.
Based on inclusion/exclusion criteria and their answers to a self-reported questionnaire, 54 older adults (60~70 years) were selected who often participated in table tennis (= 18) or tai chi (= 18) exercise or who were sedentary (= 18). The target muscle was the abductor pollicis brevis of the right hand. Motor cortex synaptic plasticity associated with the abductor pollicis brevis muscle was induced by a paired combination of peripheral nerve electrical stimulation and transcranial magnetic stimulation with an interval of 25 ms (PAS25). Single-pulse and double-pulse transcranial magnetic stimulation was applied to the left primary motor cortex to measure changes in motor evoked potentials (MEPs) and short-interval intracortical inhibition recorded in the abductor pollicis brevis muscle before and after PAS25, to compare the differences in primary motor cortex synaptic plasticity among the three groups.
The results showed that mean MEP amplitudes immediately and 30 and 60 min after PAS25 in the table tennis group were significantly higher than those in sedentary group; mean MEP amplitudes immediately and 30 min after PAS25 in the tai chi group were significantly higher than those in the sedentary group; and mean MEP amplitudes immediately and 30 and 60 min after PAS25 in the table tennis group were significantly higher than those in the tai chi group. There were no differences in the short-interval intracortical inhibition at any time point after PAS25 among the three groups.
These results indicated that regular participation in table tennis or tai chi can induce a sustained increase in primary motor cortex excitability in older adults and that there are differences in primary motor cortex synaptic plasticity in older adults associated with different forms of exercise. These results suggest that increased synaptic plasticity in the motor cortex may play an important role in the acquisition and promotion of motor skills during exercise in older adults.
physical exercise, older adults, transcranial magnetic stimulation, motor evoked potential, motor cortex
B845; B849:G804
https://doi.org/10.3724/SP.J.1041.2023.01653
2021-09-24
*安徽省哲学社会科学规划项目(AHSKY2018D58)。
孟海江, E-mail: mhaijiang@163.com
