尖孢镰刀菌cox1 基因的克隆与生物信息学分析
2023-10-09田雨纯
田雨纯 赵 丹
(晋中信息学院,山西太谷 030800)
尖孢镰刀菌(Fusarium oxysporum)为白色气生菌丝,是植物枯萎病菌的病原菌,是一种土传病原性真菌,具有致病力强、致病范围广等特点[1]。从初发到大面积泛滥只需2~3年,发病率通常为10%~30%,病情严重的年份发病率可达50%,严重影响植株果实产量,甚至还会导致绝收[2]。研究尖孢镰刀菌内部主要成分,并针对性地研制相关药物抑制病菌生长成为了刻不容缓的任务。cox1(细胞色素c 氧化酶第I 亚基)是呼吸复合物IV 的3 个线粒体DNA(mtDNA)编码的亚基(MTCO1,MTCO2,MTCO3)中的1 个,它从还原的细胞色素c中收集电子,并将电子转移到氧气中以产生水,释放的能量用于跨线粒体内膜传输质。
生物信息学(Bioinformatics)是一门新兴的交叉学科,综合运用了生物学、数学、计算机科学和工程学。它可以应用各种数据库解释生命科学研究中发现的海量数据,所以被广泛应用于生命科学中的各个领域[9]。生物信息学以互联网为媒介、数据库为载体,利用数学和计算机科学对生物学数据进行存储、检索和处理分析,并进一步挖掘和解读生物学数据,是一门理论概念与实践应用并重的学科[10]。
本研究应用生物信息学相关知识,对尖孢镰刀菌cox1基因及蛋白的理化性质、信号肽、亲/疏水性、跨膜结构、蛋白质二级结构、蛋白质三级结构等方面进行预测和分析,以期为植物保护病菌抑制领域提供一定参考。
1 材料与方法
1.1 序列检索
在NCBI 中进行BLAST 分析,检索尖孢镰刀菌cox1基因序列及其编码蛋白序列。茄病镰刀菌(Fusarium solani)、禾谷镰刀菌(Fusarium graminearum)、黄色镰刀菌(Fusarium culmrum)、轮枝镰刀菌(Fusarium verticillium)、稻瘟病菌(Pyricularia oryzae)、立枯丝核菌(Rhizoctonia solani)、古巴假霜霉菌(Pseudoperonospora cubensis)及稻平脐蠕孢(Bipolaris oryzae)cox1基因及蛋白序列从NCBI蛋白数据库中获得。
1.2 生物信息分析方法
蛋白质理化性质分析(https://web.expasy.org/protparam)、蛋白质结构域分析(https://prosite.expasy.org)、蛋白质疏水性预测(https://web.expasy.org/protscale)、蛋白质跨膜预测(https://services.healthtech.dtu.dk/services/TMHMM-2.0)、蛋白质信号肽预测(https://services.healthtech.dtu.dk/services/SignalP-4.1)、蛋白质二级结构预测(https://predictprotein.org)以及蛋白质三级结构预测(https://swissmodel.expasy.org)。
预测蛋白跨膜结构利用TMHMM 软件,信号肽预测工具利用Signal P 软件,蛋白同源性比对利用NCBI 中的BLAST X 程序,蛋白序列比对分析利用DNA MAN软件,蛋白进化树绘制MEGA7软件,蛋白理化性质分析利用Protparam工具。
1.3 总RNA提取及反转录
尖孢镰刀菌总RNA 经传统Trizol 法提取,照Takara Reverse Transcription System 说明书进行反转录。将反转录后的产物用ddH2O 稀释10 倍,-20 ℃保存备用。
1.4 尖孢镰刀菌cox1基因CDS区克隆
采用PCR的方法克隆尖孢镰刀菌cox1基因CDS区,引物序列得F:GCATAATGGGTCACCAAGTT R:CGCTCTGTTACGAGGTCAT,片段总长度为15 593 bp,退火温度为51.9 ℃。PCR 反应体系共20 μL:PCR MasterMix 10 μL,Forward/ReversePrimer(10 pmol/μL)各0.5 μL,Template cDNA 1 μL,ddH2O 8 μL;PCR扩增条件:94 ℃3 min,94 ℃30 s,51.9 ℃30 s,72 ℃1 min,35个循环;72 ℃延伸1.5 min,4 ℃保存[3]。
2 结果与分析
2.1 尖孢镰刀菌cox1基因克隆
BLSAT检索出尖孢镰刀菌cox1基因长1 590 bp,共编码530个氨基酸。尖孢镰刀菌cox1基因CDS区克隆结果如图1所示,符合预期。

图1 尖孢镰刀菌cox1基因电泳图
2.2 尖孢镰刀菌cox1蛋白质的理化分析
利用生物信息分析软件Protparam 对尖孢镰刀菌cox1蛋白进行理化分析,结果如表1所示。cox1蛋白的氨基酸数量为530个,其分子量为58 390.82 D、分子式为C2767H4174N648O698S22,cox1 蛋白的理论等电点PI为8.46。亮氨酸(Leu)含量最高,含有70个,占总氨基酸数的9.2%,甘氨酸(Gly)含有50个,占总氨基酸数的9.4%,异亮氨酸含有46 个,占总氨基酸数的8.7%,半胱氨酸(Cys)含量最低,仅含有1 个,占总氨基酸数的0.2%。

表1 蛋白质的理化性质分析
2.3 尖孢镰刀菌cox1蛋白信号肽分析
信号肽主要由三部分组成:n 区(n-region)为正电荷的氨基酸;疏水区(h-region)由9个及以上的中性氨基酸组成;加工区(c-region)是信号肽酶切割信号肽的部位[4]。使用在线网站SignalP4.1 Server预测cox1蛋白信号肽情况,具体结果如图2所示,综合评估推测cox1蛋白不存在信号肽,也不跨膜,在细胞质中合成后,不进行蛋白转运,直接在细胞质基质中与代谢底物相作用,属于非分泌型蛋白质[5]。

图2 尖孢镰刀菌cox1蛋白质信号肽
2.4 尖孢镰刀菌cox1蛋白的亲疏水性分析
不同的氨基酸侧链基团极性不同,导致其组成的蛋白质有一定的亲/疏水性。通过在线分析网站对cox1 蛋白的疏水性进行研究,如图3 所示。横轴表示的是氨基酸的位置,纵轴代表的是氨基酸平均疏水指标,并且图中的正值和负值分别表示的是疏水性和亲水性,正值越大,表明疏水性越强,负值越大,表明亲水性越强[6]。结果表明,cox1蛋白的最大疏水值(即最小亲水值)出现在第195位氨基酸,最小疏水值(即最大亲水值)出现在第443位氨基酸,由亲水性氨基酸和疏水性氨基酸的分布可知,肽链中疏水性氨基酸残基数量明显多于亲水性氨基酸残基,因此可以推测cox1 蛋白为疏水性蛋白。
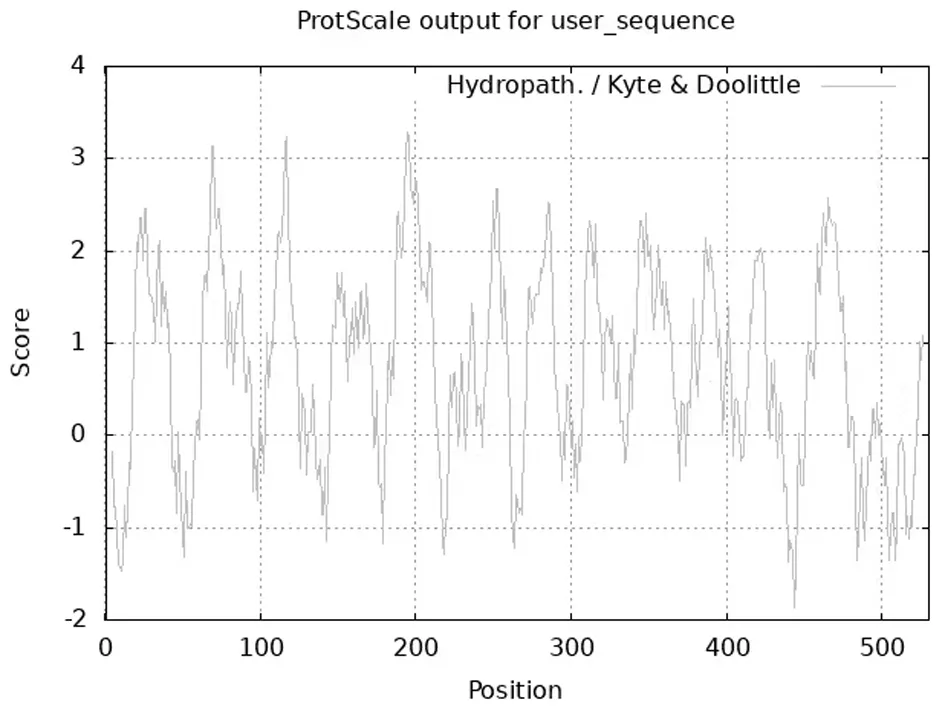
图3 尖孢镰刀菌cox1蛋白的疏水性分析
2.5 尖孢镰刀菌cox1蛋白的跨膜结构分析和预测
通过在线网站预测蛋白跨膜结构,对尖孢镰刀菌cox1蛋白进行蛋白跨膜结构预测(图4)。横轴表示的是氨基酸的位置,纵轴代表的是跨膜结构的可能性[7],图4结果显示,尖孢镰刀菌cox1蛋白存在12个跨膜区域,因此可推测cox1蛋白为12层跨膜结构蛋白。
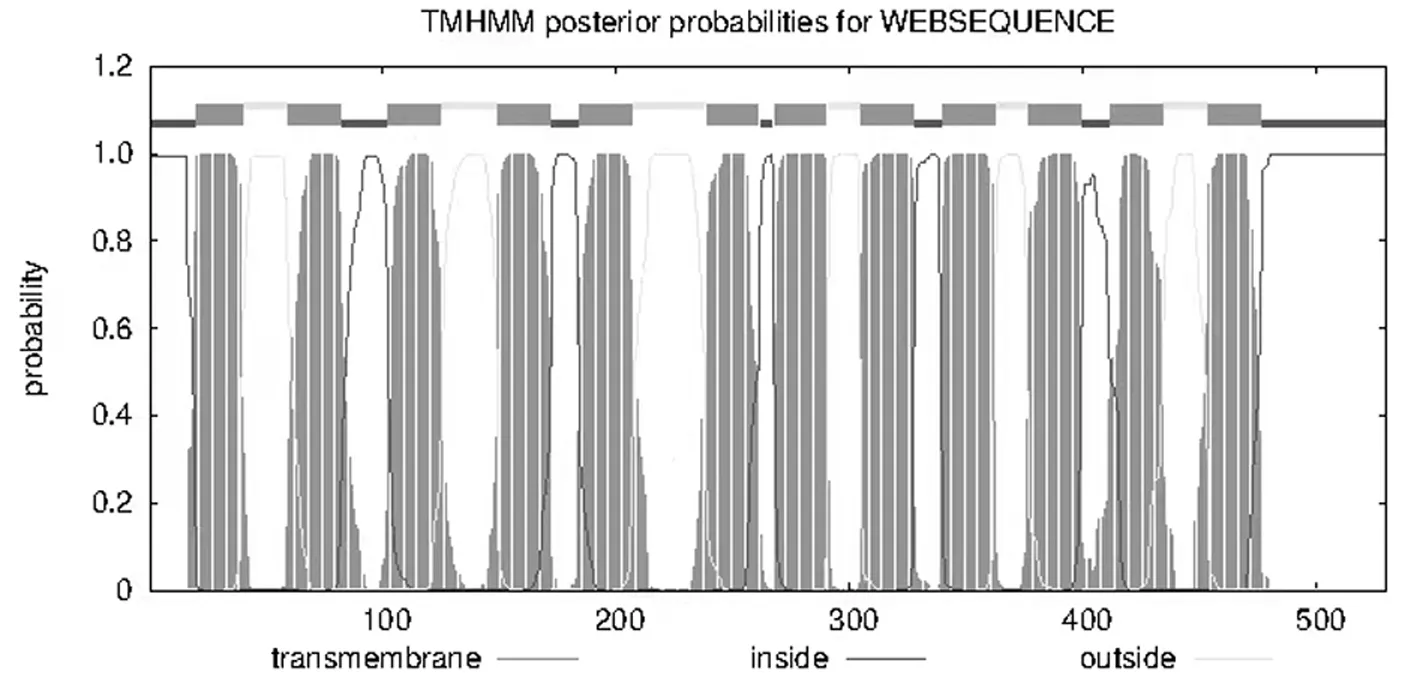
图4 尖孢镰刀菌cox1蛋白的跨膜结构预测
2.6 尖孢镰刀菌cox1蛋白序列比对与进化分析
通过NCBI 查找发现,尖孢镰刀菌cox1 蛋白有530个氨基酸,用DNA MAN软件把其氨基酸的序列与茄病镰刀菌、禾谷镰刀菌、黄色镰刀菌、轮枝镰刀菌、稻瘟病菌、立枯丝核菌和稻平脐蠕孢cox1蛋白序列进行对比,结果显示,不同生物物种cox1蛋白序列存在一定的序列一致性。图5 所示是9 个物种的系统进化树。
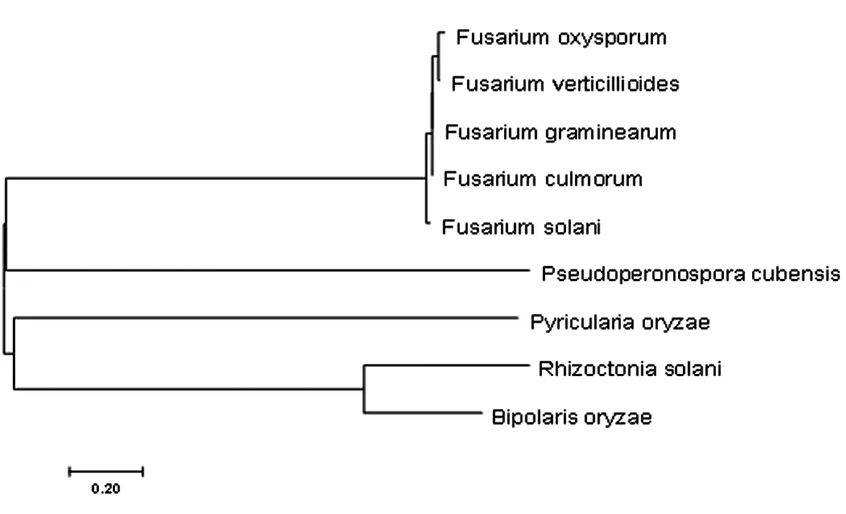
图5 9个物种cox1氨基酸序列系统进化树
2.7 尖孢镰刀菌cox1蛋白的二级、三级结构预测
蛋白质二级结构作为一级结构和三级结构的纽带,对其预测可以为三级结构和功能提供大量信息,如设计蛋白质突变体或确定蛋白质空间结构及功能[8]。
利用二级结构预测网站得α-螺旋占比较多为55.66%,片状结构(β-折叠和β-转角)为5.28%,无规则卷曲为39.06%,由此推断,cox1 蛋白二级结构中最主要结构元件是α-螺旋,此外无规则卷曲和片状结构分散于整个蛋白质中,且N-末端存在无规则卷曲形式,C-末端也存在无规则卷曲。
蛋白质的三级结构是由多肽链在二级结构的基础上经过进一步盘绕、折叠形成的复杂三维构象,这些二级结构主要包括α-螺旋、β-折叠、β-转角和无规则卷曲,它们之间通过侧链基团的相互作用借助次级键形成三级结构。cox1蛋白三级结构预测通过网站建模得图6,由图可看出α-螺旋占主要结构部分,无规则卷曲和片状结构分散于整个蛋白质中。

图6 尖孢镰刀菌cox1蛋白质三级结构预测
3 结论与讨论
本研究运用生物信息学软件对尖孢镰刀菌cox1基因进行克隆,并对cox1蛋白从理化性质、信号肽、亲/疏水性、跨膜结构、蛋白质二级结构、蛋白质三级结构等方面进行预测和分析。结果表明尖孢镰刀菌cox1基因CDS 序列1 590 bp,编码530 个氨基酸,cox1蛋白为碱性氨基酸,不存在信号肽,合成后就在核糖体处发挥作用,不存在运输,属于非分泌型蛋白质,疏水性较强,较稳定,有明显的跨膜现象。cox1蛋白二级结构中α—螺旋占主要结构部分,此外无规则卷曲和片状结构分散于整个蛋白质中,cox1 蛋白三级结构预测结果同样证实了二级结构成分含量的准确性,与二级结构结论相一致。cox1 蛋白在不同物种之间同源性较高,序列比对一致性较高,证明了该蛋白在同系同物种进化过程中发挥着至关重要的作用。研究结果为探究cox1蛋白的未知生物学功能提供了新思路,也为当下植物保护领域、植物真菌病害的防治打下了一定理论基础,结合生物信息学可研制更高效、低成本、对环境友好的绿色杀菌剂。
