地衣芽孢杆菌碱性果胶酶PelA和PelC的异源表达优化及其在不同表达宿主中的酶学性质
2023-10-08冯朋飞毕吻吻李乃强
冯朋飞,毕吻吻,沈 翔,陈 辰,李乃强,b
(东华大学 a.化学化工与生物工程学院,b.纺织科技创新中心, 上海 201620)
碱性果胶酶一般指果胶酸裂解酶(编号为EC 4.2.2.2),可通过反式消去作用来断裂聚半乳糖醛酸链的α-1,4糖苷键,并在非还原端生成4,5-不饱和低聚糖半乳糖醛酸盐[1-3]。碱性果胶酶的基因序列可分为胞外pelADE家族、胞外pelBC家族以及Yersiniapseudotuberculosis和Erwiniacarotovora菌株的周质果胶酸裂解酶4类亚家族,还有一些相对分子质量为24 kDa的真菌果胶裂解酶[2]。以上4个家族的果胶酸裂解酶基因序列相似度在50%以上,但只有pelBC和pelADE亚家族在进化上有亲缘关系[2]。对细胞外的碱性果胶酶序列同源物进行多重比对发现,所有亚家族可能共享平行的β螺旋折叠,不同碱性果胶酶之间的差异主要在于平行的β螺旋的核心和环数量不同[3],这些差异导致碱性果胶酶等电点(pI)不同,其中PelA的pI为4.7、PelB的pI为7.7、PelC的pI为8.3、PelD和PelE的pI均大于9.5[4-5]。目前许多碱性果胶酶的晶体结构已得到解析[6],如Erwiniachrysanthemi的PelC[7]、Azospirillumirakense的PelA[8]、Cellvibriojaponicus的Pel10Acm[9]等。
自1972年首次发现碱性果胶酶[10]以来,对碱性果胶酶的异源表达和应用逐渐成为研究热点。产生碱性果胶酶的菌株主要有Bacillussp.[11-12]、Erwinia.sp.[13]、Aspergillus.sp.[14]、Aspergillus.sp.[15-16]等。近年对碱性果胶酶表达和分子改造的研究也越来越多,如桂习武[17]对短小芽孢杆菌(Bacilluspumilus)中碱性果胶酶基因进行克隆表达,利用定点突变和易错聚合酶链式反应(PCR)技术对酶进行分子改造得到良好的突变体,并用于提取枸杞多糖。史文敬[18]将Bacillussubtilis7-3-3的碱性果胶酶PelA和PelC应用于苎麻脱胶中,发现这两种酶共表达具有一定的协同作用,不仅可以提高木聚糖酶、甘露聚糖酶的活力,而且在处理苎麻纤维过程中提高了脱胶率,并改善了纤维的分散性和白度。
虽然碱性果胶酶的研究较多,但是针对地衣芽孢杆菌(Bacilluslicheniformis)的碱性果胶酶PelA的研究较少,如:刘连成等[19]在大肠埃希菌中表达了B.licheniformisDG-3的pelA基因;Zhou等[20]对比了Bacilluslicheniformis91的PelA与其他芽孢杆菌的氨基酸差异,用大肠埃希菌异源表达pelA基因,探索了其耐碱、耐热特性。大肠埃希菌虽然是蛋白表达的理想宿主,但是在工业应用时,尤其在过表达重组酶时,需要破碎细胞,工序繁琐,这限制了其工业应用。枯草芽孢杆菌与Bacilluslicheniformis同为芽孢杆菌属,属于非致病菌,两者均具有遗传背景清晰、分子操作工具成熟、分泌蛋白能力突出的优点,是理想的重组蛋白表达宿主。此外,地衣芽孢杆菌碱性果胶酶PelC的氨基酸序列和PelA几乎无同源性,它们的酶学性质可能具有较大差异,目前未见相关研究报道。基于以上研究背景及不同酶共表达具有协同增效的特点,以笔者实验室保存的B.licheniformisX-01的碱性果胶酶基因pelA和pelC为研究对象,对相关的质粒载体、表达元件和宿主进行优化,以提高其异源表达的水平和碱性果胶酶酶活。对碱性果胶酶在不同宿主中的酶学性质差异进行对比,挖掘碱性果胶酶的耐温、耐热工业应用属性,为其后续在高表达酶活和大麻脱胶方面的应用奠定基础。
1 材料和方法
1.1 试验材料
笔者实验室保存的B.licheniformisX-01用于提取全基因组作为目的基因扩增模板,E.coliBL21和B.subtilis168分别作为宿主。质粒载体pUC57,穿梭质粒载体pHY-P43用于重组酶的构建。E.coliBL21、B.subtilis168和pUC57均为笔者实验室保存的菌株和质粒,pHY-P43购自湖南丰晖生物科技有限公司,聚半乳糖醛酸购自上海凛恩科技发展有限公司,DNA提取试剂盒、NormalRunTM250bp-IV DNA ladder ready-to-use、2×PCR Master Mix、10×buffer、Taq DNA Polymerase购自上海捷瑞生物工程有限公司,ClonExpress®II One Step Cloning Kit购自南京诺唯赞生物科技股份有限公司,琼脂糖购自上海生工生物工程股份有限公司,酵母粉、胰蛋白胨、氯化钠等常用试剂均为国产化分析纯试剂。

表1 本研究所用引物Table 1 Primers used in this study
1.2 试验方法
1.2.1 碱性果胶酶pelA和pelC基因的扩增
利用NCBI网上BacilluslicheniformisATCC 14580[21]的pelA(GenBank No. AAU42942.1)和pelC(GenBank No. AAU40308.1)基因序列设计引物,以B.licheniformisX-01全基因组为模板,通过PCR扩增pelA和pelC基因。PCR程序条件:98 ℃预变性5 min;98 ℃变性10 s,58 ℃退火30 s,72 ℃延伸75 s,30个循环;72 ℃再延伸7 min,4 ℃保存。用质量分数为1%的琼脂糖凝胶对上述PCR程序的产物电泳进行检测,并交予上海生工生物有限公司进行测序。
1.2.2pelA和pelC重组质粒的构建
按照一步法克隆试剂盒说明书的操作步骤构建重组质粒pUC57-pelA、pUC57-pelC、pHY-P43-pelA、pHY-P43-pelC。通过菌落PCR、酶切验证和测序验证重组质粒构建是否成功。
1.2.3pelA和pelC重组质粒的表达
将pUC57-pelA、pUC57-pelC分别转化至E.coliBL21中进行表达;然后挑取阳性单菌落至5 mL的LB(Luria-Bertani)液体培养基(含100 μg/mL的氨苄西林)试管中,于旋转式摇床进行过夜培养,培养温度为37 ℃,摇床转速为200 r/min,并设一组pUC57空载体转化子E.coliBL21-pUC57作为对照。取1 mL过夜培养物置于装有100 mL的LB液体培养基(含100 μg/mL的氨苄西林)的摇瓶中,于旋转式摇床进行发酵培养24 h,发酵温度37 ℃,摇床转速为200 r/min。将培养后的发酵液进行离心(离心温度为4 ℃,离心速度为6 000 r/min,离心时间为20 min),弃掉离心后的上清液,用10 mL浓度为0.2 mol/L的甘氨酸-氢氧化钠缓冲液(pH=9.0)重悬,超声破碎细胞20 min后,再离心20 min,测定上清液的碱性果胶酶酶活。
将质粒pHY-P43-pelA用BamHI单酶切,按第1.2.2节中步骤进行重组质粒的构建。通过菌落PCR、酶切、测序验证后,转入B.subtilis168中进行表达。挑取阳性单克隆装于含有5 mL的LB液体培养基(含5 μg/mL的四环素)的试管中,置于旋转式摇床进行过夜培养,培养温度为37 ℃,摇床转速为200 r/min。用过夜培养的种子液按体积分数为4%的接种量接入装有50 mL的LB培养基(含5 μg/mL的四环素)的摇瓶中,置于旋转式摇床培养24 h,培养温度为37 ℃,摇床转速为200 r/min,发酵结束后,按照第1.2.3节对发酵液进行处理,测定发酵液的碱性果胶酶酶活,并进行SDS-PAGE凝胶电泳鉴定。
1.2.4 重组质粒pHY-P43-pelA-pelC的共表达
将pHY-P43-pelA、pHY-P43-pelC分别转化至B.subtilis168中,转化方法参照Berensmeier等[22]的转化方法:挑取单克隆装于含有5 mL的LB液体培养基(含有5 μg/mL的四环素)的试管中,将试管置于旋转式摇床过夜培养,培养温度为37 ℃,摇床转速为200 r/min,并设置一组pHY-P43空载体转化子B.subtilis168-pHY-P43作为对照组。取1 mL过夜培养液置于装有100 mL的LB液体培养基(含5 μg/mL的四环素)的摇瓶中,于旋转式摇床进行发酵培养24 h,发酵温度为37 ℃,摇床转速为200 r/min。将培养后的发酵液进行离心(离心温度为4 ℃,离心速度为6 000 r/min,离心时间为20 min),得到上清液,测定上清液的碱性果胶酶酶活(胞外酶酶活);将沉淀溶液用10 mL浓度为0.2 mol/L的甘氨酸-氢氧化钠缓冲液(pH=9.0)重悬,利用超声破碎细胞20 min后,再离心20 min,取上清液,测定上清液的碱性果胶酶酶活(胞内酶酶活),并进行SDS-PAGE凝胶电泳鉴定。
1.2.5 碱性果胶酶活力测定
用浓度为0.2 mol/L的甘氨酸-氢氧化钠缓冲液(pH=9.0)溶解聚半乳糖醛酸配置底物溶液,其中聚半乳糖醛酸的质量分数为0.2%。取2 mL底物溶液于温度为45 ℃的恒温水浴锅中预热5 min,随后取20 μL稀释的发酵液和底物溶液混合均匀,并置于温度为45 ℃的恒温水浴锅中反应15 min,再加入3 mL浓度为0.03 mol/L的磷酸溶液以终止反应,用紫外-可见光分光光度计测定反应液235 nm处的吸光度。以灭活酶液作为空白对照。一个标准酶活单位(1 U)定义为1 min使聚半乳糖醛酸裂解产生1.0 μmol/L 的不饱和半乳糖醛酸的酶量。
1.2.6 酶学性质研究
在pH 值为9.0、温度为35~90 ℃条件下测定碱性果胶酶酶活,确定酶的最适反应温度;在温度为45 ℃时,用pH值为7~12的甘氨酸-氢氧化钠缓冲液测定酶活,确定酶的最适反应pH值;将发酵液分别置于35~60 ℃下保温60 min,测定发酵液残留酶活,确定酶的热稳定性。选择最适反应温度和最适反应釜pH值,并分别添加浓度为0.1 mmol/L的不同金属离子于发酵液中,测定发酵液的碱性果胶酶酶活,考察不同金属离子对酶活的影响。
2 结果与分析
2.1 pelA和pelC基因的扩增及重组质粒的构建
B.licheniformis的pelA和pelC基因的测序结果表明,所测序列与GenBank中报道的B.licheniformisATCC 14 580菌株pelA和pelC基因序列同源性为99%[21]。B.licheniformis的pelA和pelC对应的酶蛋白为一个完整的开放阅读框,长度分别为1.0和1.3 kb,pelA和pelC基因分别编码一个含341和435个氨基酸残基的蛋白酶,相对分子质量分别为34.5和45.2 kDa,信号肽预测表明PelA和PelC分别含有27和24个氨基酸的分泌信号肽。通过Blast比对发现,B.licheniformisX-01的PelA与芽孢杆菌属的PelA具有高同源性,与嗜碱芽孢杆菌的BliPelA(GenBank No. KX 440 958)、Bacilluslicheniformis(GenBank No. WP_144 654 533)、Bacillushaynesii(GenBank No. WP_182 069 822.1)、Bacillusparalicheniformis(GenBank No. WP_043 926 874.1)、Bacillussubtilis(GenBank No. WP_186 438 738.1)的相似性分别为98.24%、99.7%、98.53%、97.95%、97.96%。地衣芽孢杆菌的PelC与枯草芽孢杆菌的PelC无明显同源性。
PCR扩增产物如图1(a)所示。重组质粒pUC57-pelA、pUC57-pelC、pHY-P43-pelA、pHY-P43-pelC双酶切鉴定结果如图1(b)和1(c)所示。PCR扩增产物在琼脂糖凝胶电泳图(见图1(a))上于1.1和1.3 kb的位置有一明显条带,与预期基因大小一致。由图1(b)可看出:泳道1和泳道2处均有约1 kb的条带分别为pelA和pelC,约2 kb的条带为酶切的质粒骨架,两者电泳条带均与理论位置一致。由图1(c)可看出:泳道1为重组质粒pHY-P43-pelA的酶切片段,在1.1和5.0 kb处有2个明显条带;泳道2为重组质粒pHY-P43-pelC的酶切片段,在1.3和5.0 kb处有2个明显条带。两者电泳条带均与理论位置一致。菌落PCR鉴定所选转化子为阳性转化子。pHY-P43-pelA、pHY-P43-pelC在B.subtilis168中表达的SDS-PAGE电泳图如图1(d)所示。由图1(d)可看出:泳道1、2均在33.0 kDa左右有一明显条带,说明pelA得到很好的表达;泳道5、6则均未在45.0 kDa处看到明显条带,可能是因为pelC表达过弱。

图1 pelA和pelC基因的鉴定与表达Fig.1 Identification and expression of pelA and pelC genes
2.2 重组质粒pHY-P43-pelA-pelC的共表达
重组质粒启动子P43为枯草芽孢杆菌表达系统的常用强启动子,通过BamHI单酶切后,利用试剂盒将pelC基因连接至pelA基因后面,使穿梭质粒载体在B.subtilis168中共表达(见图2)。对阳性克隆进行菌落PCR鉴定,图3(a)为菌落PCR验证结果,在2 400 bp处有一明显条带,与理论pelA-pelC(2 378 bp)基因大小一致。由于pelC基因内部有1处BamHI酶切位点,因此通过BamHI单酶切理论上有3个条带(见图3(b)),泳道2的3个条带均符合BamHI酶切后片段数目和大小。通过上海生工生物有限公司测序验证pHY-P43-pelA-pelC基因正确,表明重组质粒构建成功。将重组质粒pHY-P43-pelA-pelC基因转入B.subtilis168中共表达,利用摇瓶发酵测定发酵液碱性果胶酶活。从图3(c)可以看出,重组酶BsPelA和BsPelC蛋白均已表达。发酵液碱性果胶酶的总酶活为14.6 U/mL,与仅表达pHY-P43-pelA的重组菌发酵液相比,总酶活提高了24.8%。
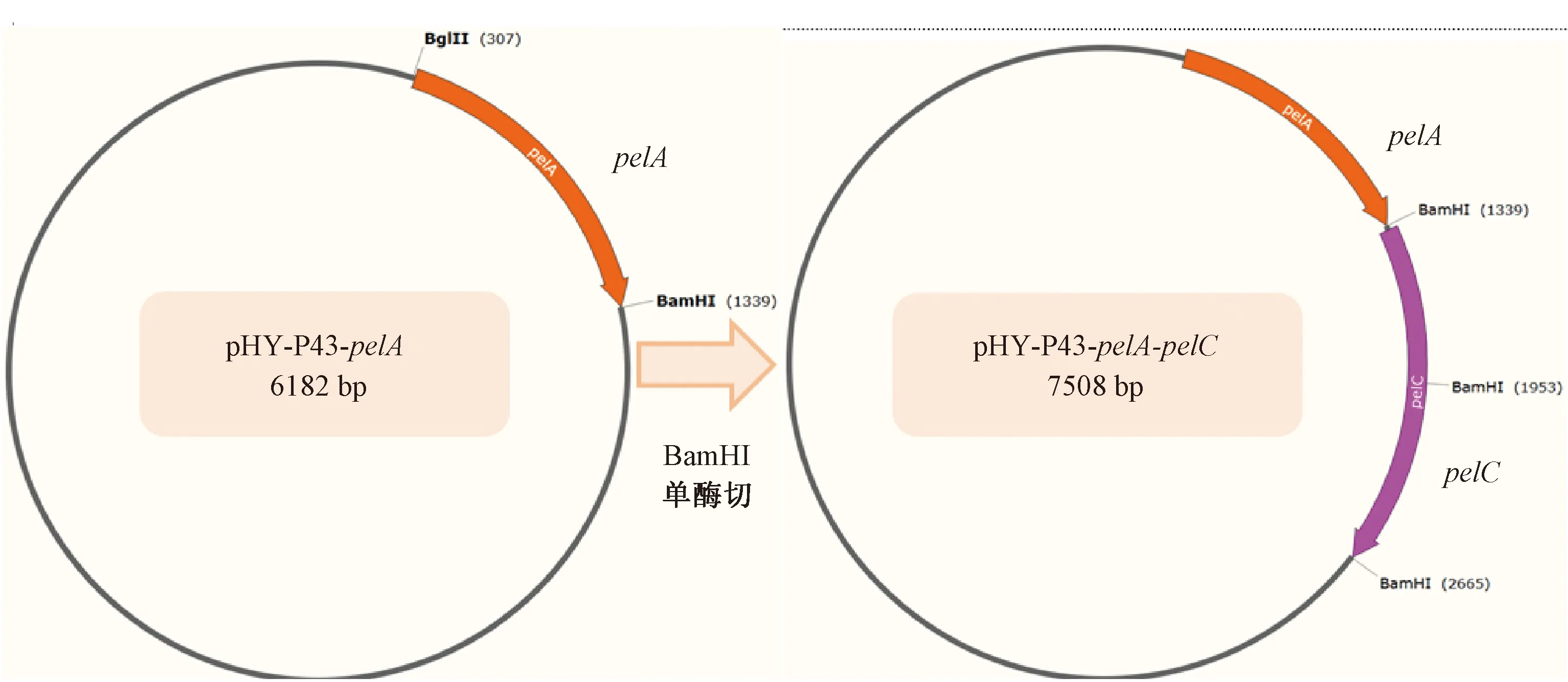
图2 重组质粒pHY-P43-pelA-pelC构建Fig.2 Construction of recombinant plasmid pHY-P43-pelA-pelC
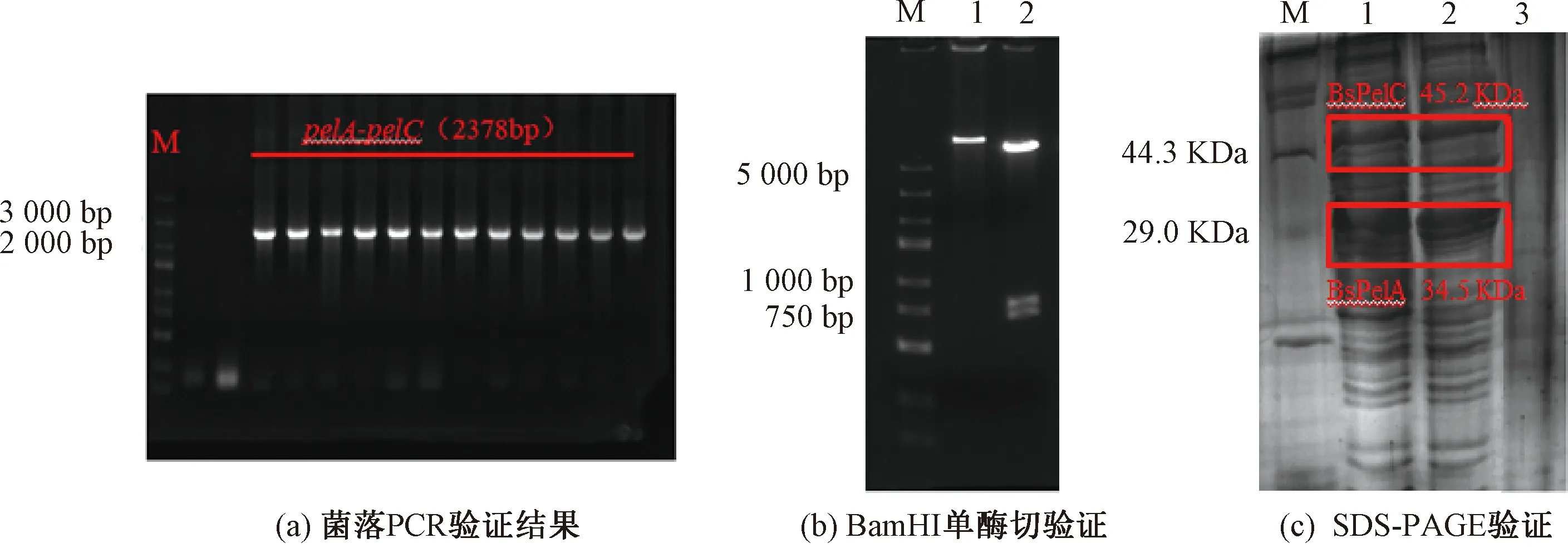
图3 pHY-P43-pelA-pelC基因的鉴定和表达Fig.3 Identification and expression of pHY-P43-pelA-pelC gene
2.3 不同宿主的重组碱性果胶酶PelA和PelC的酶学性质
2.3.1E.coliBL21为宿主的重组碱性果胶酶的酶学性质
按照第1.2.5节中步骤测定重组菌E.coliBL21-pUC57-pelA发酵液的酶活,折合到发酵液中的碱性果胶酶酶活为10.5 U/mL,说明pelA基因可在大肠成功表达并具备活性,该结果与刘连成等[19]采用大肠埃希菌异源表达BacilluslicheniformisDG-3的重组酶PelA酶活(12 U/mL)相近。E.coliBL21-pUC57-pelC与含有空质粒的对照菌株E.coliBL21-pUC57均无碱性果胶酶活性。对宿主为E.coliBL21的碱性果胶酶EcPelA酶学性质进行研究,结果如图4~7所示。由图4可知,重组碱性果胶酶EcPelA的最适反应温度为75 ℃,高于现有研究中的嗜碱地衣芽孢杆菌的PelA(温度为70 ℃)[20]和B.licheniformis14A的PelA(温度为65 ℃)[21],这对于需要高温、高pH值环境进行大麻脱胶是非常有利的。由图5可知,重组酶EcPelA在温度为35~50 ℃时具有良好的热稳定性,酶活均保持在90%以上,但当温度为60 ℃时,该酶迅速失活。由图6可知,重组菌E.coliBL21中重组碱性果胶酶EcPelA的最适反应pH值为11,与BliPelA和B.licheniformis14A的PelA相似。由图7可知,Mg2+对重组酶具有激活作用,相对酶活达到110%。Cu2+、Fe2+、Zn2+、Mn2+对重组酶EcPelA均有不同程度的抑制作用,其中Fe2+对重组酶PelA抑制效果最为显著。
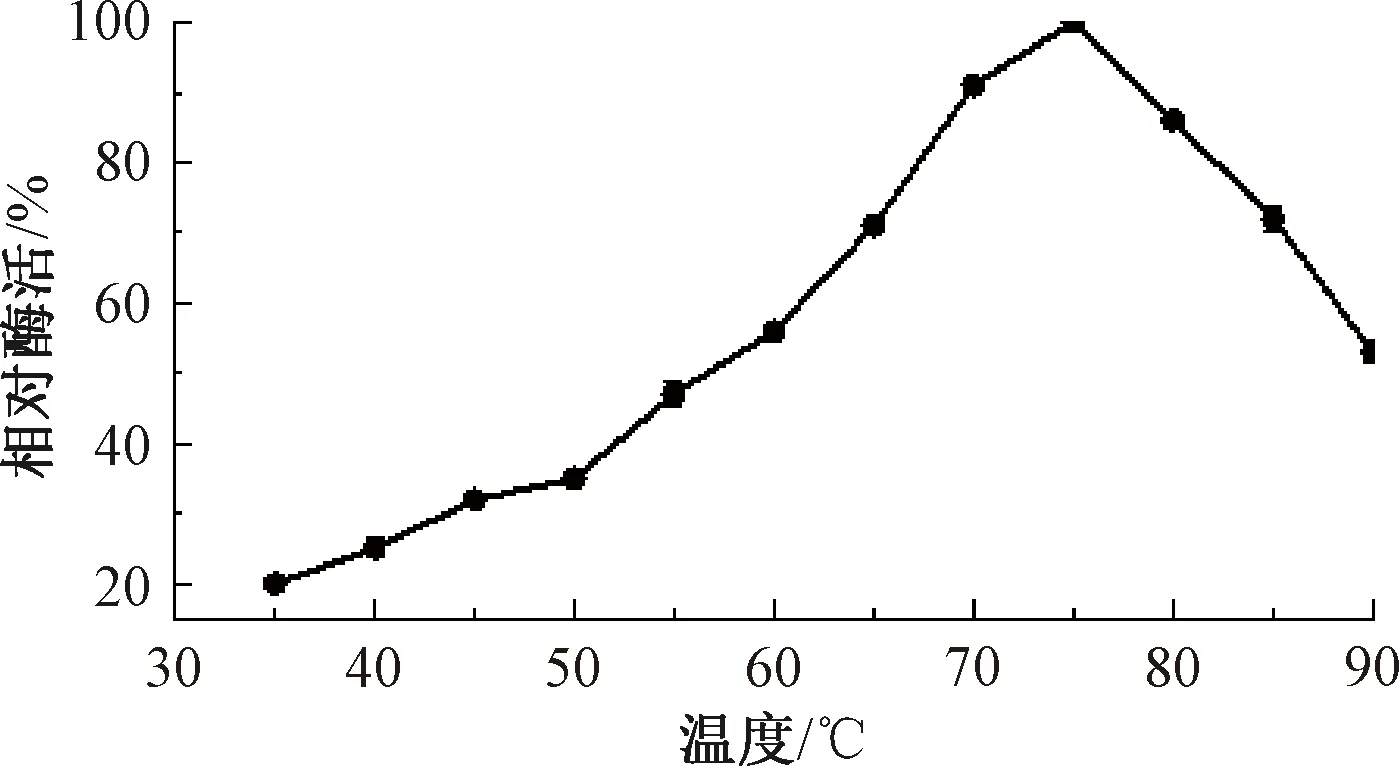
图4 温度对重组酶EcPelA的影响Fig.4 The effect of temperature on recombinase EcPelA
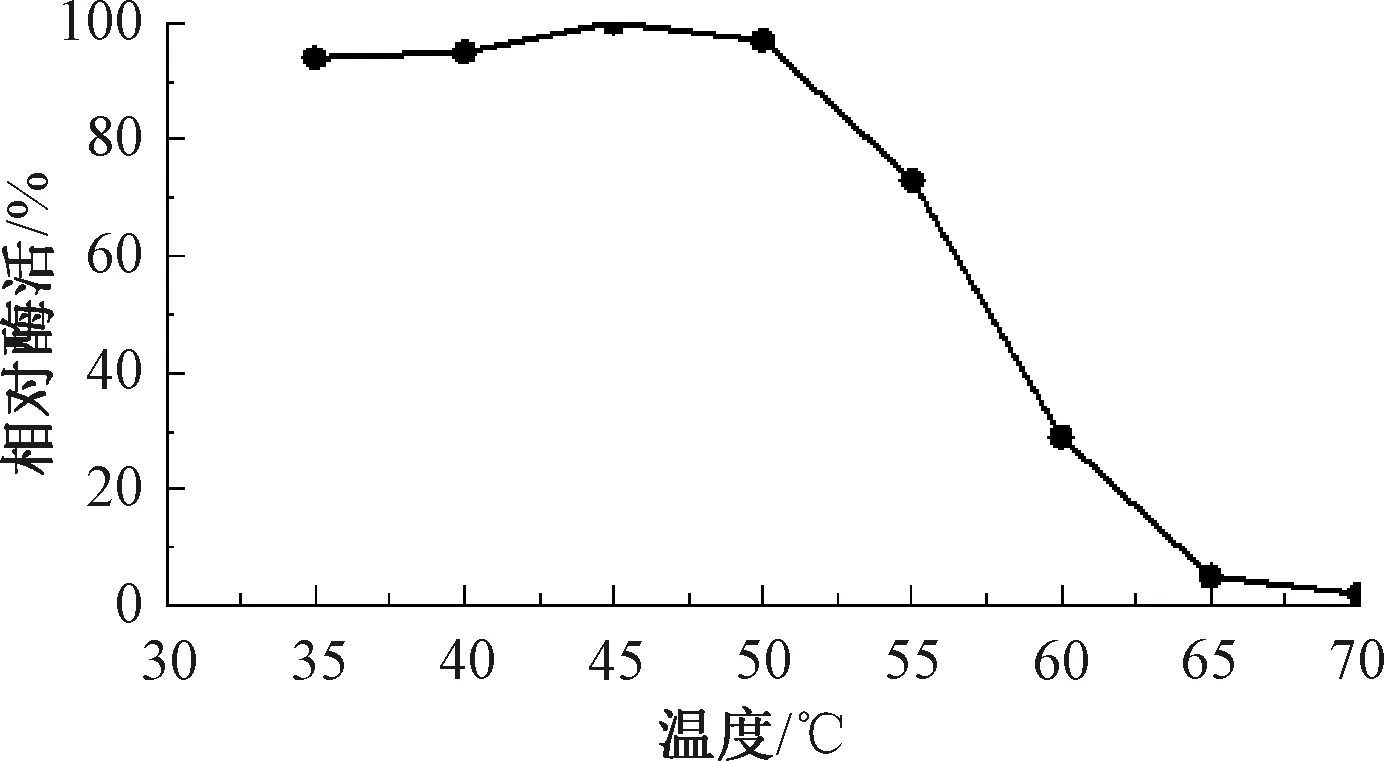
图5 重组酶EcPelA的热稳定性Fig.5 Thermal stability of recombinase EcPelA
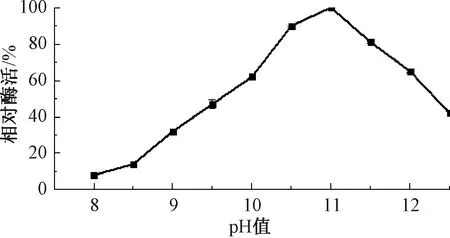
图6 pH值对重组酶EcPelA的影响Fig.6 The effect of pH on recombinase EcPelA
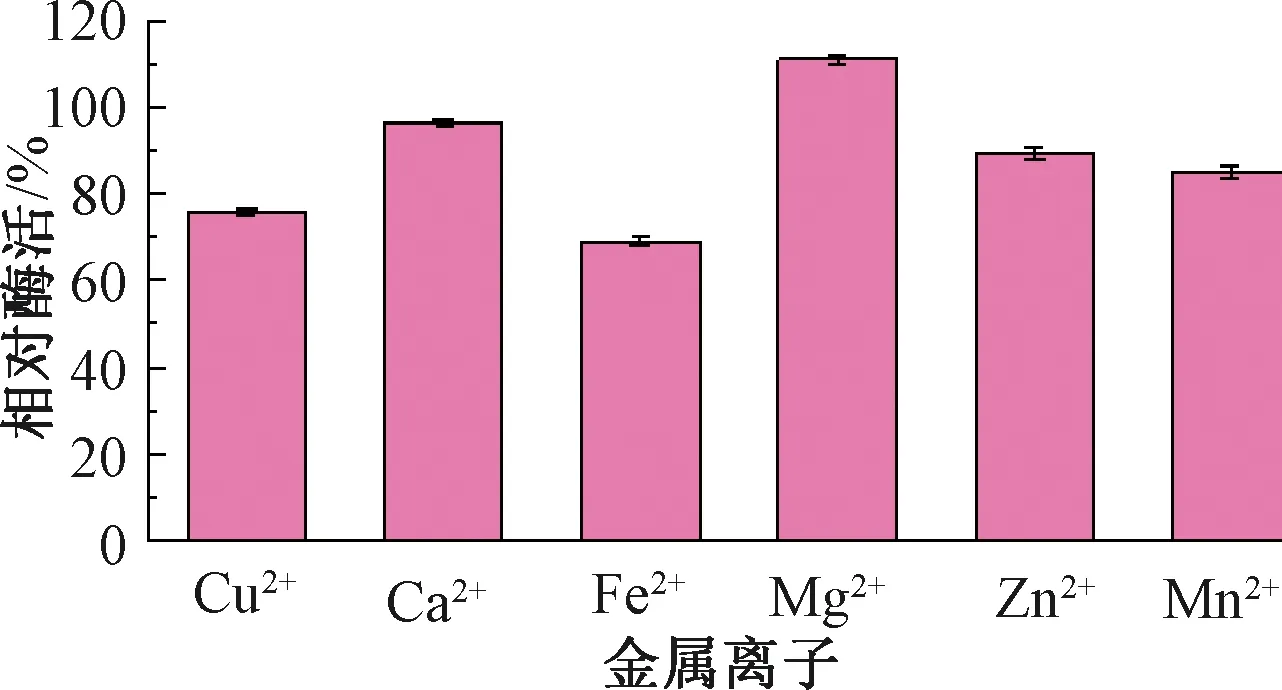
图7 金属离子对重组酶EcPelA的影响Fig.7 The effect of metal ions on recombinase EcPelA
2.3.2B.subtilis168为宿主的重组碱性果胶酶的酶学性质
采用强启动子P43,将pelA和pelC基因分别和穿梭质粒pHY进行Gibson无缝重组,并转化至B.subtilis168中进行发酵,重组碱性果胶酶BsPelA的胞外酶活和胞内酶活分别为7.0和 4.7 U/mL,重组碱性果胶酶BsPelC的胞外酶活为4.1 U/mL,表明pelA和pelC基因在B.subtilis168成功表达并具备活性。发酵液的碱性果胶酶的酶学性质分析如图8~11所示。
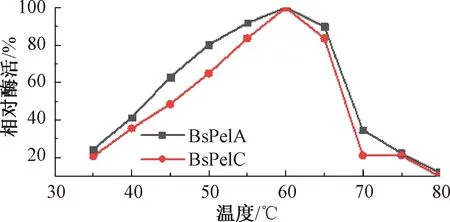
图8 温度对重组酶BsPelA和BsPelC的影响Fig.8 The effect of temperature on recombinase BsPelA and BsPelC
重组酶BsPelA和BsPelC在枯草芽孢杆菌中最适反应温度均为60 ℃(见图8)。热稳定性试验结果表明,BsPelA和BsPelC在温度为35~55 ℃保温1 h,相对酶活均在90%以上(见图9)。在温度为55~60 ℃时,重组酶BsPelC酶活下降比BsPelA慢,说明BsPelC的热稳定性比BsPelA好。碱性果胶酶在不同表达系统中酶学性质不同,这可能是由大肠埃希菌和枯草芽孢杆菌的蛋白修饰系统不同所导致的。
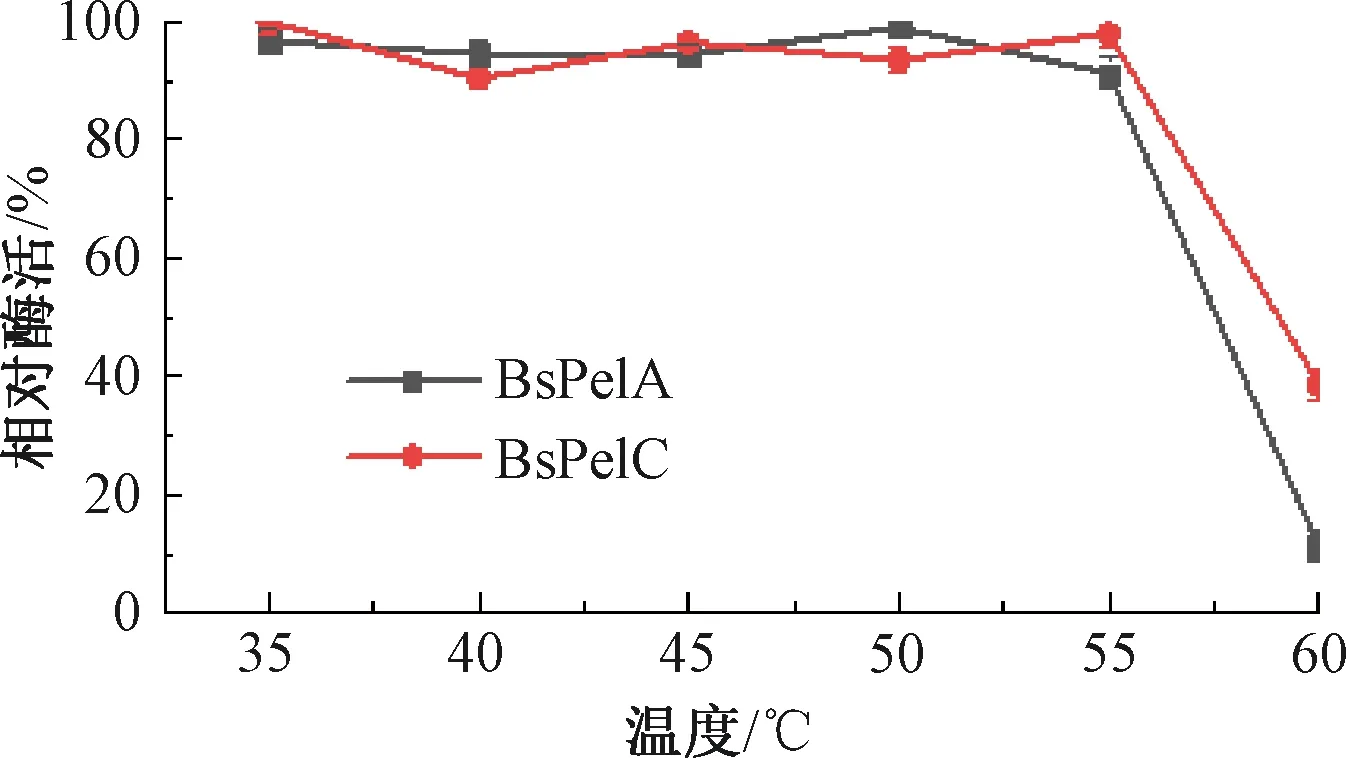
图9 重组酶BsPelA和BsPelC的热稳定性Fig.9 Thermal stability of recombinase BsPelA and BsPelC
重组酶BsPelA和BsPelC的最适pH值分别为11和10(见图10),Mg2+、Ca2+对BsPelA和BsPelC均有激活作用,其中Ca2+使相对酶活达到了116%和141%,这与在大肠埃希菌表达系统中Ca2+对EcPelA没有促进作用是不同的,相关机制需要进一步研究。Cu2+、Zn2+对BsPelA和BsPelC的酶活有明显的抑制作用,相对酶活分别下降到30%和47%。
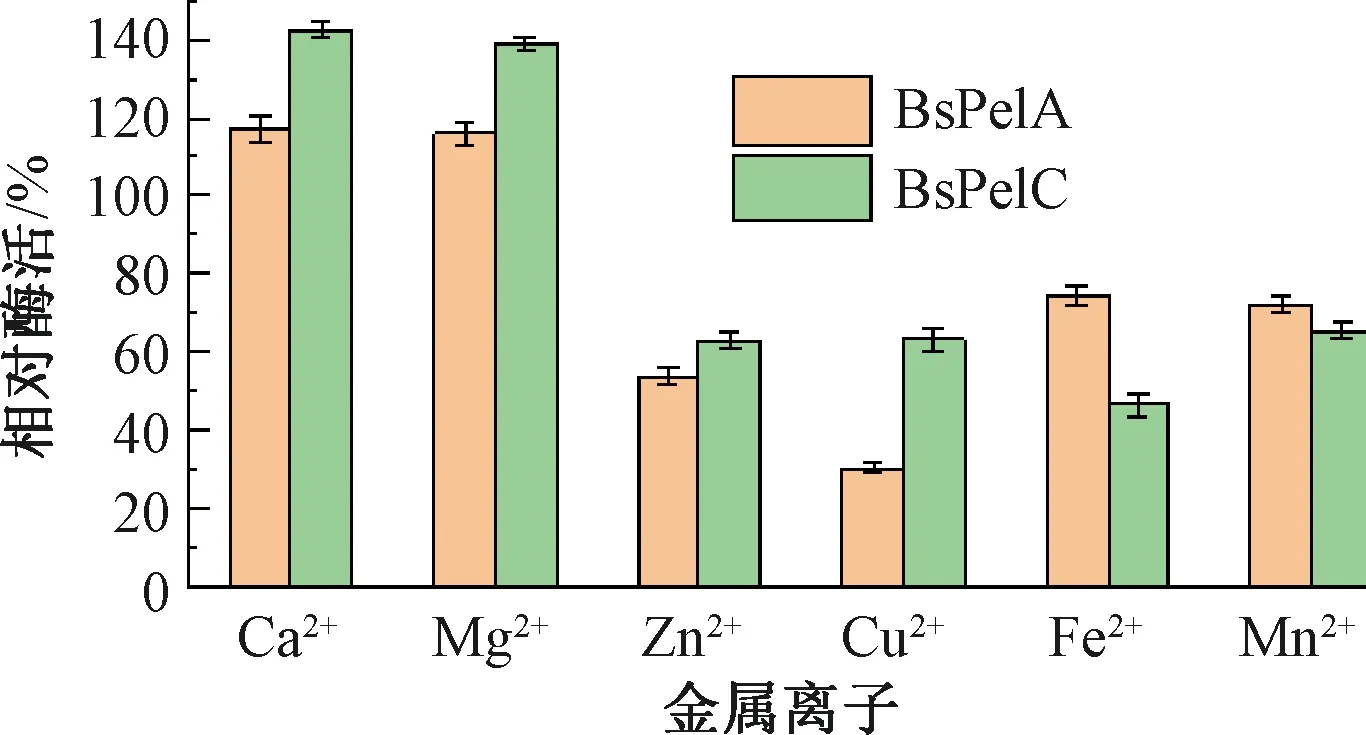
图11 金属离子对重组酶PelA和PelC的影响Fig.11 The effect of metal ions on recombinase PelA and PelC
3 结 论
本研究通过选择合适的质粒载体、强启动子和遗传背景清晰的表达宿主,实现pelA和pelC基因的异源表达和共表达,提高了碱性果胶酶的酶活,并研究了不同宿主的碱性果胶酶的酶学性质。
(1)构建的强启动子共表达穿梭质粒pHY-P43-pelA-pelC转化至B.subtilis168,使碱性果胶酶的酶活比对照提高了24.8%。
(2)以大肠埃希菌为表达宿主时,B.licheniformisX-01的重组碱性果胶酶 PelA最适温度为75 ℃,高于嗜碱地衣芽孢杆菌的PelA最适温度(70 ℃)[20]和B.licheniformis14A的PelA最适温度(65 ℃)[22],这和大麻脱胶要求的高温、高碱性的应用环境是相符合的,具有一定的应用价值。
(3)宿主分别为E.coliBL21和B.subtilis168两种重组酶PelA的最适温度为75和60 ℃,且以B.subtilis168为宿主时,Ca2+对重组酶PelA和PelC的酶活均有明显促进作用。
(4)地衣芽孢杆菌的PelC的酶学性质和地衣芽孢杆菌的PelA类似,其热稳定性优于PelA。
目前,来自地衣芽孢杆菌的碱性果胶酶酶活低是普遍存在的问题,后续研究将进一步对其表达系统和发酵工艺进行优化,并控制两种基因的表达水平,以更好地满足其工业应用。
