病灶清除联合敏感抗生素治疗腰椎术后早期手术部位感染并发脓毒症
2023-10-08李骁腾郭营李宝田吕丰姿郭小伟潘玉林
李骁腾,郭营,李宝田,吕丰姿,郭小伟 ,潘玉林
(1.郑州市骨科医院,河南 郑州 450052;2.河南省人民医院,河南 郑州 450003)
手术部位感染是脊柱手术的严重并发症之一,其发生率为0.2%~20%[1-2],其中腰椎术后手术部位感染的发生率约为0.81%[3]。手术部位感染可并发脓毒症,造成全身多器官功能障碍,会增加患者术后死亡风险。腰椎术后早期手术部位感染并发脓毒症较为少见,其相关文献报道也较少。为了探讨腰椎术后早期手术部位感染并发脓毒症的最佳治疗方法,2015年1月至2021年12月,我们采用病灶清除联合敏感抗生素治疗腰椎术后早期手术部位感染并发脓毒症患者13例,并对其临床疗效及安全性进行了观察,现报告如下。
1 临床资料
本组13例,男9例、女4例。年龄 31~58岁,中位数48岁。均为在郑州市骨科医院住院治疗的腰椎术后并发脓毒症患者。所有患者均接受过后路腰椎椎管减压椎间融合器植骨融合术,其中腰椎间盘突出症合并腰椎管狭窄症7例、单纯腰椎滑脱症6例。原手术节段:单节段4例,其中L4~53例,L5S11例;2节段6例,其中L3~4、L4~54例,L4~5、L5S12例;3节段3例,其中L2~3、L3~4、L4~52例,L3~4、L4~5、L5S11例。感染累及肌层8例,累及椎体、椎间隙5例。感染并发脓毒症时间,原手术后1~7 d 3例、8~10 d 5例、11~14 d 5例。13例患者中有10例切口愈合不良,且局部有渗出物。体温38.9~40.3 ℃,中位数 39.5 ℃。血培养和穿刺液培养结果显示:表皮葡萄球菌3例,金黄色葡萄球菌5例,肺炎克雷伯菌1例,大肠杆菌1例,阴沟肠杆菌3例。所有患者均不合并泌尿道感染、肺炎等疾病。
2 方 法
2.1 术前准备定时测量体温,常规检测红细胞沉降率、C-反应蛋白和降钙素原,将其调整至适合手术水平。密切观察切口愈合情况,对于切口愈合不良、局部有渗出物者[图1(1)],及时进行体格检查,必要时(腰痛伴下肢神经症状)行腰椎MRI。腰椎MRI提示内固定物周围有积液[图1(2)]或椎体局部呈水肿样信号改变[图1(3)],于切口处穿刺抽取积液进行细菌培养。细菌培养结果阳性,即可诊断为腰椎术后手术部位感染,采用敏感抗生素治疗;细菌培养结果阴性,宜结合症状、体征,以及实验室检查、影像学检查结果综合判断,及时采用广谱抗生素治疗,必要时请感染科协助诊疗。
2.2 治疗方法于炎症控制后1~3 d,采用清创灌洗引流术处理局部感染病灶。于原手术切口分层清除病灶,并留取病灶标本送细菌培养。每层病灶均采用碘伏和生理盐水反复冲洗。使用注射器加压冲洗椎弓根钉钉尾,彻底清除椎弓根钉周围的感染组织,必要时取出椎弓根钉浸泡、冲洗。感染未累及椎体内部、椎管、椎间隙者,不进行深部清创。感染累及椎间隙者,先取出融合器及其内部的骨粒,反复冲洗融合器,并用聚维酮碘浸泡10 min;然后清理椎间隙内植骨颗粒及炎性骨质,局部用聚维酮碘浸泡10 min,并用大量生理盐水冲洗;最后于原手术切口取健康椎体的椎板或棘突制为骨粒,置入融合器内,重新植入融合器。局部用生理盐水反复冲洗后用碘伏浸泡 10 min,再用生理盐水反复冲洗。术者及助手更换手套、手术器械等,并铺无菌巾。分别于原手术切口两侧放置冲洗管和引流管,逐层缝合切口。术后用生理盐水持续冲洗,隔2 d进行1次细菌培养,细菌培养结果提示对庆大霉素敏感者,在冲洗液中间断加入庆大霉素。连续2次细菌培养结果阴性时,停止冲洗并拔除冲洗管(总冲洗时间7~10 d)。待每日引流量小于50 mL后拔除引流管。术后根据药敏试验结果选择敏感抗生素,先静脉滴注抗生素4~6周,待各项炎性指标恢复正常1周以上,改为口服抗生素6~8周。
2.3 疗效评价方法记录手术前后白细胞、C-反应蛋白、红细胞沉降率、降钙素原的检测值,随访观察内固定物固定等情况。采用Oswestry功能障碍指数(oswestry disability index,ODI)[4]评价腰椎功能,采用疼痛视觉模拟量表(visual analogue scale,VAS)[5]评价腰部、腿部疼痛情况,采用改良 MacNab 标准[6]评价综合疗效。
3 结 果
本组13例患者均采用1次清创手术,均于炎症控制后1周出院。所有患者均获随访,随访时间6~24个月,中位数14个月。患者手术前后的白细胞、C-反应蛋白、红细胞沉降率、降钙素原检测值见表1,腰部疼痛VAS评分、腿部疼痛VAS评分、ODI指数见表2。末次随访时评价综合疗效,优11例、良2例。至末次随访时,所有患者均未出现感染复发、内固定物松动等并发症。
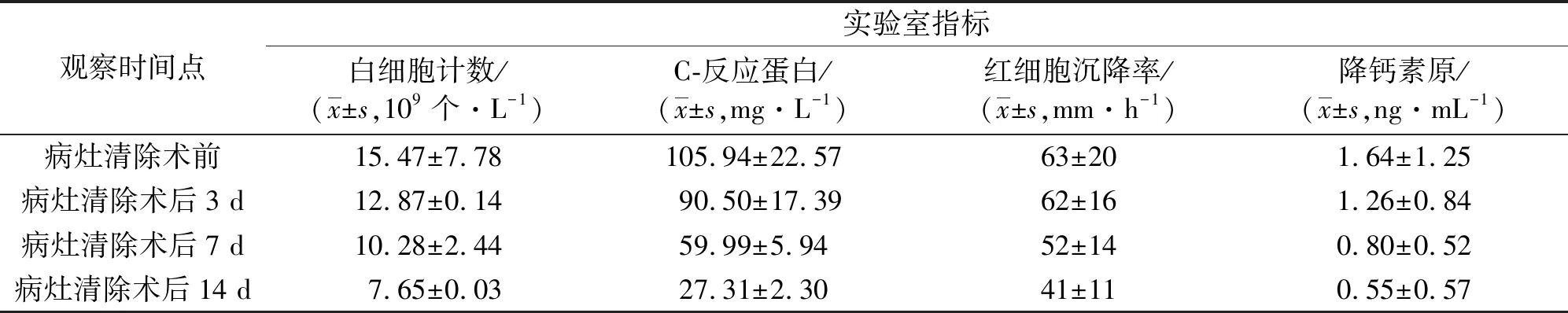
表1 13例腰椎术后早期手术部位感染并发脓毒症患者病灶清除联合敏感抗生素治疗前后的实验室指标
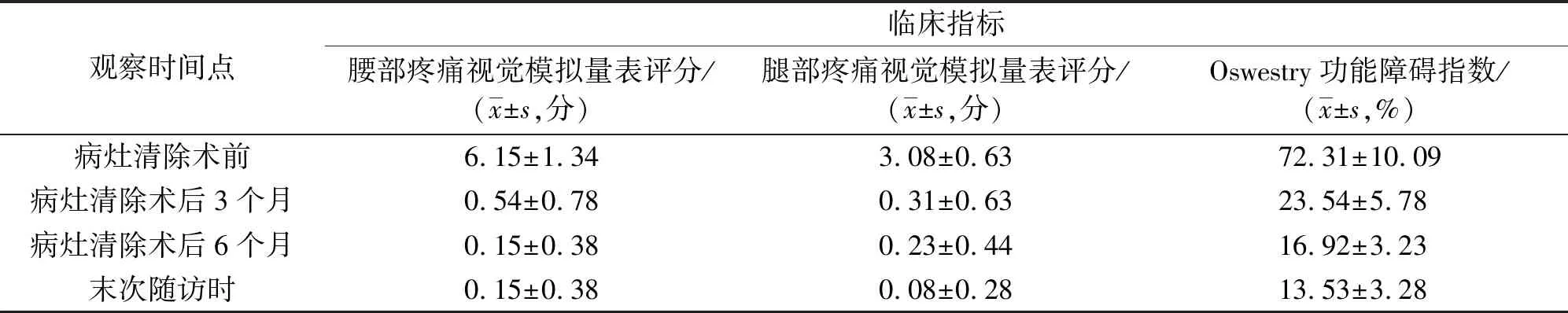
表2 13例腰椎术后早期手术部位感染并发脓毒症患者病灶清除联合敏感抗生素治疗前后的临床指标
4 讨 论
脊柱术后早期感染在时间方面尚无统一标准,脊柱术后1个月或3个月内发生的感染均可称为早期感染[7],我们倾向于将脊柱术后1个月内发生的感染称为早期感染。脊柱术后感染可并发脓毒症,会给患者和社会带来巨大的经济负担。
术后感染并发脓毒症的原因较多,如长期留置静脉导管、导尿管等,但主要原因是切口感染后病原菌进入血液循环。术后早期手术部位感染与术中或术后切口污染,以及术后患者免疫力降低等因素有关[8]。多数接受腰椎手术的患者因长期腰腿疼痛而较少活动,加上手术本身的创伤,术后机体的防御能力下降,对细菌的易感性增加。此外,若合并糖尿病或贫血等影响软组织修复能力的疾病,会造成切口愈合缓慢,从而增加了细菌进入血液的风险[9-10]。临床应注意区分手术部位感染与脓毒症之间的关系,如果切口深部穿刺液培养与血培养中的细菌相同,可推断切口感染并发了脓毒症,否则应注意观察是否合并其他疾病。脓毒症一般出现在术后1周左右,患者可有寒战、高热等表现,可通过实验室检查明确诊断。
腰椎术后手术部位感染的患者可能没有发热、腰背部疼痛或活动受限、下肢神经症状等典型表现,有时实验室检查可能也无阳性结果。Pappou等[11]研究发现,即使脊柱术后切口已经感染,但发热症状并不明显。本研究中患者均有发热表现,这可能与感染并发脓毒症有关。术后早期手术部位感染的常见表现是切口渗出物增多,且无论切口浅部或深部感染,均有此表现[12]。本研究中患者均有腰背部疼痛或下肢疼痛,这可能与脓毒症引起的全身炎症反应有关。临床用于诊断炎症反应的实验室检查项目较多,主要包括白细胞计数、红细胞沉降率、C-反应蛋白、降钙素原,以及细菌培养等[13]。腰椎术后手术部位感染患者的白细胞计数可能升高也可能处于正常值范围,因此白细胞计数并非诊断手术部位感染的敏感指标[14]。Inose等[15]研究发现,脊柱内固定术后6~7 d,中性粒细胞百分比和中性粒细胞计数与淋巴细胞计数的比值可用来预测手术部位感染,其灵敏度为80%、特异度为70%。红细胞沉降率是常用的炎性指标,一般在术后4~7 d达到高峰,约4周左右恢复正常,但干扰因素较多,特异性不强。C-反应蛋白是高敏感性的炎性指标,一般在术后2~6 h开始升高,在术后2~3 d达到高峰,在术后4 d开始下降,此后约1周时间趋于正常。当C-反应蛋白的动态变化呈“双峰曲线”,应高度怀疑脊柱术后手术部位感染[16]。Jean等[17]研究发现,C-反应蛋白能够早期诊断脊柱感染性疾病。因此对于术后腰背部疼痛加重的患者,应常规检查C-反应蛋白。降钙素原是临床常用的炎性指标之一,可随着炎症和感染程度的加重而升高。Aljabi等[18]对200例脊柱手术患者的降钙素原进行了动态监测,发现降钙素原是诊断术后感染的可靠指标。目前诊断术后手术部位感染、脓毒症的金标准是细菌培养阳性。Li等[19]研究发现,术区穿刺物细菌培养的阳性率为65%,认为这可能与细菌生物被膜有关。我们认为,在术区收集穿刺物时可分层穿刺,有利于提高细菌培养的阳性率。如果术区穿刺物细菌培养阴性,但患者有明显的腰部疼痛及下肢神经症状,同时炎性指标升高、MRI检查提示局部炎性改变,可考虑穿刺物细菌培养结果为假阴性,可按照腰椎术后手术部位感染进行干预。
在脊柱内固定术后手术部位感染的早期诊断中,影像学检查的作用相对有限。X线及CT并非术后感染的常规检查项目,对于MRI,有研究[20]发现其无法明显区分感染组织与正在修复的组织,以及血肿与脓肿。Sebaaly等[7]研究发现,MRI横断面上椎弓根钉头部周围存在积液可提示手术部位感染,MRI诊断手术部位感染的敏感度和特异度分别为88.2%和89.1%。本组患者的MRI均有异常表现,这提示MRI对术后感染并发脓毒症有高敏感性。
腰椎术后手术部位感染并发脓毒症一旦确诊,应首先处理全身症状较重的脓毒症,待病情平稳后尽早采用手术联合敏感抗生素治疗。脓毒症具有起病急、病情重、进展快等特点,患者甚至会很快进入休克状态。由于血培养时间较长,可请感染科会诊,先采用广谱抗生素治疗,待血培养结果出来后选择敏感抗生素治疗[21]。有文献[22]报道,约45%的脊柱感染由革兰氏阳性菌引起。Billières等[23]研究发现,20%~30%的脊柱手术感染由多病原菌所致。有研究[24]表明,随着第3代和第4代头孢类抗生素的应用,革兰氏阴性菌出现下降趋势,但革兰氏阳性菌却开始呈上升趋势。我们认为,对致病菌进行深入研究十分重要,可以在细菌培养结果未出的情况下根据经验使用抗生素。刘少强等[25]研究发现,早期诊断脊柱术后手术部位感染,并及时采用万古霉素或替考拉宁等治疗,效果良好,可以避免进行清创手术。Cornett等[26]建议,对于脊柱手术感染患者,选用的抗生素应涵盖抗甲氧西林金黄色葡萄球菌和革兰氏阴性菌,常用药物包括万古霉素和头孢吡肟等。脊柱感染性疾病常采用多种抗生素联合治疗,如万古霉素联合头孢曲松或头孢吡肟等,在无法进行彻底清创的情况下可联合应用利福平[27]。单纯的脓毒症,可通过应用敏感抗生素在短期内控制全身症状。手术部位感染并发脓毒症,需要较长时间应用敏感抗生素,一般是先静脉滴注4~6周,待体温正常、症状基本消失、3次血培养阴性,以及各项炎性指标恢复正常1周以上,再改为口服抗生素3~6个月[28]。
腰椎术后手术部位感染的常用疗法是彻底清除坏死组织和引流,能够防止感染进一步发展。Pull等[29]研究发现,72.9%的脊柱手术切口浅层感染患者可通过非手术疗法治愈;89.3%的脊柱手术切口深层感染患者需要通过1次或多次清创手术才能治愈。本组13例患者中有2例在末次随访时的综合疗效为良,这2例患者在确诊后仅通过敏感抗生素治疗就获得了良好的效果,但停用抗生素后腰部疼痛及下肢神经症状再次出现,且炎性指标再次升高,之后才进行了病灶清除术。我们认为,腰椎术后手术部位感染并发脓毒症的病情相对复杂,因此应在全身炎症反应控制后尽早手术,同时联合应用敏感抗生素,有利于快速缓解感染症状。清创术后封闭灌洗引流,可以降低局部细菌浓度和毒素浓度,能够减少细菌和毒素对机体的不利影响。缝合切口时在局部涂抹抗生素也可以预防切口感染,但局部使用抗生素的方法和剂量不同,且存在单次使用、药物早期释放后无法维持药物浓度等问题,而当药物浓度低于最小抑菌浓度时可能导致耐药菌的产生[30]。王攀等[31]报道,对冲引流术治疗腰椎术后感染的效果良好。对冲引流术与我们的灌洗引流术相似,可以在控制感染的同时避免感染复发。清创术后体温正常、炎性指标趋于正常、引流液细菌培养连续3次阴性,且24 h引流量<50 mL,可考虑拔除引流管[32]。
腰椎手术内固定物的存在,会增加控制感染的难度[33],但过早取出内固定物可能会导致脊柱不稳定,且需要长时间采用支具固定或卧床制动。因此,腰椎术后感染并发脓毒症是否保留内固定物需要根据患者的实际情况而定。我们认为,是否保留内固定物还取决于感染是早期感染还是晚期感染。崔孔蛟等[34]研究发现,清创术治疗腰椎术后早期感染,多数情况下可以保留内固定物。Kalfas等[35]报道,51例脊柱内固定术后感染患者中有2例取出内固定物,其余患者均通过多次清创和使用抗生素而保留了内固定物。刘少强等[36]研究发现,当脊柱内固定术后手术部位感染的清创次数达2次及以上时,应考虑取出内固定物,以便有效控制感染。对于内固定物松动、反复清创后感染仍未控制的患者,可考虑取出内固定物,对远期可能出现的脊柱失稳或畸形等问题,可后期再行翻修手术[37]。
本组患者治疗结果显示,病灶清除联合敏感抗生素治疗腰椎术后早期手术部位感染并发脓毒症,可以有效控制感染、减轻腰腿部疼痛、恢复腰椎功能,且安全性较高,同时无需取出内固定物。
