外周血T淋巴细胞亚群变化对于慢阻肺患者急性加重期相对危险性的评价
2023-10-07唐文君曾珠孙增涛杨洪静杨帆
唐文君 曾珠 孙增涛 杨洪静 杨帆
慢性阻塞性肺疾病 (chronic obstructive pulmonary disease,COPD) 是一种进行性、使人衰弱且高度普遍的疾病,发病机制非常复杂,一般认为其主要特征是气道、肺实质和肺血管的慢性炎症反应[1]。其特征是肺破坏、气道重塑和粘液分泌过多[2]。COPD 在短时间内出现呼吸功能和症状的发作性恶化,称为 COPD 急性加重期(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)。加重的原因包括气道细菌、病毒和污染以及这些诱因之间的相互作用,通常会导致肺功能加速下降、生活质量下降以及死亡率增加[3]。据报道,AECOPD 与呼吸道微生物有关,其中一些来自环境触发因素,然而,全身性糖皮质激素治疗的急性有益作用表明,过度活跃的炎症反应比微生物更可能决定 AECOPD 的症状[4]。目前,还没有专门的治疗方法,其临床应用的主要目的只是为了缓解患者的症状。肺功能的测定是COPD诊断的金标准,但急性加重期患者需要结合其他生物标志物进行综合诊断。有研究证实,COPD属于混合免疫反应,该疾病的免疫反应包括先天免疫和适应性免疫,涉及巨噬细胞、中性粒细胞和T淋巴细胞[5]。除此之外,吸烟可以激活免疫细胞释放炎症介质,进而加速疾病的进程[6]。本文旨在通过比较分析AECOPD患者肺功能指标、血生化指标和外周血T淋巴细胞亚群变化,探讨其在COPD急性加重中的作用,以提高COPD患者的治疗效果和预后。
资料与方法
一、研究对象
选取2019年9月至2022年6月收治于我院的98例COPD患者作为研究对象,根据患者病情,将短期内出现气促、咳嗽、喘息、伴脓性或黏液脓性痰等呼吸道症状急性恶化,并出现发热等炎症加重表现,超出日常变异范围的患者纳入AECOPD组(63例,男性31例,女性32例),将气短、咳嗽、咳痰等症状轻微或稳定的患者纳入COPD组(35例,男性18例,女性17例),AECOPD组年龄45~95岁,平均年龄(72.69±4.45)岁;COPD组年龄45~94岁,平均年龄(71.55±5.69)岁。本研究经成都中医药大学附属医院伦理委员会审批通过(ChiECRCT20200195)。
二、纳入标准和排除标准
AECOPD组患者纳入标准:(1)年龄≥45岁。(2)支气管扩张剂后一秒用力呼气量 (FEV1) ≤ 70 %。(3)连续每天咳嗽≥3个月。(4)在过去三年中,每年至少有一次 AECOPD 需要就医和更换药物(添加口服糖皮质激素、抗生素)。(5)呼吸系统症状在短时间内出现恶化,如呼吸短促、咳嗽、喘息、痰增多,需要对患者进行额外治疗或改变治疗方法。COPD组患者纳入标准:(1)年龄≥45岁。(2)符合2013年修订版《慢性阻塞性肺疾病诊治指南》中关于COPD的诊断标准。(3)近3个月内气短、咳嗽、咳痰等症状轻微或稳定,不需要调整用药方案。排除标准:(1)有严重认知障碍。(2)不稳定的心脏病、中风、气胸或血肿。(3)有癌症、哮喘、囊性纤维化或静脉功能不全患者。(4)使用骨合成材料或无法进行评估的患者。(5)肺结核和甲型流感患者。(6)有临床意义的支气管扩张、肺癌或其他炎症或纤维化肺部疾病。
三、检测方法
肺功能参数水平检测:利用肺功能仪并由专业人员指导操作,测定以下指标:用力肺活量占预计值百分比(FVC%)、第 1 秒用力呼气容积占预计值百分比(FEV1%)及二者的比值百分比(FEV1/FVC%),上述数据均需重复三次获得。采集入院时患者的血液,采用全自动血液分析仪(南京巴登迈瑞医疗有限公司)检测患者血常规参数,酶联免疫吸附测定来确定血清上清液中炎症生物标志物的水平。利用流式细胞仪鉴定外周血中的淋巴细胞,取静脉抗凝液,4000 rpm离心10 min,取血浆入试管,加入相应抗体,用PE和FITC标记T淋巴细胞,室温孵育15 min。加入适量红细胞裂解液,37℃水浴20 min,加入磷酸盐缓冲液洗涤细胞。离心后用流式细胞仪(CytoFLEX,中国贝克曼库尔特贸易有限公司)检测免疫T细胞亚群并进行分析。
四、观察指标
收集患者临床资料,包括年龄、性别、吸烟史、肺功能指标、嗜酸性粒细胞(Eosinophil,EOS)、C-反应蛋白 (C-reaction protein,CRP)、中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、身体质量指数(body mass index,BMI)、营养风险筛查(nutrition risk screening,NRS 2002)评分以及全身免疫炎症指数(systemic immune-inflammation index,SII)、联合预后营养指数(prognostic nutritional index,PNI)、外周血淋巴细胞亚群的水平包括T细胞(CD3+、CD4+、CD8+、CD4+/CD8+、Treg、Th17)、自然杀伤细胞(natural killer cell,NK 细胞) CD3-CD56+和自然杀伤细胞T细胞(Natural killer T cell,NKT细胞)CD3+CD56+。NRS 2002考虑了疾病的严重程度和营养状况受损,营养状况受损包括体重下降、食物摄入量减少和BMI降低,分数越高则代表受损越严重[7]。SII为血小板计数×中性粒细胞/淋巴细胞计数,PNI是一种新的预后评分,通过白蛋白×淋巴细胞计数计算得出,反映患者的炎症和营养状况[8]。
五、随访及诊断标准
通过电话等线上联系方式或门诊复诊等方式对患者病情进行1个月随访,每周随访 1 次并进行NRS 2002评分。AECOPD被定义为呼吸系统症状(呼吸困难、咳嗽和痰量增加或化脓)出现急性恶化,需调整治疗方案,额外增加抗生素、口服糖皮质激素或两者同时使用对患者进行治疗,并通过体检和胸部X线片以排除肺炎。
六、统计学方法

结 果
一、两组患者临床资料的比较
经统计分析,两组患者在年龄、性别和FVC%方面无明显差异(P>0.05);但在吸烟史、FEV1/FVC、FEV1%、SII、PNI、BMI、NRS2002 评分方面具有统计学意义(P均<0.05)。AECOPD组中有吸烟史、SII、NRS2002 评分和WBC、NEUT、EOS、CRP、NLR水平明显高于COPD组,FEV1/FVC、FEV1%、PNI、BMI均显著低于COPD组(见表1)。
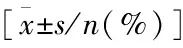
表1 两组患者临床资料的比较
二、两组患者外周血T淋巴细胞亚群比较
根据两组患者外周血淋巴细胞亚群的比较结果发现,两组患者在T细胞、NK和NKT细胞百分比方面均具有统计学意义(P<0.05),AECOPD组的CD3+、CD4+、CD4+/CD8+、Treg水平显著低于COPD组,CD8+、Th17、CD3-CD56+、CD3+CD56+水平高于COPD组(如表2)所示。
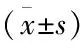
表2 两组患者外周血淋巴细胞亚群比较
三、外周血T淋巴细胞亚群变化与AECOPD相关性
将上述(表2)具有统计学意义的指标经过多因素Logistic回归分析发现,外周血T淋巴细胞亚群与慢阻肺患者急性加重有一定的相关性;其中CD8+、Th17、CD3-CD56+、CD3+CD56+水平增加是引起急性加重的独立影响因子(OR>1,P<0.05);CD3+、CD4+、CD4+/CD8+、Treg水平增加为保护因素(OR<1,P<0.05),结果(如图1)。
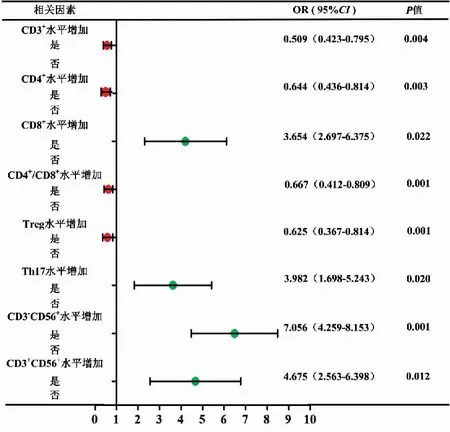
图1 影响慢阻肺患者急性加重的危险因素森林图
四、模型构建
根据多因素分析结果,将CD3+、CD4+、CD4+/CD8+、Treg、CD8+、Th17、CD3-CD56+、CD3+CD56+水平作为第一层的输入变量,每个变量都连接到隐藏层中的所有节点H(1∶1)到H(1∶4),将结局指标作为输出层,与隐藏层节点相连。线条的粗细程度与各指标对输出结局的重要性成正比,结合(图2)可知,CD8+、Th17、CD4+/CD8+和CD3-CD56+所占权重均较高。
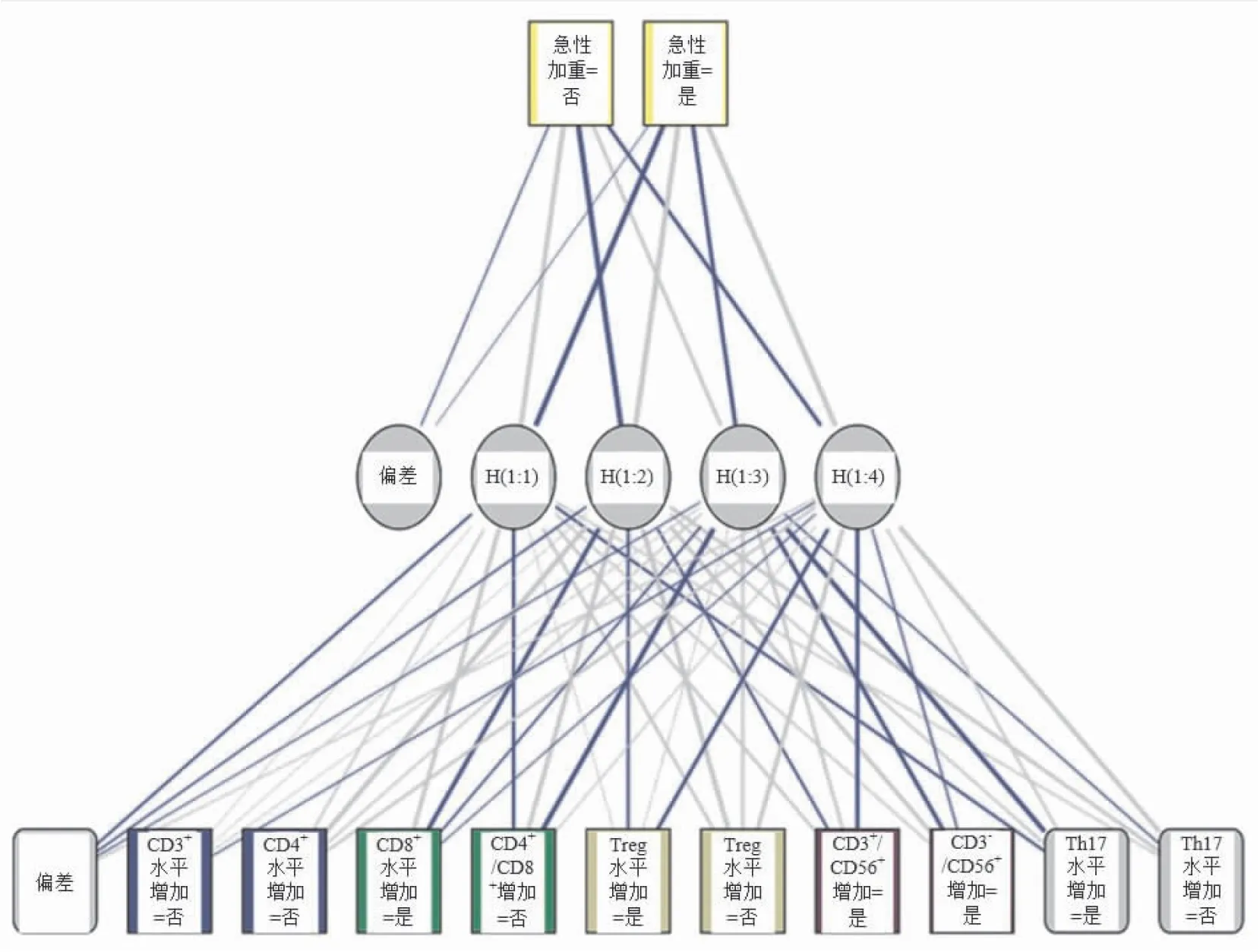
图2 慢阻肺患者急性加重的人工神经网络架构图
五、模型验证
1 模型区分度评价 采用ROC曲线评价预测模型的区分度,训练集AUC为0.724(95%CI:0.619~0.833,P<0.001)(见图3A),C-index为0.828。验证集AUC为0.774(95%CI:0.669~0.815,P<0.001)(见图3B),C-index为0.847。预测模型在训练集和验证集中的C-index均>0.75,模型区分度较高。
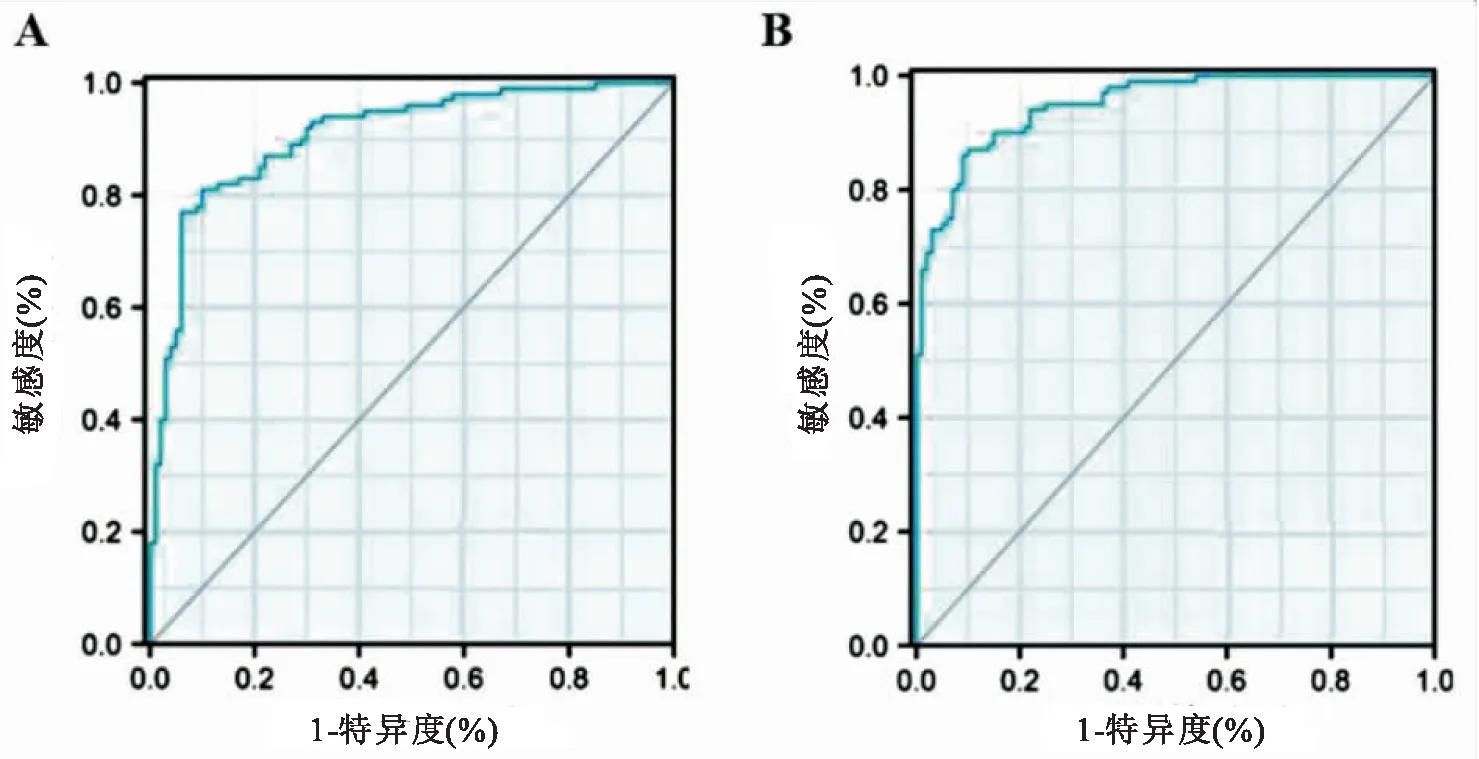
图3 预测模型的ROC曲线 A:训练集ROC曲线;B:验证集ROC曲线
2 校准度评价 对预测模型进行Hosmer-Lemeshow拟合优度检验:在训练集中χ2=7.084,P=0.687(图4A);在验证集中χ2=4.874,P=0.663(图4B),无明显差异(P>0.05)。
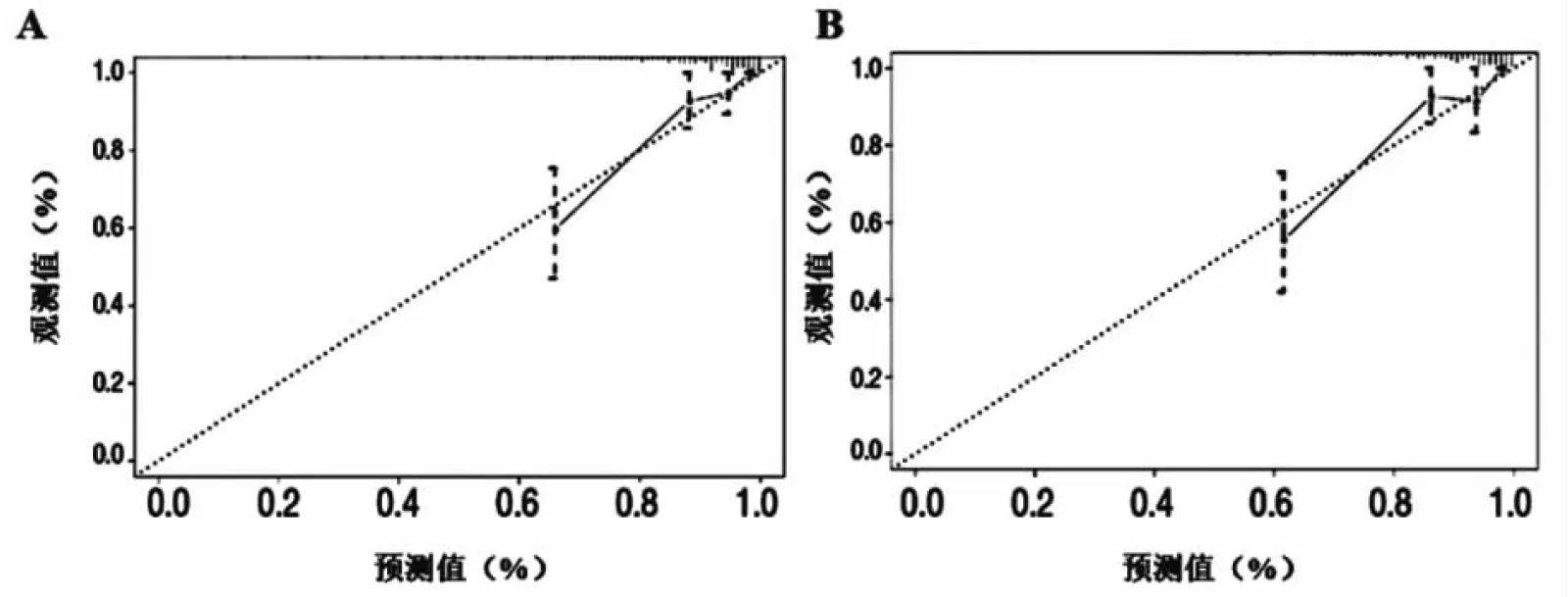
图4 预测模型的校准度 A:训练集校准曲线;B:验证集校准曲线
3 临床决策曲线 临床决策曲线显示预测模型远离极端曲线,当阈概率在12%~94%时使用人工神经网络架构图预测模型预测慢阻肺患者急性加重的净获益率高(图5A),而在验证集中,阈概率在11%~98%范围内净获益高(图5B),由此可见模型安全可靠,实用性强。
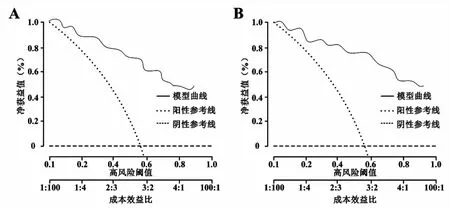
图5 预测模型的决策曲线分析 A:训练集临床决策曲线;B:验证集临床决策曲线
六、T淋巴细胞亚群及免疫细胞表达与AECOPD患者肺功能指标的相关性
采用 Pearson 相关分析显示,CD8+、NEUT与AECOPD患者FEV1%、FEV1/FVC呈负相关(P<0.05),Th17与患者FEV1%呈负相关(P<0.05),Treg与患者FEV1%、FEV1/FVC呈正相关(P<0.05),CD4+/CD8+与患者FEV1%呈正相关(P<0.05)(见表3)。
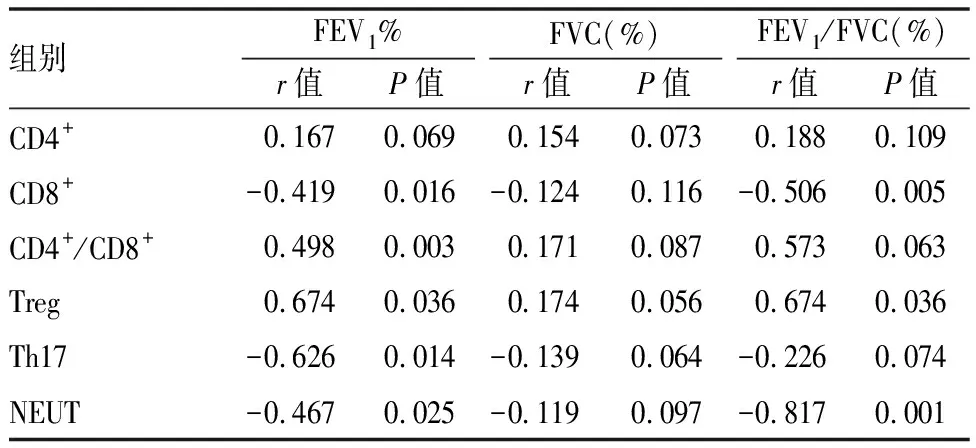
表3 T淋巴细胞亚群及免疫细胞表达与AECOPD患者肺功能指标的相关性
讨 论
COPD是一种与异常免疫反应相关的炎症性疾病,会导致气流阻塞。引起的主要原因是吸烟、遗传和环境因素,如长期吸入有毒颗粒和气体会导致肺实质破坏,激活上皮细胞,增加粘液产生并刺激许多炎症细胞的迁移[9-10]。这会导致小气道和肺泡出现异常炎症反应,其中涉及许多炎症细胞,包括中性粒细胞、巨噬细胞和T淋巴细胞。T淋巴细胞广泛存在于COPD患者的肺泡壁中,是COPD患者中央气道和肺实质的主要炎症细胞,与患者肺泡损伤数量和气道阻塞和疾病严重程度相关[11-13]。
在COPD的发病机制中确定了不同的T细胞亚群,有研究已在 COPD 受试者的气道和血液中观察到CD4+和CD8+的数量和质量变化,COPD患者气道和肺组织中积累的CD4+T淋巴细胞主要类型为Th1,可通过分泌炎症细胞因子和趋化因子引起肺组织破坏,导致肺气肿[14]。CD8+细胞的增加是T淋巴细胞浸润气道和肺部的主要特征,CD8+细胞与气道限制及疾病的发生发展密切相关,COPD急性加重的特征是肺中 CD8+的细胞毒性潜能或细胞因子产生能力增加。除了局部炎症,在 COPD 恶化期间,这种全身炎症的强度也会增加[15]。故在本文研究对比两组患者SII指数时,急性加重组要显著高于COPD组。几份报告表明,支气管阻塞增加与肺 CD8+产生的干扰素 IFN-γ增加及其细胞毒性分子表达增加相关[16];除此之外,在患者气道和肺部积聚的CD4+细胞也产生IFN-γ,因此具有Th1表型[17]。然而,COPD受试者的肺显示促炎性T辅助细胞Th17细胞的积累,类似于自身反应性免疫反应[18]。目前的研究表明,Th17和Treg亚群的关键作用与免疫病理学炎症有关,产生作为促炎效应细胞的Th17细胞与在外周耐受和炎症下调中充当效应细胞的Treg细胞之间的不平衡可能有助于炎症的进展[19]。Treg细胞是 CD4+的一个子集表达转录因子forkhead-box-P3 (FoxP3)并参与维持对自身抗原的耐受性和消除自身免疫反应的 T 细胞,Treg细胞的分化依赖于多种信号,例如来自细胞因子的信号(即白细胞介素-2、转化生长因子-β )以及T 细胞抗原受体和共刺激分子[20-21]。由于Treg在控制自身免疫反应中发挥核心作用,导致 FoxP3 剪接形式的表达下降以及Treg细胞生成和功能受损。
吸烟也可能导致免疫反应的激活,进而导致肺中Th1和Th17 CD4+的产生,在这种情况下,慢性炎症性疾病和自身免疫的免疫发病机制与自身反应性 T 细胞的过度活跃和主要由Treg细胞介导的局部调节机制的失败有关[22]。在与COPD相关的环境因素中,营养状况最近被认为是疾病发病机制的促进因素。事实上,全身炎症反应在COPD患者急性加重期进一步被激活,高水平炎症因子的表达有利于促进多种蛋白质分解代谢过程,加快患者在静息状态下的能量消耗,使患者出现营养不良的情况,从而导致BMI降低,机体抵抗力下降,加重患者感染情况和病情,形成恶性循环[23]。而COPD的气道免疫炎症反应主要由T淋巴细胞介导,初始T淋巴细胞分化出Th17和Treg两大细胞亚群,二者共同维持机体的免疫平衡,因此提示Th17和Treg细胞的免疫代谢在COPD的发病机制中发挥重要作用[24]。
综上所述,外周血T淋巴细胞亚群变化在COPD病情发展过程中有重要参考价值,与病情的急性加重有较大的相关性,对患者的治疗和预后具有十分重要的预测价值,为AECOPD的临床诊断和免疫治疗提供研究思路。
