超声成像参数联合血清Ang-2、PLAC1对非小细胞肺癌淋巴结转移的诊断价值
2023-10-07邹立君马建刚华菁
邹立君 马建刚 华菁
肺癌是全球癌症死亡的主要原因[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌患者的80%以上[2]。对于可切除的Ⅲ期NSCLC,5年总生存率范围为16%至42%,威胁患者的生命健康[3]。血管生成素-2(angiopoietin-2,Ang-2)是一种相对较新的血管生成调节因子,已被确定为某些类型癌症的潜在预后生物标志物[4]。Ang-2在多种炎症相关肿瘤中上调,并与肺癌进展密切相关[5]。高表达水平胎盘特异性蛋白1(placenta-specific 1,PLAC1)已在多种实体瘤中检测到,包括肝脏肿瘤、消化道肿瘤和子宫肿瘤等[6]。超声在NSCLC的筛查和病情评估中广泛应用,有助于对病变性质的评估[7]。单一诊断对NSCLC淋巴结转移具有局限性,因此本研究探究超声成像参数联合血清Ang-2、PLAC1对非小细胞肺癌淋巴结转移的诊断价值。
资料与方法
一、研究对象
选取2021年5月-2022年5月我院收治的疑似NSCLC的患者175例,经病理检查结果确诊为NSCLC的患者有114例,其中有淋巴结转移的68例即为转移组,无淋巴结转移的46例即为未转移组。纳入标准:(1)符合《中国原发性肺癌诊疗规范(2015年版)》NSCLC的诊断标准[8]。(2)首次确诊为NSCLC的患者。排除标准:(1)患有其他恶性肿瘤的患者。(2)无法正常交流的患者。(3)心脏、肝脏、肾脏功能异常的患者。(4)患有传染性疾病的患者。本研究符合本院伦理委员会的规定并获得批准(2021-0023),所有患者均自愿签署知情同意书。
二、研究方法
1 超声成像 所有患者在入院当天进行超声成像检测,检查仪器为彩色多普勒超声诊断仪(货号:E8,上海涵飞医疗器械有限公司),所有患者呈现仰卧状,探头涂抹耦合剂,使用7~12MHz的探头频率,对其肺门进行扫描,观察肺门淋巴结转移情况,测量收缩期峰值流速(PSV)、淋巴结最短径(MAD)、舒张期末血流速度(EDV),由三名经验丰富的超声医生共同诊断。
2 血清Ang-2、PLAC1表达水平检测 所有患者在入院次日清晨空腹抽取5 mL的静脉血,4000 rpm/min离心10 min,离心半径为10 cm,取其上清液放置于-20℃保存待用。血清Ang-2、PLAC1表达水平采用酶联免疫吸附测定(ELISA)法检测,试剂盒货号分别为FY-C0516830(购自上海富雨生物科技有限公司)和orb405025(购自武汉博欧特生物科技有限公司),所有试验均严格按照试剂盒说明书进行。
三、统计学方法
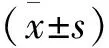
结 果
一、一般资料比较
转移组和未转移组TNM分期、分化程度具有显著差异性(P均<0.05),两组性别、年龄、肿瘤直径比较不具有统计学意义(P>0.05)(见表1)。
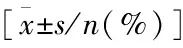
表1 一般资料比较
二、血清中Ang-2、PLAC1表达水平比较
与未转移组相比,转移组NSCLC患者血清中Ang-2、PLAC1表达水平显著升高,差异具有统计学意义(P<0.05)(见表2)。
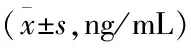
表2 血清中Ang-2、PLAC1表达水平比较
三、血清中Ang-2、PLAC1表达水平相关性
相关性分析显示,NSCLC患者血清中Ang-2、PLAC1表达水平呈正相关关系(r=0.431,P<0.001)(见图1)。
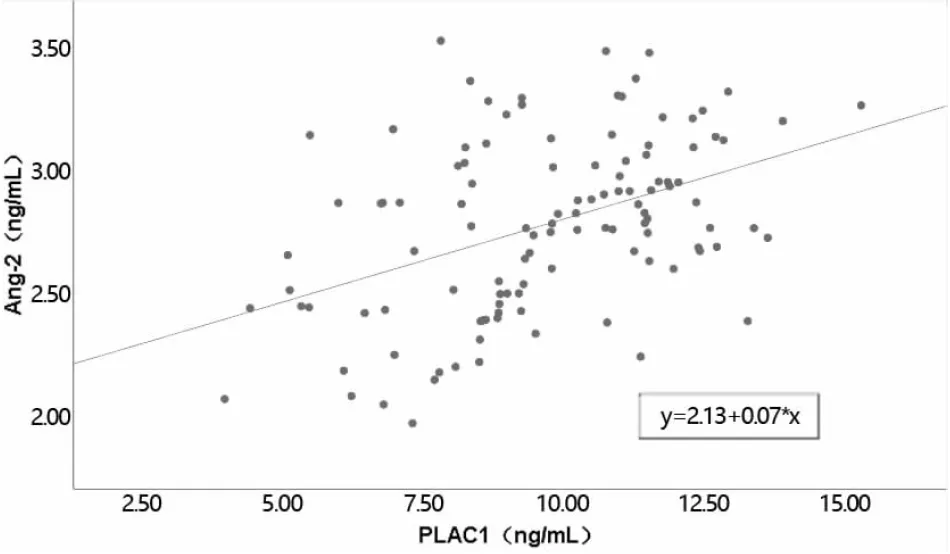
图1 血清中Ang-2、PLAC1表达水平相关性
四、两组超声成像参数比较
与未转移组相比,转移组超声成像参数PSV、MAD、EDV均显著升高(P<0.05)(见表3)。
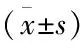
表3 两组超声成像参数比较
五、超声成像参数联合血清Ang-2、PLAC1对NSCLC淋巴结转移的诊断
超声成像参数联合血清Ang-2、PLAC1诊断NSCLC淋巴结转移的曲线下面积为0.958,均大于单一指标诊断(Z联合-Ang-2=5.480,P=0.019;Z联合-PLAC1=6.683,P=0.010;Z联合-PSV=11.787,P=0.001;Z联合-MAD=26.087,P<0.001;Z联合-EDV=6.237,P=0.013),敏感度为43.00%,特异度为95.70%。超声成像参数联合血清Ang-2、PLAC1诊断NSCLC淋巴结转移的特异度高于超声成像参数、血清Ang-2、PLAC1单独诊断(见表4、图2)。
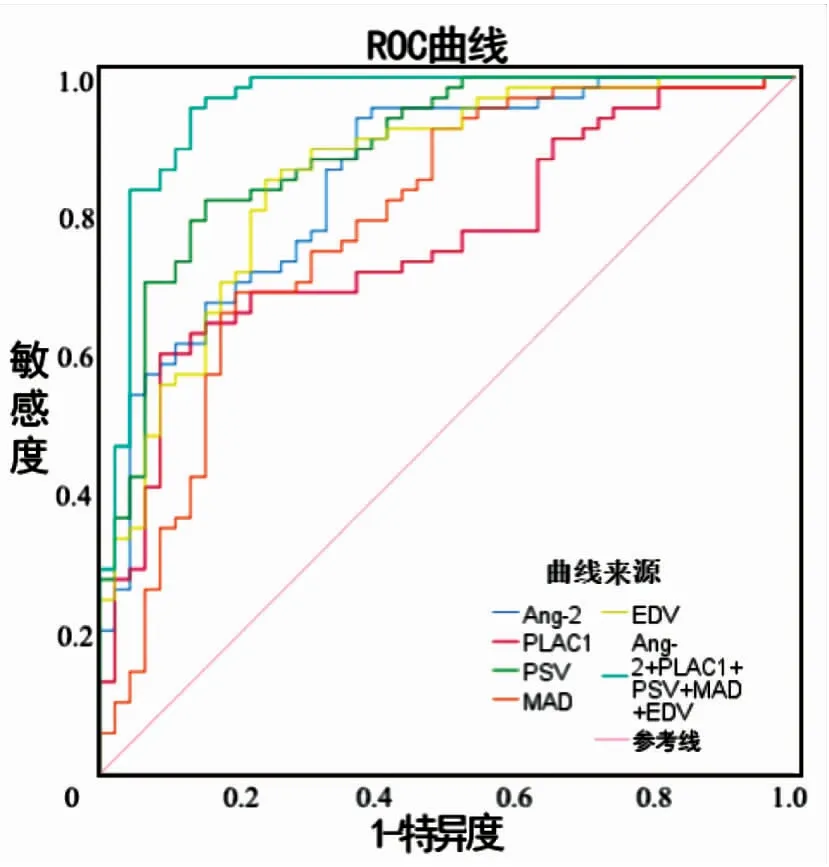
图2 ROC曲线分析超声成像参数联合血清Ang-2、PLAC1对NSCLC淋巴结转移的诊断
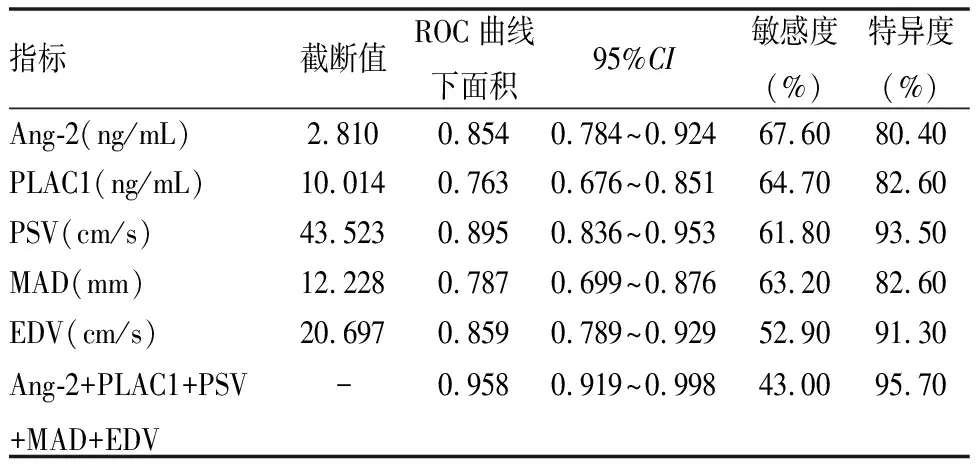
表4 超声成像参数联合血清Ang-2、PLAC1对NSCLC淋巴结转移的诊断
讨 论
NCSLC的主要影响因素是吸烟、辐射暴露、空气污染、家族史和人类免疫缺陷病毒感染[9-10],可表现为持续咳嗽、胸痛、体重减轻、呼吸困难、胸腔积液、肺炎、慢性阻塞性肺病或肺纤维化[11]。早期诊断对治疗和预后都很重要,NSCLC患者越早诊断,存活率越高。
Ang-2是一种重要的促血管生成因子,与炎症过程有关,在多种炎症相关肿瘤或信号通路中上调[12]。Ang-2可在没有血管内皮生长因子的情况下降低细胞-基质接触,同时刺激内皮细胞迁移和增殖,还通过Tie-2依赖性和/或非依赖性信号通路与血管内皮生长因子和Ang-1合作,作为肿瘤的促血管生成信号[13]。肺癌脉管系统是由血管生成、血管鞘生长和内皮祖细胞生长所促成,在没有血管形成的情况下,肺组织缺氧会导致肿瘤细胞产生大量血管生成因子,诱导血管生成、促进肿瘤生长,Ang-2是肺癌检测的有效生物标志物[14]。本次研究表明,与未转移组相比,转移组NSCLC患者血清中Ang-2表达水平显著升高,表明NSCLC患者Ang-2表达的上调与淋巴结转移有关。
PLAC1与几种癌症的生存率呈负相关[15]。与PLAC1表达较高的胃腺癌患者相比,PLAC1表达相对较低的胃腺癌患者的生存时间更长[16]。在前列腺癌中,PLAC1表达与格里森评分呈正相关,与前列腺特异性抗原表达呈负相关[17]。研究结果表明,高PLAC1蛋白表达与乳腺癌状态、晚期TNM分期和腋窝淋巴结转移显著相关,这是乳腺癌术后复发的重要特征,并且通常预后较差[18]。本次研究表明,与未转移组相比,转移组NSCLC患者血清中PLAC1表达水平显著升高,表明PLAC1表达水平参与NSCLC患者淋巴结转移的发生过程。
相关性分析显示,NSCLC患者血清中Ang-2、PLAC1表达水平呈正相关关系,提示二者共同参与NSCLC患者淋巴结转移;超声成像可早期检测NSCLC和评估病变[19]。超声成像参数能够有效弥补血清检测无法定位的缺陷,通过测量超声回波在不同组织中的变化,联合检测可以增加鉴定的准确性[20]。与未转移组相比,转移组超声成像参数PSV、MAD、EDV均显著升高,超声成像参数联合血清Ang-2、PLAC1诊断NSCLC淋巴结转移的特异度及ROC曲线下面积高于超声成像参数、血清Ang-2、PLAC1单独诊断,提示超声成像参数联合血清Ang-2、PLAC1诊断可以提高NSCLC淋巴结转移的诊断效能。
综上所述,Ang-2、PLAC1在NSCLC淋巴结转移患者血清中呈高表达,二者呈正相关关系,超声成像参数联合血清Ang-2、PLAC1诊断可以提高NSCLC淋巴结转移的诊断效能,三者互为补充,对NSCLC早期诊断具有重要意义。由于本次研究的病例数较少,仍需要后期大量的研究数据来进一步验证。
