婴 儿 肺 泡 微 结 石 症 1 例 及 文 献 复 习▲
2023-10-07古常基黄惠萍
古常基 覃 敏 谭 杰 黄惠萍
(广西壮族自治区妇幼保健院儿科,广西南宁市 530003)
肺泡微结石症(pulmonary alveolar microlithiasis,PAM)是一种罕见的肺部慢性疾病,其特征是肺泡内弥漫性分布含钙和磷酸盐的微结石。该病常见于年轻人,且多无症状,在婴幼儿中极为罕见[1-3]。成人PAM的典型临床表现为劳力性呼吸困难,其他表现包括咳嗽、发绀、胸痛、咯血和气胸等。但婴幼儿临床表现无特异性,主要表现为干咳和急性呼吸衰竭,易与儿童某些呼吸道疾病(如肺泡蛋白沉积症、粟粒性肺结核等)混淆,给儿科医师的诊治造成困扰,严重危害婴幼儿身体健康。目前国内外尚无该病的诊治共识。本文结合广西壮族自治区妇幼保健院收治的1例PAM婴儿的临床资料,并对国内外文献进行回顾性复习,探讨该病的特点,为儿科医师诊治该病提供参考。
1 临床资料
患儿女性,1个月6 d,因反复咳嗽1个月于2020年12月2日入院。患儿于入院前1个月前无明显诱因下出现咳嗽,以干咳为主,轻咳且不频繁,无咯血、发绀、呼吸困难、消瘦、午后潮热、盗汗等表现,家属未重视,未治疗。但患儿咳嗽反复,为进一步治疗家属遂带其至我院门诊就诊。胸部CT检查提示两肺各叶可见斑片状、淡片状密度增高模糊影,部分呈磨玻璃样改变,以间质性改变为主。门诊拟“间质性肺炎”收入院。既往无结核病史、结核接触史、粉尘接触史。父母亲为近亲结婚,姐姐现8岁,反复咳嗽8年,多次在当地医院就诊,咳嗽无好转,具体不详。入院查体:呼吸平顺,无三凹征;双侧胸廓对称且无畸形,双肺叩诊呈清音,无啰音;心率111次/min,律齐,各瓣膜听诊区未闻及病理性杂音;腹部平软,无压痛及反跳痛,肝、脾肋下未触及;双下肢无水肿;无杵状指;神经系统查体无异常。入院常规实验室检查:血气分析、降钙素原、血常规、C反应蛋白、传染病四项、凝血功能、电解质(钾、钠、钙)、肝肾功能、心肌酶、大小便常规及葡萄糖-6-磷酸脱氢酶活性检测结果均未见异常;肺炎支原体抗体阴性,肺炎支原体抗体滴度<1 ∶40;结核杆菌抗体阴性;呼吸道病原体抗体(包含嗜肺军团菌、Q热立克次体、肺炎衣原体、腺病毒、呼吸道合胞病毒、甲型流感病毒、乙型流感病毒、副流感病毒、EB病毒等)均阴性;血清半乳甘露聚糖试验阴性;痰涂片阴性,痰培养未见致病菌生长;痰解脲脲原体、沙眼衣原体DNA-PCR定性阴性;痰、咽拭子肺孢子菌DNA-PCR定性阴性;百日咳杆菌核酸阴性;血培养阴性。支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)微生物宏基因组测序:RNA测序结果提示细菌、真菌均为常见微生态菌群,病毒为人呼吸道合胞病毒B型(序列数6525),未发现寄生虫;DNA测序结果提示细菌为常见微生态菌群,真菌为耶氏肺孢子菌(序列数2,相对丰度3.0%),未发现病毒和寄生虫。肺功能:轻中度阻塞性潮气功能障碍,支气管舒张试验阳性。心电图:窦性心律,正常范围心电图。喉镜:鼻窦炎,喉软化。心脏彩超:卵圆孔未闭(2 mm)。胸部CT:两肺充气不均,支气管血管束增粗、模糊,两肺各叶可见斑片状、淡片状密度增高模糊影,部分呈磨玻璃样改变(见图1)。气道重建检查显示气管和支气管走形、管径无明显异常,内腔通畅(见图2A);纵隔内未见明显占位病变,未见钙化灶(见图2B);两侧胸腔未见积液;检查结论为两侧肺炎,以间质性改变为主。纤维支气管镜及肺泡灌洗术中所见:呼吸道黏膜轻度充血,BALF未见牛奶样改变。BALF病原学检查:涂片阴性,培养未见致病菌生长,肺孢子菌DNA-PCR定性阴性,半乳甘露聚糖试验阴性,解脲脲原体DNA-PCR定性阴性,沙眼衣原体DNA-PCR定性阳性。患儿母亲乳汁巨细胞病毒DNA-PCR定性阴性。未进行肺组织活检。全外显子高通量测序:致病基因溶质转运蛋白家族34成员2(solute carrier family 34 member 2,SLC34A2),变异位点c.524-2A>G,先证者存在纯合突变,家系验证提示父母均为携带者,提示PAM,常染色体隐性遗传。故诊断PAM、间质性肺炎。入院后先后给予头孢曲松钠、哌拉西林/他唑巴坦、红霉素抗感染,甲泼尼龙抗炎,氨溴索化痰,布地奈德+异丙托溴铵+特布他林雾化,静注人免疫球蛋白免疫治疗,以及拍背、吸痰和理疗等对症治疗。患儿症状稍好转后出院。2022年3月电话随访,患儿出院后至今仍有咳嗽,干咳为主,症状较前无明显加重。

图1 胸部CT表现
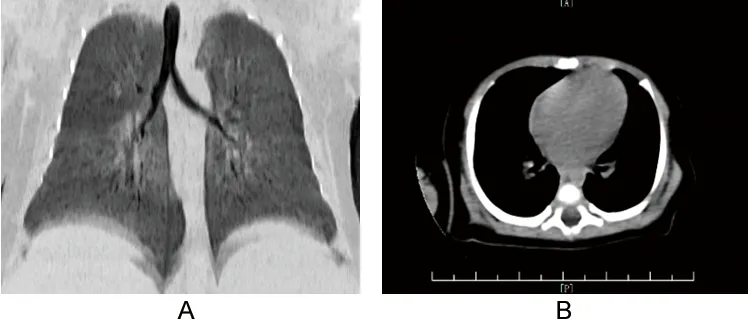
图2 气道重建检查结果
2 讨 论
2.1 流行病学特点 PAM属于常染色体隐性遗传,无性别差异[4],土耳其、意大利和美国的患病率最高[3]。该病病因不明,有明显的家族遗传倾向,1/3病例为家族性发病,2/3病例为散发性发病。Castellana等[5]于2015年报告了迄今为止样本量最大的研究结果,分析了来自65个国家的1 022例PAM患者的相关资料,发现其中381例(37%)患者存在PAM家族病史。家族性发病患者的父母多为近亲结婚,并且患者同胞的患病概率较高[6]。本文所报告的这一病例父母为近亲结婚(表兄妹关系),与文献报告一致。患儿同母异父的姐姐反复咳嗽8年,但因未规范诊治,未确诊该病。
2.2 发病机制 2006年Corut等[7]通过对一个近亲结婚的土耳其大家系的遗传学特征进行分析,首次将PAM的致病基因定位在染色体4p15上一段大小为4.2 Mbp的区域内,并证实PAM与该区域内的基因SLC34A2突变有关。SLC34A2基因包含13个外显子,它编码一个由2 280个核苷酸组成的mRNA和一个由690个氨基酸组成的SLC34A2蛋白。SLC34A2蛋白主要在Ⅱ型肺泡细胞表面表达,并负责转运肺泡中磷脂代谢产生的磷酸盐[8-9]。SLC34A2基因突变后,其编码的SLC34A2蛋白失去活性,失去活性的SLC34A2蛋白丧失转运功能,因而无法转运肺泡液中的磷酸盐,导致磷酸盐大量累积并与钙结合形成羟基磷灰石微结石并沉积在肺泡中,引起巨噬细胞炎症反应、肺纤维化,使肺顺应性降低[10]。研究显示PAM患者BALF中的钙和磷浓度显著增加,而血清钙磷浓度正常[11],说明该病患者无全身性钙磷代谢。一项小鼠PAM模型研究显示,在BALF中分离出的微石易溶解于乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),并证实EDTA 灌洗可减少肺部微结石;在给予低磷酸盐饮食4周后PAM小鼠肺部微结石明显减少,说明低磷酸盐饮食可防止微石形成[12]。以上研究表明SLC34A2蛋白在PAM发病机制中具有重要作用,使用PAM小鼠模型作为实验对象有望研究出治疗该病的有效方法。
2.3 临床表现 有学者对来自不同国家的576例PAM患者进行分析后发现,PAM患者平均发病年龄为28.7岁,35.8%的PAM患者年龄<20岁[1]。由此可见,PAM大多为成年后发病,极少见于婴幼儿。Sigur等[13]的研究显示,截至2019年1月,全球5岁及以下PAM患儿病例有28例,仅占所有病例的2%左右。国外PAM确诊病例中,年龄最小的患者为新生儿[14]。而国内有关新生儿、婴儿PAM的病例报告更为罕见。成人PAM患者多无症状,通常是在因其他原因行胸片或肺部CT检查时偶然发现。随着微结石在肺泡内累及的范围不断扩大,肺通气功能不断降低,患者逐渐出现典型临床表现,其中劳力性呼吸困难为最常见的症状,其他症状包括咳嗽、发绀、胸痛、咯血和气胸等,通常上述症状并不如影像学表现严重,被称为临床-放射学分离[15]。此外,病程较长的PAM患者由于长期缺氧可出现杵状指,一项纳入1 022例PAM病例的全球回顾性分析结果显示,杵状指者仅占7%[7]。而已发生肺纤维化的患者肺部听诊可闻及velcro啰音,晚期患者可因肺泡严重受损及肺组织间质纤维化而出现肺气肿、肺动脉高压、肺源性心脏病、呼吸衰竭、肺大泡、气胸等并发症,且肺纤维化、肺动脉高压和呼吸衰竭可随着PAM的发展而进一步加重[16-17]。婴幼儿PAM主要表现为干咳和急性呼吸衰竭,影像学表现与成人PAM的不同之处在于磨玻璃影更突出,钙化更轻微,几乎无肺外钙化[15]。本例患儿的临床表现主要是干咳,CT提示磨玻璃样改变,符合文献报告的特点。值得注意的是,婴幼儿PAM临床表现的个体差异大,即使是同一家庭中的两个患儿,也会出现其中一个需要肺移植,另一个仅表现出轻度症状[18]。PAM可发生肺外钙化,钙化部位包括腰交感神经[19]、肾[20-21]、胆囊[22]、睾丸[23]、精囊[24]、附睾、尿道[25]、主动脉瓣和二尖瓣[26]、心包[27],然而PAM患者的肺外钙化是否与SLC34A2蛋白相关,目前尚不清楚。
2.4 辅助检查 (1)通常PAM患者的血清磷、钙、甲状旁腺激素、维生素D3水平正常,但血清表面活性蛋白A和D的水平与疾病进展相关,因此可作为该病的监测指标[28]。(2)通常在发病早期PAM患者的肺功能未见异常,但随着时间的推移,患者逐渐出现限制性通气功能障碍、肺活量减少等典型肺功能受损表现[20,29]。对于早期肺功能正常的PAM患者,行6 min步行测试可发现其运动耐力下降和运动引起的血氧饱和度降低。(3)晚期PAM患者的超声心动图检查结果可能提示肺动脉高压和右心室肥厚。(4)胸部X线提示在双肺中下部呈磨玻璃状或面纱征改变,称为“沙尘暴肺”,这是PAM的典型特征;随着疾病的进展,肺实质的高密度影可能会掩盖心脏边界、膈肌、肋膈沟,称为“心脏消失现象”。胸部CT提示双肺磨玻璃样、虚线征、白线征改变。可见PAM影像学表现具有特征性,这对本病的诊断及鉴别诊断有重要意义。婴幼儿PAM症状和胸部X线的特异性较低,因此应注意在胸部CT中寻找纵隔窗处的钙化影[30]。高分辨CT能显示PAM患者整个肺部广泛存在的微小钙化灶,表现为弥漫性高密度微结节,呈磨玻璃样改变,在下叶后段和上叶前段最广泛[31]。可见高分辨CT能清晰显示特征性的改变,有利于PAM的早期诊断及病情严重程度的评估[32]。(5)支气管镜肺泡灌洗术可以发现BALF中有典型层状结构的微石。有学者认为,肺组织活检是诊断PAM的金标准,活检组织可见胸膜表面呈颗粒状和结节状,表现为纤维化、钙化[33]。然而肺组织标本一般通过经支气管镜活检、经支气管冷冻活检、外科肺活检、肺移植患者的肺外植体或尸检获得,活检结果可能会受到取样误差的影响,主要与微结石沉积的程度和部位有关,并有出血和气胸等风险。经支气管冷冻活检是一种新兴的诊断技术,可提供比经支气管镜活检多3~4倍的组织,能提高检查的准确性,但出血和气胸等风险也随之增加[34-35]。(6)痰液检查可见微结石,但是痰液有微结石并不仅见于PAM,也偶尔见于慢性阻塞性肺疾病和肺癌[36-37],因此须结合典型病史及高分辨CT方可以明确诊断PAM。(7)99m锝骨显影扫描术对软组织上的钙化灶具有亲和力,可以检测到早期的肺钙化[38]。(8)基因检测是确诊PAM的重要手段,对于年龄较小的婴幼儿、无典型临床表现和影像学特征的患者,可通过基因检测确诊。基因检测结果具有高度特异性,如结果提示SLC34A2基因突变,即可考虑PAM,无须再进行更多的侵入性检查,如肺组织活检。
2.5 诊断 根据相关文献总结诊断要点如下:(1)有家族史,既往无粉尘接触史及其他慢性肺部疾病史,无明显的钙磷代谢紊乱。(2)成人主要表现为劳力性呼吸困难,婴幼儿主要表现为干咳和急性呼吸衰竭。(3)咳出的痰液或BALF中可有微结石。(4)有典型影像学征象,如“沙尘暴肺”“白线征”等,且有临床-放射学分离现象。(5)骨显影扫描可以检测到早期的肺钙化。(6)经支气管镜活检可能是诊断PAM的金标准,但当影像学表现典型且与临床表现相符时通常不需要依赖经支气管镜活检。(7)基因检测提示SLC34A2基因突变。(8)若家中已有确诊PAM的患者,其他家庭成员只需完善胸片或CT检查即可确诊[5,15,39]。
2.6 鉴别诊断 因PAM的临床表现无特异性,常被误诊为粟粒性肺结核、尘肺、细支气管肺泡癌等。此外,还需要鉴别的疾病有肺泡蛋白沉积症、肺结节病、水痘并发的肺炎、转移性肺钙化、肺含铁血黄素沉着症等。
2.7 治疗 PAM目前尚无特效治疗方法,主要为对症支持治疗。根据相文献,将治疗方法总结如下。
2.7.1 药物治疗:常用药物包括糖皮质激素、依替膦酸钠、硫代硫酸钠。(1)关于糖皮质激素治疗PAM的效果,相关文献报告的结论并不一致。有学者认为糖皮质激素并不能阻止PAM的进展[16,29,40-41],但它可以用于治疗PAM伴随其他症状和肺功能异常的患者,如阻塞性肺病、哮喘、淋巴细胞性间质性肺炎、盘状红斑狼疮等[42-44]。大部分学者不推荐PAM患者常规使用吸入性糖皮质激素,不过有极少数病例报告,部分患者在使用吸入性糖皮质激素治疗后咳嗽症状及影像学征象轻微好转,但该病例均未进行长期随访[45]。使用全身性糖皮质激素治疗PAM的相关研究较少。一项研究显示,PAM患者使用全身性糖皮质激素治疗48 d后,病情没有得到改善[46]。另一项研究显示,2例PAM患者使用泼尼松治疗2个月,其中1例无效,另1例失访[47]。还有1例47岁的PAM男性患者在肺移植前接受泼尼松治疗,部分症状得到改善[48]。(2)依替膦酸钠可抑制羟基磷灰石形成微结石[49],基于这一点,有学者将依替膦酸钠用于治疗PAM。Jankovic等[50]报告1例8岁6个月的PAM女性患儿在服用依替膦酸钠18个月后,症状及影像学征象未见任何改善,认为短期应用依替膦酸钠治疗PAM的效果欠佳。Emiralioglu等[51]使用依替膦酸钠治疗3例PAM患者,2年后复查超声心动图提示患者的心壁、腱索或瓣膜无小的高回声,肺动脉高压明显改善,且患者未出现与治疗相关的不良反应。Ozcelik等[45]应用依替膦酸钠治疗1例5岁PAM 患儿9年,患儿的自觉症状、影像学征象、肺功能均明显改善,且未观察到明显的不良反应,此后停药11年,患者病情未进展。以上研究提示长期应用(至少2年)依替膦酸钠治疗PAM可获较好效果,但目前依替膦酸钠治疗PAM的具体疗程尚未形成共识。不同个体对依替膦酸钠治疗反应存在差异。研究显示,1例11岁男童及其4岁妹妹存在相同的SLC34A2基因纯合突变,均接受依替膦酸钠治疗,男童的胸片和高分辨CT征象有所改善,但其妹妹的影像学征象没有任何改善[52]。说明即使在具有相同遗传缺陷的患者中,依替膦酸钠的治疗反应也可能存在差异。此外,依替膦酸钠的不良反应包括一过性低钙血症、骨软化症、一过性发热、眼部并发症、一过性肌痛、白细胞减少、淋巴细胞减少、儿童佝偻病[53],因此用药过程须密切监测血钙、尿钙和血清磷酸盐水平。(3)硫代硫酸钠是一种钙螯合剂,已被用于治疗异位钙化的相关疾病,例如终末期肾病血管钙化[54]。理论上硫代硫酸钠可用于治疗PAM,但目前未有研究报告证明其有效。相反,有学者对1例PAM患者进行了每月1次硫代硫酸钠静脉输注治疗,共治疗9个月,治疗期间每次复查高分辨CT均提示病情未改善,而肺密度显著增加,分析原因可能是硫代硫酸钠的剂量不足,不能抑制疾病进展,或者是硫代硫酸钠可能加快PAM的疾病进展[55]。
2.7.2 氧疗和疫苗接种:目前尚无证据表明氧疗可以降低PAM的死亡率,但随着疾病的进展,患者肺功能逐渐降低,缺氧者须接受长期家庭氧疗。相关专家共识建议使用氧疗治疗PAM患者时,无肺心病患者的经皮血氧饱和度目标值为88%,有肺心病患者的经皮血氧饱和度目标值>90%[56]。此外,因为呼吸道感染会加重PAM患者的症状,所以建议PAM患者接种肺炎疫苗、流感疫苗,以减少呼吸道感染的发生。
2.7.3 饮食控制:限制饮食中磷酸盐的摄入已被证明可以显著减少PAM模型小鼠中的微结石沉积[1],因此建议PAM患者低磷酸盐饮食,例如避免摄入可乐饮料和加工肉类等。但关于磷酸盐摄入量阈值及该治疗方法的安全性和有效性,仍有待进一步研究。
2.7.4 支气管肺泡灌洗术:该技术通常用于治疗肺泡蛋白沉积症,且疗效确切。理论上,该技术也可以用于治疗PAM。正如前文提到PAM模型小鼠BALF中的微结石可溶解于EDTA,所以可尝试对PAM患者采用EDTA进行灌洗。由于微结石不断产生,可能每隔几年或更短的时间就需要进行一次治疗性灌洗。但该疗法是否有效尚需相关研究进一步证实。
2.7.5 外科治疗:迄今为止,对于晚期PAM患者,肺移植是唯一公认有效的治疗方法,手术方式包括单肺移植和双肺移植。目前尚无研究报告移植后肺泡内微结石复发的病例。在维也纳医科大学附属医院的一项小型病例研究中[57],5例PAM患者接受双侧肺移植,从出现症状到移植的平均时间为8.6年,其中1例患者在术后第2天出现原发性移植物排斥反应故再次移植,术后第11天死于败血症,其余4例患者分别随访至术后29个月、35个月、67个月、74个月,均表现良好。还有研究显示,肺移植对合并右心衰竭及严重呼吸衰竭的PAM患者依然有效[58]。但当PAM患者合并气胸时,仅有胸膜固定术治疗有效[50]。外科手术存在诸多挑战,包括钙化的肺实质会限制术中通气、引起胸膜粘连,以及术中和术后出血风险较高。
2.7.6 基因治疗:基因治疗PAM仍处于试验阶段,短期内难以应用于临床,但致病基因SLC34A2的确定,为今后的基因治疗奠定了基础。此外,开发针对调节磷酸盐转运的药物可能会给PAM的治疗带来新希望。
2.7.7 其他治疗方法:粉尘和烟雾吸入、感染等均可能导致PAM患者的病情进展或恶化[7],所以应避免粉尘和烟雾的吸入,以及呼吸道感染的发生。由于1/3 PAM病例呈家族性聚集性发病,原因多为近亲结婚,因此禁止近亲结婚可降低该病的发生率,并建议患者的其他家庭成员即使没有症状也应进行PAM筛查,如胸部影像学检查、基因检测等。对于婴幼儿PAM患者,早诊断、早治疗能否延长患儿生存时间、减少肺动脉高压等并发症的发生,还有待进一步研究。
2.8 预后 PAM患者长期预后较差。在一项纳入53例日本PAM患者的研究中,分别有34.1%、42.9%的患者在诊断后10~49年内、20~49年内死亡,死亡时平均年龄为46.2岁,最常见的死亡原因是呼吸衰竭[59]。80岁以上的老年PAM患者症状相对较轻[60],而暴发性发作且进展迅速的儿童PAM患者,尤其是婴儿患者,预后不良[61]。
3 展 望
目前,人类对PAM的了解甚少,从命名该病至今已近百年历史,尚无特效治疗方法。但PAM发病机制及遗传特征的明确是一项重大突破,它揭示了疾病的发病及发展过程,为未来研发新疗法提供了思路。
