神经生长因子对脂多糖引起的奶山羊支持细胞毒性抵抗研究
2023-10-07吕东良赵梦洁刘伟东任毅杰胡建宏
吕东良,倪 洁,赵梦洁,刘伟东,任毅杰,胡建宏
( 西北农林科技大学 动物科技学院,陕西 杨凌 712100)
在畜牧业中,维持稳定的精子发生对种公畜的生殖能力十分重要。而精子发生需要生殖细胞和多种体细胞的密切合作,其中支持细胞(Sertoli cell,SCs)能够为精子发生提供稳定的微环境[1-2]。SCs之间、SCs和生殖细胞之间形成的血睾屏障能够保证精子发生的每一步有序进行,同时不受病理条件和体内免疫系统的影响,创造特殊的免疫豁免环境,保障遗传信息的稳定传递[3-4]。但是,外来有毒物质能够引起SCs稳态失衡,产生细胞毒性,影响精子发生,可能导致雄性不育[5-6]。其中,革兰氏阴性细菌产生的内毒素,如脂多糖(Lipopolysaccharide,LPS)能够破坏免疫环境的稳态,损害雄性生育能力[5]。余亮亮等[7]研究报道,5 μg/mL LPS能够引起大鼠细胞凋亡显著增加;在换用无LPS的培养基继续培养后,细胞活力无法完全恢复,表明SCs仅凭细胞自身调节无法完全抵抗LPS的细胞毒性,挽救细胞受到的损伤。LPS也能够刺激细胞产生大量的炎症小体从而激活凋亡信号Caspase-8,同时BAX/BAK被激活导致凋亡抑制蛋白降解,引发细胞凋亡[8]。
神经生长因子(Nerve growth factor,NGF)在睾丸中由SCs分泌,通过SCs表面受体TrkA作用于SCs,在雄性生殖系统中起到至关重要的作用[9]。牛巧歌[10]研究发现,培养基中添加外源性的NGF能够提高初生犊牛SCs的活力,并显著上调增殖相关基因CCNE2、CCND1及PCNA的表达。Fodelianaki等[11]研究报道,在LPS诱导的小鼠小胶质细胞炎症反应中,NGF能够通过其受体TrkA下调LPS诱导的促炎细胞因子和一氧化氮的产生,并抑制LPS受体TLR4介导的NFκB和JNK信号通路,同时降低LPS引起的小胶质细胞糖酵解活性升高,抑制LPS的细胞毒性及细胞炎症反应。
然而,目前关于NGF如何保护奶山羊SCs尚不明确。因此,本研究首先提取奶山羊原代SCs,对其进行鉴定后用NGF处理,检测细胞活力并探究NGF最适浓度;其次,利用LPS处理SCs,检测细胞抑制率,筛选半数抑制浓度;用乳酸脱氢酶(Lactate dehydrogenase,LDH)评估细胞毒性,并通过Western blot技术进一步揭示NGF对LPS引起的SCs毒性抵抗机制,为系统研究家畜等大型哺乳动物雄性生殖机理提供参考。
1 材料与方法
1.1 试验动物
本研究选择健康、体况良好的2~3月龄雄性奶山羊,采集两侧睾丸,于冰盒30 min内冷藏运输至无菌手术台,通过两步酶消化法,过筛及差速贴壁等步骤获得原代奶山羊SCs。
1.2 仪器设备
离心机(Cence),多功能酶标仪(BioTek),倒置光学显微镜(Nikon),倒置荧光显微镜(Nikon),二氧化碳培养箱(Thermo Scientific),电泳仪(Bio-Rad),转膜仪(Bio-Rad),凝胶成像显影系统(ChemiDoc)。
1.3 试验试剂
PBS(Hyclone,SH30256.01),双抗(青霉素-链霉素)(Hyclone,SV30010),Ⅳ型胶原酶(Sigma,V900893),透明质酸酶(Sigma,H3506),脱氧核糖核酸酶I(Sigma,DN25),胰酶(Sigma,T1426),DMEM培养基(Hyclone,SH30243.01),胎牛血清(Gibco,10270106),4%多聚甲醛(Solarbio,P1110),Triton X-100(Sigma,9002-93-1),牛血清白蛋白(BSA)(Sigma,9048-46-8),SOX9鼠抗(SANTA,sc-166505),WT1兔抗(Proteintech,12609-1-AP),PI3K兔抗(Proteintech,60225-1-Ig),p-PI3K兔抗(Bioss,bs-3332R),AKT兔抗(Abcam,ab81283),p-AKT兔抗(Proteintech,10176-2-AP),NFκB兔抗(Cell Signaling,8242),p-NFκB兔抗(Cell Signaling,3031),山羊抗鼠IgG(CWBIO,CW0102S),山羊抗鼠IgG-FITC(BIOSS,bs-0296G-FITC),DAPI(Sigma,28718-90-3),CCK-8(NCM Biotech,C6005),NGF(Peprotech,450-01)。
1.4 试验方法
1.4.1 细胞形态观察 将获得的SCs在12孔板中培养,密度不宜超过90%。在倒置光学显微镜下进行观察。
1.4.2 细胞免疫荧光染色 将获得的SCs在12孔板中培养,密度不宜超过80%,依次进行甲醛固定、通透、封闭、一抗孵育、二抗孵育、洗涤、细胞核染。并处于避光条件下在倒置荧光显微镜下进行观察。
1.4.3 细胞活力及细胞抑制率检测(CCK-8) 将获得的SCs在96孔板中培养,密度为80%左右。每孔加入10%体积的CCK-8溶液,培养箱中继续孵育后,用酶标仪测定450 nm下的吸光度。根据试验目的依据试剂盒说明书进行计算。
1.4.4 细胞毒性(LDH释放)检测 将获得的SCs在96孔板中培养,密度不宜超过80%。分别依次进行冲洗、LDH释放、孵育、离心及LDH反应等步骤,用酶标仪测定450 nm下的光密度值(Optical Density,OD)。根据试验目的依据试剂盒说明书进行计算。
1.4.5 Western Blot 提取SCs总蛋白,蛋白变性后依次进行电泳、转膜、封闭、一抗孵育、二抗孵育等步骤,根据目的蛋白分子量大小获得蛋白条带图像。
1.5 数据统计与分析
获得数据用SPSS(SPSS version 19.0,SPSS Inc)软件统计与分析,数据以“平均值(MEAN)±标准差(SD)”表示。试验数据采用t检验及单因素方差分析评估其显著性。小写字母不同代表差异显著(P<0.05),相同代表差异不显著(P>0.05)。
2 结果与分析
2.1 奶山羊支持细胞鉴定
利用倒置光学显微镜对获得的原代奶山羊SCs进行形态学鉴定。由图1A可以看出,本研究分离的SCs呈不规则纺锤状,符合SCs形态学。另外,利用免疫荧光技术鉴定SCs特异蛋白SOX9及WT1的表达,由图1B可以看出,在倒置荧光显微镜下观察到SOX9和WT1均在细胞中表达,表明本研究获得细胞为SCs。

图1 SCs形态学鉴定及特异蛋白(SOX9和WT1)的表达Fig.1 Identification of Sertoli cells and maker (SOX9 and WT1) expression
2.2 神经生长因子对奶山羊支持细胞活力的影响
在培养基中分别加入25、50、100、200、400和1 000 ng/mL的NGF处理SCs 12 h、24 h。由图2可知,培养12 h后,100、200和400 ng/mL处理组细胞活力显著高于对照组(P<0.05);培养24 h后,100~400 ng/mL处理组细胞活力显著高于对照组(P<0.05)。其中,200 ng/mL的NGF对SCs的细胞活力促进效果最佳。以上结果表明,100~400 ng/mL的NGF对细胞活力有积极的作用。

图2 NGF对SCs活力的影响注:小写字母不同代表差异显著(P<0.05),相同代表差异不显著(P>0.05)。下同。Fig.2 Effects of exogenous NGF treatment on the activity of Sertoli cells Note: Different small letters mean significant difference(P< 0.05), the same letters mean insignificant difference(P>0.05). The same below.
2.3 脂多糖对奶山羊支持细胞活力的影响
利用CCK-8检测细胞活力,筛选LPS最佳处理浓度。如图3所示,分别用5、10、25、50、100、250、500、1 000和2 000 ng/mL的LPS处理细胞24 h,检测细胞活力抑制率,当LPS浓度为5~25 ng/mL时,细胞活力被促进;当LPS浓度为50~2 000 ng/mL时,细胞活力被抑制。其中,当使用1 000 ng/mL的LPS处理细胞24 h后细胞活力抑制率达到50%以上,因此在后续试验中选用1 000 ng/mL作为LPS处理浓度。

图3 不同浓度LPS对细胞活力的影响Fig.3 Effects of different concentrations of LPS on cell viability
2.4 神经生长因子对脂多糖细胞毒性的影响
分别使用1 000 ng/mL的LPS与0、100、200和400 ng/mL的NGF共培养细胞6、12、24 h后测定其细胞毒性,结果如图4所示。培养6 h后,LPS+NGF(200 ng/mL)组细胞毒性显著低于LPS组(P<0.05);培养12 h后,LPS+NGF(200 ng/mL)和LPS+NGF(400 ng/mL)组细胞毒性显著低于LPS组(P<0.05);此外,培养24 h后,LPS+NGF(200 ng/mL)与LPS+NGF(400 ng/mL)组细胞毒性显著低于LPS组(P<0.05)。可以看出,200 ng/mL的NGF对LPS的毒性抵抗效果最佳。

图4 LDH测定LPS的细胞毒性Fig.4 LPS cytotoxicity evaluated by LDH
2.5 神经生长因子和脂多糖对PI3K/AKT/NFκB信号通路的影响
综合以上研究,200 ng/mL的NGF对SCs具有最佳保护作用。因此,以此浓度进一步探究NGF抵抗LPS对SCs细胞毒性的保护机制,并利用Western blot检测磷酸化PI3K(p-PI3K)、总PI3K(t-PI3K)、磷酸化AKT(p-AKT)、总AKT(t-AKT)、磷酸化NFκB(p-NFκB)和总NFκB(t-NFκB)的表达量,磷酸化的信号蛋白与信号总蛋白比值表示信号蛋白的激活情况。由图5可知,与LPS组相比,LPS+NGF组PI3K信号的表达显著降低(P<0.05);对于AKT信号,LPS+NGF组显著低于LPS组(P<0.05);此外,LPS+NGF组NFκB信号表达显著低于LPS组(P<0.05)。以上结果表明,NGF能够抑制LPS激活的PI3K/AKT/NFκB信号。
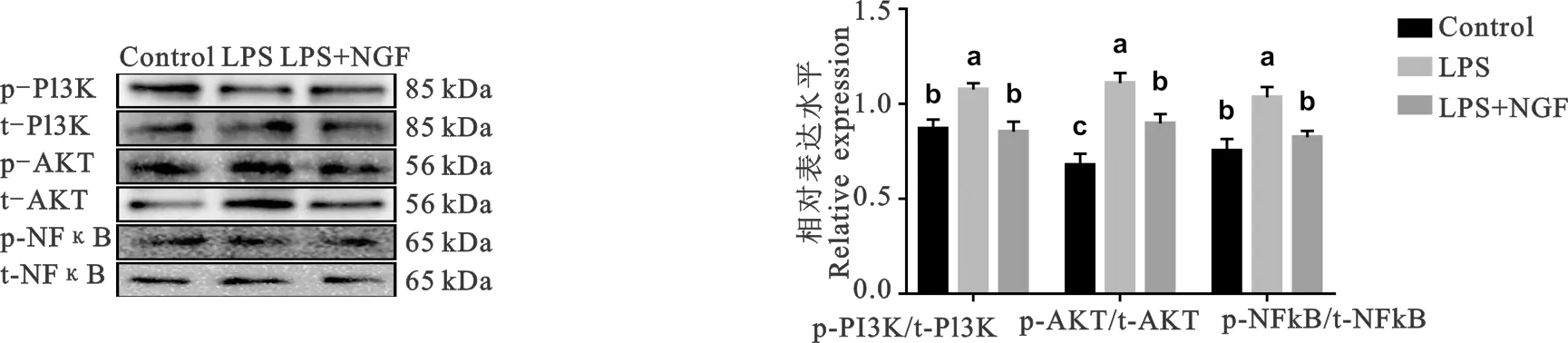
图5 Western blot检测p-PI3K,t-PI3K,p-AKT,t-AKT,p-NFkB和t-NFκB的表达Fig.5 Western blot for pp-PI3K, t-PI3K, p-AKT, t-AKT, p-NFκB, and t-NFκB
3 讨 论
本试验分离纯化获得的奶山羊原代SCs形态与陈庭锋[12]关于猪SCs贴壁后的形态一致。此外,本研究用免疫荧光进行鉴定,结果表明SOX9和WT1在获得的奶山羊SCs中表达,而SOX9和WT1的表达证实分离纯化后获得的细胞为SCs,这与Su等[13]和汤玉燕[14]的研究结果一致。表明本研究获得SCs,可以用于后续试验研究。
为探究NGF对SCs活力的影响,本研究检测了细胞CCK-8活性,结果表明100~400 ng/mL的NGF能够显著提高奶山羊SCs活力。Zhang等[15]研究发现,200 ng/mL的NGF能够促进间质干细胞的增殖,上调间质干细胞的CCK-8活力,这与本研究结果类似。SCs增殖是以有丝分裂的方式进行,这一过程需要ATP提供充足能量,产生更多的代谢产物,表现为CCK-8活力增加。Niu等[16]研究认为,培养基中添加10~200 ng/mL的NGF能够促进初生犊牛SCs的增殖,当添加浓度在10~100 ng/mL时,随着浓度升高,NGF对初生犊牛SCs增殖的促进效果逐渐提高,其最适添加浓度为100 ng/mL,这与本研究结果不同,推测二者最适浓度不同是因为初生犊牛刚脱离母牛子宫内环境,原先SCs所处的睾丸内环境及母牛子宫内环境均含有大量NGF,SCs表面仅表达少量NGF受体(TrkA)即可在与母牛体液交流时获得足够的NGF信号,因而初生犊牛SCs最适NGF浓度较低;而本试验选择的是2~3月龄奶山羊睾丸,其SCs已脱离母畜子宫一段时间,仅能获取睾丸内NGF信号,SCs表面需要大量TrkA捕获NGF信号,因而SCs体外培养需要的NGF最适浓度较高[9]。
本研究使用不同浓度LPS处理奶山羊SCs,结果发现,低浓度的LPS能够提高细胞活力,而高浓度的LPS抑制细胞活力,且半数抑制浓度为1 000 ng/mL,并选择1 000 ng/mL的LPS诱导SCs产生细胞毒性。本研究结果与Feng等[17]研究结果一致,该研究用0~20 μg/mL的LPS处理犊牛SCs 6~24 h,发现低浓度的LPS能够促进SCs的增殖,但处理结果并不显著;高浓度LPS处理12 h后细胞活力显著降低,细胞发生不同程度的凋亡。这是因为LPS能够结合位于细胞表面的受体TLR4,激活下游信号通路产生大量的炎症因子,而睾丸在生精过程中会产生轻微炎症,因此SCs能够适应低浓度的LPS,在0~25 ng/mL的LPS处理组中其活力被促进,而50~2 000 ng/mL的LPS引起过度的炎症反应,破坏细胞内稳态,导致细胞活力降低[5]。
另外,本研究结果表明,NGF能够抑制LPS激活的PI3K/AKT/NFκB信号,进而维持细胞内的稳态并抵抗LPS对SCs的细胞毒性。这与Zhou等[18]研究一致,NGF对于大鼠脊髓损伤的保护作用是通过PI3K/AKT/GSK-3信号实现,同时AKT信号与NFκB信号相互作用,因而NGF能够通过多种信号的协同降低脊髓炎症中小胶质细胞产生的细胞毒性。此外,Lachyankar等[19]和Langhnoja等[20]研究均表明,NGF能够结合其高亲和力受体TrkA及低亲和力受体p75,并通过PI3K和ERK1/2的协同作用提高小鼠神经母细胞活力,进而促进细胞增殖和分化,这与本研究结果相似。异常激活的信号会引起细胞内稳态失调,并产生多种病理反应,而NGF可将外界刺激引起的异常激活信号维持在正常范围,抵抗一定的有害刺激。以上研究结果能够为后续深入研究大型家畜生殖机理调控奠定基础,并为哺乳动物睾丸相关疾病的治疗提供参考。
4 结 论
本研究发现NGF能够提高细胞活力,并通过PI3K/AKT/NFκB信号一定程度抵抗LPS引起的细胞毒性。
