诱导多能干细胞分化的平滑肌细胞促进糖尿病鼠创面愈合的研究
2023-10-07高喜翔高明杰谷涌泉郭连瑞
高喜翔,高明杰,谷涌泉,郭连瑞∗
(1.首都医科大学宣武医院血管外科,首都医科大学血管外科研究所,北京 100053;2.首都医科大学附属潞河医院超声科,北京 101199)
随着人们生活水平的不断提高,糖尿病的患病率也越来越高。目前,我国成年人中糖尿病患病率为11.6%,糖尿病前期患病率更是高达50.1%[1]。同样,美国的糖尿病患病率约为9.4%,这些患者中每年大概有600 万会出现糖尿病足溃疡(diabetic foot ulcers,DFU)[2]。据统计,全球每年会有910 万~ 2610 万糖尿病患者会出现足溃疡[3]。DFU 是糖尿病的严重并发症之一,常常导致截肢甚至死亡[3-4]。DFU 的标准治疗方法包括血运重建、清创、控制感染和减压等。但是,即便进行良好的治疗,仅有50%的DFU 可以在20 周内愈合。并且,DFU复发率高,1 年复发率约为40%,3 年复发率约为60%[3,5]。
DFU 的发生机制是一系列复杂的病理生理改变,包括缺氧、成纤维细胞和表皮细胞功能失调、过度的炎症反应、巨噬细胞功能异常、继发于活性氧的损伤和晚期糖基化终产物、生长因子生成减少、血管新生受损,以及干细胞归巢受损等[6-9]。尽管有多种可用于糖尿病足创面的治疗措施,但是仅取得了一定程度的临床成功。近年来,干细胞疗法作为再生医学领域一种非常具有前景的治疗方法,已开始用于糖尿病足创面的治疗[10]。干细胞以其多能性和自我更新能力为特征,可以动员并归巢到受损组织,在那里合成和分泌再生趋化因子和生长因子[11-12]。这些细胞因子反过来又促进细胞募集、血管新生和细胞外基质(extracellular matrix,ECM)重塑,从而创造有利于伤口愈合的局部微环境[10,13]。成体来源的干细胞,如间充质干细胞(mesenchymal stem cells,MSC),已在临床试验中显示出疗效,目前已有几种市售产品[14-16]。尽管MSC 具有丰富的细胞因子,但由于MSC 具有很强的免疫调节作用,下调伤口愈合早期所需的炎性细胞因子的表达[17]。并且,与诱导多能干细胞(induced pluripotent stem cells,iPSC)相比,成体来源的干细胞的获取通常需要有创操作,如骨髓穿刺,不具有分化为所有皮肤细胞谱系的能力,并且需要以非活性状态进行运输。因此,MSC 可能不是治疗DFU 的最佳细胞类型。
iPSC 是一种非常具有临床转化潜能的治疗糖尿病足溃疡的干细胞。iPSC 是多能干细胞,可以来源于成纤维细胞等成体细胞,可以通过无创或微创操作获得,并在体外重新编程为多能状态,可以分化成任何成体细胞谱系[18-19]。人iPSC(human pluripotent stem cell-derived smooth muscle cells,hiPSC)衍生的内皮细胞(human pluripotent stem cell-derived endothelial cells,hiPSC-EC)、成纤维细胞和hiPSC 衍生的MSC 在动物模型中可以促进创面的愈合[20-22]。此外,hiPSC-EC 和人多能干细胞分化的平滑肌细胞(human pluripotent stem cellderived smooth muscle cells,hiPSC-SMC)增强了体外小管网络的形成,在裸鼠全层伤口模型中,与单独给予iPSC-EC 相比,iPSC-EC 和iPSC-SMC 共同植入后血管新生显著增加,伤口愈合加速,小动脉密度增加[23]。并且,与制备hiPSC-EC 的方法相比,将hiPSC 分化为平滑肌细胞(smooth muscle cells,SMC)的方法更有效并且产生更均匀的细胞群。这表明,hiPSC-SMC 可成为治疗DFU 的一种重要的细胞类型。但迄今为止,仍缺乏单独研究iPSC-SMC促进创面愈合潜力的报道。
研究表明,在糖尿病裸鼠创面模型,脂肪来源干细胞(adipose-derived stem cells,ADSC)可加速糖尿病创面愈合[24-25]。假设hiPSC-SMC 在改善糖尿病裸鼠创面愈合方面具有与ADSC 相似的治疗效果,拟在糖尿病裸鼠背部夹板创面模型中验证这一假设。为了增加研究结果的临床转化潜力,本文使用该模型来研究单独使用hiPSC-SMC 是否加速糖尿病裸鼠创面的愈合。
1 材料与方法
1.1 材料
1.1.1 实验动物
本实验于2019 年4 月至2020 年10 月在耶鲁大学Vascular Biology and Therapeutics Program 实验室完成。30 只SPF 级雄性无胸腺裸鼠,8~ 12 周龄;体重20~ 30 g,购买于美国缅因州杰克逊实验室(NU/J#002019 homo,RRID:IMSR_JAX:002019),用于创建糖尿病裸鼠背部创面模型。饲养于耶鲁大学Vascular Biology and Therapeutics Program 动物实验室(USDA License and Registration Number:16-R-0001)。饲养期间,环境温度23~ 25°C,相对湿度40%~ 60%,昼夜各半循环照明,自由饮水饮食。所有动物研究均得到耶鲁大学实验动物伦理委员会的批准(2019-11379)。
1.1.2 主要试剂与仪器
半透辅料(Tegaderm,3M,MN,USA),10 ×最低培养基(Sigma-Aldrich,MO,USA),平滑肌生长培养基(SmGM-2 medium,Lonza),mTeSR1 培养基(StemCell Technologies),EB 分化培养基(含有10%胎牛血清的DMEM,Hyclone),SMC 成熟培养基(含有1% FBS 和1ng/mL TGFβ1 的DMEM 培养基,Hyclone),ADSC 培养基(ADSC-GM SQ Kit,Lonza)大鼠鼠尾胶原(Enzo Life Sciences,NY,USA),Anti-Ki67 (Abcam,ab15580),Anti-caspase 3 (Cell Signaling,Asp175),Anti-VEGF-A (Santa Cruz Biotechnology,sc-152),Anti-α-SMA (Abcam,ab5694),Anti-CD31(Cell Signaling,77699T),HSP-90 (Santa Cruz,sc-13119),Anti-PDGF(Santa Cruz,sc-7878),Envision+dual link HRP rabbit/mouse secondary antibodies (Agilent Dako,CA,USA),辣根过氧化物酶偶联二抗(Cell Signaling,7074),链脲佐菌素(Tocris Biosciences,Bristol,UK),RiPA 裂解缓冲液(Millipore),聚偏二氟乙烯微孔膜(0.45 μm 孔径,Immobilon,Millipore)。
快速血糖仪(罗氏,瑞士),相机(奥林巴斯,SP-800 UZ,日本),正置光学显微镜(尼康,Nikon Eclipse E200,日本),化学发光成像仪(GE,USA)。
1.2 方法
1.2.1 hiPSC-SMC 的制备
细胞制备遵循耶鲁大学科研委员会批准的方案。使用先前建立的hiPSC 系Y6[26-27]。参照Luo等[28]基于胚状体(embryoid body,EB)形成驱动的方法,从hiPSC 衍生出平滑肌细胞(SMC)。将hiPSC 扩增至80%融合并解离形成细胞簇。细胞团在mTeSR1 培养基中的6 孔低附着板中悬浮培养24 h。将培养基逐渐过渡到EB 分化培养基以促进EB 形成直至第6 天。然后将EB 转移到明胶包被的平板中并在EB 分化培养基中培养6 d。随后,分化的细胞被收获,接种在Matrigel 包被的平板上并在平滑肌生长培养基中再培养7~ 10 d 以获得增殖性hiPSC-SMC。为了促进hiPSC-SMC 的成熟,将增殖性hiPSC-SMC 进一步接种在明胶锡包被的平板上,并在SMC 成熟培养基中培养5~ 7 d,以达到获得成熟的hiPSC-SMC。
1.2.2 人ADSC 的培养
人ADSC 是从EMD Serono 公司购买(Billerica,MA;Lot VP1708071);细胞来自成年健康供体。第2 代的ADSC 培养24 h,达到近90%融合率。ADSC传3~ 4 代在ADSC 基础培养基中培养和维持,并加入ADSC 培养基。使用前,将培养基更换为无胎牛血清(fetal bovine serum,FBS)培养基12 h。
1.2.3 干细胞胶原蛋白膜片的制备
通过将500 μL 10 × 最低必需培养基与4 L 的I型鼠尾胶原蛋白混合,并将pH 值调节至7.0 来制备胶原蛋白膜片[25]。在胶原蛋白凝固之前将0.5 mL 细胞特异性培养基中的2 × 106hiPSC-SMC 或ADSC 添加到胶原混合物中,0.5 mL 不含细胞的PBS 用作无细胞对照。然后让胶原蛋白溶液在室温下在矩形模具内凝固(20 min)。随后将凝固的凝胶从模具中取出并在玻璃板之间压缩(5 min)以去除所有液体。然后使用镊子卷起剩余的胶原蛋白片,并在细胞特异性、无FBS 的组织培养基中孵育72 h,以确保膜片(在37℃)的最大细胞活性。孵育72 h 后,展开卷起的胶原蛋白膜片用于体内研究。
1.2.4 动物分组及实验干预
裸 鼠 分 为 3 组: hiPSC-SMC 组,ADSC 组(Acellular 组,阳性对照),无细胞组(阴性对照),每组10 只。参照Guo等[24]的方法建立糖尿病裸鼠创面模型。为了诱发糖尿病,连续7 d 每天给裸鼠注射链脲佐菌素(50 mg/kg IP)。在最后1 次注射7 d后开始通过尾静脉针刺,用快速血糖仪测量血糖水平。血糖连续3 次在超过16.7 mol/L 后,动物被认为患有糖尿病。注射链脲佐菌素可以破坏胰岛β细胞,制备的糖尿病模型更接近1 型糖尿病。麻醉裸鼠后,并在每只动物的上背部两侧缝合两个内径和外径分别为6 mm 和10 mm 的硅胶夹板。使用六根间断的5-0 聚丙烯缝合线将每个夹板固定到位。然后使用剪刀沿着夹板的内缘切除全层皮肤,制作糖尿病鼠创面模型[29]。含有干细胞或无细胞的胶原蛋白膜片随后展开并分成相等的两半。创面制备后立即用8-0 单丝缝合线将膜片固定在创面上,然后用半透敷料覆盖创面。术后镇痛采用皮下注射丁丙诺啡(0.05~ 0.1 mg/kg)。
从术后当天开始,每隔1 d 更换敷料并检查伤口。使用异氟醚对裸鼠进行短暂麻醉,并用安装在三脚架上的奥林巴斯SP-800 UZ 相机以7 cm 的固定距离拍摄伤口。换药时,更换松动的缝线,以确保夹板正确固定。然后使用Image J 软件分析伤口区域。在术后第7 天,对裸鼠实施安乐死,对创面进行取材,并浸没在10%磷酸盐缓冲福尔马林中过夜。然后将样品进行石蜡包埋,每5 μm 连续切片,并如下所述进一步处理。
1.2.5 免疫组化
参照文献[25]进行免疫组化。使用二甲苯和一系列分级的乙醇对载玻片进行脱蜡。将切片在100℃的柠檬酸缓冲液(pH=6.0)中加热10 min以进行抗原修复,随后在室温下用含有5%牛血清白的PBST(含有吐温的PBS)中的封闭1 h,后在4℃一抗中孵育过夜。用于免疫组织化学的一抗包括:Anti-Ki67、Anti-caspase 3、Anti-VEGF-A,Anti-α-SMA,Anti-CD31。与一抗孵育过夜后,切片在室温下用Envision+双链HRP 兔/小鼠二抗处理1 h。用二氨基联苯胺四盐酸盐显影并用苏木精复染后,显微镜下拍照,并手动计数4 个高倍视野中的阳性细胞数量和占总细胞数的百分比。
1.2.6 蛋白免疫印迹
用RiPA 裂解缓冲液提取组织裂解物。在10%SDS-PAGE 凝胶上分离等量的蛋白质(20~ 40 μg),并电泳转移到聚偏二氟乙烯微孔膜上。然后将膜封闭在含5%牛血清白蛋白的TBS-T(含有Tween 20 的TBS)中,在室温下孵育1 h,并在Anti-VEGF-A、Anti-PDGF 或HSP-90 一抗在摇床上在4℃下过夜。用TBS-T 洗涤膜并在室温下与辣根过氧化物酶偶联二抗孵育1 h 后,按照制造商的方案使用化学发光显影仪观察免疫复合物。
1.3 统计学分析
2 结果
2.1 hiPSC-SMC 具有和ADSC 一致的促进糖尿病创面愈合的能力
为了明确在之前描述的胶原蛋白膜片中使用hiPSC-SMC 是否会促进伤口愈合,将无细胞、含有ADSC 或hiPSC-SMC 的胶原蛋白膜片应用于糖尿病裸鼠的全层皮肤缺损创面。用硅胶夹板来避免由于创缘收缩引起的创面缩小[24-25,29]。ADSC 被用作阳性对照,之前的研究证明,ADSC 在糖尿病大鼠夹板创面模型中能够明显促进伤口愈合[24]。与无细胞膜片相比,hiPSC-SMC 组和ADSC 均能够明显加速伤口愈合(P<0.001,图1),在术后第2 天就表现出明显的促进创面愈合的作用。
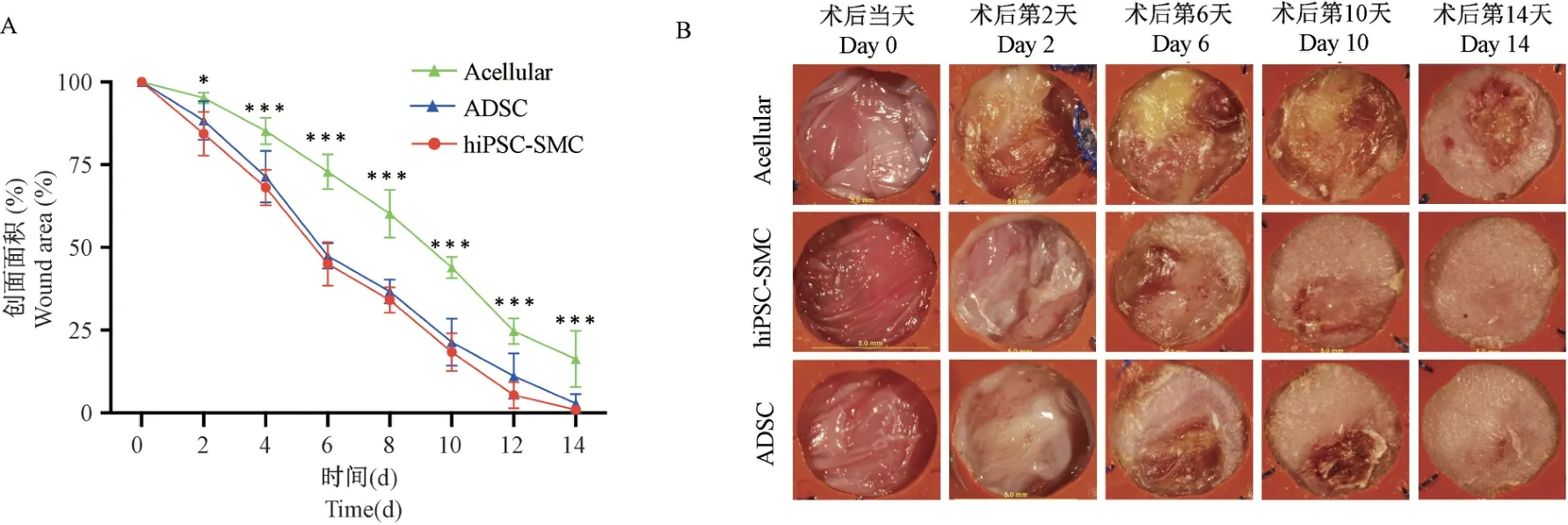
图1 创面愈合情况(n=6~ 8)Note.A.Line graph shows wound size over time.B3.Representative images of wounds at day 0,2,6,10,and 14.Compared with negative control group,∗P <0.05,∗∗∗P <0.001.(The same in the following figures)Figure 1 Wound healing in vivo(n=6~ 8)
2.2 hiPSC-SMC 和ADSC 均可减少细胞凋亡
术后第7 天时取材,病理检查发现用hiPSCSMC 和ADSC 组的创面与无细胞组相比,均有着明显增高的增殖率(P<0.0001,图2A,2B);同时,细胞凋亡率均较低,组间差异无统计学意义(P=0.3786,图2C,2D)

图2 术后第7 天创面免疫组化染色(n=6~ 8)Note.A,C,E,G,I.Images of immunohistochemistry for Ki67,caspase-3,α-actin,CD31 and VEGF-A.B,D,F,H,J.Quantification of percentage of positive cells or number of the capillaries.Compared with negative control group,∗∗∗∗P <0.0001.Figure 2 Immunohistochemistry of the wounds of postoperation day 7(n=6~ 8)
2.3 hiPSC-SMC 和ADSC 均可促进创面愈合
为了确定hiPSC-SMC 是否可以促进血管新生,从而促进创面愈合,进行血管平滑肌细胞核内皮细胞标志物的免疫组化染色。hiPSC-SMC 和ADSC 组的创面中,α-SMA 阳性细胞(P<0.0001,图2E,2F)、CD31 阳性细胞(P<0.0001,图2G,2H)和VEGF-A 阳性细胞(P<0.0001,图2I,2J)均明显增多。这些数据表明,ADSC 和hiPSC-SMC 均增加了体内细胞增殖,促血管新生和再生细胞因子的表达以及促进创面愈合。
2.4 hiPSC-SM 和ADSC 促进血管新生和再生细胞因子的释放
我们进行了促进血管新生和再生细胞因子的检测。免疫印迹结果显示,与无细胞组相比,hiPSCSMC 和ADSC 组的VEGF-A 和PDGF 表达明显升高(P<0.05,图3)。这些数据表明,hiPSC-SMC 和ADSC 组通过促进血管新生和再生细胞因子的表达,促进创面愈合。

图3 蛋白质印迹定量分析VEGF-A 和PDGF 表达(n=6~ 8)Note.A.Western Blot of VEGF and PDGF.B.Quantification of VEGF-A and PDGF relative expression in vivo.Compared with negative control group,∗∗P <0.01.Figure 3 Quantification of VEGF-A and PDGF expression in vivo by Western Blot(n=6~ 8)
3 讨论
iPSC 结合了MSC 和ESC 优点,开创了再生医学的新时代。iPSC 代表了成人来源干细胞的突破性创新,具有增强治疗和转化潜力。iPSC 技术的使用允许产生来自成体细胞的自体多能干细胞群,从而避免与人类ESC 相关的伦理问题。此外,自体iPSC 是非免疫原性的,可以在体内长期存活[30]。由于iPSC 可以分化成所有3 个胚层的细胞,因此可能通过旁分泌和直接细胞效应增强伤口愈合的每个阶段[31]。iPSC 分化的细胞可以分泌诸多生长因子和细胞因子,这些因子与免疫调节、细胞增殖和迁移、血管新生和 ECM 合成以及重塑密切相关[21,32-34]。
本实验表明,在糖尿病裸鼠全层皮肤缺损夹板创面模型中,hiPSC-SMC 与ADSC 具有相似的促进创面愈合的能力,两种干细胞治疗的创面,有着较高的细胞增殖率,较低的细胞凋亡率,创面的血管新生明显增多,细胞因子的表达增多。这些数据表明,hiPSC-SMC 能够在裸鼠模型中加速糖尿病创面的愈合,具有治疗DFU 的临床转化潜力。
研究发现,hiPSC-SMC 促进创面愈合的能力与ADSC 相似,在术后第2 天即表现出了明显的促进愈合的能力。SMC 在创面愈合中发挥多种作用,特别是在糖尿病伤口中[35]。SMC 可促进内皮细胞新生血管形成和伤口愈合,并且作为肉芽组织形成所必需的肌成纤维细胞的来源[34,36-37]。本研究的数据显示,hiPSC-SMC 可以促进血管新生和再生细胞因子的表达,促进血管新生和细胞增殖。hiPSCSMC 处理的创面VEGF 和PDGF 的表达增多,毛细血管数量增多。尽管hiPSC 衍生多种细胞,如hiPSC-EC、hiPSC-MSC 和成纤维细胞在裸鼠模型中表现出促进伤口愈合的能力,但单独应用hiPSCSMC 促进伤口愈合的研究较少。本实验证实了hiPSC-SMC 促进糖尿病裸鼠创面愈合的能力。
虽然本研究证实了hiPSC-SMC 在糖尿病裸鼠创面模型中加速创面愈合的能力,但仍有一些局限性。首先,注射链脲佐菌素的糖尿病模型更接近1 型糖尿病,而2 型糖尿病更常见于患有慢性伤口和糖尿病足溃疡。其次,将iPSC 衍生细胞的临床转化的一个主要障碍是未分化细胞的致畸性[38-39]。尽管本实验中,局部应用iPSC-SMC 后未观察到畸胎瘤形成,但仍需研究进一步证实其安全性。再次,本研究只选用了雄性动物,因为与女性相比,男性DFU 更为常见;有必要对雌性动物进行进一步研究以验证上述结论。最后,尽管本研究表明,hiPSCSMC 与ADSC 有着一致的促进创面愈合的能力,但具体的机制仍有待进一步研究。
4 结论
本研究表明,单独应用hiPSC-SMC 可以促进血管新生和再生细胞因子的表达,促进血管新生和细胞增殖,从而进糖尿病裸鼠全层皮肤缺损的夹板创面的愈合。
