眼部组织细胞增生症诊疗进展
2023-09-27乔俊逸何为民
乔俊逸,何为民
眼部组织细胞增生症是一组罕见的成人及儿童均可发病的异质性疾病,其临床及影像学表现无特异性,临床上该类疾病的诊疗存在巨大困难。随着对组织细胞增生症分子机制的研究,BRAFV600E突变基因的发现使人们对组织细胞增生症有了进一步的认识,也使多数患者能够得到针对性的治疗。诊断的金标准发展为组织病理活检联合突变基因的检测,治疗方式不再是单一的手术切除治疗,靶向治疗对MAPK-ERK通路中突变基因阳性的患者也有极好的疗效。但是眼部组织细胞增生症类型众多且常常涉及多个系统,临床表现多样,对其早期、正确地诊断仍面临挑战。因此本文就近年眼部组织细胞增生症的诊疗进展进行文献复习,总结眼部组织细胞增生症的临床病理特征并对最新的治疗进展进行综述,旨在提高临床医生对该疾病的诊疗水平。
•KEYWORDS:histiocytosis; ocular; Langerhans cell histiocytosis; non-Langerhans cell histiocytosis
0 引言
组织细胞增生症是一组罕见的成人及儿童均可发病的异质性疾病,以单核巨噬细胞系统的细胞浸润为特征,几乎所有器官都可受累,好发于皮肤、骨、肺、淋巴结、中枢神经系统和心脏,眼部少见[1]。组织细胞增生症的分类最初于1987年由组织细胞协会(HS)工作组发布,根据受累细胞和增殖类型将其分为三类:(1)朗格汉斯细胞组织细胞增生症(Langerhans cell histiocytosis,LCH),源于树突状细胞;(2)非朗格汉斯细胞组织细胞增多症(non-Langerhans cell histiocytosis,NLC),源于单核巨噬细胞;(3)恶性组织细胞增生症(malignant histiocytosis,MH)[1]。随着基因测序技术的发展,人们在LCH中发现了BRAFV600E的突变,这彻底改变了人们对组织细胞增生症的认识。2016年,组织细胞学会根据临床、组织学和分子特征将组织细胞增生症重新分为五组(L、R、C、M和H)[2]。目前,大量关于组织细胞增生症的研究正在进行中,病理诊断技术的发展以及靶向药物的治疗使得该病的死亡率不断降低。然而该病的类型繁多且临床表现多样,早期、正确地诊断仍然面临极大挑战。由于眼部组织细胞增生症的发病率低,目前多数文献报道都集中在单一类型,如儿童或成人LCH、埃尔德海姆-切斯特病(Erdheim-Chester disease,ECD)、幼年黄色肉芽肿(Juvenile xanthogranuloma,JXG)或Rosai-Dorfman 病(Rosai-Dorfman disease,RDD),且多为病例报道。因此本文就近年眼部组织细胞增生症的诊疗进展进行综述,以提高临床医师对此病的认识。
1 组织细胞起源
组织细胞是免疫系统中的一类细胞,能够捕捉、加工、处理抗原,并将抗原呈递给抗原特异性淋巴细胞,也称为抗原呈递细胞。组织细胞的主要功能可以分为两类,即吞噬传递抗原和激活适应性免疫,对应两种不同功能的细胞,即巨噬细胞和树突状细胞。巨噬细胞的主要功能是吞噬和消化组织中的凋亡细胞、碎片和病原体,而树突状细胞则通过呈递与Ⅱ类主要组织相容性复合物相关的抗原启动T细胞依赖的免疫反应[3]。树突状细胞在表皮内、黏膜或支气管上皮时称为朗格汉斯细胞,当局部存在炎症时,朗格汉斯细胞迁移到对应引流的淋巴结,并分化为并指状树突细胞,进一步发挥抗原呈递作用,从而启动适应性免疫应答。组织细胞也在炎症的启动和调节中发挥关键作用[4]。
2 疾病分类
组织细胞增生症最初被分为三类,分别基于受累细胞(单核巨噬细胞或树突状细胞)和增殖类型(炎性刺激反应性增殖或恶性增殖),这一分类由组织细胞学会工作组于1987年发表[1]。然而,这三个类别的组织细胞增生症在分子改变和临床病理表现上存在相似之处。因此,组织细胞学会在2016年重新修订了分类,并根据临床表现、组织学和分子特征将组织细胞分为五组(L、R、C、M和H)(图1)[2]。
3 病因及发病机制
组织细胞增生症的病因及发病机制尚未完全明确,但可能与免疫失调、环境刺激、遗传及外伤等因素有关。目前认为有两种可能的发病机制,即免疫调节异常和肿瘤性增殖。
3.1免疫调节机制一种观点认为组织细胞增生症是炎症因子介导的反应性增生性疾病。在LCH的病变组织中,除了有特征性的病理性树突状细胞的增殖和聚集,还有嗜酸性粒细胞、淋巴细胞和巨噬细胞的炎症浸润[5],这些细胞会互相刺激并产生大量的细胞因子,从而在病变组织中构成一个“细胞因子风暴”,导致免疫功能异常[6]。全身和局部炎症似乎是器官损害的主要驱动因素。
3.2肿瘤性增殖机制自BRAFV600E突变在LCH中被发现,彻底改变了人们对组织细胞增生症的认识,从而也开启了该病靶向治疗的时代。BRAF基因编码一种丝氨酸/苏氨酸特异性激酶,是MAPK(RAS-RAF-MEK-ERK)信号通路中最重要的转导因子。正常情况下,BRAF蛋白只有被RAS激酶磷酸化之后才有激酶活性,当BRAF基因发生激活突变后,突变的BRAF蛋白一直处于激活状态,会导致其下游靶向蛋白上调,进而出现组织细胞过度增殖,最终导致肿瘤形成[1]。研究发现,在超过90%的LCH和ECD病例中存在MAPK通路突变,LCH或ECD患者活检样本中BRAFV600E被检测到的频率为50%~60%,在缺乏BRAFV600E突变的LCH和ECD活检样本中MAPK信号通路也包含其他类型的基因突变[7],如MAP2K1、ARAF、NRAS和KRAS等[8]。
4 临床表现
组织细胞增生症可发生于各年龄段,男性多于女性[1]。其临床表现多样,取决于发病部位和对特定器官系统的影响,眼部受累约占组织细胞增生症的20%,各类型占比略有不同,见表1[9-27]。
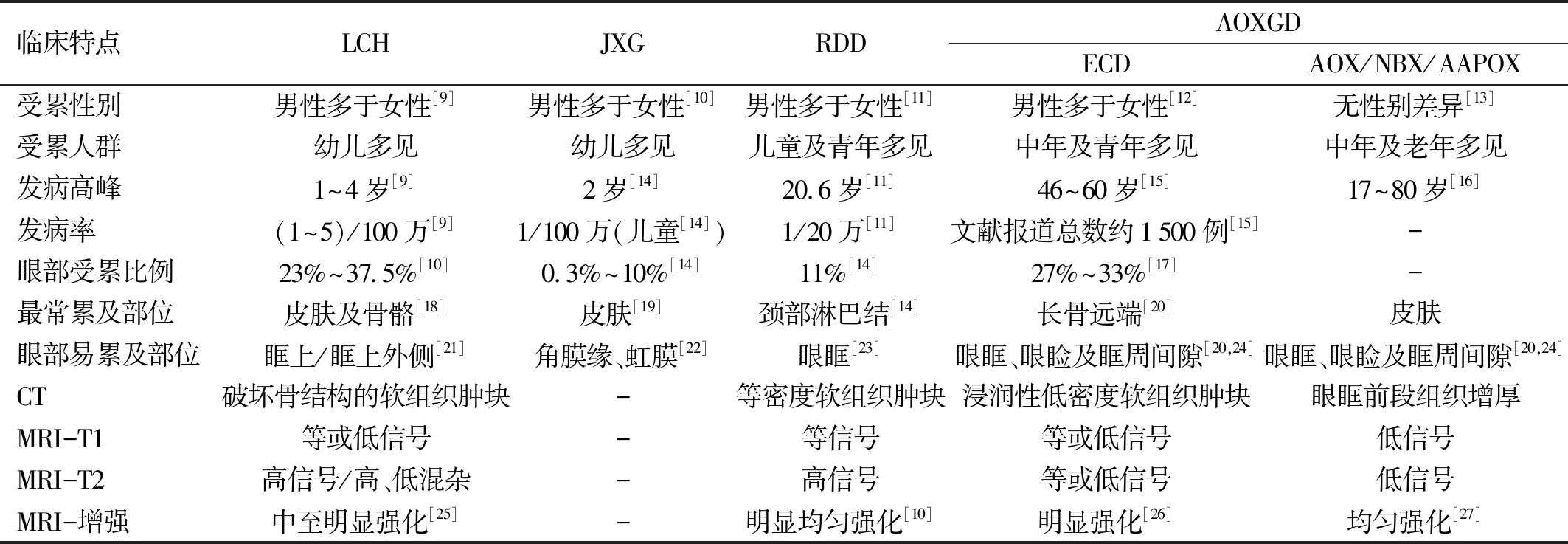
表1 眼眶部LCH、JXG、RDD、AOXGD(ECD、AOX、NBX、AAPOX)的临床特点及影像学比较
眼部LCH以侵蚀眶骨为特征,多为孤立的骨质病变并伴有软组织肿块[21],也可合并多灶性病变或多系统病变[28]。患者通常表现为单侧眼睑及眶周局部皮肤红肿疼痛,眶缘可扪及固定硬性肿物,伴有眼球突出、眼球运动受限及上睑下垂等症状。
眼部ECD以眼眶内病变组织浸润性生长为特征,患者通常表现为眼球突出、眼睑肿胀、眼痛流泪等症状,当病变侵犯视神经可引起视力下降或失明。此外,病变还可侵犯脉络膜和视网膜[29-30]。眼部ECD通常伴有全身症状,最常见为长骨、中轴骨及四肢骨的对称性骨质硬化,约50%患者伴有骨痛;当病变侵犯腹膜后和肾脏时,患者通常表现为特征性的腹膜后纤维化,有时可伴有双肾积水[31]。此外,心血管及呼吸系统也可受到累及,出现心包炎、心包渗出或积液、胸膜增厚、胸腔积液等表现[32]。
眼部JXG以眼表或眼内孤立性肿块为特征,通常表现为虹膜内或角巩膜缘光滑、淡黄色单发结节[22],也可累及结膜、角膜、脉络膜、视神经、眼眶及眶周皮肤[33]。自发性前房积血是虹膜JXG的常见表现,进一步可出现继发性青光眼、新生血管等相关并发症威胁视力[34],目前认为JXG是儿童前房积血最常见的原因[19]。
眼部RDD常为单侧眼眶无淋巴结受累的孤立性肿物,表现为眼球突出及活动受限,也可出现眼内肿物,葡萄膜炎,浆液性视网膜脱离等眼内表现[23]。眼眶病变常为单灶性病变,眼内受累的RDD常累及呼吸系统及心血管系统等其他系统,常伴有发热、贫血、白细胞升高、血沉加快等全身表现[35],故以眼内受累为表现的RDD可能更具侵袭性,往往需要进一步的系统性评估[23]。
当眼部组织细胞增生症表现为眶周皮肤黄色瘤时称为成人眼眶黄色肉芽肿病(AOXGD),以双眼高出皮面的局限或弥漫性黄色浸润性皮肤病变为特征,伴眼睑无痛性水肿,也可出现泪腺肿大、泪腺脱垂等体征[36]。AOXGD可分为4个亚型,即成人起病的黄色肉芽肿(AOX)、坏死性黄色肉芽肿(NBX)、ECD和成人起病的哮喘和眼周黄色肉芽肿(AAPOX)[13],其中坏死性肉芽肿最为常见,ECD次之,见表2[13,16-17,20,36-38]。除了眼部表现,AOXGD通常伴随一些严重的并发症(如副蛋白血症、多发性骨髓瘤等),若不及时处理,患者常因并发症而死亡[36]。AOXGD的眶周病变通常在全身病变前出现,若能在严重的并发症出现之前及时治疗,通常预后良好[36],因此眼科医生在怀疑患者为AOXGD时,应完善系统的筛查并进行适当的转诊。

表2 眼眶AOXGD(ECD、AOX、NBX、AAPOX)的临床及病理表现
5 辅助检查
眼眶CT和MRI是评估组织细胞增生症眶内病灶范围和性质的最常用影像学手段。组织细胞增生症在影像上常表现为眼眶内占位性病变,眼眶内突出的均质软组织肿块,可破坏周围软组织及骨组织,也有少数患者可见眼外肌和视神经的包裹或浸润,见表1[10,25]。超声生物显微镜(UBM)可以观察眼前段病变与邻近组织的关系,可提供有关眼部JXG是否适合手术治疗及治疗后病变变化的有价值信息[22]。评估其他系统和全身情况对于诊断和判断病情也至关重要[9],对疑似组织细胞增生症的患者完善外周血的检查包括血细胞计数、血沉、C反应蛋白和免疫球蛋白水平[39]及全身影像学检查是十分必要的,但是否需要对每一位组织细胞增生症患者进行全身成像,如仅皮肤受累或仅孤立眼眶病变的患者,这一点仍存在争议[40]。但是在没有完善检查的情况下,患者是单系统受累还是多系统受累是未知的。因此,对疑似多系统疾病的患者应考虑进行全身影像学检查。目前18F-FDG PET/CT因其可以提供病灶的功能与代谢分子信息,可以弥补CT局部观察的局限性,是评估是否有多器官受累的首选影像学方法[11]。
6 病理表现
组织细胞增生症的病理表现以巨噬细胞或树突状细胞表型的肿瘤细胞浸润为特点,伴有不同程度的纤维化和炎性细胞浸润,见表3[13,20,22,41-44]。免疫组织化学(IHC)检查和BRAFV600E突变基因检测对进一步明确诊断、分型及选择治疗方案极为重要[2]。辅助诊断组织细胞增生症最常用的标志物包括CD163、CD68、S-100、CD1a、CD207(Langerin)和FXⅢa等,见表3[2]。由于部分组织细胞增生症的形态学不典型,往往需要结合患者全身表现及进一步的MAPK-ERK途径基因突变测序分析才能做出正确诊断[39]。突变基因的测序分析不仅对明确诊断十分重要,也是后续是否可以进行靶向治疗及靶向药物选择的依据[45]。目前BRAFV600E突变基因的检测主要采用直接测序法和实时PCR法,近年来一种BRAFV600E突变特异性单克隆抗体,因其与上述方法一致性达95%以上[46],且兼具简单、低成本和高效的优势,已逐渐成为BRAF基因突变最常用的初筛方法,其在组织细胞增生症中尤其是LCH及ECD的评估中具有很高的特异性[47]。

表3 眼眶部LCH、JXG、RDD、AOXGD的病理表现及组织免疫学特征
7 治疗
眼部组织细胞增生症目前没有标准的治疗方案。部分眶周皮肤病变可自行缓解[48],眼眶病变较少有自发消退的报道,通常以手术切除为主[49],不能完全切除者,局部放射治疗或眶内皮质类固醇注射也可作为辅助治疗[36]。眼部JXG和RDD通常为局限性病变,手术和局部皮质类固醇治疗可使多数患者的肿瘤得到控制并获得满意的视力效果[34]。眼部LCH和ECD常伴随全身病变,需要采用包括化疗、靶向治疗、免疫治疗等在内的全身治疗方案,手术切除通常只作为活检用以明确诊断或作为肿物压迫眼眶内结构需要立即缓解症状以挽救视力的紧急方案[50]。
由于在组织细胞增生症中发现了与MAPK-ERK信号通路相关的突变基因,靶向治疗已成为其治疗的首选方案[15]。在BRAFV600E患者中,BRAF抑制剂(维莫菲尼、达拉菲尼)具有良好的疗效。一项多中心的队列研究表明,维莫非尼对BRAFV600E突变的组织细胞增生症具有长期疗效,其客观缓解率(objective remission rate,ORR)为61.5%,2a无进展生存时间(progression free survival,PFS)和总生存期(overall survival,OS)分别为86%、96%[45],但在治疗过程中,常出现关节痛、皮疹(光敏感、毛周角化症、鳞状细胞癌、嗜酸性粒细胞增多性皮病以及药物超敏反应综合征)、乏力或其他毒副作用而需要减少药物用量[51]。MAP2K1抑制剂(曲美替尼、考比美替尼)可用于治疗存在MAPK-ERK通路的其他基因突变(ARAF、KRAS、MAP2K1)的患者。在一项考比美替尼治疗组织细胞增生症的Ⅱ期临床试验中,其ORR为89%[52]。MTOR抑制剂(西罗莫司、伊维洛莫斯)和KIT抑制剂(伊马替尼)等也常常作为难治性组织细胞增生症的治疗选择[15]。虽然靶向治疗在存在突变基因的患者中具有良好的反应,但停药后也有复发的风险[4]。
长春新碱+泼尼松(VP)的化疗方案对年龄<20岁的LCH患者有效,但随着年龄增大,会表现出较高的神经毒性而导致总体反应较差;眼眶孤立性LCH作为中枢神经系统的危险病变,根据国际治疗方案(LCH Ⅳ方案)需进行至少6mo的VP化疗方案[53]。克拉屈滨(2-氯脱氧腺,2-CdA)是一种嘌呤核苷类似物,可抑制DNA修复和合成,对淋巴细胞和单核细胞具有直接毒性,并可诱导树突状细胞凋亡,目前作为LCH和ECD的二线治疗方案,但由于该药存在长期淋巴细胞减少的风险,使用不能超过3~4个周期[54]。环磷酰胺、长春花碱、大剂量静脉注射甲氨蝶呤等也用于难治性的组织细胞增生症。TNF-α曾作为ECD的一线治疗方案,目前仍是没有靶向治疗情况下ECD的最佳选择,其ORR为50%~80%,3a PFS和OS分别为64.1%和84.5%[55]。
目前,关于组织细胞增生症的治疗方案主要依赖于针对儿童病例的研究数据,其中大部分数据来自国外。国内纳入研究的人数最多的是一项关于95例儿童LCH治疗与预后分析的研究[56]。由于成人组织细胞增生症的发病率较低,缺乏针对成人的前瞻性研究,对于成人组织细胞增生症治疗的支持性证据主要来自于小规模的回顾研究、病例系列报道和个案病例报道。目前成人组织细胞增生症的诊断和治疗建议是基于从儿童的前瞻性研究中推断出来的。因此,对于成人组织细胞增生症的治疗方案仍需要进一步观察和探索[40]。
8 预后
仅眼部受累的组织细胞增生症预后普遍较好,存活率接近100%,但有复发风险[21]。当多个系统或全身受累时,患者的预后通常较差,存在潜在的死亡风险。有研究显示,在确诊时有高危器官(如肝、脾、骨髓、中枢神经系统等)受累的LCH患者存活率约为77%[42],累及肾脏、肝脏或下呼吸道的RDD患者,预后也较差[11]。过去对ECD的认识不足,3a死亡率高达59%,随着治疗方法的改进和对ECD认识的提高,ECD的预后显著改善,3a死亡率约为20%[37],但高龄和中枢神经系统、肺部和腹膜后等的受累仍是ECD较低存活率的高危因素[12]。对于AOXGD,其死亡风险主要来源于其严重的合并症[36]。
9 小结
眼部组织细胞增生症作为一组罕见的成人及儿童均可发病的异质性疾病,多系统受累者预后不佳且有潜在死亡风险,尽早正确诊断和治疗对预后极为重要。但由于其较为罕见且临床表现多样,临床诊疗仍面临巨大挑战。目前对该病发病机制的研究使得靶向治疗成为了治疗该病的有效方法,但无突变基因的病例仍以手术切除、辅以放、化疗为主,对该部分病例的发病机制和病因研究仍有待探索。现关于眼部组织细胞增生症的研究以个案报道及病例系列报道为主,为建立眼部组织细胞增生症的诊疗规范,还需要大量的相关研究。期待未来能够有更多关于眼部组织细胞增生症的研究并发现更多有效治疗方法,形成规范的诊疗体系,最大程度降低患者死亡风险。
