紫锥菊近三倍体的非整倍体离体扩繁能力分析
2023-09-26李庆玲黎幸莲杨跃生
李庆玲,黎幸莲,戴 倩,杨跃生*
(1.云浮市南药研究院,广东 云浮 527300;2.华南农业大学 生命科学学院,广东 广州 510642)
紫锥菊(Echinacea purpureaL. )为菊科(Asteraceae)紫锥菊属(EchinaceaL.)植物,原产于北美,因具有抗菌、消炎、提升人体免疫力等药用功效而备受市场青睐。同时,紫锥菊又因花色鲜艳,花期长,而广泛用于园艺植物观赏和切花生产。与观赏紫锥菊育种[1]相比,药用成分含量高的药用紫锥菊品种的培育相对滞后,且药用成分含量在紫锥菊新品种审定中是非常重要的指标。倍性育种是一种重要的生物技术育种方法,相对于低倍体,多倍体具有营养器官巨大化和次生代谢产物含量更高等优点。多倍体尤其是三倍体在有性繁殖过程中非常容易产生非整倍体后代[2-3]。非整倍体由于特定染色体的附加或减少会使得位于该染色体上的基因剂量增加或减少,相对于二倍体和四倍体,性状变化具有多样性;同时,非整倍体具有重要的遗传学价值,如探究基因与染色体的关系,确定基因所属的连锁群或染色体臂等。与动物相比,植物对非整倍体具有更强的忍耐力[4],如香豌豆(Lathyrus sativusL.)[5]、苹果属(Malus)[6]和菊科植物[7]等的非整倍体均可以健壮生长并作为遗传研究材料或者种质资源在育种上应用,这使得植物的繁殖方式更加多样化,通过大量培育具有不同染色体数目和构成的非整倍体材料以达到繁育的目标。
云浮市南药研究院/华南农业大学杨跃生研究员课题组从2003年开始从事紫锥菊倍性育种研究,相继成功培育出单倍体[8]、四倍体[9]、三倍体、六倍体[10]、和八倍体[11]等植株。相对于二倍体,四倍体表现出更粗壮的植株长势和更高的药用物质含量[12-13]。紫锥菊多倍体,尤其是三倍体与二倍体自然杂交授粉产生大量非整倍体后代,Li等[3]在比对二、三倍体杂交后代的21个非整倍体株系时发现,13个株系的全株菊苣酸含量高于二、三倍体亲本,其中有5个株系的全株菊苣酸含量接近二、三倍体亲本的2倍以上;有14个非整倍体株系的全株绿原酸含量高于二、三倍体亲本,其中有1个株系的全株绿原酸含量接近二、三倍体亲本的5倍。紫锥菊四倍体也被报道过含有更高的菊苣酸和绿原酸含量[12-14],但还没有达到非整倍体的增长幅度。
因非整倍体育性降低,不能正常进行有性生殖,必须通过无性扩繁的方式进行繁殖。本课题组在二、四倍体杂交过程中发现了接近三倍体的非整倍体株系,通过对其中4个非整倍体株系(染色体数目分别为31、32、32和34条,分别命名为CN31、CN32-1、CN32-2、CN34)系统性地开展离体扩繁能力研究,以期为后续选育和批量繁殖优良非整倍体株系提供参考。
1 材料与方法
1.1 外植体制备及接种方式
1.1.1 不定芽诱导 切取无菌克隆苗的叶片、叶柄和根作为外植体。叶片切成0.5 cm×0.5 cm的小方块,叶柄和根均切成0.7 cm的长度。外植体接种时,以叶片的上表面接触培养基,叶柄和根外植体则随机平放在培养基上并稍加按压使其与培养基紧密接触。每个培养瓶接种7个外植体,每个处理设6次重复。
1.1.2 不定芽生根 将高约2 cm,生长状态正常,至少有2片展开叶的不定芽接种至生根培养基上,30 d后观察并统计根系形成情况。
1.2 培养基配制
在培养基中添加了试验剂量的激素、非激素等成分后,另外添加30 g/L蔗糖、7 g/L琼脂、0.1 g/L肌醇,用透气性好的塑料瓶分装,每个培养瓶分装约40 mL;所有培养基pH值调至6.0,于121 ℃、100 kPa湿热灭菌15 min。
1.3 培养条件
不定芽诱导、不定芽生根试验均在(25±2)℃的恒温培养室中进行,正常光照时间约12 h/d,光强约2000 lx。
1.4 数据统计
紫锥菊在不定芽诱导过程中会产生玻璃化不定芽,这类不定芽不能正常生根,且随着时间的延长会逐渐褐化死亡,为无效芽。因此,本研究在不定芽诱导过程中只统计每个外植体诱导的有效不定芽数,每个培养瓶取平均值。试验数据采用SPSS 17.0数据处理系统和Excel 2010软件进行统计分析,采用Duncan’s法检验各处理间的差异显著性。
2 结果与分析
2.1 激素对紫锥菊非整倍体有效不定芽诱导的影响
2.1.1 BA BA是一种最常用的植物细胞分裂素,对紫锥菊不定芽诱导有良好的刺激作用。4个非整倍体株系叶片、叶柄和根外植体诱导的不定芽分化情况如图1所示。直观上看,CN31不定芽数最多,诱导效果最好,且4个非整倍体株系叶片的诱导效果优于叶柄和根外植体的。

图1 4个紫锥菊非整倍体株系叶片、叶柄和根外植体的不定芽诱导情况
本研究设定的BA质量浓度分别为0.1、0.2、0.4、0.8、1.6 mg/L,在一定的范围内,随BA质量浓度递增,4个非整倍体株系诱导的有效不定芽数递增,不同非整倍体株系及其不同的外植体对BA的敏感度不同(表1)。当CN31的叶片在添加0.8 mg/L BA培养基中诱导时,其有效不定芽数最多,为1.96个;在添加0.4 mg/L BA培养基中的诱导效果次之,但两者差异不显著;叶柄和根的最适BA质量浓度为0.4 mg/L,此时有效不定芽数分别为1.38个和2.04个。CN32-1叶片外植体不定芽诱导的最适BA质量浓度为0.4 mg/L,叶柄、根的分别为0.1、0.2 mg/L;叶柄外植体的有效不定芽数高于叶片和根的。CN32-2的叶片、叶柄、根外植体的最适BA浓度分别为0.8、0.4和0.4 mg/L,不定芽诱导率整体较低。CN34的叶片和叶柄外植体在添加0.4 mg/L BA时,有效不定芽数最多,分别为1.13、1.03个;根在添加0.2 mg/L BA时有效不定芽数最多,但也只有0.53个。综上,取0.4 mg/L BA对4个非整倍体诱导不定芽较为适宜,CN31的不定芽诱导能力优于其他3个株系的。
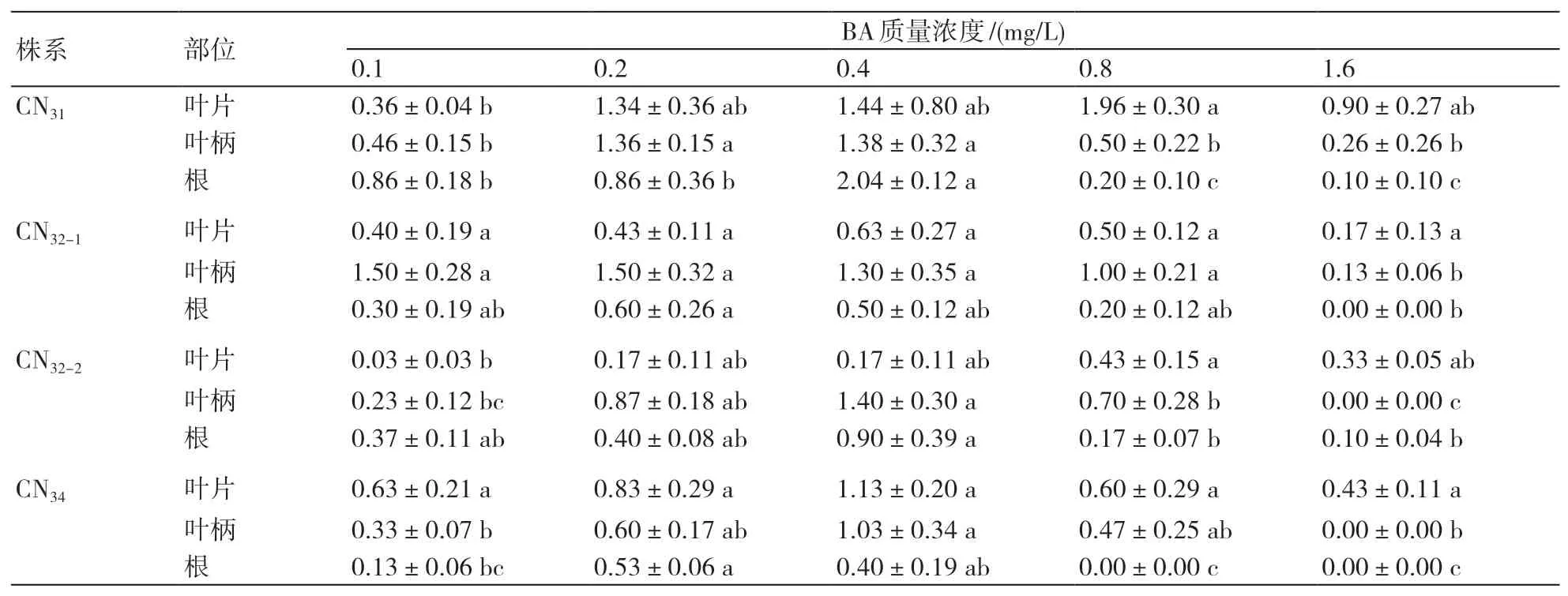
表1 不同BA质量浓度对紫锥菊非整倍体有效不定芽数的影响 个
2.1.2 NAA NAA是一种人工合成的植物生长素,与IAA相比能耐高温、不易降解,因此广泛应用于植物组织培养技术中。本研究设定的NAA质量浓度分别为0(CK)、0.005、0.010、0.015、0.020、0.025和0.030 mg/L,与含0.4 mg/L BA的MS培养基配合使用。由表2可知,NAA显著影响非整倍体紫锥菊不定芽诱导,随NAA质量浓度的升高,紫锥菊不定芽诱导率明显升高,到达高值后诱导率逐渐下降。CN31在添加0.015 mg/L NAA时,叶片、叶柄和根外植体的有效不定芽数均达到最大值,且与其他处理差异明显。CN32-1叶片和根外植体不定芽诱导的最佳NAA质量浓度为0.010 mg/L,而叶柄的为0.015 mg/L。CN32-2和CN34叶片外植体对NAA的耐受性较高,在添加0.025 mg/L NAA时有最多有效不定芽;叶柄和根外植体的最适NAA质量浓度均为0.020 mg/L。综上,CN31诱导的有效不定芽数高于其他3个株系的。
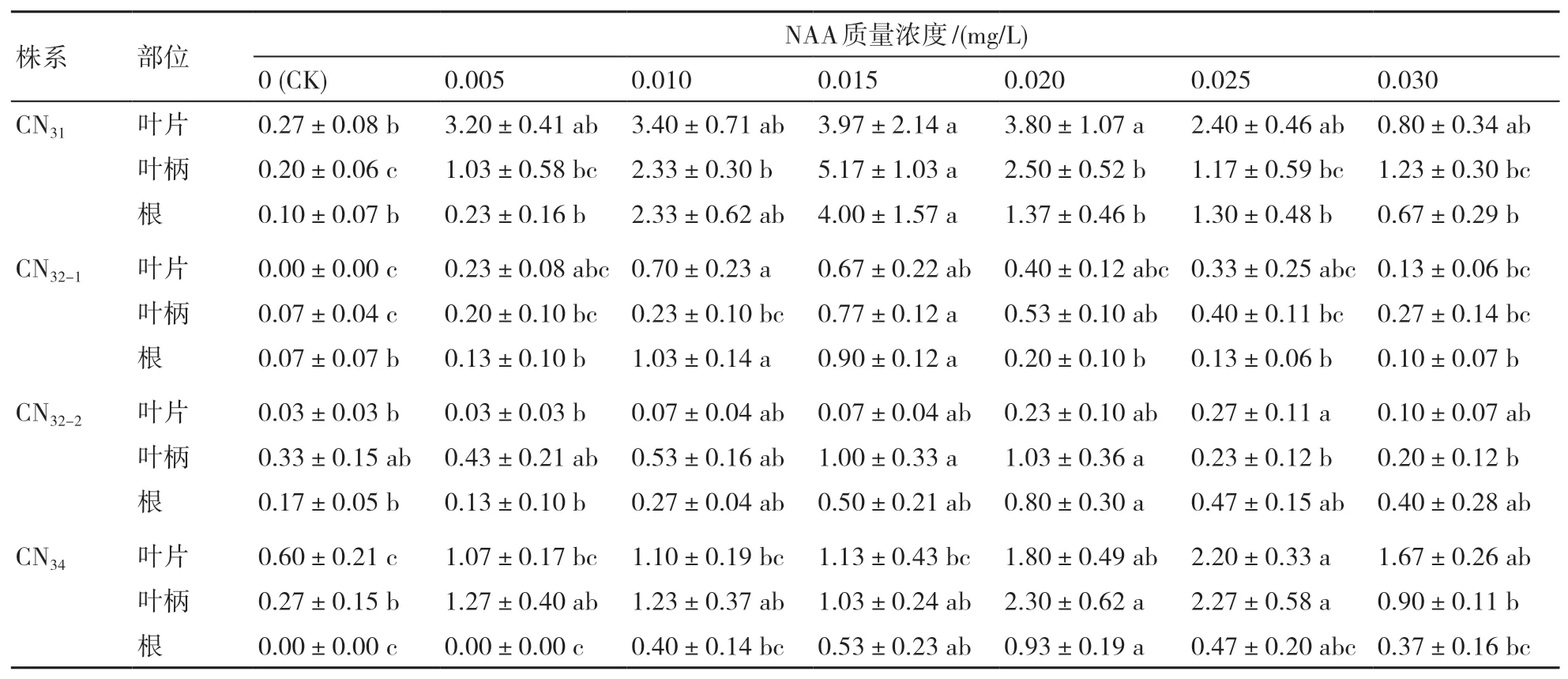
表2 不同NAA质量浓度对紫锥菊非整倍体株系有效不定芽数的影响 个
2.1.3 DA-6 DA-6是一种高效植物生长物质,具有很高的生物活性,对多种农作物具有显著的增产、抗逆、抗病,改善品质、催熟等功效。本研究设置6个DA-6质量浓度:0(CK)、0.02、0.04、0.08、0.16和0.32 mg/L,配合添加了0.01 mg/L NAA、0.4 mg/L BA的MS培养基使用。由表3可知,4个非整倍体株系及其不同外植体对DA-6的敏感程度不同,其中,根对DA-6最为敏感,仅在浓度很低时能促进不定芽再生;叶片的敏感度次之;叶柄则在较高DA-6浓度时才表现出促进作用。CN31叶片和根外植体在0.04 mg/L DA-6时有效不定芽数最高,而叶柄的最佳DA-6质量浓度为0.08 mg/L,平均每个外植体有效不定芽数为3.50个,高于叶片和根外植体的。CN32-1叶片和叶柄的最佳DA-6质量浓度分别为0.08和0.16 mg/L,DA-6对根无明显的促进作用。CN32-2叶片和叶柄外植体分别在添加0.02和0.04 mg/L DA-6时,有效不定芽数最高,对叶柄的促进作用尤其明显,添加0.02 mg/L DA-6对根外植体表现出微弱促进作用,当添加量高于0.02 mg/L时就开始抑制不定芽再生。在添加0.04 mg/L DA-6时,CN34叶片和叶柄外植体有效不定芽数最高,对叶片的促进作用更为明显;添加0.02 mg/L DA-6对根外植体有微弱的促进作用。
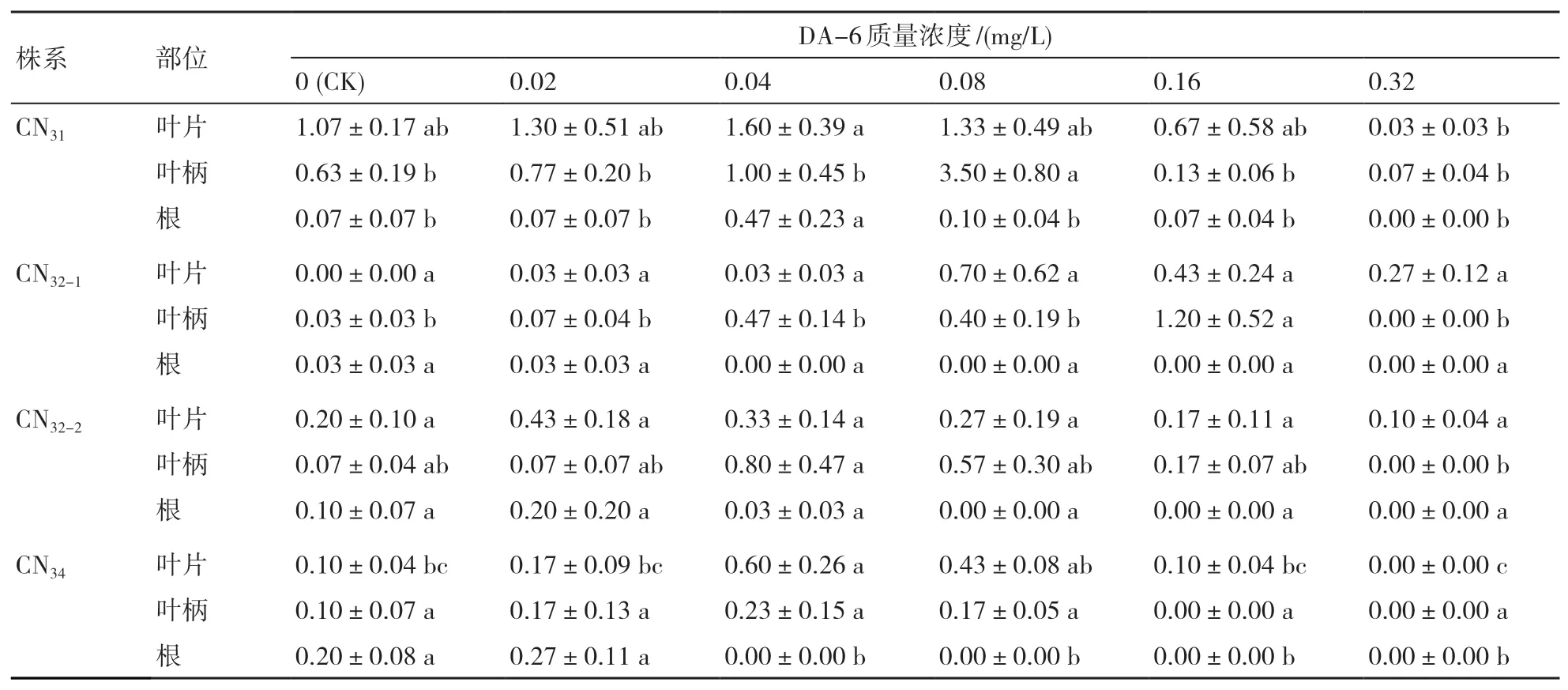
表3 不同DA-6质量浓度对紫锥菊非整倍体植株有效不定芽数量的影响 个
2.2 非激素条件对紫锥菊非整倍体有效不定芽诱导的影响
2.2.1 MS大量元素 大量元素含有丰富的矿质元素,是组培实验室或工厂使用量最大的耗材之一。为探究不同比例的MS大量元素对紫锥菊非整倍体不定芽诱导的影响,本试验设定MS大量元素为标准比例的1/4、1/2、2倍,以标准比例为对照,4个处理分别表示为:1/4MS、1/2MS、MS和2MS。由表4可知,大量元素比例对紫锥菊不同非整倍体有效不定芽诱导的影响有差别,但最适比例是1/2MS和MS。CN31株系的3种外植体在1/2MS和MS培养基中有效不定芽数最多,CN32-1在1/2MS培养基中有效不定芽数量最高,CN32-2的叶片、叶柄在MS培养基中有效不定芽诱导效果最好,CN34在1/2MS培养基中3种外植体的有效不定芽数量均最佳。如果大量元素比例过低,外植体会因为得不到足够的矿质营养而逐渐褐化死亡。
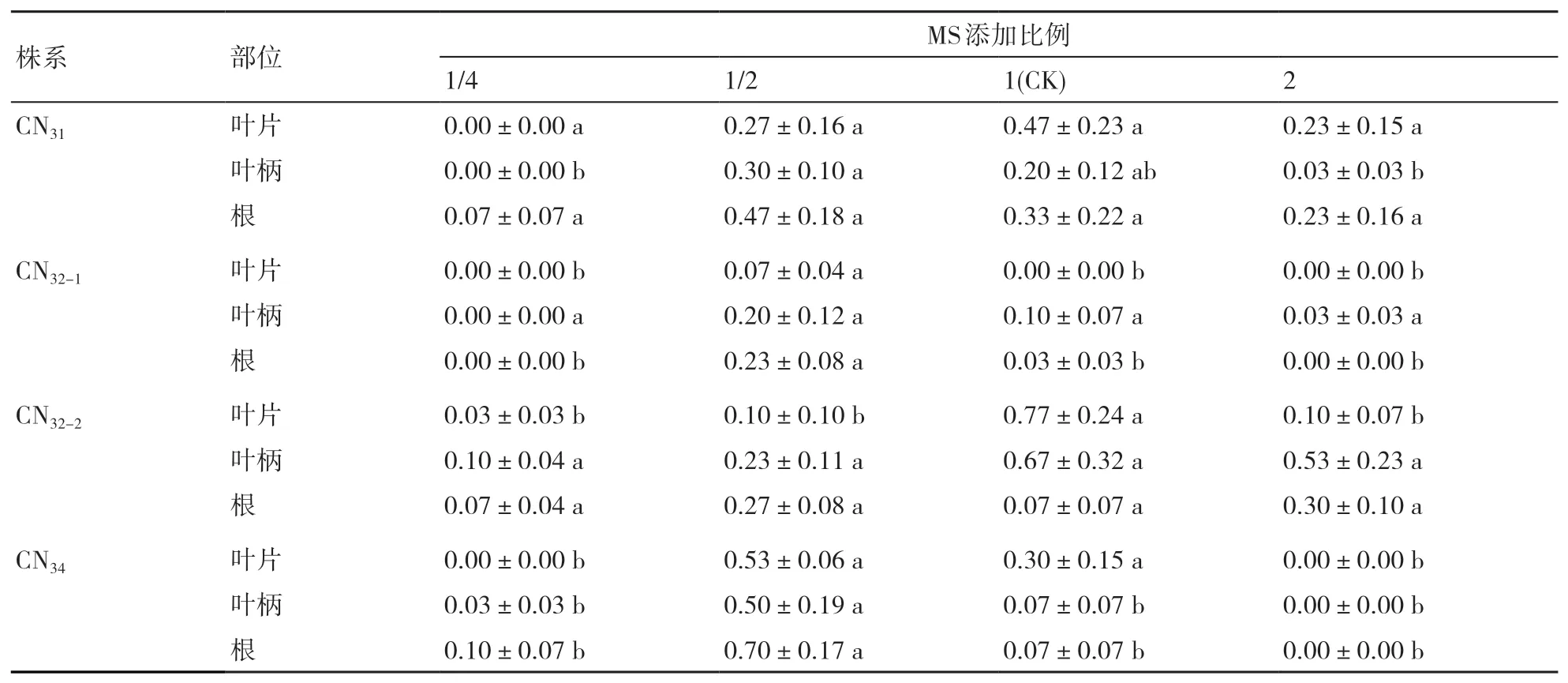
表4 不同MS大量元素比例对紫锥菊非整倍体有效不定芽数量的影响 个
2.2.2 土豆泥 本课题组前期研究发现在培养基中添加土豆泥可以减轻玻璃化现象,能提高有效不定芽数量。为进一步优化土豆泥的添加比例,本研究设置5个添加剂量:0(CK)、2.5%、5.0%、7.5%和10.0%(质量分数),均配合添加0.01 mg/L NAA、0.4 mg/L BA的MS培养基。由表5可知,CN31本身玻璃化严重,在添加2.5%土豆泥时3种外植体有效不定芽数量最多,但当添加量超过2.5%时就出现显著的抑制作用。CN31-2自身玻璃化不严重,在添加土豆泥后3种外植体表现不一:叶片对土豆泥不敏感,叶柄在添加5.0%土豆泥时有效不定芽数量最高,根在添加2.5%土豆泥时有效不定芽数最高。添加5.0%的土豆泥能促进CN32-2叶片和叶柄外植体的有效不定芽诱导,对根外植体的促进作用不明显。CN34本身玻璃化不严重,添加2.5%的土豆泥就能促进有效不定芽诱导,添加太多反而起到抑制作用。因此,针对玻璃化严重的株系,在培养过程中添加适当比例的土豆泥能有效抑制玻璃化,提高有效不定芽比例;玻璃化不严重的株系不必添加土豆泥。
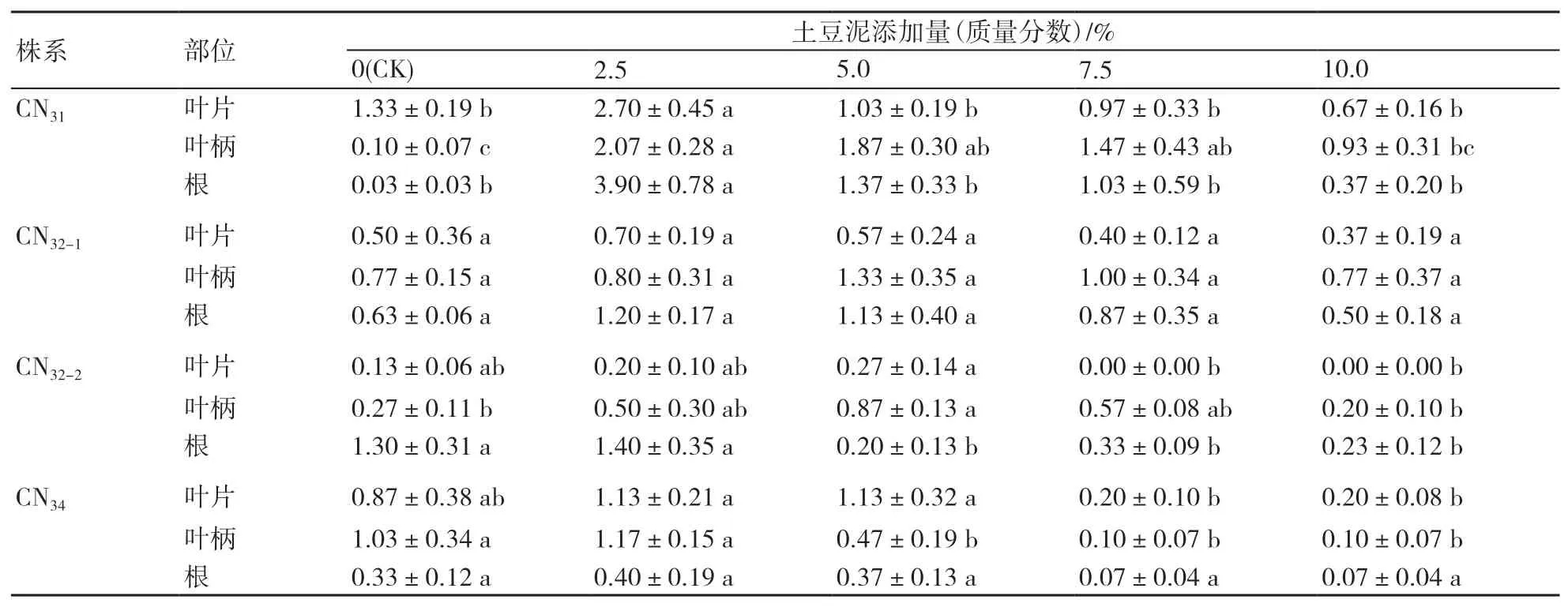
表5 不同土豆泥含量对紫锥菊非整倍体有效不定芽数的影响 个
2.2.3 光暗条件 光照是影响植物生长的重要因素。将4个非整倍体株系的叶片、叶柄和根外植体接种在含0.4 mg/L BA、0.01 mg/L NAA的MS培养基中,分为2组:一组放置于完全黑暗条件下培养2周后转置正常光照培养,另一组一直置于正常光照下培养。由表6可知,短暂的暗培养可以有效提升叶片、叶柄和根外植体的有效不定芽诱导能力,但对不同非整倍体株系的提升效果不一致,对CN31的提升效果更为明显。该结果与本课题组早期在二倍体上的研究结果一致。
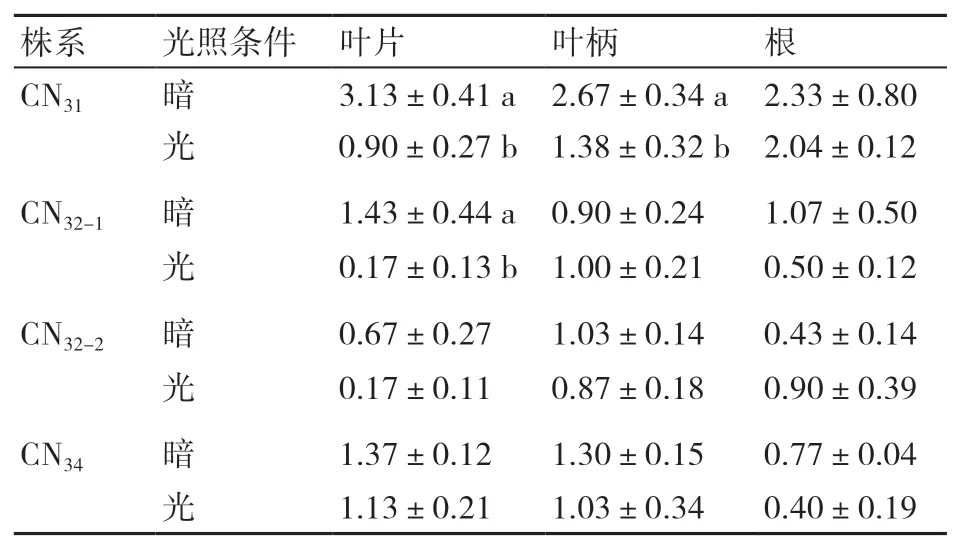
表6 光照条件对紫锥菊非整倍体有效不定芽数的影响 个
2.3 NAA对紫锥菊非整倍体生根的影响
本课题组前期研究发现,在诱导紫锥菊的不定芽生根时,NAA比IBA有更好的诱导能力,本试验设定5个NAA质量浓度:0(CK)、0.01、0.03、0.05和0.08 mg/L。由图2可知,4个非整倍体株系在不含或含较低质量浓度NAA时,植株长势较差,根细,次根很少。随着NAA质量浓度的升高,地上部分随地下部分的生长而生长,根明显表现出紫红色。CN31在添加0.05 mg/L NAA时,植株整体长势较好;CN32-1的主根数在添加0.08 mg/L NAA时最多,根直径最粗,考虑地上部分长势,生根时选择添加0.05 mg/L NAA;CN32-2根粗随NAA质量浓度的升高而增加,最优的生根浓度仍为0.05 mg/L NAA;CN34在0.08 mg/L NAA时整体表现出最佳的生长状态。
3 讨论
本研究4个非整倍体株系不同外植体的有效不定芽诱导能力差异较大,整体来讲,诱导率整体不高,还需要继续改良培养基配方[15-17],以提升繁殖能力。目前,紫锥菊的无性扩繁体系已经建立成熟[10,18],可以满足非整倍体繁殖的要求。无菌克隆苗的表型性状直接决定移栽到室外环境时的成活率,本研究4个非整倍体株系的无菌苗根系发达,地上部分舒展,均可正常移栽到室外种植。Li等[3]在前期21个非整倍体株系研究发现,每一个非整倍体株系都有其特定的核型特征,即使有与亲本相同的染色体类型(m、sm、st),但是每种染色体类型占据的比例却截然不同,另外有少数非整倍体的个别染色体出现了极度缩短的变异;另外,非整倍体还可能会发生染色体缺失/复制/易位、基因组变化和基因表达紊乱等变异[19-20],所有的这些染色体变异都会引起非整倍体的性状多样性[2]。紫锥菊非整倍体所有有关染色体的变异还需要通过核型分析和荧光原位杂交技术等更准确的分析方法进行验证,以明确非整倍体具体的染色体构成[21-22]。
4 结论
BA和NAA是组织培养过程中不定芽诱导的主要决定因素。4个非整倍体株系及3种外植体对BA、NAA的敏感度不同,CN31的3种外植体的有效不定芽诱导能力优于其他3个非整倍体株系的。DA-6对4个非整倍体株系3种外植体有效不定芽诱导能力的提升作用不明显。大量元素含有丰富的矿质元素,4个非整倍体株系的3种外植体在1/2MS或MS培养基中会诱导出较多的有效不定芽。针对玻璃化严重又很重要的株系,在培养过程中添加适当比例的土豆泥能有效抑制玻璃化,提高有效不定芽比例;玻璃化不严重的株系则不必添加土豆泥。短暂的暗培养可以有效提升叶片、叶柄和根外植体的有效不定芽诱导能力,对CN31的提升效果更为明显。4个非整倍体株系在添加0.05或0.08 mg/L NAA时的根系更发达,整体表现出最佳生长状态。
