AlH3配合物研究进展
2023-09-26崔中昱夏德斌林凯峰杨玉林
崔中昱,夏德斌,林凯峰,张 健,杨玉林
(哈尔滨工业大学化工与化学学院, 黑龙江 哈尔滨 150001)
0 引 言
含能材料是能够在短时间内释放大量能量并能够对外做功的化合物或混合物。诸如推进剂、炸药等含能材料已经在军事和民用上得到了广泛的应用。为满足精确打击、高效毁伤能力等现代武器的要求,黑索今(RDX)[1]、奥克托今(HMX)[2]、六硝基六氮杂异伍兹烷(CL-20)[3]等具有高能量密度的新型含能材料已被应用于固体火箭推进剂中。近年来,三氢化铝(AlH3)因其具有极高的能量密度和优秀的储氢能力被各界学者广泛关注。其在燃烧过程中释放大量的能量,同时产生 的H2、H2O 等气态产物能提高发动机的比冲[4-5]。在端羟基聚丁二烯/高氯酸铵/铝粉(HTPB/AP/Al)体系中,若将Al 粉替换为α-AlH3,可以明显降低绝热火焰温 度(1 MPa 空 气 条 件 下,α-AlH3为3310 K,Al 为3912 K),比冲增加接近25 s,且侵蚀性气体排放量更低,减少了对发动机喷管的侵蚀[6-7]。
AlH3是共价金属氢化物,其质量储氢量为10.1%,体积储氢量为148 kg·m-3,具有极为优秀的储氢能力。目前AlH3已被发现7 种晶型结构,分别为α、α′、β、γ、δ、ε和ζ晶相,其中α相最为稳定,在150 ℃左右分解为H2和Al。AlH3的标准摩尔生成焓(ΔfHθm)为-11.8 kJ·mol-1,绝对熵(S0)为30.0 kJ·mol-1·℃-1,标准生成摩尔吉布斯自由能(ΔfGmθ)为45.4 kJ·mol-1[8]。AlH3溶于乙醚和四氢呋喃,对水不稳定且易被空气氧化,是一种热力学不稳定而动力学稳定的物质。
AlH3的合成方法主要有液相合成法[9-11]、机械球磨法[12-14]、直接氢化法[15-16]、超临界合成法[17]和电化学合成法[18]。目前液相合成法和机械球磨法已经能够实现小批量生产。其中液相合成法的发展历史最为悠久,通过控制转晶温度和加入结晶促进剂的方法,能够得到晶体结构较好的α-AlH3[10]。虽然液相合成法合成AlH3已经趋于完善和成熟,但该法存在着安全性低、消耗大量溶剂、后处理复杂等缺点,很难实现大规模的工业化生产。
转晶是AlH3液相合成法中最危险的步骤。转晶时,其他稳定性较差的杂相会随着稳定的α相同时结晶[9-10],杂相的分解会放出H2和大量的热,从而引燃作为转晶母液的有机溶剂,酿成安全事故。解决安全隐患的根本方法是采用其他工艺代替转晶操作实现AlH3的稳定化。AlH3结构具有缺电子性质,能够与电子供体配位,得到动力学与热力学稳定的AlH3配合物。同时,与通过分子间氢桥键链接形成仅动力学稳定的AlH3晶体的转晶工艺相比,AlH3的配位无疑具有更高的工艺安全性。且AlH3配合物的配体具有可调节性,通过分子设计有望实现储存稳定性好且能量密度高的配合物合成,具有广阔的应用前景。
1 AlH3配合物合成方法
首个AlH3配合物的合成源于对(AlH3)x是否存在的探索性研究。1942 年,Stecher和Wiberg[19]在尝试制备AlH3时意外合成了三甲胺(TMA)配合物AlH3·nTMA(n=1,2),但其纯度和产率均很低。经过几十年的研究,AlH3配合物的合成方法逐渐完善,广泛应用的合成方法主要有复分解法和配体交换法。
1.1 复分解法
1947 年,Finholt等[20]采用LiAlH4与AlCl3的复分解反应,在乙醚(Et2O)中首次实现了配合物AlH3·nEt2O的制备。具体方案为:在N2保护的条件下,使LiAlH4和AlCl3在乙醚中反应,过滤除去LiCl,得到了AlH3·nEt2O的乙醚溶液。溶液经自发沉降一段时间后,得到白色固体AlH3·nEt2O。该法具有反应速度快、副产物LiCl易除去的优点,开创了复分解法制备AlH3配合物的先河。
目前复分解法制备AlH3配合物主要有3 种方法(Scheme 1):a) LiAlH4与AlCl3发生复分解反应,在配体分子(L)的存在下,得到AlH3配合物[20-22];b) HCl(或H2SO4)代替AlCl3与LiAlH4发生复分解反应,制备AlH3配合物[23-25];c) LiAlH4与配体盐酸盐发生复分解反应,直接生成AlH3配合物[26-28]。由于干HCl 和无水H2SO4制备与保存条件较为苛刻,难以应用于大规模的工业生产。但配体的盐酸盐制备较为方便,储存稳定性好,因此配体盐酸盐复分解法应用较为广泛,具有良好的工业化前景。
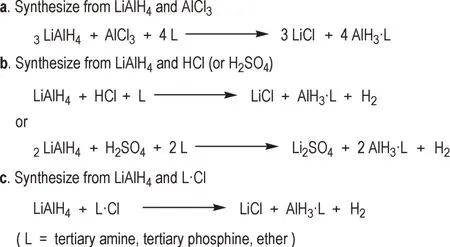
Scheme 1 Syntheses of AlH3 complexes by double decomposition method
复分解法制备配合物范围广泛,经由此法可得到醚[20,24]、叔胺[29-30]、叔膦[23,31]的AlH3配合物,但卡宾的AlH3配合物尚未通过此法制得。
1.2 配体交换法
配体交换法一般是以乙醚配合物(AlH3·nEt2O)或三甲胺配合物(AlH3·TMA)为前体,经过配体交换反应,制备目标配体的AlH3配合物(Scheme 2)。一般步骤为:在N2保护的条件下,将目标配体加入到前体溶液中,一定时间后,反应液经浓缩得到目标配体的AlH3配合物固体。
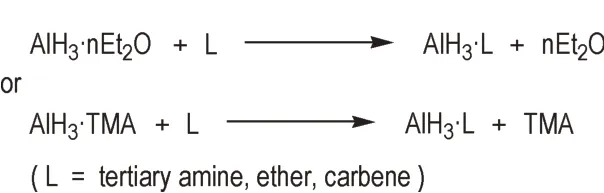
Scheme 2 Syntheses of AlH3 complexes by ligand exchange method
该方法广泛应用于各种AlH3胺配合物的制备,且是目前唯一能够得到AlH3卡宾配合物[32-34]的方法。但由于叔膦与AlH3的相互作用较弱,通过AlH3·TMA的配体交换,无法得到叔膦的AlH3配合物,产物为三甲胺和叔膦混合配体配合物[23,35]。此外,配体交换法的前体是AlH3·nEt2O 或AlH3·TMA,空气稳定性较差,具有一定的危险性。
1.3 其他合成方法
Ashby[36]首 次 提 出 了 以 活 性Al 粉 和H2为 原 料 制备AlH3配合物的铝粉氢化法(Scheme 3)。在70 ℃和35 MPa的条件下,活性铝粉与H2在三乙烯二胺(TEDA)的四氢呋喃溶液中反应6 h,得到浅灰色固体,经元素分析确定该固体中含有AlH3·TEDA。Qrtmeyer 等[37]对铝粉氢化工艺进行改良,在室温和10 MPa 的条件下,将活性Al 粉与TEDA 在H2气氛中球磨,得到纯度较高的AlH3·TEDA,大大降低反应的温度和压力,进一步提高了工艺的安全性。
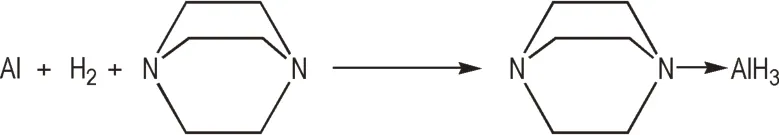
Scheme 3 Synthesis of AlH3·TEDA by hydrogenation of aluminum powder
Marlett 等[38]将LiAlH4与叔胺在甲苯中直接反应,成功制备了二甲基乙胺(DMEA)和N-甲基吡咯烷(NMPy)的AlH3配合物(Scheme 4)。但该法只适用于部分AlH3叔胺配合物的制备,若选用三乙胺为配体,则不能得到AlH3的三乙胺(TEA)配合物(AlH3·TEA),产物为LiAlH4的三乙胺配合物(LiAlH4·TEA)。
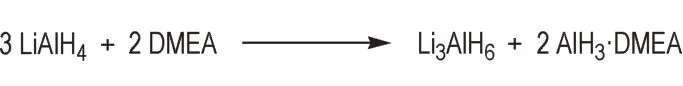
Scheme 4 Synthesis of AlH3·DMEA directly from LiAlH4
2 AlH3配位规律
AlH3是电子不饱和平面结构分子,是一种Lewis酸,可以与电子供体Lewis 碱相互作用,形成以Al 为中心、配位数为4 或5 的AlH3配合物。常见的Lewis 碱配 体 有:胺[19,39-41]、膦[23,31,35]、卡宾[32-34]、醚[10,24]等化合物。
2.1 配体的配位方式
目前,AlH3配合物采取多种配位模式已被证实。按配位单元结构中AlH3与配体的比例可以分为1∶1配合物(AlH3·L)和1∶2 配合物(AlH3·2L)。
1∶1 配合物常见的配位模式主要有2 种,单体体系通常采取以Al 为中心、配位数为4 的四面体构型(图1a);二聚体体系则是2 个四配位单体以氢桥键(H→Al—H)连接形成的二聚体为结构单元(图1b)。单 体 体 系 的 配 体 有 奎 宁 环(QUIN)[35]、三 正 丁 胺(TBA)[42]、三 环 己 基 膦(TCP)[31]、三 叔 丁 基 膦(TTBP)[23]等。二聚体体系的配体有TMA[39-40]、三烯丙基胺(TAA)[26]、1-甲基四氢吡啶(MTHP)[27]、4-二甲氨基吡啶(DMAP)[28]等。
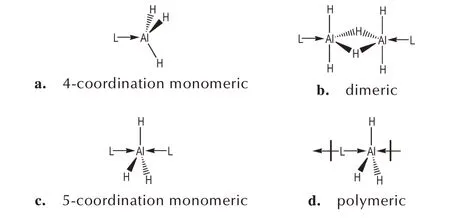
图1 AlH3配合物的配位体系Fig.1 Coordination systems of AlH3 complexes
1∶2 配合物通常采取以Al 为中心、配位数为5 的三角双锥构型的单体体系(图1c),配合物中1 个Al 与3 个H 均在同一个面上,即三角双锥的赤道面。该体系的配合物非常少见,目前发现的有QUIN[41]、TMA[43]和四氢呋喃(THF)[24]配合物。此外,一些混合配体也采用5 配位单体模式进行配位[23,35]。
当与AlH3配位的是多齿配体时,则有可能形成特殊的聚合物体系(图1d),如N,N,N′,N′-四甲基乙二胺(TMEDA)[44]、N,N,N′,N′-四 甲 基-1,3-丙 二 胺(TMPDA)[45]、1,2-双(二 异 丙 基 膦 基)乙 烷(DIPE)[31]等。
2.2 配体碱性对结构的影响
Humphries 等[46-47]用配体的pKa值近似表达其碱度,对AlH3配合物的结构和性质进行了预测。如果胺配体的pKa值低于9.76,就会形成1∶1 的二聚体,如果高于10.59,则会形成单体。他们认为,一个碱性强的胺能够满足AlH3的Al 中心对电子需求,并且能够形成稳定的单体配合物。然而,随着胺的pKa值的降低,胺提供的电子密度不能完全满足缺电子的Al 中心,从而通过形成桥接Al─H 键的二聚体提供额外的电子密度来稳定配合物。但体积较大的配体因空间位阻等因素,在结构上更倾向于形成单体体系。此外,他们还研究了1∶1 配合物和1∶2 配合物热学性能差异。对单体体系而言,1∶1 配合物的熔点比1∶2 配合物低,而聚合物体系具有最高的熔点。AlH3配合物的分解温度随配体的pKa值的减小而降低[46-47]。
对于含能材料而言,良好稳定性是AlH3配合物应用的前提。配体的碱度越强,AlH3配合物的稳定性越好,同时配位体系与空间位阻对配合物的稳定性有显著贡献。因此开发碱度较强配体的聚合物体系AlH3配合物更具有实际应用价值。
3 AlH3配合物结构及性能
AlH3的化学性质非常活泼,室温下在空气中会缓慢分解释氢,能够与含有活泼氢的有机分子(醇、酚、伯胺、仲胺等[48-50])反应生成金属化产物。因此,这里只讨论能够保留AlH3结构的配合物。
3.1 叔胺配合物
胺是含有C、H、N 3 种元素的有机化合物,N 原子上有1 对孤对电子,是常见的Lewis 碱,经常被作为碱性催化剂用于各种有机化学反应。胺的Lewis 碱性较强,能够与AlH3形成诸多稳定的配合物。目前研究工作主要集中在含sp3杂化N 原子的胺配合物,而碱性相对较弱的sp2杂化N 原子的胺配合物研究较少。
一般情况下,胺配合物的配体是不含有活泼氢的叔胺(即分子内没有N─H 键)配体,含有活泼氢的胺(即伯胺、仲胺)会与AlH3反应失去H2,形成胺的金属化产物[48,50]。但一些大分子仲胺,因具有较大的空间位阻,能够形成稳定的AlH3仲胺配合物。例如,2,2,6,6-四甲基哌啶(TMP)与AlH3能够形成稳定的仲胺配合物[51],其分解温度高达115 ℃。图2 为AlH3·TMP 的分子结构图,对该配合物的晶体学研究表明N─Hδ+…δ-H─Al基团间,Hδ+…δ-H 的间距为2.31 Å,达到了氢分子的范德华极限,即氢分子消除的临界过渡态。同理,六甲基二硅氮烷(HMDS)与AlH3的仲胺配合物也有着显著的稳定性[52],在甲苯中沸点为90 ℃。
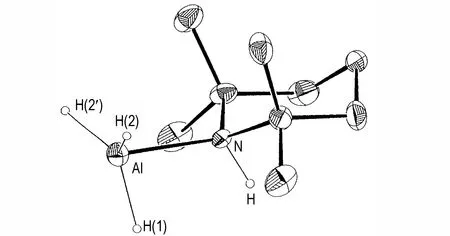
图2 AlH3·TMP 的分子结构图[51]Fig.2 Molecule structure of AlH3·TMP[51]
叔胺是常见的有机配体,根据分子中N 原子数量不同,可以分为能够提供1 个配位键的单齿配体和提供多个配位键的多齿配体。
3.1.1 单齿叔胺配合物
在众多的配合物中,三甲胺(TMA)配合物是人们研究最早,也是研究最充分的配合物之一。早在1942年,Stecher 和Wiberg[19]已经成功制备了AlH3·2TMA。对三甲胺配合物的进一步研究表明,TMA 与AlH3能够得到2 种化学计量比(1∶1 和1∶2)的配合物[39-40]。晶体学研究证实,AlH3·TMA 采取二聚体的配位模式(图3a)[29],而AlH3·2TMA 采取5 配位单体的配位模式(图3b)[43]。AlH3·TMA 与AlH3·2TMA 的熔点分别为76 ℃和95 ℃[39],由于具有线性N─Al─N 骨架的1∶2 配合物具有更高的对称性,能够更有效地堆积,因而AlH3·2TMA 的熔点更高[46]。
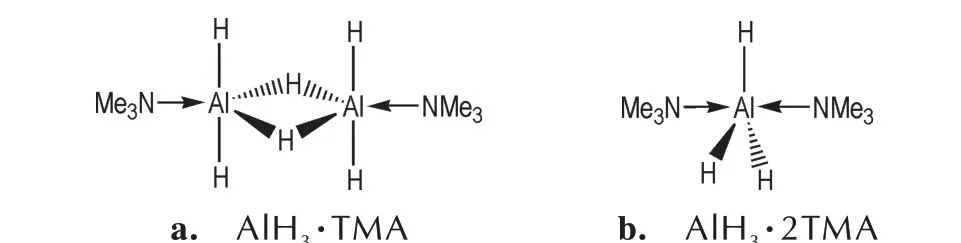
图3 AlH3·TMA 和AlH3·2TMA 的结构式Fig.3 Structural formulas of AlH3·TMA and AlH3·2TMA
与TMA 的配合物相比,二甲基乙胺(DMEA)和三乙胺(TEA)的配合物的熔点相对低很多,3 种配合物的熔点顺序为:AlH3·TMA(76 ℃)>AlH3·TEA(18.0 ℃)>AlH3·DMEA(3.2 ℃)[46]。AlH3·DMEA 的 分 子 对 称性较低,妨碍了其在固态下的有效堆积[21],因而熔点最低。AlH3·TEA 的熔点低于AlH3·TMA,这是由于乙基的自由度较高,AlH3·TEA 晶体排列相对无序的缘故[47]。
奎宁环(QUIN)与TMA 相类似,与AlH3配位后得到2 种化学计量比分别为1∶1 和1∶2 的配合物。AlH3·QUIN 采取4 配位单体的配位模式(图4a)[35],而AlH3·2QUIN 则采取二聚体的配位模式(图4b)[41]。与TMA 相比,QUIN 具有更强的碱性,因而QUIN 的2种配合物具有比TMA 配合物更高的熔点(AlH3·QUIN 熔点:108 ℃;AlH3·2QUIN 熔点:175 ℃)[53],其中AlH3·QUIN 的分解温度为165 ℃[35]。
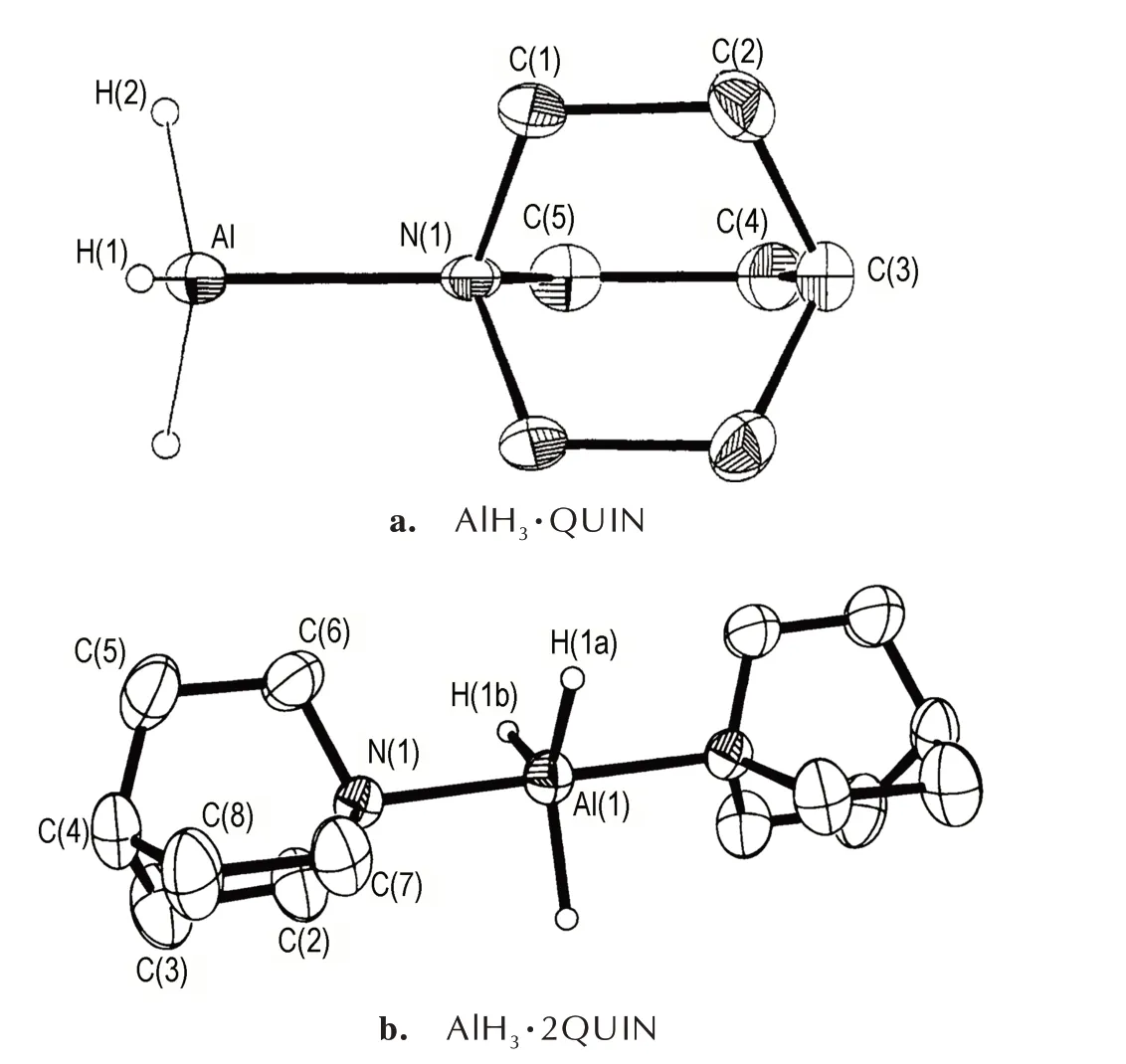
图4 AlH3·QUIN 和AlH3·2QUIN 的分子结构图[35,41]Fig.4 Molecule structures of AlH3·QUIN and AlH3·2QUIN[35,41]
N-烷基吡咯烷和N-烷基哌啶的碱性适中(比TMA 强,但比QUIN 弱),分子具有较大的偶极,二者与AlH3的配合物在常温下为液态,在空气中缓慢分解,在低温条件下(<0 ℃)具有较好的储存稳定性。Li等[22]的研究表明,N-甲基吡咯烷(NMPy)与AlH3的配合物具有2 种化学计量比(1∶1 和1∶2),原料LiAlH4与NMPy 比例略高于3∶4 时得到AlH3·NMPy,比例略高于3∶8 时 得 到AlH3·2NMPy。Ni 等[54]发 现,无 论LiAlH4与N-乙基吡咯烷(NEPy)的比例如何,只能得到配合物AlH3·NEPy。Veith 等[55]以AlH3·nEt2O 和N-甲基哌啶(NMPi)为原料成功制备了AlH3·NMPi,并通过单晶X 射线衍射确定了其为二聚体配位体系。
4-二甲氨基吡啶(DMAP)是一种常见的碱催化剂,4 号位上二甲氨基的N 原子与吡啶环间有较强的p-π共轭作用,N 上的孤电子对不易给出,因此sp2杂化的吡啶N 原子给出孤电子对与AlH3配位。AlH3·DMAP采取二聚体配位模式(图5),配合物有2 个共振式(Scheme 5),其中Ⅱ式能够有效分散电荷,因此AlH3·DMAP 的稳定较好,分解温度为102 ℃[28]。
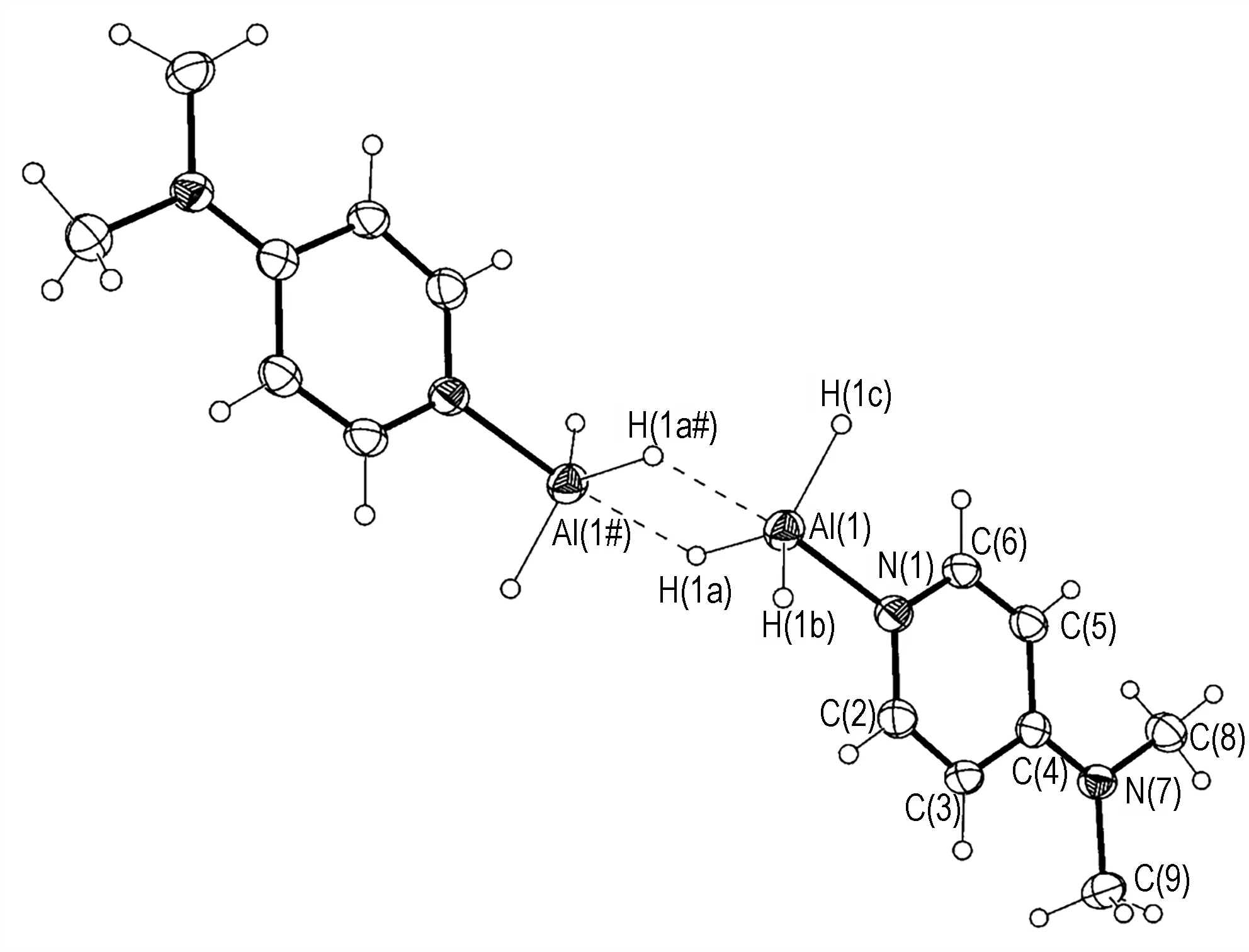
图5 AlH3·DMAP 的分子结构图[28]Fig.5 Molecule structure of AlH3·DMAP[28]
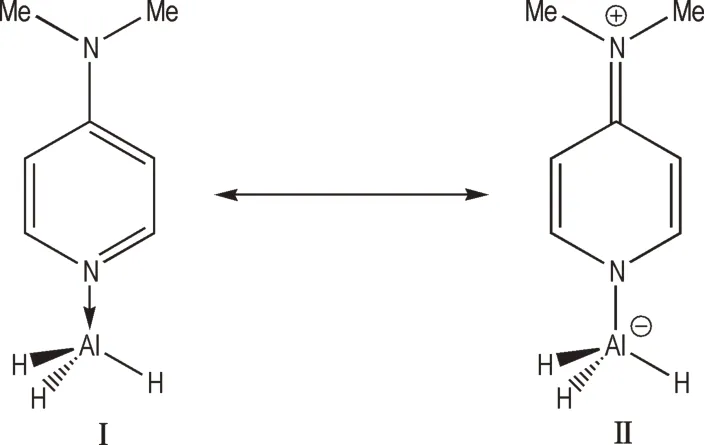
Scheme 5 Resonance structural formula of AlH3·DMAP[28]
随着对AlH3叔胺配合物应用的探索,越来越多的叔胺配合物被制备出来并尝试应用于化学气相沉积、储能、AlH3再生等领域中,这些化合物的结构也不断被单晶X 射线衍射所证实[27,30,42,55-56]。
3.1.2 多齿叔胺配合物
分子结构中具有2 个及以上N 原子的多齿Lewis碱配合物,因其具有独有的聚合物配位体系,而显示出更 高 的 稳 定 性。Davidson 和Wartik[57]采 用2 种 方 法首次合成N,N,N′,N′-四甲基乙二胺(TMEDA)配合物AlH3·TMEDA,并发现与其他AlH3配合物相比,该配合物具有更高的蒸气压。因此,他们认为AlH3·TMEDA是以氢键桥接的6 配位二聚体形式存在(图6a)。1965 年,Archie 等[58]推翻了前者的氢桥二聚体结构,提出了叔胺桥接的5 配位环状聚合物结构模型(图6b)。同时他们合成了N,N,N′,N′-四甲基丙二胺(TMPDA)配合物AlH3·TMPDA,并通过AlH3·TMPDA 的苯溶液红外光谱数据,证明了该结构的真实性。
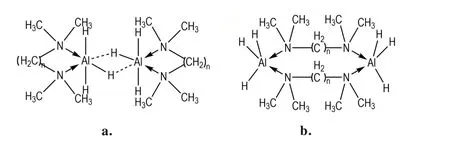
图6 AlH3·TMEDA 的结构式Fig.6 Structural formulas of AlH3·TMEDA
Palenik[44]采用单晶X射线衍射确定了AlH3·TMEDA的晶体结构。AlH3·TMEDA 为无色针状晶体,空间群为P212121。TMEDA 的N 原子与AlH3的Al 原子配位,形成链状聚合物体系。其中TMEDA 采取反式构型与AlH3配 位,AlH3的3 个H 原 子 位 于 赤 道 面。同 样,AlH3·TMPDA 也采取聚合物配位模式[45]。因聚合物配位模式的特殊稳定性,AlH3·TMEDA 和AlH3·TMPDA的熔点均高于135 ℃[46],而其同系物N,N,N′,N′-四甲基亚甲二胺(TMMDA)的AlH3配合物因采取单体螯合模式,熔点只有25 ℃[59]。
为探究由Al 加氢制备AlH3的可能性,Ashby[36]发现在三乙烯二胺(TEDA)的存在下,Al与H2在中等温度和压力下能够生成配合物AlH3·TEDA。该物质具有极高的稳定性,200 ℃以上也可以稳定存在。Ortmeyer等[37]采用配体交换法和铝粉氢化法同样合成了AlH3·TEDA,并对其性质进行研究。通过粉末XRD 模拟计算得,AlH3·TEDA 的空间群为Cmcm,配合物采取聚合物配位模式,晶体中AlH3与TEDA 交错排列。进一步的TGA-DSC-MS 测试表明,AlH3·TEDA 的分解温度为229 ℃。
1,3,5-三甲基六氢-1,3,5-三嗪(TMTZ)是一种三齿叔胺,但其与AlH3配位时只有2 个配位位点[45]。通过调节反应物AlH3·TMA 与TMTZ 的比例,可以合成化学计量比为1∶1 的配合物AlH3·TMTZ 和1∶2 的配合 物AlH3·2TMTZ。AlH3·TMTZ 以 聚 合 物 配 位 模 式存在(图7a),AlH3·2TMTZ 以5 配位单体配位模式存在(图7b)。AlH3·2TMTZ 受热脱去1 分子TMTZ,得到更稳定的AlH3·TMTZ 配合物;123 ℃左右AlH3·TMTZ 分解,表现为C―N 键的断裂[45]。
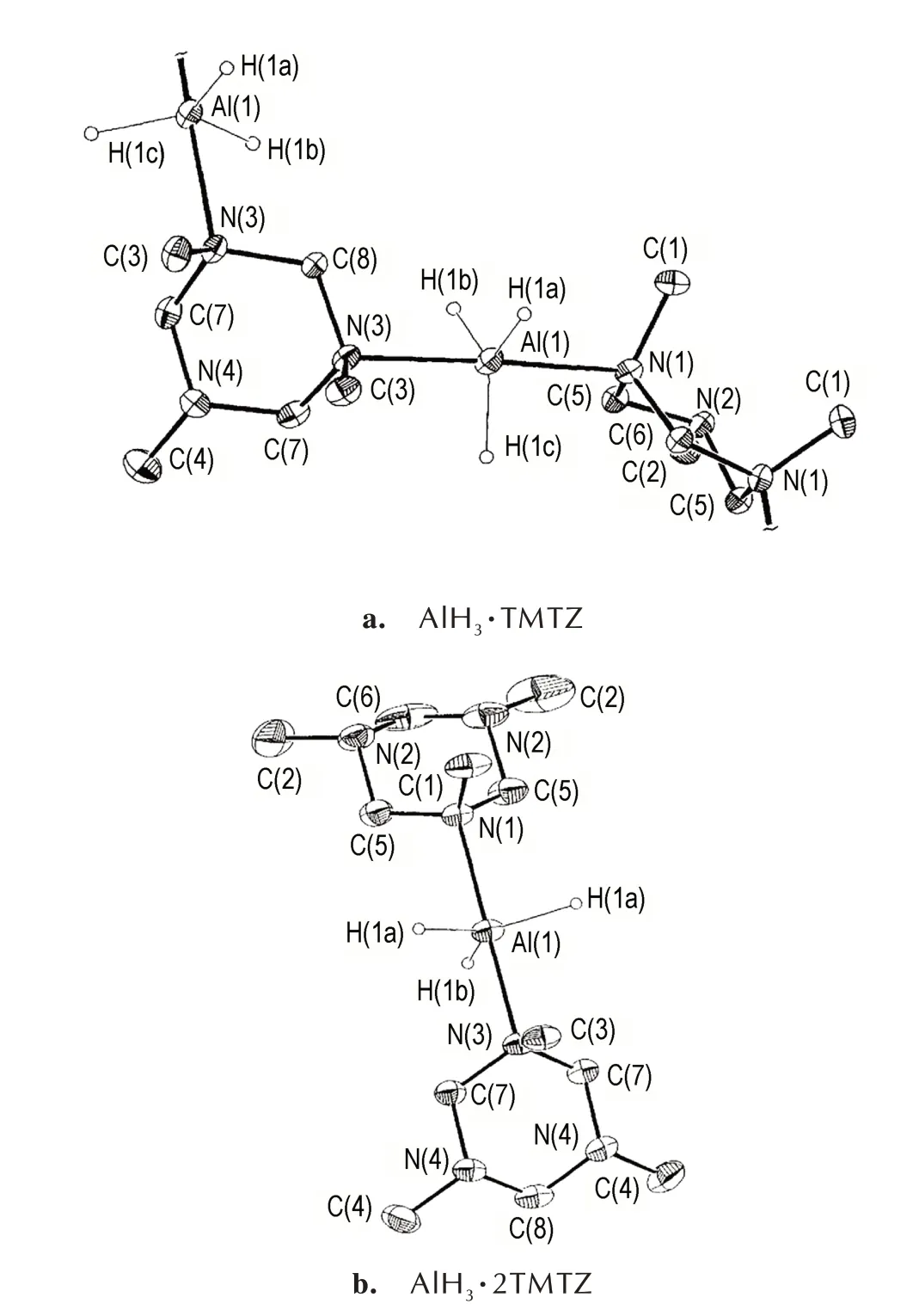
图7 AlH3·TMTZ 和AlH3·2TMTZ 的分子结构图[45]Fig.7 Molecule structures of AlH3·TMTZ and AlH3·2TMTZ[45]
与单齿叔胺配合物相比,多齿叔胺配合物更倾向于以聚合物配位模式存在,因此具有更高的稳定性。但目前多齿叔胺配合物的种类较少,配体多为非含能分子,燃烧性能研究仍未起步。制备含能分子的AlH3配合物势在必行。
3.2 叔膦配合物
叔膦与叔胺类似,都是Lewis 碱,但叔膦的碱性要弱于叔胺。相较于AlH3叔胺配合物而言,AlH3叔膦配合物的稳定性无疑要弱得多,例如AlH3·PEt3的分解温度 只 有-20 ℃[60]。从 软 硬 酸 碱 理 论[61-62]角 度 上 看,AlH3是硬酸,叔胺是硬碱,而叔膦是软碱。根据“硬亲硬,软亲软”的原则,同为“硬”的AlH3叔胺配合物稳定性更佳;而“软”“硬”结合的AlH3叔膦配合物稳定性差的现象得到了合理的解释[46]。
为了得到能稳定存在的AlH3叔膦配合物,空间位阻较大的叔膦Lewis 碱在研究中被广泛采用。Atwood 等[23]以三叔丁基膦(TTBP)为配体,得到了化学计量比为1∶1 的4 配位单体型配合物AlH3·TTBP,该配合物的熔点为103~105 ℃,分解温度为180 ℃。
Bennett 等[31]采用空间位阻更大的环己基(Cy)代替TTBP 的叔丁基(tBu)作为烷基取代基,以三环己基膦(TCP)和1,2-双(二环己基膦基)乙烷(DCPE)为配体得到了配合物,二者均采用四配位单体的配位模式(图8a,8b),分解温度为163~165 ℃。但当配体为1,2-双(二异丙基膦基)乙烷(DIPE)时,配合物AlH3·DIPE采取聚合物配位模式(图8c),分解温度为160 ℃。

图8 AlH3·TCP、AlH3·DCPE 和AlH3·DIPE 的分子结构图[31]Fig.8 Molecule structures of AlH3·TCP, AlH3·DCPE and AlH3·DIPE[31]
Anders 等[63]以常见的三苯基膦(TPP)为配体,得到了首个化学计量比为1∶2 的5 配位单体模式的膦配合物AlH3·2TPP(图9)。该配合物具有良好的水氧稳定性,在溶液中能够解离1 分子TPP,得到具有还原活性的AlH3·TPP。
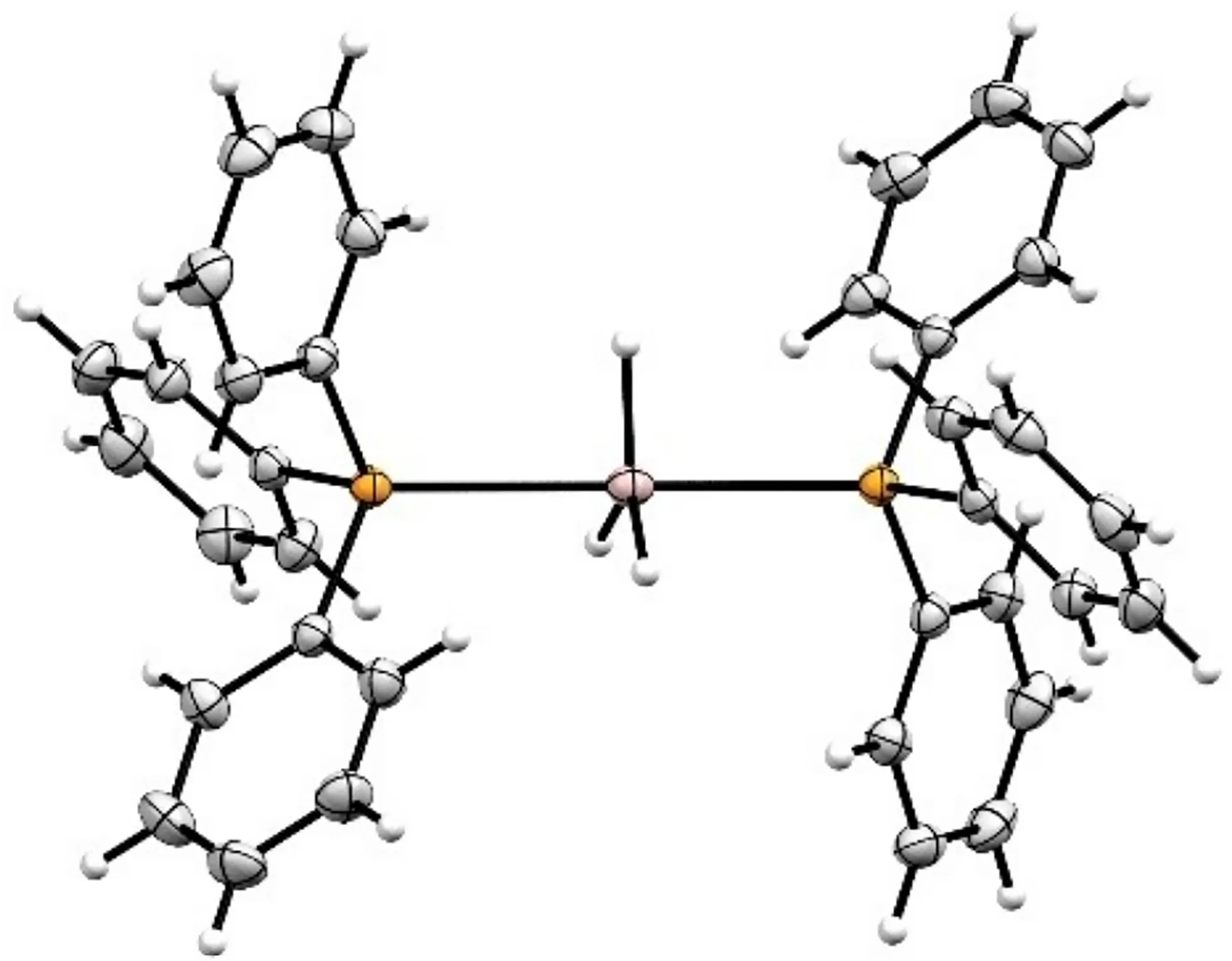
图9 AlH3·TTP 的分子结构图[63]Fig.9 Molecule structure of AlH3·TTP[63]
AlH3叔膦配合物的稳定性主要由叔膦配体的空间位阻提供,虽然庞大的配体为AlH3配合物提供了足够的稳定性,但也极大的稀释了配合物整体能量。
3.3 醚配合物
AlH3乙醚(Et2O)配合物AlH3·nEt2O 是人们最早研究的AlH3配合物之一。由于配体乙醚非常容易脱去,AlH3·nEt2O 经常用于液相法合成AlH3[10,20,64]和配体交换制备其他AlH3配合物[37,63,65]。AlH3·nEt2O 的性质非常不稳定,常温条件下遇见空气即可自燃。朱朝阳等[66-67]研究表明,AlH3·nEt2O 的储存稳定性较差,在储存过程中会发生自脱醚现象,转变为γ相或α′相的AlH3,TGA-DSC 进一步证实了AlH3·nEt2O 在25~120 ℃的脱醚过程。在动态真空的条件下,AlH3·nEt2O 的乙醚/甲苯溶液在70~80 ℃可转晶得到不同晶型的AlH3[68]。
Gorrell 等[24]将溶剂轻油加入到AlH3的四氢呋喃(THF)溶液中,成功制备了AlH3·THF 和AlH3·2THF。AlH3·THF 在加入大量溶剂轻油时得到,采取4 配位二聚体配位模式(图10a);而AlH3·2THF 在加入少量轻油时得到,采取5 配位单体配位模式(图10b)。二者的稳定性较低,AlH3·2THF 在氩气环境中可失1 分子THF 生成AlH3·THF,AlH3·THF 在真空条件下60 ℃即可分解生成AlH3。
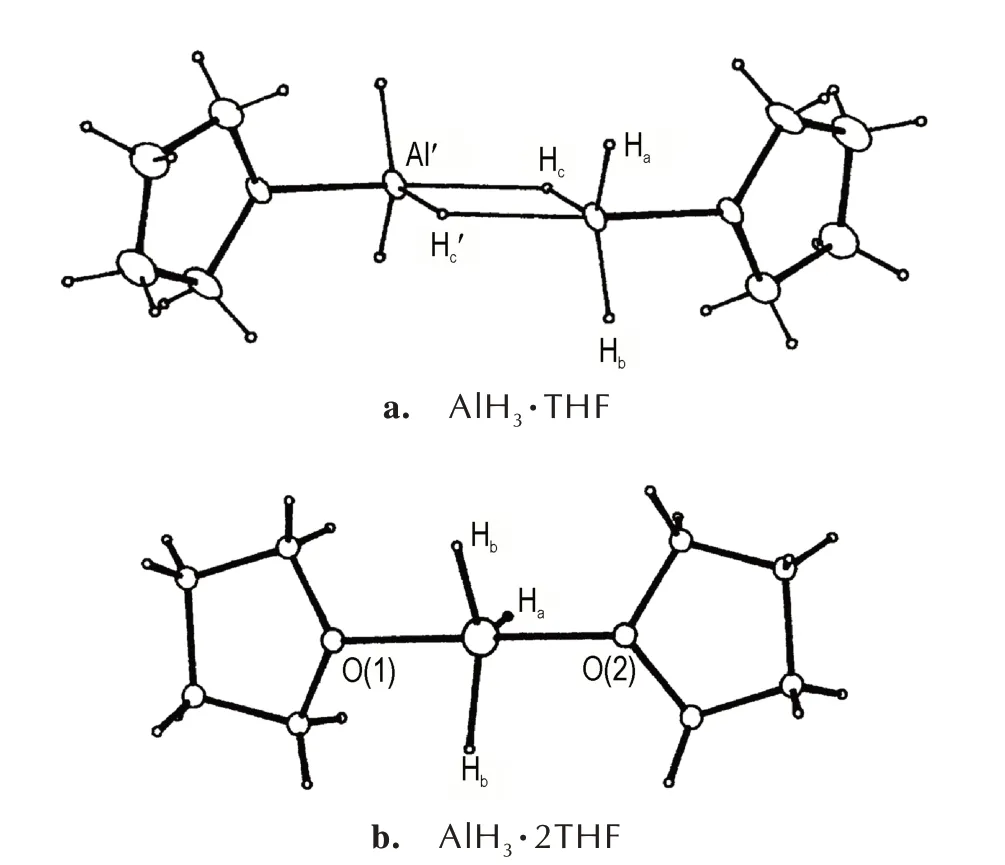
图10 AlH3·THF 和AlH3·2THF 的分子结构图[24]Fig.10 Molecule structures of AlH3·THF and AlH3·2THF[24]
Humphries 等[47]以1,4-二氧六环(DIOX)为配体制备了AlH3·DIOX,并对该配合物进行了晶体学分析。AlH3·DIOX 采取聚合物配位模式,空间群为P21/c。该配合物具有良好的热稳定性,熔点为82.4 ℃,分解温度为125.2~150.5 ℃[46]。
AlH3醚配合物的稳定性通常较差,易脱去醚配体得到AlH3,通过控制脱醚条件可实现α-AlH3的制备。
3.4 卡宾配合物
卡宾的性质非常活泼,很难分离得到稳定存在的卡宾。1991 年,第一个具有极高稳定性的N 杂环卡宾(NHCs)——1,3-二(1-金刚烷基)咪唑-2-亚基(BAIY)成功合成,该卡宾是单线态卡宾,无水无氧条件下稳定存在,熔点为240~241 ℃[69]。
与胺、膦、醚类似,NHCs 具有一对孤电子对,具有高度亲核性质,是一种Lewis 碱。基于这一性质,NHCs在配位化学中得到了极大的应用。第一个NHCs 的AlH3配合物是1,3-二均三甲苯基咪唑-2-亚基(BMIY)配合物AlH3·BMIY,该配合物采取4配位单体配位模式(图11),具有极高的热稳定性,熔点为246~247 ℃[33]。
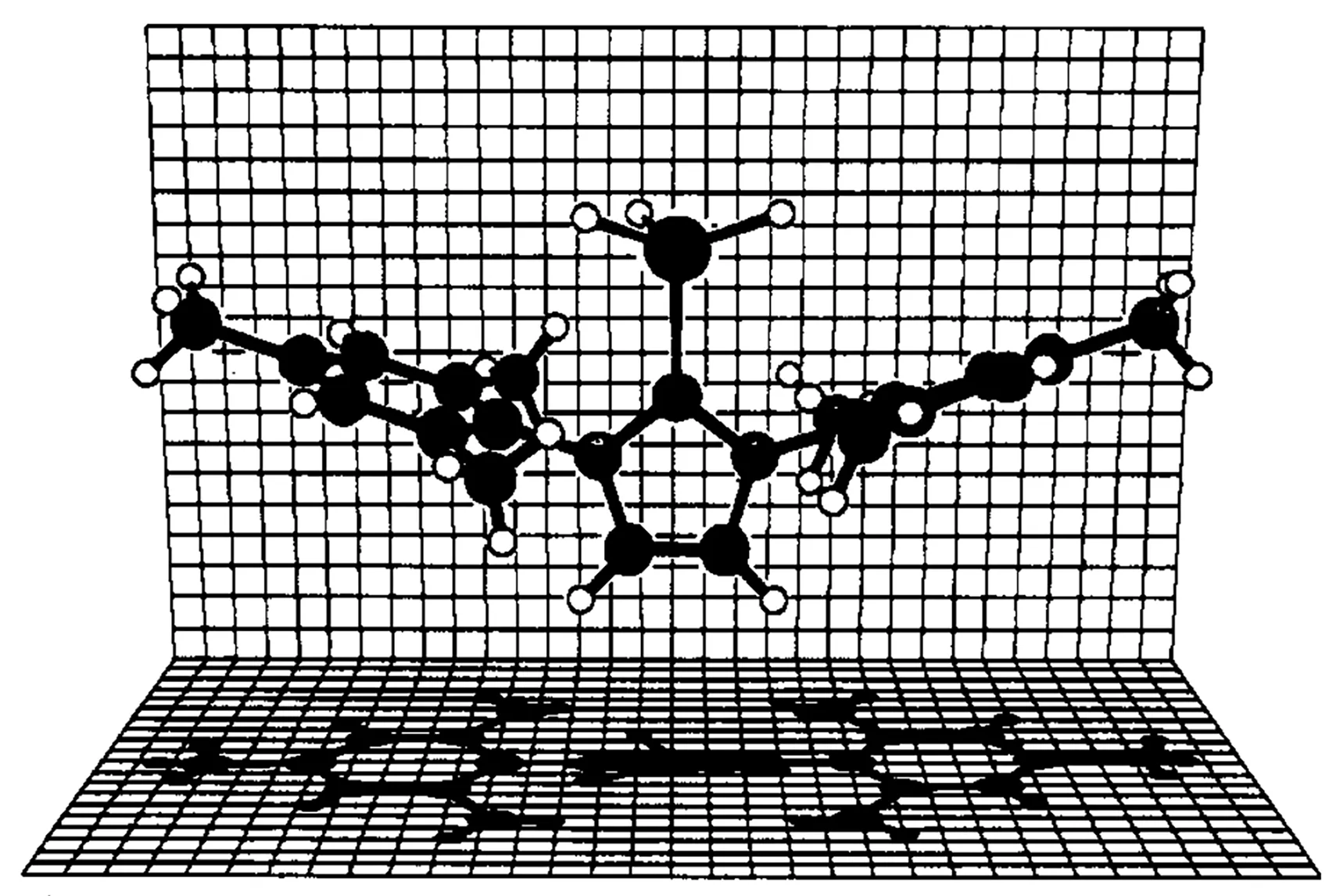
图11 AlH3·BMIY 的分子结构图[33]Fig.11 Molecule structure of AlH3·BMIY[33]
Schneider 等[65]研究了AlH3·NHCs 的化学反应性质,发现AlH3·BPIY(BPIY:1,3-二异丙基咪唑-2-亚基)可以与1 分子BPIY 继续反应生成化学计量比为1∶2 的配合物,但AlH3·2BPIY 的稳定性较差,70 ℃就会缓慢转化为扩环产物,Scheme 6 为扩环反应机理。
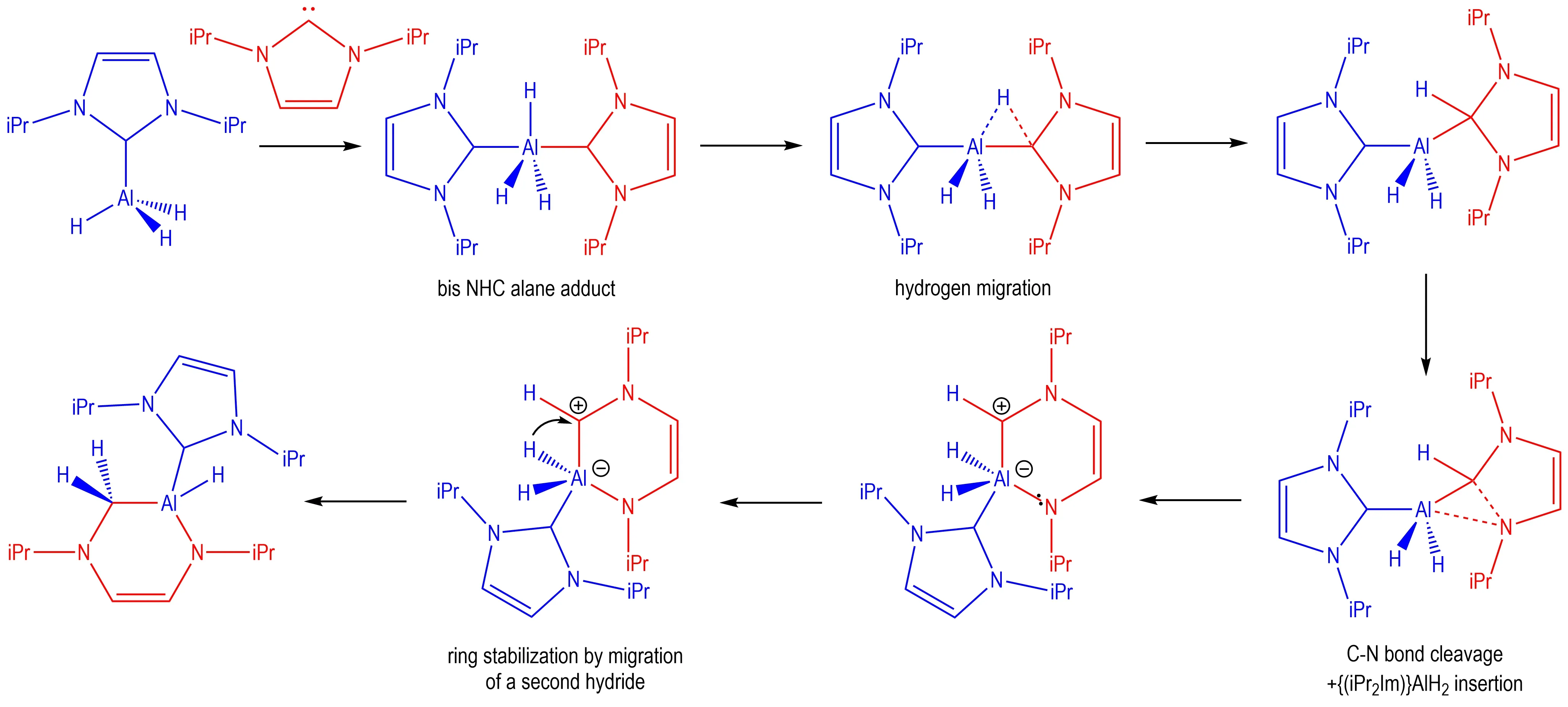
Scheme 6 Mechanism for the ring-expansion reaction of AlH3·BPIY[65]
Chernysheva 等[70]在研究LiAlH4与1,3-二叔丁基咪唑-2-亚基(BBIY)时发现NHC 的异构现象。在非极性溶剂甲苯中,反应生成正常的2 号位配合物AlH3·2-BBIY;但在极性溶剂THF 中,生成了异构化的4 号位配合物AlH3·4-BBIY。他们认为极性溶剂能够促进AlH3·NHCs 的异构化,Scheme 7 异构化机理。
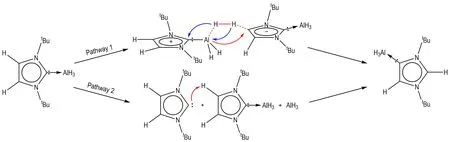
Scheme 7 Isomerization pathways of AlH3·2-BBIY into AlH3·4-BBIY[70]
3.5 混合配体配合物
混合配体配合物,即含有不同配位原子的Lewis碱与AlH3形成的配合物。若按配体组成不同分类,可分为多配体混配物和单一配体混配物两类。
配合物结构单元中含有多种不同配体,是多配体混配物的特点。例如,AlH3·TMA 与1,2-双(二甲基膦)乙烷(DMPE)反应生成配合物2(TMA·AlH3)·DMPE,2 个AlH3均采取5 配位单体配位模式,每个AlH3与1 分子TMA 和1 分子DMPE 的一端连接[35]。该配合物的熔点为35~36 ℃,真空条件下50 ℃时明显升华但没有任何分解。
在配体交换法制备AlH3·TTBP 的过程中,若采用AlH3·TMA 为前体,则得到配合物TMA·AlH3·TTBP[23]。该配合物采取5 配位单体配位模式,熔点为61~64 ℃,分解温度为150 ℃。但在真空条件下,该配合物40 ℃即可分解,生成1 分子TMA 和1 分子AlH3·TTBP。导致这种现象的可能原因是三甲胺的挥发性和叔膦的空间位阻,使得化学平衡向分解为AlH3·TTBP 的方向移动。
N-烷基吗啉中N 和O 原子均能与AlH3配位,所形成的配合物为单一配体混配物。N-烷基吗啉与AlH3的配合物均采取聚合物配位模式,但不同的是N-甲基吗啉(NMM)与AlH3能够形成化学计量比为1∶1 的配合物AlH3·NMM,该配合物中Al 原子只有1 种化学环境 即N―Al―O(图12)[35]。AlH3·NMM 的 熔 点 为123~125 ℃,分解温度为145 ℃。
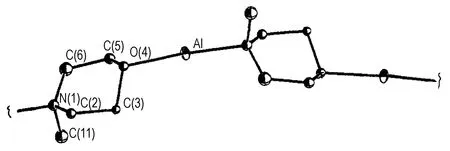
图12 AlH3·NMM 的分子结构图[35]Fig.12 Molecule structure of AlH3·NMM[35]
N-乙基吗啉(NEM)与AlH3能够形成2 种化学计量比(2∶1 和1.5∶1)配合物[25]。2AlH3·NEM 可以看做若干个二聚体单元组成的聚合物链,其中NEM 有头对头和尾对尾2 种排列方式,因此2AlH3·NEM 中Al 原子有2 种化学环境(图13a)。1.5AlH3·NEM 中Al 原子有3 种化学环境(图13b),其中1 种与2AlH3·NEM 相同,另外2 种环境分别为O―Al―O 和N―Al―H。
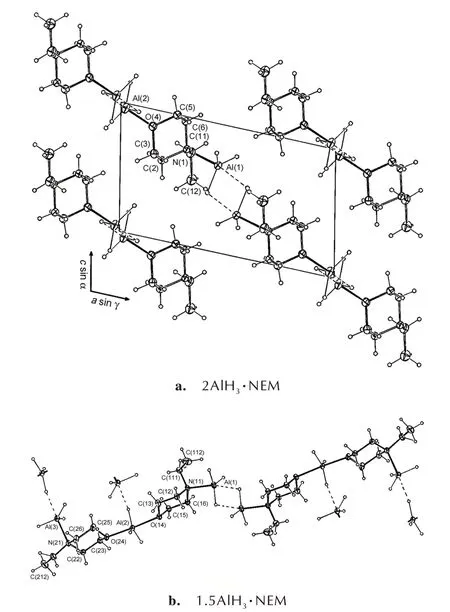
图13 2AlH3·NEM 和1.5AlH3·NEM 的分子结构图[25]Fig.13 Molecule structures of 2AlH3·NEM and 1.5AlH3·NEM[25]
总的来说,AlH3可以与叔胺、叔膦、醚、卡宾等电子供体配位形成稳定的配合物(表1)。卡宾和叔膦的给电子能力较弱,不能满足AlH3的电子需求,因此需要空间位阻较大的配体提供额外的稳定性,以保证AlH3配合物稳定存在。但配体分子越大,对配合物的能量稀释越高,限制了卡宾和叔膦配合物在含能材料领域的应用。叔胺的给电子能力最强,形成配合物的稳定性也最好,其中能够形成聚合物配位模式的配合物具有优异的热稳定性。同时,有机配体的存在使得AlH3配合物具有很好的界面相容性,能够有效防止界面脱湿现象的发生,在含能材料领域具有巨大的应用潜力。
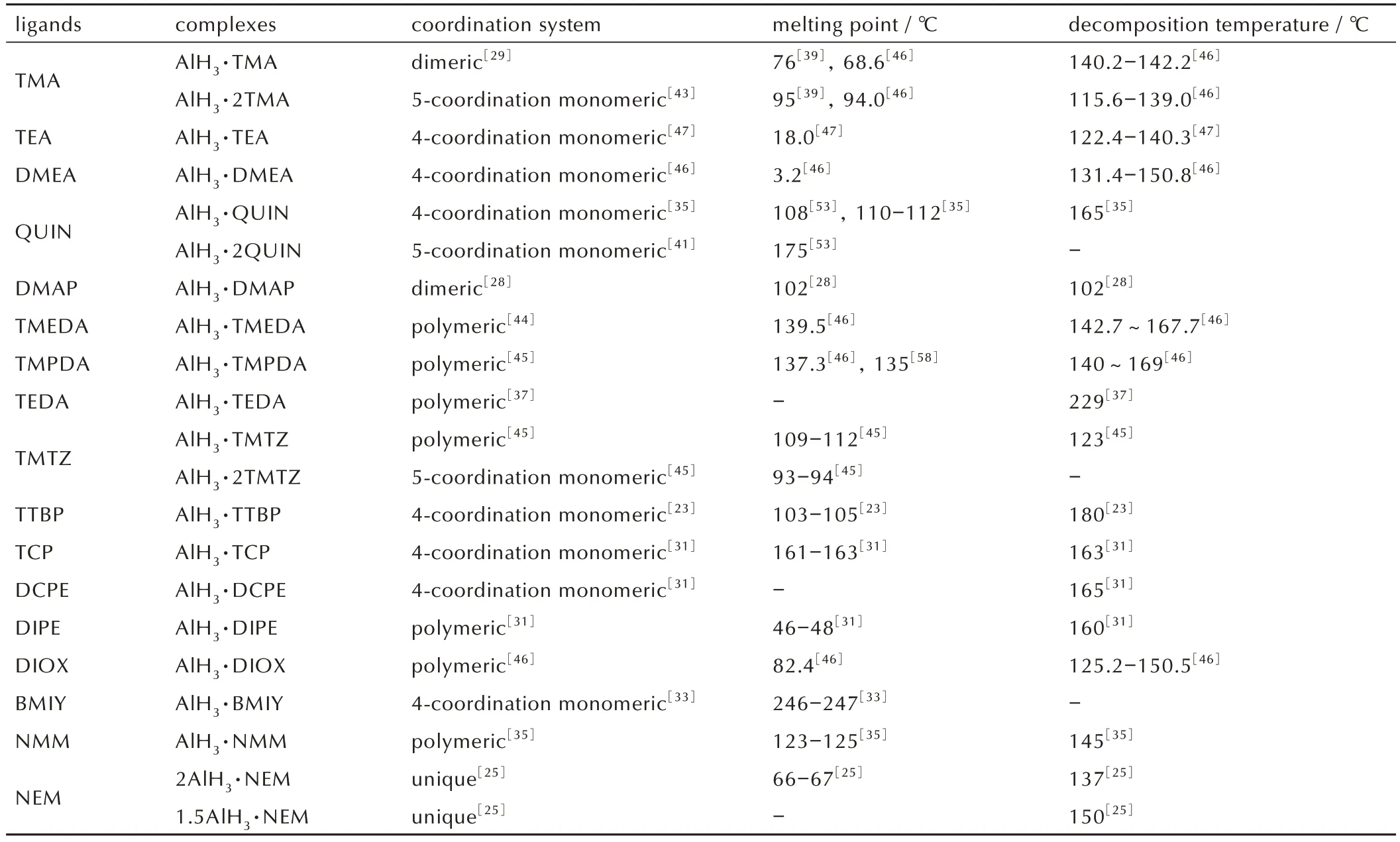
表1 不同配体的AlH3配合物性质汇总Table 1 Properties of AlH3 complexes with different ligands
4 AlH3配合物应用
AlH3配合物中H 显负价,具有很强的还原能力,可以作为化学反应中的还原剂。不同配体的AlH3配合物熔点和分解温度差异较大,分解产物也各不相同。若配合物的分解温度较高,分解产物通常为Al,可作为金属有机化学气相沉积的底物;反之,分解温度低则易解配位生成AlH3,可用作AlH3的再生。其中热稳定性和空气稳定性均较高的AlH3配合物具有含能材料的应用价值。
4.1 化学反应还原剂
AlH3中H 的化合价为-1 价,具有较强的还原能力。α-AlH3稳定性较好,但制备工艺复杂、不溶于有机溶剂,难以参与液相反应;β-AlH3和γ-AlH3虽能溶于有机溶剂,但稳定性差,很难作为还原剂在有机反应中应用。AlH3配合物稳定性相对较好,保留了AlH3的还原性,且对多种官能团具有较高的选择性和良好的收率。
Marlett 等[38]对 二 乙 基 甲 胺(DEMA)配 合 物AlH3·DEMA 的 还 原 性 进 行 了 研 究,在THF 和 甲 苯 的混合溶液中,AlH3·DEMA 能够在0 ℃将羧酸和酰氯选择性还原为醇,在25 ℃将腈和酰胺还原为胺,对卤素和硝基没有还原活性,且还原产率高达90% 以上(表2)。
4.2 金属有机化学气相沉积
Al 作为集成电路中连接金属之一,在微电子器件制备过程中具有广泛的应用。以金属有机化合物为沉积原料,采用金属有机化学气相沉积(MOCVD)的方法,可以得到覆盖率更高且更贴合Si 基片的Al 薄层[71]。烷基铝和AlH3配合物均可作为MOCVD 的沉积源,但AlH3配合物在应用中更具有优势。相较于烷基铝中的Al―C 键,AlH3配合物中的Al―N 键更容易裂解,因此能极大减少沉积Al 膜中的碳含量[60]。AlH3配合物分解过程为解配位、失氢、形成金属Al 3 个步骤,通过筛选配位能力不同的配体,控制MOCVD 的操作温度,优化Al 薄层沉积的工艺。
Frigo 等[21]采 用 复 分 解 法 在 戊 烷 中 制 备 了AlH3·DMEA,避免了含氧化合物的污染,具有极高的纯度,室温下为挥发性液体,0~40 ℃挥发未见分解。Neo 等[71]进一步研究了AlH3·DMEA 在Si(1 0 0)晶面的生长情况,在150~250 ℃范围内,生长速率与Si衬底温度有关,并实现了在Si表面的选择性生长(图14)。
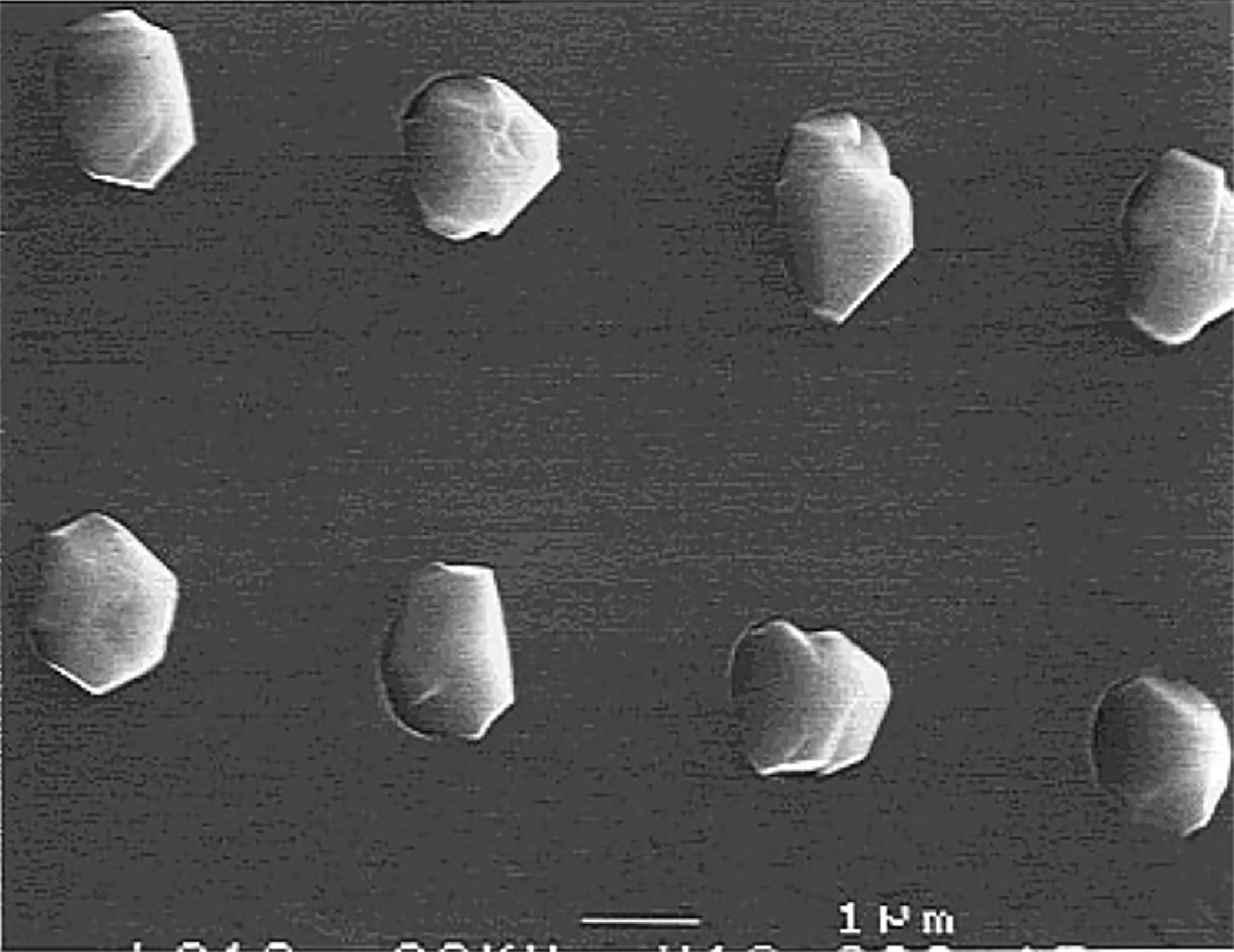
图14 1.5 μm 通孔中选择性沉积的Al 的SEM 图[71]Fig.14 SEM images of selectively deposited Al in 1.5 μm via-holes[71]
4.3 AlH3储氢材料再生
AlH3的含氢质量百分数为10.1%,储氢密度为148 kg·m-3,具有极高的氢含量。但AlH3的再生却十分困难,若在室温条件下,由Al 和H2再生AlH3需要的H2分压至少为710 MPa[72]。由此可见,直接氢化再生AlH3不是一个可行的方案。
1964 年,Ashby[36]发 现,TEDA 存 在 下Al 与H2在中等温度和压力的条件下即可再生为AlH3,该工艺的具体条件为35 MPa 的H2分压、70 ℃加热6 h。配体与AlH3之间相互作用,能够在较温和的条件下生成AlH3配合物。Graetz 等[72]研究表明,在Al 粉中掺加少量Ti 能够降低再生温度和压力。
AlH3储氢材料再生的先决条件是AlH3配合物能够在AlH3不分解的情况下脱除配体。Lacina 等[73-75]采取“氢化/配位-转胺-脱胺/分离”策略,由Al 粉制备AlH3·DMEA 和AlH3·TMA,配 体 交 换 转 胺 得 到AlH3·TEA(脱胺温度:70 ℃),继而脱除配体TEA 得到AlH3(Scheme 8)。Ni等[54,76]沿用该策略,以NMPy为加氢配体、NEPi 为转胺配体也实现了AlH3储氢材料的再生,其中配合物AlH3·NEPi的脱胺温度为60~70 ℃。
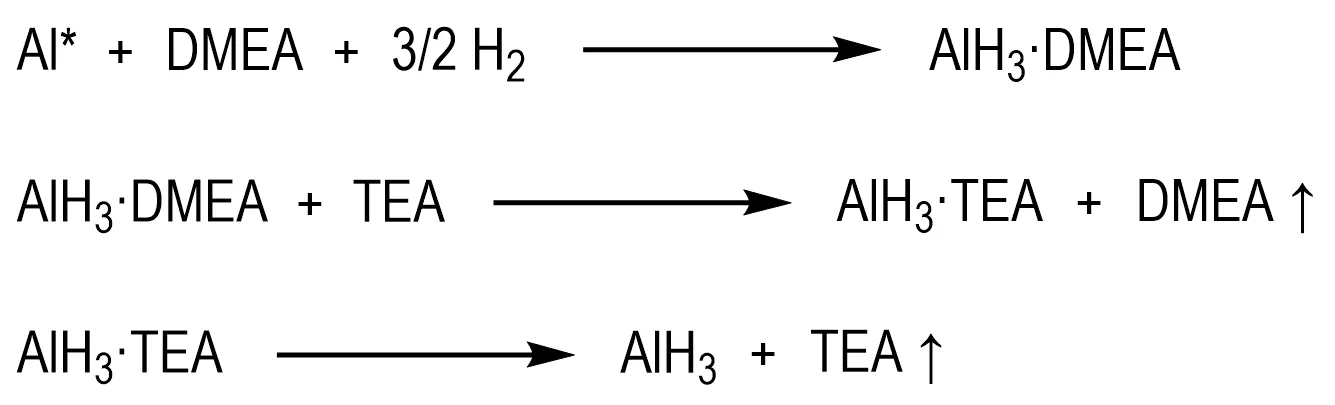
Scheme 8 Regeneration procedure with AlH3·DMEA and AlH3·TEA[73]
4.4 推进剂含能组分
复合固体推进剂的主要成分为氧化剂、黏结剂、固化剂、金属燃料等。其中Al 粉作为推进剂的金属燃料具有密度高、生成焓高、耗氧量低、成本低、资源丰富等特点,被广泛应用于推进剂和火炸药中。为了满足军事战略的需要,具有更高能量水平的AlH3引起了研究者的关注。但AlH3制备工艺复杂、转晶过程危险度高、不稳定杂相难以分离、储存稳定性差,难以满足其作为含能组分的应用要求,因此采用各种方法稳定AlH3的研究应运而生[5,77-78]。
若采用AlH3配合物作为含能组分,无需经历转晶步骤,可以有效降低操作风险。同时,可以采用重结晶的方法提纯AlH3配合物,从而避免了不稳定杂质对配合物稳定性的影响。杨玉林课题组[79]采用具有含能性质的有机配体TMTZ 合成AlH3配合物,并进行了燃烧性能和稳定性分析。 配合物的燃烧热为37284.39 kJ·kg-1,与α-AlH3的燃烧热(38012.42 kJ·kg-1)接近。AlH3·TMTZ 的燃烧过程见图15a,与α-AlH3的燃烧行为[80](图15b)相比,AlH3·TMTZ 的燃烧速度更快,火焰更稳定。该配合物热稳定性好(分解温度>140 ℃),室温、空气条件下储存30 d 几乎没有任何分解。
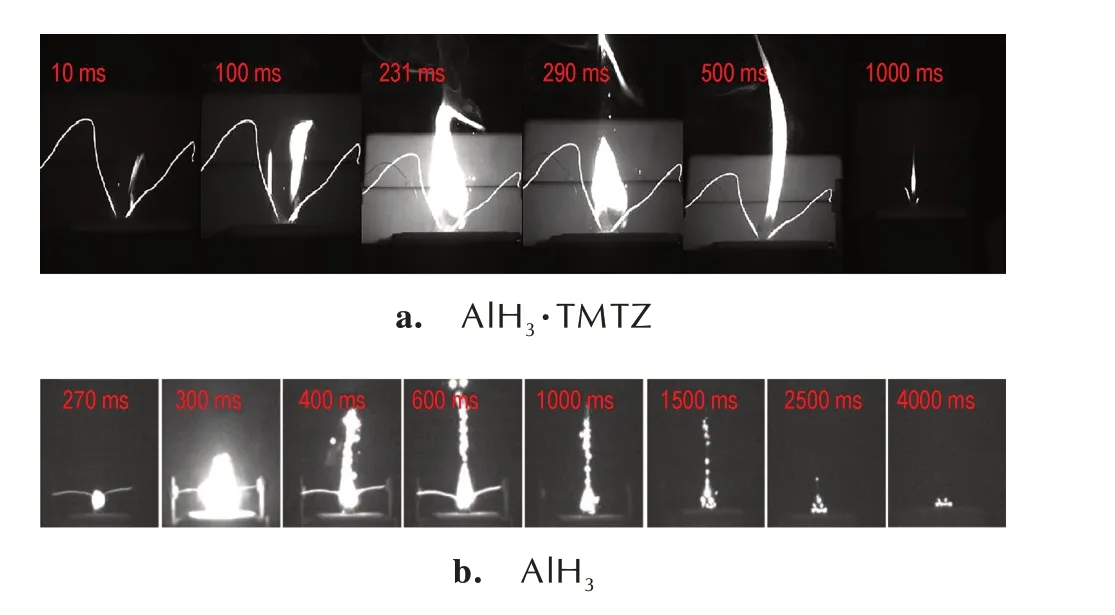
图15 空气条件下AlH3·TMTZ 和AlH3的燃烧过程[79-80]Fig.15 Combustion processes of AlH3·TMTZ and AlH3 in air[79-80]
5 总结与展望
AlH3可以与Lewis 碱形成各种各样的配合物,并且有着各种应用。但归根结底,AlH3配合物的应用与其热性质是密不可分的。MOCVD 应用要求AlH3配合物具有挥发性,AlH3再生时要求配合物的分解温度不能太高,作为含能组分时必须要有足够的稳定性和能量。通过对现有文献的归纳和总结,AlH3配合物的稳定性与Lewis 碱的种类、碱度、空间位阻以及配位方式有关。众多的AlH3配合物中,AlH3叔胺配合物无疑是最稳定的;同时Lewis 碱的碱度越强,配合物的稳定性越好;具有较大空间位阻的配体有助于AlH3膦配合物的稳定;聚合物配位体系的配合物具有更高的稳定性。
目前,AlH3配合物在含能材料领域的研究依旧处于初级阶段,具有足够稳定性的AlH3配合物的种类较少,配合物的感度较高,配体的添加会稀释AlH3自身的能量。综上所述,未来AlH3配合物的发展可以围绕以下几个方向深入研究:
(1)探索合成更多种类的AlH3配合物,归纳整理各种配体对AlH3配合物的稳定性及感度的影响,建立理论模型,通过理论计算,对AlH3配合物的物化性能进行合理的预测。
(2)开展AlH3含能配合物的研究。选用含能的Lewis 碱配体或在Lewis 碱配体中引入含能基团,合成稳定的、能量密度更高的AlH3配合物。
(3)目前AlH3配合物的合成方法主要有复分解法和配体交换法,开发更加安全、绿色的配合物合成路径具有很大的现实意义。
(4)开展AlH3配合物作为含能组分的应用研究。AlH3叔胺配合物具有较高的燃烧热值和良好的热稳定性,满足作为复合固体推进剂填料的要求,有望部分取代Al 粉提高推进剂性能。
