Cdc42蛋白参与中性粒细胞弹性蛋白酶诱导的人气道上皮细胞黏蛋白高分泌
2023-09-26何明欣周向东杨雅楼徐立张华李琪
何明欣,周向东,杨雅楼,徐立,张华,李琪
气道黏液高分泌是慢性气道炎性疾病的重要病理特征,长期的黏液高分泌易造成病原菌定植,进而引起持续性的感染和难以缓解的气道阻塞,从而严重影响患者的预后。气道黏蛋白 (mucin, MUC) 5AC是气道黏液最具代表的病理性表达产物,在各种炎性介质、致病菌产物、蛋白酶及冷空气等始动因素刺激下易导致其过度表达[1-2]。然而在众多促黏液因子中,目前已知中性粒细胞弹性蛋白酶 (neutrophil elastase, NE) 对病理性黏蛋白分泌的促进作用最强,极易促成黏液栓的形成[3-4]。气道慢性炎性状态下,MUC5AC的合成储备量已较正常时明显增加,而当气道炎性反应急性发生时,胞浆中的黏蛋白储存量无法在短时间内进一步增多,因此,急性发作时出现气道黏液大量分泌的现象势必与胞内某种强有力的极性诱导因素导致黏蛋白出胞增多有关[5-6]。已有研究表明,Rho作为一种小分子G蛋白,在蛋白囊泡出胞过程中起着至关重要的作用,其亚型细胞分裂周期蛋白 (cell division cycle,Cdc) 42在细胞信号通路中具有分子开关的功能,参与细胞的黏附、迁移与极化,是蛋白出胞领域中研究最为广泛的小分子G蛋白之一[7-8]。目前,Cdc42在癌细胞转移领域的研究较多,有关气道黏液高分泌的研究甚少,故本实验以NE作为黏液高分泌刺激因子构建体外细胞模型,采用siRNA干扰技术探究Cdc42与气道黏蛋白高分泌的关系及其可能的介导作用,报道如下。
1 材料与方法
1.1 实验材料 (1)细胞、试剂:人支气管气道上皮细胞(16HBE) (ATCC,美国)、DMEM培养液、HEPES、Trizol、胎牛血清 (FBS)、HNE、抗GAPDH单克隆抗体(Sigma,美国)、Cdc42 siRNA及阴性对照(Santa Cruz,美国)、兔抗Cdc42蛋白抗体(博奥森,北京)、小鼠抗MUC5AC单克隆抗体,HRP-羊抗兔抗体(Santa Cruz,美国)、HRP-羊抗鼠抗体(Sigma,美国)BAC蛋白浓度测定试剂盒(碧云天,上海)、人MUC5AC ELISA试剂盒(凡科维)、LipofectamineTM2000试剂(Invitrogen,中国)。(2)仪器:SynergyHTX型多功能酶标仪(Bio-TeK,美国),LightCycler 480 Ⅱ型荧光定量PCR仪(Roche,瑞士),ABLX5全自动化学发光图像分析系统(Tanon,中国)。
1.2 细胞培养及分组 将16HBE细胞培养于含10%的胎牛血清和双抗(100 U/ml青霉素、100 μg/ml链霉素)的DMEM培养基中,置于37℃、5% CO2培养箱内孵育,常规换液培养。当细胞贴壁达80%~90% 时将其传代至6孔板内,细胞数量为 (2~5)×105/孔,分为6组。(1)对照组:无FBS和双抗的基础DMEM培养基培养细胞;(2)NE组:无FBS培养基中加入NE 25 nmol/L;(3)NE + Cdc42 siRNA组:细胞Cdc42 siRNA 5 μmol/L预处理30 min后加入25 nmol/L NE;(4)NE+阴性siRNA组:以阴性siRNA转染后加入NE 25 nmol/L;(5)Cdc42 siRNA组:无FBS培养基中加入Cdc42 siRNA 5 μmol/L预处理;(6)阴性siRNA组:以阴性siRNA转染后,无FBS培养基培养。每组设5个复孔进行统计学分析,实验重复5次。
1.3 细胞转染 将处于对数生长期的细胞调整浓度至(1~2)×105/L,加入无双抗的培养基孵育12~24 h,当细胞融合达70%~80%时进行转染,按转染试剂LipofectamineTM2000说明书的实验步骤将Cdc42 siRNA及阴性对照转染入16HBE细胞中,以阴性siRNA为阴性对照,转染后24~48 h进行细胞处理及相关检测。
1.4 Western印迹检测Cdc42蛋白含量 将细胞置于冰上,每孔加入100 μl的RIPA强裂解液(含PMSF∶RIPA=1 μl∶100 μl)裂解5 min,转移至提前预冷的EP管中匀速摇15 min,使细胞充分裂解。4℃条件下14 000 r/min离心15 min,用BCA蛋白分析试剂盒测定上清液总蛋白并调平。选择10% SDS-PAGE分离胶和5%浓缩胶,电泳跑胶,湿转至PVDF (0.45 μm) 膜上。转膜后把膜放入QuickBlock Western封闭液中低速振荡封闭15 min。弃掉封闭液加入兔抗Cdc42蛋白一抗(1∶500) 匀速摇床30 min后放4℃摇床过夜。次日用1×TBST洗膜3次加入HRP标记的二抗(1∶1 000)室温下摇床1 h,再次洗膜后用滤纸吸取多余水份,滴加ECL化学发光底物,放置1~3 min。使用凝胶成像仪对膜进行曝光和显影,并用Image J软件分析结果。GAPDH作为内参蛋白,实验重复3次。
1.5 ELISA法测MUC5AC蛋白水平 采用双抗夹心ELISA法检测样品中MUC5AC靶蛋白浓度。取6组已经过处理的细胞培养液,离心20 min后收集上清液。设置标准品孔、样本孔,标准品孔各加入不同浓度的标准品50 μl,样本孔内加入待测样品50 μl(10 μl样品+40 μl样品稀释液),每孔加入酶标试剂100 μl(空白孔不加样品及酶标试剂),用封板膜封住反应孔置37℃孵育60 min。随后PBS洗板5次,拍干,每孔加入显色剂避光15 min。加终止液50 μl,测各孔A值(λ=450 nm),测量结果与标准品比值计算黏蛋白MUC5AC的相对值。
1.6 免疫荧光检测各组细胞MUC5AC蛋白表达 将贴壁生长良好的细胞消化后接种于35 mm玻底共聚焦培养皿中,细胞密度为1×105/ml,分别对各种细胞进行加药刺激。处理结束后PBS洗涤3次,每次3~5 min,随后使用4%多聚醛室温下固定30 min;PBS洗涤3次,0.1 Triton X-100室温下通透20 min,PBS洗涤3次,5%山羊血清室温封闭30 min,滴加MUC5AC蛋白一抗 (1∶300) 后置于4℃湿盒过夜;次日PBS洗3次,避光滴加羊抗鼠荧光二抗 (1∶500) 室温放置30 min;PBS洗涤3次,避光滴加DAPI染色液5 min;PBS洗3遍,滴加防淬灭剂。共聚焦激光扫描生物显微镜下观察并拍片,采用Image Pro Plus 软件分析细胞相对荧光强度。

2 结 果
2.1 各组细胞内Cdc42蛋白表达水平比较 Cdc42 siRNA组的Cdc42蛋白表达量相较于对照组和阴性siRNA组显著降低 (P<0.05),表明转染成功。与对照组相比,NE组以及NE+阴性siRNA组的Cdc42表达量有明显升高 (P<0.001),显示NE可刺激Cdc42蛋白的表达;NE+Cdc42 siRNA组相对于NE组其Cdc42蛋白表达有明显的下降 (P<0.001);对照组与NE+Cdc42 siRNA组以及阴性siRNA组的Cdc42蛋白表达无明显差异(P>0.05),见图1。
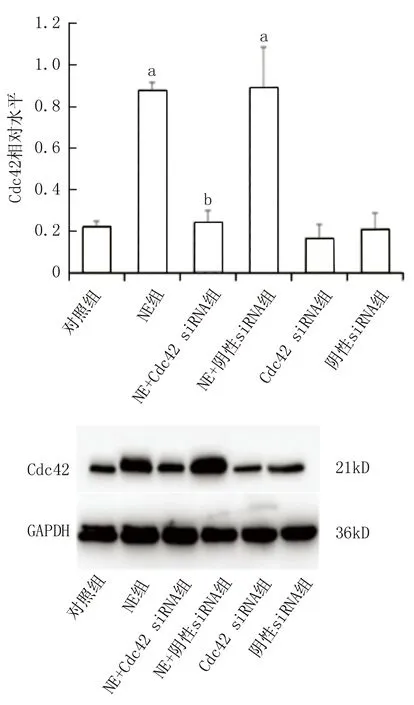
注:与对照组比较,aP<0.001;与NE组比较,bP<0.001。图1 各组细胞内Cdc42蛋白的表达水平比较Fig.1 Comparison of the expression levels of Cdc42 protein in each group of cells
2.2 各组细胞分泌至上清液中的MUC5AC蛋白水平比较 与对照组相比,NE组以及NE+阴性siRNA组MUC5AC蛋白分泌水平明显上升(P<0.001);而NE+Cdc42 siRNA组MUC5AC蛋白分泌水平与对照组比较差异无统计学意义(P=0.400),但与NE组以及NE+阴性siRNA组相比MUC5AC蛋白水平明显下降(P<0.001);对照组与阴性siRNA组比较MUC5AC蛋白水平无明显差异(P=0.450),见图2。
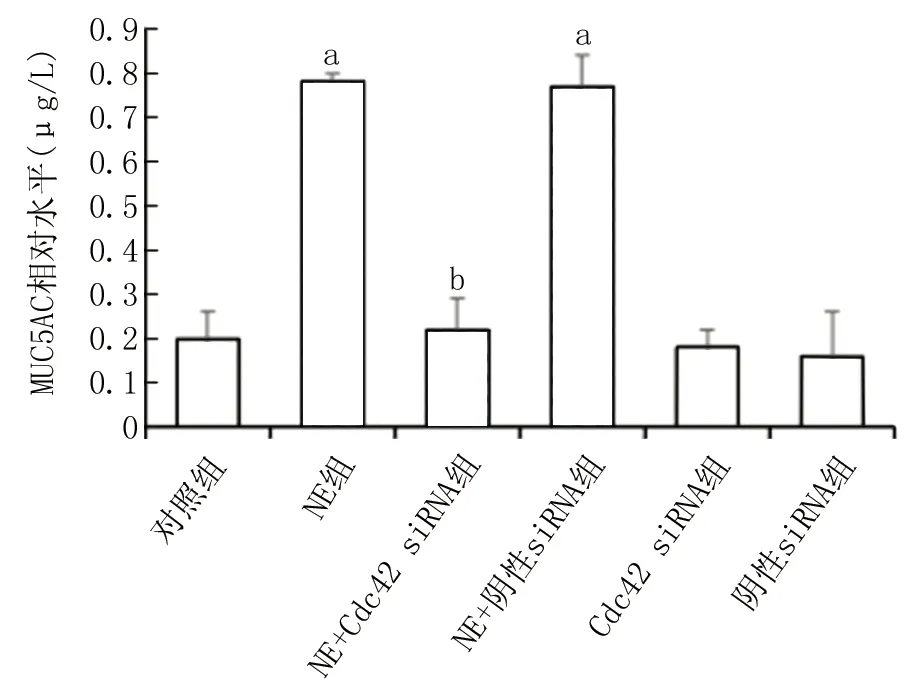
注:与对照组比较,aP<0.001;与NE组比较,bP<0.001。图2 各组细胞培养上清中MUC5AC蛋白水平比较Fig.2 Comparison of MUC5AC protein levels in cell culture supernatant of each group
2.3 各组细胞中MUC5AC蛋白水平比较 免疫荧光结果显示,与对照组相比, NE组和NE+阴性siRNA组的MUC5AC表达明显增高 (P<0.001);NE+Cdc42 siRNA组MUC5AC蛋白分泌与对照组相比差异无明显统计学意义(P>0.05),而与NE组以及NE+阴性siRNA组相比MUC5AC蛋白表达水平明显下调(P<0.05);对照组与阴性siRNA组比较MUC5AC蛋白水平差异无统计学意义(P>0.05),见图3。
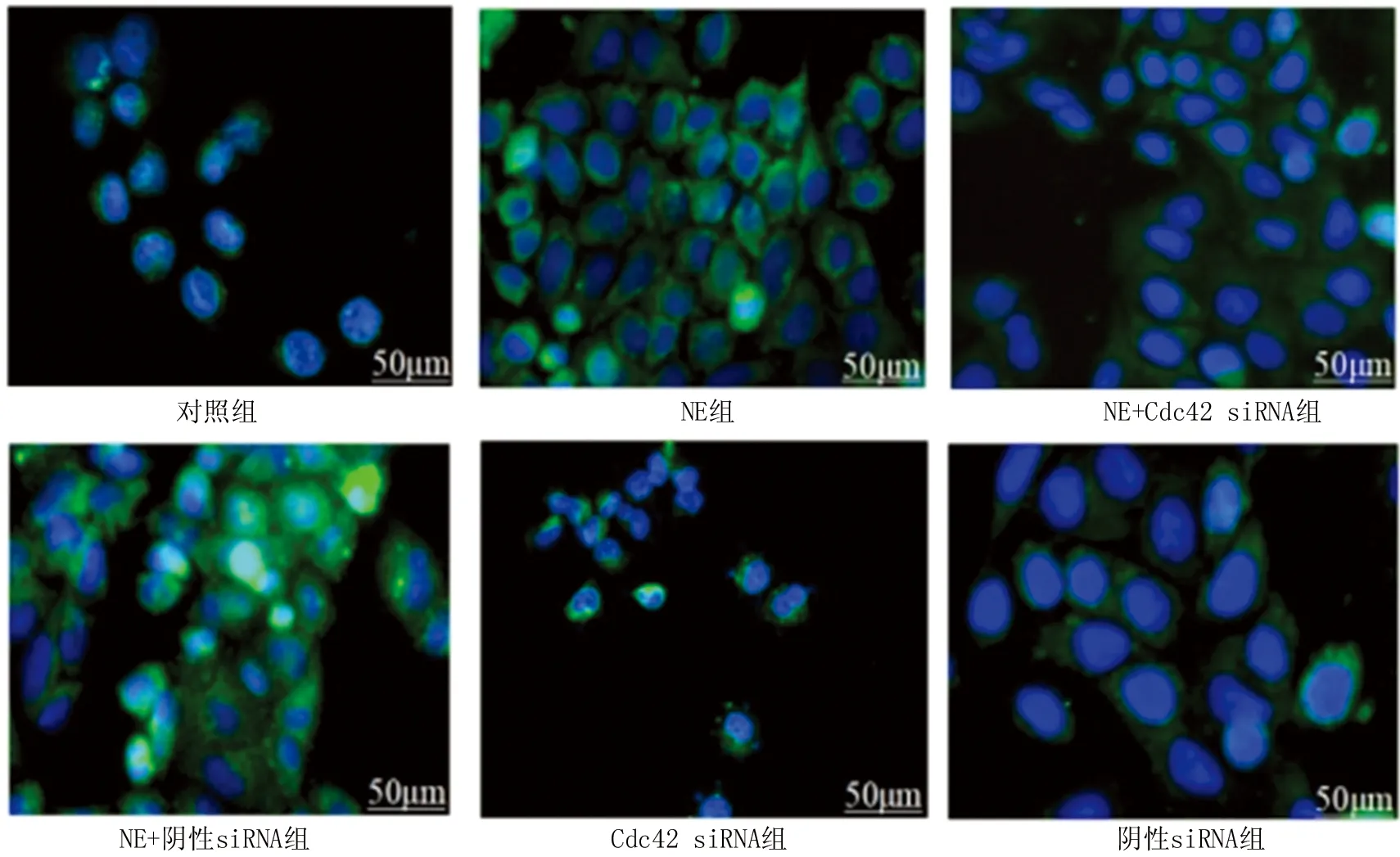
注:绿色荧光表示MUC5AC蛋白,蓝色荧光表示细胞核。图3 各组细胞中MUC5AC蛋白的表达水平比较Fig.3 Comparison of the expression levels of MUC5AC protein in each group of cells
3 讨 论
正常分泌的气道黏液能抵御部分外来的致病因子和刺激因子,起到保护气道、湿润空气等作用。但各种致病因子长期反复作用于气道黏膜时,会引起黏膜下腺体过度增生及杯状细胞过度化生,从而产生大量的黏稠黏液,表现为气道黏液高分泌。该状态是诸多慢性气道炎性疾病如哮喘、慢性支气管炎等最早出现也是最常伴随的症状之一[9]。此类疾病除了黏液分泌过多以外其纤毛清除功能也呈不同程度的下降,导致病理性的黏液无法随纤毛摆动而顺势排出,常随潴留时间的延长而形成黏液栓,有利于气道细菌的生存与繁殖,如此周而复始诱导气道黏液高分泌现象的进一步恶化,最终严重影响患者的治疗和预后[10-11]。
NE作为丝氨酸蛋白酶超家族成员,由中性粒细胞生成,是目前病理性黏蛋白高分泌过程中已知的最强刺激因子,破坏性极强,可诱导气道重塑引发肺纤维化等[12-13]。现已证实诸多促进黏蛋白生成的因素同时也会促进其分泌至胞外,而Rho蛋白是调控囊泡出胞的蛋白之一,其作为GTPase的Ras超家族成员,广泛存在于真核细胞中膜相关的细胞器内,当它与GTP结合时处于活性状态 (Rho-GTPase),与GDP结合时处于失活状态,该机制使其可通过类似分子开关的作用调控蛋白囊泡的出胞过程[14]。而Rho蛋白又包含诸多亚型,如Rac、Cdc42、Rif等,其中Cdc42蛋白亚型是细胞极性建立过程中的关键因子,起初随机分布在细胞内,被激活后就会富集到细胞膜上,然后启动一系列下游生物过程,辅助相关蛋白囊泡的出胞运动[15]。因此,气道炎性反应急性发作时出现的黏液分泌大量增多,很可能与胞内有极强的介导因素促使黏蛋白出胞相关[16-17],故而Cdc42蛋白在黏液高分泌中的作用值得进一步详细研究。
本实验以NE作为刺激因子,构建黏液高分泌的体外细胞模型,分别对转染前和转染后的16HBE细胞进行刺激。结果发现,16HBE在NE刺激后其细胞外MUC5AC以及细胞内的Cdc42蛋白水平表达明显增加;而转染Cdc42 siRNA后,再用NE刺激,胞内Cdc42蛋白水平分泌量相较对照组没有明显升高,相较于NE组却出现了明显的下降,同时上清液中的MUC5AC与之结果相一致。由此可见,NE这些促黏液因子会通过刺激Cdc42蛋白的表达,进而促进MUC5AC的分泌和出胞,反之亦然。因此推测抑制Cdc42蛋白很可能成为控制慢性气道炎性疾病的病理性黏液高分泌的又一重要靶点。
综上所述,Cdc42蛋白是NE刺激下气道MUC5AC蛋白高分泌的重要上游信号分子。但Cdc42如何促进MUC5AC出胞的具体膜介导机制还尚不十分清楚,未来需要更多的体内和体外实验来进一步阐明Cdc42在黏液高分泌中的确切机制。
利益冲突:所有作者声明无利益冲突
作者贡献声明
何明欣:设计研究方案,实施研究过程,论文撰写;周向东、李琪、张华:提出研究思路,分析试验数据,论文审核;徐立:实施研究过程,资料搜集整理,论文修改;杨雅楼:进行统计学分析
