SETD1A与KDM4A在非小细胞肺癌中的表达及临床价值
2023-09-26朱小慧李亚云张海燕刘海涛于志娟
朱小慧,李亚云,张海燕,刘海涛,于志娟
肺癌是最常见的恶性肿瘤,全球每年发病220万例,死亡180万例[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌类型的85%[2]。对于可切除的早中期NSCLC,手术是首选的治疗方案,但仍有术后复发、转移的风险[3]。组蛋白赖氨酸甲基转移酶SET结构域包含1A (histone lysine methyltransferase SET domain containing 1A,SETD1A)是组蛋白赖氨酸甲基转移酶SET1家族成员,能够特异性催化组蛋白H3赖氨酸4位点3甲基化,促进下游基因的转录[4]。研究表明,SETD1A在直肠癌[5]、前列腺癌[6]等恶性肿瘤中表达上调,能诱导插头框M1的转录,促进肿瘤恶性增殖及侵袭。赖氨酸去甲基酶4A (lysine demethylase 4A,KDM4A)具有组蛋白去甲基化功能,参与染色质结构调节、表观遗传学信号传导[7]。研究发现,前列腺癌等肿瘤中KDM4A的表达能诱导肿瘤上皮间质转化,促进肿瘤侵袭和转移[8]。目前NSCLC中SETD1A、KDM4A表达及临床意义尚不明确。本研究通过检测NSCLC中SETD1A、KDM4A的表达,探讨两者临床意义,报道如下。
1 资料与方法
1.1 临床资料 选取2017年1月—2020年1月南通市肿瘤医院综合内科收治NSCLC患者116例为研究对象,男65例,女51例,年龄32~83(61.79±6.47)岁;肿瘤直径:≤5 cm 者66例,>5 cm者50例;病理类型:腺癌78例,鳞癌38例;肿瘤TNM分期:Ⅰ~Ⅱ期81例,Ⅲ期35例;肿瘤分化程度:高中分化70例,低分化46例;合并淋巴结转移33例;接受术后辅助化疗42例。本研究经医院伦理委员会审核批准通过(LW2023010),患者或家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①所有患者均接受根治性手术切除治疗,且术后组织病理检查确诊为NSCLC;②首次诊治;③临床资料完整。(2)排除标准:①确诊后合并其他恶性肿瘤;②术后30 d内因并发症或合并症死亡;③既往有放化疗及靶向药物治疗史;④合并严重的肝肾等脏器衰竭。
1.3 观测指标与方法
1.3.1 SETD1A、KDM4A表达检测:采用免疫组织化学方法检测。术中留取部分癌组织和癌旁组织(距离癌组织边缘2 cm以上),10%多聚甲醛固定12 h,常规石蜡包埋切片。EG1150石蜡包埋机及RM2235切片机购自德国徕卡公司。通用型两步法免疫组化染色试剂盒购自北京中杉金桥公司,货号PV9000。梯度水化后柠檬酸盐溶液中进行抗原热修复,5%山羊血清室温封闭2 h,滴加兔抗人SETD1A单克隆抗体(稀释比1∶200,购自abcam公司,货号ab243881)和兔抗人KDM4A单克隆抗体(稀释比1∶100,购自abcam公司,货号ab191433),4℃过夜,滴加HRP标记二抗,室温孵育30 min,二氨基联苯胺显色4 min,苏木素复染,梯度脱水后树胶封片。镜下观察染色情况(DX31显微镜购自日本奥林巴斯公司),染色强度评分判定:未着色为0分,浅黄色为1分,棕褐色为2分。肿瘤阳性细胞所占面积评分:阳性细胞数≤5%为0分,6%~25%为1分,26%~49%为2分,≥50%为3分。阳性染色判定根据染色强度及阳性细胞所占的面积评分的乘积计算,乘积≥2分为阳性,<2分为阴性。
1.3.2 术后随访:NSCLC患者出院后进行定期随访,以门诊、电话或网络方式进行,随访截止至2023年2月1日。术后第1年每3个月随访1次,第2、3年每6个月随访1次。随访内容为患者生存状态和生存时间。随访终点为患者死亡或随访结束。

2 结 果
2.1 NSCLC癌组织和癌旁组织中SETD1A、KDM4A表达比较 NSCLC癌组织中SETD1A棕黄色阳性染色主要位于细胞核,KDM4A阳性染色主要位于细胞浆和细胞膜。见图1。NSCLC癌组织SETD1A阳性率为61.21%(71/116),高于癌旁组织的6.90%(8/116),差异有统计学意义(χ2=76.546,P<0.001)。NSCLC癌组织中KDM4A阳性率为65.52%(76/116),高于癌旁组织的8.62%(10/116),差异有统计学意义(χ2=80.487,P<0.001)。
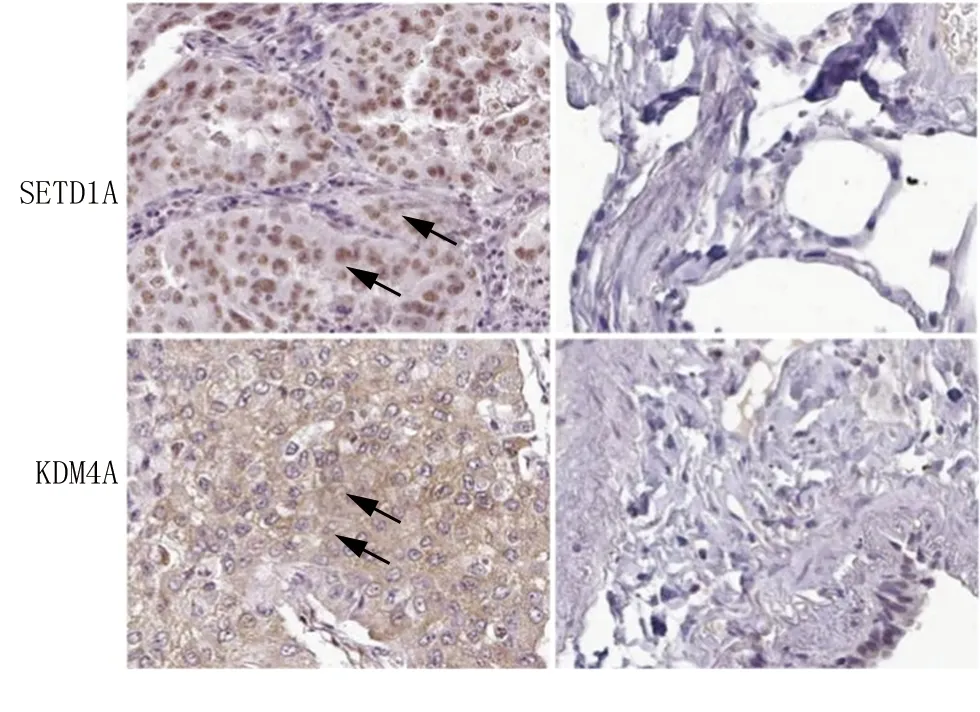
注:箭头为SETD1A阳性染色定位于细胞核,KDM4A阳性染色位于细胞浆和细胞膜。图1 NSCLC癌组织和癌旁组织中SETD1A、KDM4A表达比较(免疫组化染色,×200)Fig.1 Comparison of SETD1A and KDM4A expression in NSCLC cancer tissue and adjacent tissues (immunohistochemical staining, × 200)
2.2 NSCLC癌组织中SETD1A、KDM4A表达的相关性 Spearman秩相关分析,NSCLC癌组织中SETD1A与KDM4A表达呈显著正相关(rs=0.722,P<0.001)。
2.3 癌组织中SETD1A、KDM4A表达在NSCLC患者不同临床病理特征中比较 TNM分期Ⅲ期、低分化程度、伴淋巴结转移患者在NSCLC癌组织中SETD1A、KDM4A阳性率高于TNM分期Ⅰ~Ⅱ期、高中分化程度、无淋巴结转移患者,差异均有统计学意义(P均<0.05),见表1。
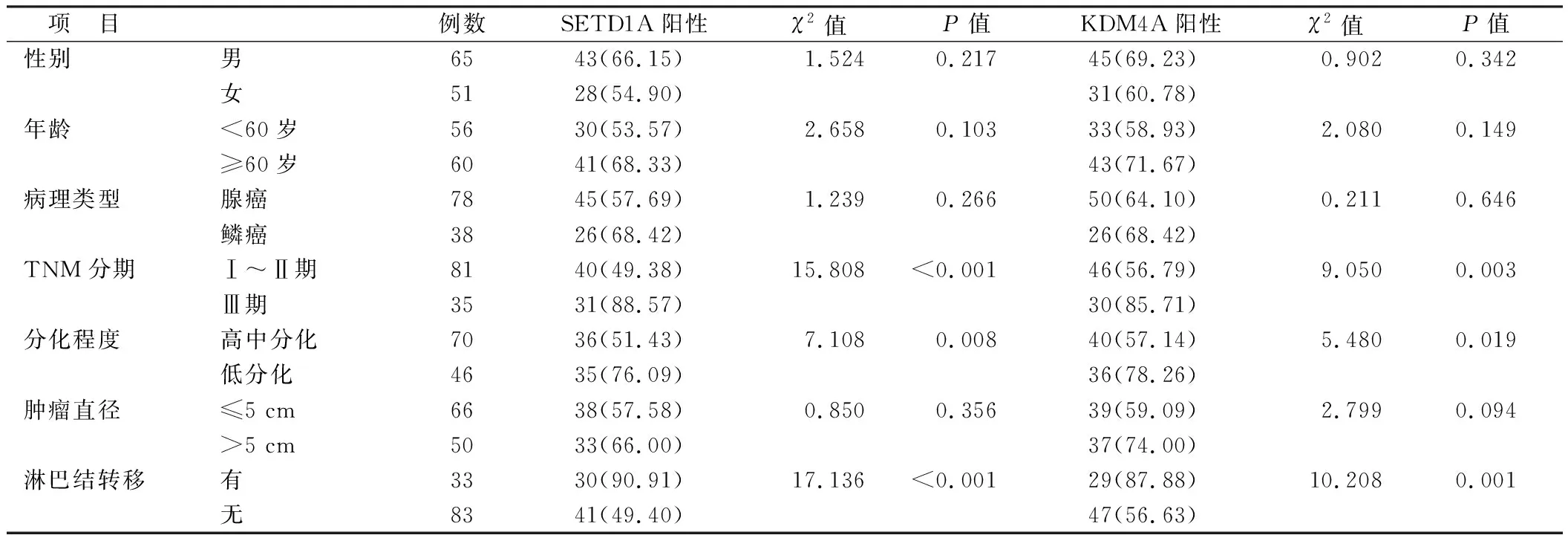
表1 SETD1A、KDM4A表达在NSCLC不同临床病理特征中比较 [例(%)]Tab.1 Comparison of SETD1A and KDM4A expression in different clinical and pathological features of NSCLC
2.4 癌组织中SETD1A、KDM4A表达与NSCLC患者生存预后关系 116例NSCLC患者随访过程中,失访3例,死亡44例,3年总体生存率为61.21%(71/116)。SETD1A阳性组和阴性组患者3年总体生存率分别为49.28%(34/69)、78.72%(37/47)。Kaplan-Meier分析结果,SETD1A阳性组患者3年累积生存率明显低于阴性组患者(χ2=12.984,P<0.001)。KDM4A阳性组和阴性组3年总体生存率分别为48.65%(36/74)、83.33%(35/42)。Kaplan-Meier分析结果,KDM4A阳性组患者3年累积生存率明显低于阴性组患者(χ2=17.175,P<0.001),见图2。
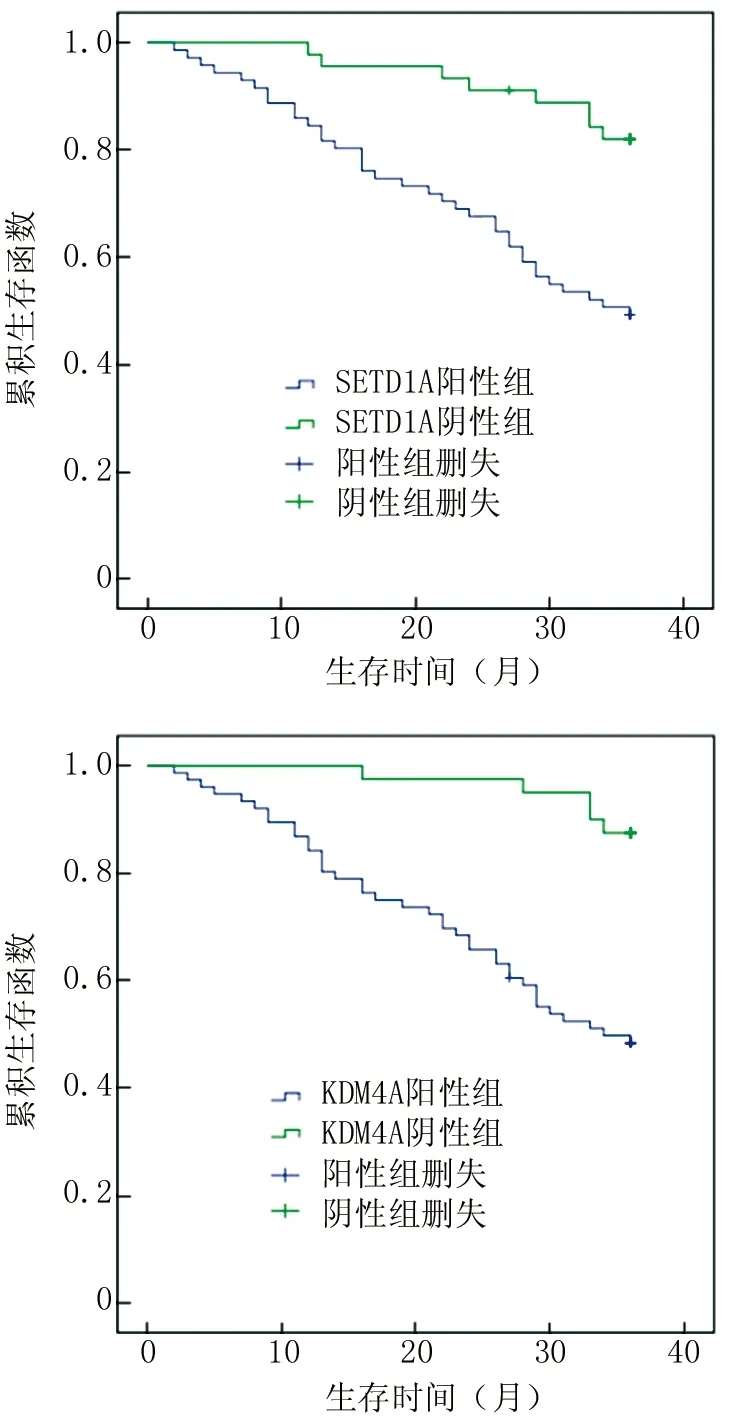
图2 癌组织中SETD1A、KDM4A表达与NSCLC患者生存预后关系Fig.2 Relationship between the expression of SETD1A and KDM4A in cancer tissue and the survival and prognosis of NSCLC patients
2.5 影响NSCLC预后的多因素Cox回归分析 以NSCLC预后情况为因变量,以上述结果中P<0.05项目为自变量,进行多因素Cox回归分析,结果显示,TNM分期Ⅲ期、合并淋巴结转移、SETD1A阳性、KDM4A阳性为影响NSCLC患者不良预后的独立危险因素(P<0.01),见表2。
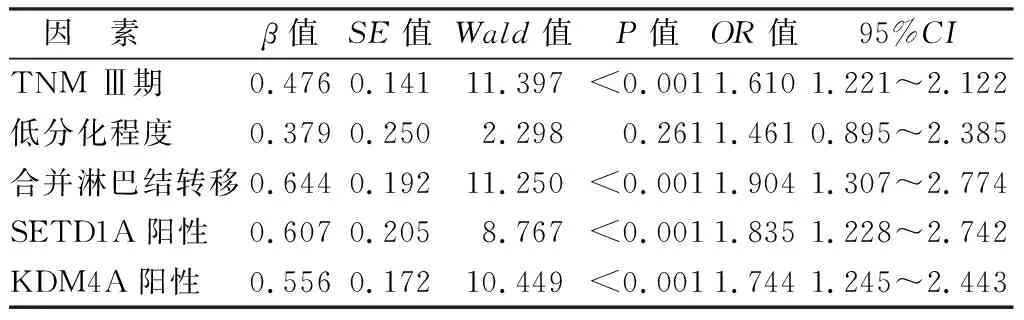
表2 影响NSCLC预后的多因素Cox比例风险回归模型比较Tab.2 Comparison of Cox proportional risk regression models with multiple factors affecting the prognosis of NSCLC
3 讨 论
NSCLC是最常见的肺癌类型,由于NSCLC早期无特异性临床症状,确诊时患者多处于中晚期,生存预后较差,5年生存率仅19%[9]。目前临床上NSCLC预后评估主要采用TNM分期及病理分型等,但TNM分期忽略机体免疫状态、健康状况等其他因素,在评估临床预后上存在一定的缺陷。因此,深入研究NSCLC疾病机制,寻找能够有效评估NSCLC患者临床预后的生物标志物,具有重要的临床意义。组蛋白的甲基化能够调节染色质整体的松散及紧密程度,引起基因表达的增强或抑制,参与DNA复制、重组及修复等生物学过程。近年来发现,组蛋白甲基化修饰涉及的甲基化酶和去甲基化酶是组蛋白甲基化修饰的关键因子,参与肿瘤等疾病发生发展过程的调节[10]。
SETD1A又称为SET1,广泛表达于全身上皮、神经等多种组织中,其作为一种组蛋白赖氨酸甲基化转移酶,能够将甲基基团转移到目标赖氨酸ε-氨基基团上,促进靶基因转录活化。研究发现,SETD1A通过激活缺氧诱导因子1α的表达促进糖酵解,促进胃癌细胞增殖及转移[11]。本研究中,NSCLC组织中SETD1A表达升高,与既往研究中NSCLC中SETD1A mRNA表达升高的结果一致[12],但鉴于蛋白是分子功能的执行者,本研究在蛋白水平检测SETD1A表达,结果更为准确。NSCLC中SETD1A表达升高可能受非编码RNA的调节。研究表明,胃癌中长链非编码RNA FOXD2-AS1表达上调,其作为分子海绵结合抑制微小RNA-1913的表达,微小RNA-1913的下游靶基因SETD1A mRNA稳定性增加,导致SETD1A蛋白表达升高,肿瘤增殖及抗凋亡能力增强[13]。本研究中,SETD1A表达与NSCLC患者TNM分期、肿瘤分化程度及淋巴结转移有关,提示SETD1A促进NSCLC的肿瘤进展。研究发现,NSCLC肿瘤细胞中SETD1A能够与Zeste同源物增强子2的启动子结合并诱导其发生组蛋白H3赖氨酸4位点3甲基化,上调Zeste同源物增强子2基因的转录,激活Wnt/β-连环蛋白通路,导致肿瘤细胞侵袭和转移能力增强[12]。本研究发现,癌组织SETD1A阳性是影响NSCLC患者不良生存预后的独立危险因素,提示SETD1A是新的评估NSCLC患者预后的肿瘤标志物。分析其原因,一方面是SETD1A阳性表达肿瘤细胞存在上皮间质转化的现象,间质性标志物N-钙黏素表达升高,而上皮性标志物E-钙黏素表达下调,肿瘤细胞侵袭和转移能力较强,肿瘤术中难以彻底清除,术后肿瘤易发生复发转移,导致患者不良预后[14]。另一方面, SETD1A的表达升高能够通过促进Yes相关蛋白的磷酸化激活,促进肿瘤细胞对索拉非尼等靶向治疗药物的耐药性形成,而敲除肿瘤细胞中SETD1A的表达能够增强索拉非尼对肿瘤的增殖抑制效应[15]。
KDM4A是一种组蛋白去甲基化转移酶,能够以二价铁离子、α-酮戊二酸为共底物,促进赖氨酸去甲基化,参与基因转录、细胞周期调控及DNA损伤修复等生物学过程[16]。近年来发现,骨肉瘤中KDM4A能够促进溶质载体家族7成员11启动子区的组蛋白H3赖氨酸9位点去甲基化,抑制肿瘤细胞铁死亡发生,导致肿瘤进展[17]。本研究中,NSCLC中KDM4A表达升高,提示KDM4A参与NSCLC肿瘤的发生,与既往学者在NSCLC肿瘤细胞系中报道结果一致[18]。NSCLC中KDM4A表达上调与肿瘤缺氧微环境有关。研究发现,肿瘤组织缺氧能够上调KDM4A的表达,进而通过组蛋白H3赖氨酸9位点3甲基化增强缺氧诱导因子1α转录,促进血管内皮生长因子及葡萄糖转运蛋白1的表达,增强肿瘤恶性增殖及转移能力[19]。此外,KDM4A表达与患者TNM分期、肿瘤分化程度及淋巴结转移有关,表明KDM4A促进NSCLC肿瘤的恶性进展。有学者在NSCLC肿瘤细胞中发现,KDM4A过度表达能促进远端缺失同源盒5的去甲基化,增加远端缺失同源盒5的转录活性,激活癌基因Myc的表达和下游Wnt/β-连环蛋白信号通路,促进NSCLC肿瘤细胞的增殖、侵袭及转移[18]。本研究中,KDM4A阳性表达NSCLC患者生存预后较差,提示KDM4A是一种新的评估NSCLC预后肿瘤标志物。既往亦有学者证实,亚洲人群中KDM4A基因rs586339位点A等位基因多态性能够增加患者不良生存预后的风险[20]。另外,KDM4A表达升高能够降低白血病肿瘤细胞中组蛋白H3赖氨酸36位点3甲基化水平,激活DNA损伤修复通路,导致肿瘤对阿糖胞苷等化疗药耐药性的形成,而应用KDM4A的抑制剂JIB-04处理肿瘤细胞后,能够重新恢复肿瘤细胞对阿糖胞苷的敏感性[10]。因此,KDM4A作为新的NSCLC预后相关肿瘤标志物,以KDM4A为靶点的治疗可能有助于改善患者临床预后,值得今后进行深入研究。
本研究中,NSCLC中SETD1A与KDM4A表达呈显著正相关,提示两者可能在NSCLC中发挥协同作用。SETD1A主要通过组蛋白3赖氨酸4位点的三甲基化,促进下游癌基因的转录激活,而KDM4A主要促进组蛋白3赖氨酸9和36位点的去甲基化,重新激活基因起始位点的转录,促进癌基因的表达[21]。因此,NSCLC中SETD1A与KDM4A可能存在协同的作用关系,共同加快NSCLC肿瘤的恶性进展。但两者在NSCLC中的相互作用机制仍有待今后进行深入的实验研究。
综上所述,SETD1A、KDM4A在NSCLC中的表达升高,二者与肿瘤TNM分期、肿瘤分化程度及淋巴结转移有关,均促进NSCLC的肿瘤发生发展过程。SETD1A、KDM4A阳性是影响NSCLC患者不良生存预后的独立危险因素,临床医生可根据NSCLC患者SETD1A、KDM4A的表达,对其生存预后进行评估,对高危患者采取相应的治疗及随访方案,以改善NSCLC患者的临床预后。但本研究由于样本量有限,未对NSCLC中SETD1A、KDM4A具体作用机制进行深入研究,有待今后设计大样本的临床研究,深入研究两者的作用机制及临床意义。
利益冲突:所有作者声明无利益冲突
作者贡献声明
朱小慧、李亚云:设计研究方案,实施研究过程,论文撰写;张海燕、于志娟:提出研究思路,分析试验数据,论文审核;刘海涛:资料搜集整理,实施研究过程,进行统计学分析
