基于PI3K-Akt信号通路的清带汤对大肠癌细胞增殖的影响
2023-09-25陈彦华陈佳旻刘蕾王连洁吴范晨冯媛媛周利红
陈彦华,陈佳旻 ,刘蕾 王连洁 吴范晨 冯媛媛 周利红
1.上海中医药大学附属曙光医院,上海 201203;2.上海中医药大学中西医结合研究院,上海 201203;3.上海浦南医院,上海 200125
大肠癌又名结直肠癌,是临床最常见的消化系统恶性肿瘤,发病率和病死率均呈逐年上升趋势。根据全球癌症统计报告2020年最新统计数据显示,2020年全球大肠癌病例新增193万(10.0%),占第3位,死亡病例94万(9.4%),占第2位[1]。2020年,中国大肠癌病例新增56万(12.3%),占第2位,死亡病例29万(9.7%),占第5位[2]。早期大肠癌治疗以手术切除为主,中晚期辅以放疗、化疗、靶向治疗、免疫治疗等综合治疗方案。中药以其低毒性、多靶点、多部位及综合性的特点在临床广泛应用,挖掘有效治疗大肠癌的中药复方具有重要的临床意义。
清带汤出自《医学衷中参西录》,由山药、茜草、海螵蛸、龙骨和牡蛎组成,具有固元化滞、活血散瘀之功。课题组临床实践中常用该方加减治疗大肠癌术后放疗、化疗患者,能减轻患者放化疗不良反应、提高生活质量。本研究观察清带汤对人大肠癌细胞(HCT116、LoVo、HT29)及荷瘤裸鼠的抑制作用,采用网络药理学和分子对接技术分析清带汤治疗大肠癌的分子机制,并通过Western blot和qPCR实验进行验证,为该方治疗大肠癌的临床应用提供实验依据。
1 实验材料
1.1 细胞株
人大肠癌HCT116、LoVo、HT29细胞,购于武汉普诺赛生命科技有限公司,货号分别为CL-0096、CL-0144、CL-0118,于上海中医药大学附属曙光医院肿瘤研究室保存。正常人肠上皮NCM460细胞,上海中医药大学附属龙华医院脾胃病研究所徐汉辰教授课题组惠赠。
1.2 动物
SPF级BALB/c雄性裸鼠10只,4周龄,体质量16~18 g,购于上海吉辉实验动物饲养有限公司,生产许可证号SCXK(沪)2017-0012。饲养于上海中医药大学动物实验中心,温度20~25 ℃,相对湿度40%~60%,自由摄食饮水。适应性饲养1周后进行实验。动物饲养及实验操作符合相关管理要求并通过上海中医药大学实验动物伦理委员会审批(PZSHUTCM220711016)。
1.3 药物
清带汤由山药30 g、茜草9 g、海螵蛸12 g、龙骨18 g、牡蛎18 g组成,饮片购于上海康桥中药饮片有限公司,批号分别为220211、220222、220317、220310、220218,上海中医药大学附属曙光医院中药房提供。称取各中药饮片,常规水煎并浓缩,得到浓缩液(相当于原药材1.16 g/mL)用于动物实验,4 ℃冷藏备用。称取各中药饮片,放入2000 mL圆底烧瓶,加入600 mL蒸馏水,室温浸泡1 h后煎煮,煎煮至液体剩余200 mL,过滤,4 ℃静置,待温度降至室温,加入无水乙醇1000 mL,4 ℃静置48 h,过滤,取滤液,减压浓缩至无醇味[3],冻干机真空干燥,即得冻干粉,置于-80 ℃冰箱保存,用于细胞实验。冻干粉得率为0.115 g冻干粉/1 g原药材。
1.4 试剂与仪器
CCK-8试剂盒(日本东仁化学研究所,批号SB793),RPMI-1640培养基(中科迈晨科技有限公司,货号CM10040),DMEM培养基(中科迈晨科技有限公司,货号CM10013),F-12K培养基(上海源培生物科技股份有限公司,货号L450KJ),胎牛血清(美国Gibco公司,货号2324371),胰蛋白酶(上海碧云天生物技术研究所,货号C0201),β-actin单克隆抗体(美国CST公司,货号3700S),mTOR、p-mTOR、Akt、p-Akt(Thr308)、p-Akt(Ser473)单克隆抗体(美国CST公司,货号分别为2983T、2971S、4691S、13038T、4060T),HRP标记山羊抗兔IgG(上海碧云天生物技术研究所,货号A0208),HRP标记山羊抗鼠IgG(上海碧云天生物技术研究所,货号A0216),ECL化学发光超敏显色试剂盒(翌圣生物科技股份有限公司,货号36208ES60)。
240i恒温CO2细胞培养箱(美国Thermo公司),SCIENTZ-10N冷冻干燥机(宁波新芝生物科技股份有限公司),SVE-6A1型超净工作台(新加坡ESCO公司),5804R台式高速离心机(德国Eppendorf公司),680酶标仪(美国Bio-Rad公司),1658004蛋白转印系统(美国Bio-Rad公司),4600SF化学发光图像分析系统(上海天能科技)。
2 实验方法
2.1 CCK-8法检测细胞增殖
取对数生长期人大肠癌HCT116、LoVo、HT29细胞及人正常肠上皮NCM460细胞,常规消化后,分别以5000、8000、5000、6000个/孔接于96孔板,待细胞贴壁后,分别加入各细胞系对应的培养基(RPMI-1640、F-12K、DMEM、RPMI-1640培养基)配制的清带汤冻干粉溶液(10、20、40、80、160 μg/mL),对照组加入相应培养基常规培养,每组5个复孔,另设空白孔只加培养基,不接种细胞,置于培养箱中培养48 h。细胞用PBS清洗2次,加入90 μL培养基和10 μL CCK-8试剂,置入培养箱孵育1~2 h,酶标仪检测450 nm波长处吸光度(OD值),计算细胞存活率。存活率(%)=(给药组OD值-空白孔OD值)÷(对照组OD值-空白孔OD值)×100%。
2.2 裸鼠皮下移植瘤模型建立、给药及取材
无菌条件下取10只裸鼠,于单侧腋窝皮下注射1×107/mL HCT116细胞悬液0.1 mL,待注射部位皮下出现2~3 mm硬质肿物时,将裸鼠随机分为对照组和清带汤组,每组5只。清带汤组予清带汤浓缩液11.6 g/kg(相当于临床等效剂量)灌胃,对照组予等体积饮用水灌胃,连续21 d。每3日测量瘤体最长直径(A)和最短直径(B),计算瘤体积(A×B2÷2),绘制肿瘤相对生长曲线。末次给药24 h后异氟烷麻醉,心脏取血处死,剥离瘤体并称重。
2.3 网络药理学分析
通过TCMSP(https://old.tcmsp-e.com/tcmsp.php)、HERB(http://herb.ac.cn/)数据库结合中国知网(https://cnki.net/)、PubMed(https://pubmed.ncbi.nlm.nih.gov/)检索,获取清带汤组成药物有效成分。以口服生物利用度(OB)>30%、类药性(DL)>0.18为条件筛选有效成分,将文献记载有良好药理作用但不符合上述条件的成分也补充作为有效成分。通过TCMSP、HERB、SwissTargetPrediction(http://www.swisstargetprediction.ch/)、STITCH(http://stitch.embl.de/)数据库及PubMed获得清带汤有效成分的潜在靶点。利用GeneCards(https://www.genecards.org/)和OMIM(https://www.omim.org/)数据库收集大肠癌相关靶点蛋白,采用Venny 2.1(https://bioinfogp.cnb.csic.es/tools/venny/)获取清带汤有效成分治疗大肠癌的潜在靶点。在STRING11.5(https://string-db.org/)数据库选择多种蛋白质(Multiple Proteins),物种(Organism)选择智人(Homo sapiens),置信度设为中等置信度(medium confidence=0.9),输入清带汤治疗大肠癌潜在靶点信息,获得蛋白相互作用(PPI)关系,将结果数据导入Cytoscape3.9.1软件构建清带汤治疗大肠癌潜在靶点PPI网络。采用基于R语言的clusterProfiler包对清带汤治疗大肠癌潜在靶点进行GO功能注释和KEGG通路富集分析,筛选条件为pvalue<0.05和qvalue<0.05。利用SwissADME(http://www.swissadme.ch/index.php)对核心有效成分的ADME参数、药代动力学特性、药物性质进行描述或预测。
2.4 分子对接
将筛选出的核心有效成分与对应靶蛋白进行分子对接,预测其结合模式和亲合力,辅助判断清带汤对大肠癌的调控机制。首先在TCMSP和PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库获取核心有效成分的2D结构,再通过Chem3D软件转化为3D结构。采用RCSB PDB数据库(http://www.rcsb.org/)下载核心靶点的蛋白结构,应用PyMOL软件对受体进行除水及小分子配体等操作,再应用AutoDock Vina进行分子对接,得到对接最低结合能。
2.5 细胞实验验证
取对数生长期HCT116和LoVo细胞,常规消化后,分别以5×105、1×106个/孔接种于6孔板,待细胞贴壁后,清带汤组分别加入相应培养基配制的半抑制浓度(IC50)清带汤冻干粉溶液[4],对照组加入对应培养基常规培养,每组3个复孔,置于培养箱培养48 h。
2.5.1 qPCR检测
收集细胞,采用总RNA提取试剂盒提取细胞总RNA,测定浓度,使用RNA反转录试剂,按照说明书步骤将总RNA反转录为cDNA。配制PCR体系进行扩增,反应条件:95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火延伸30 s,共40个循环。采用2-ΔΔCt法计算mRNA相对表达量。引物由通用生物有限公司合成,引物序列见表1。

表1 各基因PCR引物序列
2.5.2 Western blot检测
培养结束后,PBS清洗细胞,每孔滴加蛋白裂解液60 μL(RIPA裂解液∶PMSF∶蛋白酶抑制剂∶磷酸酶抑制剂=100∶1∶2∶2),冰上裂解30 min,4 ℃、12000 r/min离心20 min,吸取上清液,BCA法测定蛋白浓度。取30 μg蛋白样品,加入5×loading buffer,沸水浴10 min,使用PAGE凝胶快速制备试剂盒制胶(7.5%),上样,电泳,将蛋白电转至PVDF膜,用5%BSA室温封闭2 h。PBST洗膜3次,每次10 min,加入β-actin、AKT、p-AKT、mTOR、p-mTOR一抗(均为1∶1000),4 ℃孵育过夜,PBST洗膜3次,每次10 min,加入辣根过氧化物酶标记二抗,室温孵育2 h,洗膜,ECL显影。以β-actin为内参,计算目的蛋白相对表达量。
2.6 动物实验验证
将2组裸鼠肿瘤组织研磨后,分别提取RNA,采用qPCR检测相关基因表达。
3 统计学方法
采用SPSS25.0统计软件进行分析。计量资料以±sx表示,组间比较采用独立样本t检验。P<0.05表示差异有统计学意义。
4 结果
4.1 清带汤对大肠癌细胞增殖的影响
20~160 μg/mL清带汤处理HCT116、LoVo、HT29细胞48 h后,均能显著抑制细胞增殖,降低其存活率(P<0.05,P<0.01),HCT116、LoVo细胞IC50分别为40、60 μg/mL。而10~160 μg/mL清带汤处理正常人肠上皮NCM460细胞48 h后对细胞增殖无明显影响(P>0.05)。见图1。

图1 不同浓度清带汤对大肠癌细胞及正常人肠上皮细胞存活率比较(±sx,n=5)
4.2 清带汤对裸鼠皮下移植瘤生长的影响
造模后第8日开始记录肿瘤体积,实验过程中对照组瘤体生长速度高于清带汤组,给药21 d后清带汤组肿瘤体积和质量均显著低于对照组,差异有统计学意义(P<0.05)。见图2。

图2 各组裸鼠肿瘤体积和质量比较(±sx,n=5)
4.3 网络药理学分析结果
4.3.1 清带汤有效成分筛选
通过TCMSP数据库检索并根据OB>30%、DL>0.18筛选,得到清带汤中茜草和山药有效成分35个,未被TCMSP收录的3味中药(海螵蛸、龙骨、牡蛎)通过HERB数据库和文献检索,获得海螵蛸有效成分6个、龙骨有效成分5个、牡蛎有效成分7个。删除重复数据后,获得清带汤有效成分共52个。
4.3.2 药物-疾病共同靶点
通过TCMSP、HERB、SwissTargetPrediction、STITCH数据库及PubMed检索获取清带汤有效成分作用靶点,去除重复靶点后,得到作用靶点340个。通过GeneCards和OMIM数据库检索得到大肠癌相关靶点1561个。对清带汤作用靶点和大肠癌相关靶点取交集,得到清带汤治疗大肠癌潜在靶点141个。
4.3.3 蛋白相互作用网络构建
通过STRING11.5对清带汤治疗大肠癌潜在靶点进行分析,利用Cytoscape3.9.1软件构建PPI网络(见图3),该网络包含140个靶点、561条边,靶点代表蛋白,边代表蛋白与蛋白的相互作用关系,连线越多表示关联度越大,靶点蛋白平均节点度为8.01。

图3 清带汤治疗大肠癌潜在靶点PPI网络
4.3.4 GO功能注释和KEGG通路富集分析
对清带汤治疗大肠癌的141个潜在靶点进行GO功能注释及KEGG通路富集分析。GO功能注释显示,生物过程主要富集在miRNA的转录调控、细胞对生长因子刺激的反应、酶联受体蛋白信号通路、跨膜受体蛋白丝氨酸/苏氨酸激酶信号通路、细胞对TGF-β刺激的反应及TGF-β信号通路等;细胞组分主要富集在转录调控/抑制复合体、RNA聚合酶Ⅱ转录调节因子复合物、细胞膜的维持等;分子功能主要富集在蛋白的磷酸化结合、核心启动子序列特异性DNA结合、RNA聚合酶Ⅱ特异性DNA结合转录因子结合等。见图4。KEGG通路富集分析主要涉及PI3K-Akt信号通路、脂质与动脉粥样硬化、AGE-RAGE信号通路、HIF-1信号通路、TNF信号通路、IL-17信号通路等(见图5)。排除非特异性通路及与大肠癌关联较小的通路后,发现其与PI3K-Akt信号通路密切相关。

图4 清带汤治疗大肠癌潜在靶点GO功能富集分析

图5 清带汤治疗大肠癌潜在靶点KEGG通路富集分析
4.3.5 PI3K-Akt信号通路关键靶点筛选及清带汤核心有效成分筛选
通过R语言clusterProfiler包对清带汤治疗大肠癌的有效成分及靶点进行筛选与分析,以pvalue<0.05为筛选条件,发现清带汤中共有16个有效成分及其对应的20个靶点参与PI3K-Akt信号通路抑制大肠癌细胞增殖过程(见图6)。根据上述20个靶点进行筛选,挑选出PI3K-Akt信号通路核心靶点PIK3CG、AKT1、MTOR,并找出其对应的核心有效成分10个,见表2。
4.3.6 分子对接
选择核心靶点PIK3CG、AKT1、MTOR及清带汤核心有效成分,通过AutoDock Vina进行分子对接结合能力分析,AutoDock结合能<-5.0 kcal/mol表明具有良好结合能力[5]。结果显示,各有效成分与对应靶点有良好的结合能力。见表3。

表3 清带汤核心有效成分与PI3K-Akt信号通路关键靶点分子对接结果(kcal/mol)
4.4 清带汤对HCT116和LoVo细胞PI3K-Akt信号通路相关蛋白和基因表达的影响
Western blot结果显示,清带汤组HCT116和LoVo细胞p-Akt和p-mTOR蛋白表达显著降低(P<0.05),见图7、表4。qPCR结果显示,清带汤组HCT116和LoVo细胞PI3K-Akt信号通路下游基因CDK2、BCL-2和MCL-1表达均显著降低(P<0.05,P<0.01),见图8。

图7 各组细胞PI3K-Akt信号通路相关蛋白免疫印迹
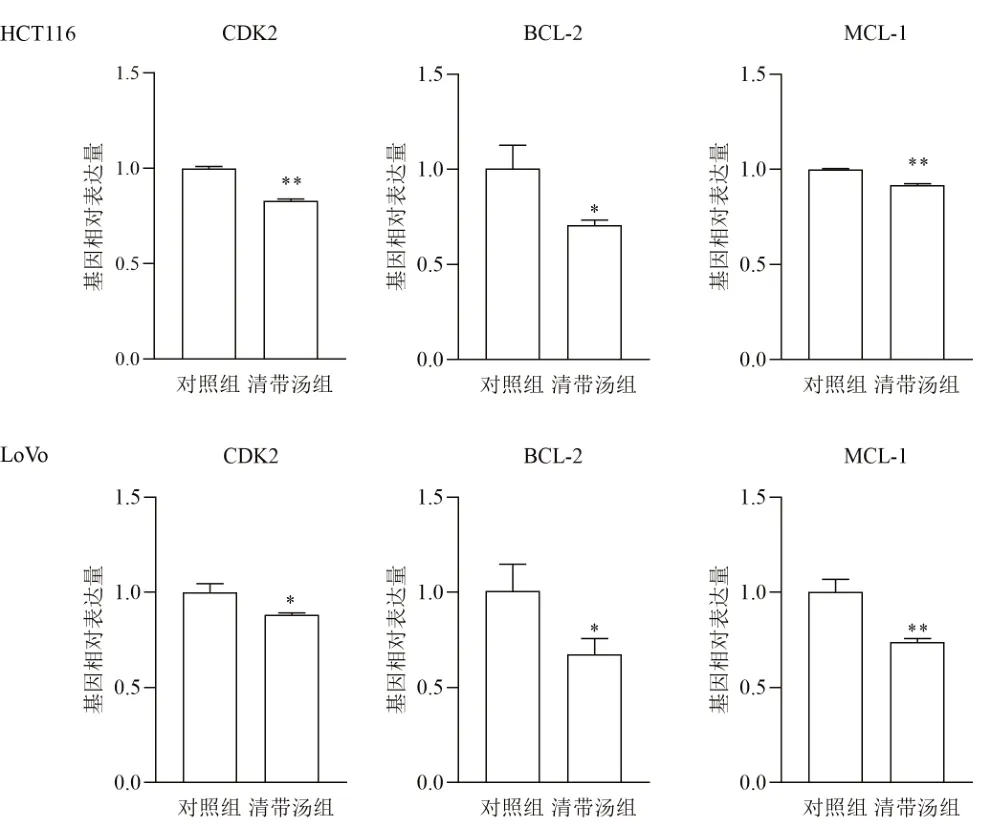
图8 各组细胞PI3K-Akt信号通路相关基因表达比较(±sx,n=6)
表4 各组细胞PI3K-Akt信号通路相关蛋白表达比较(±sx)
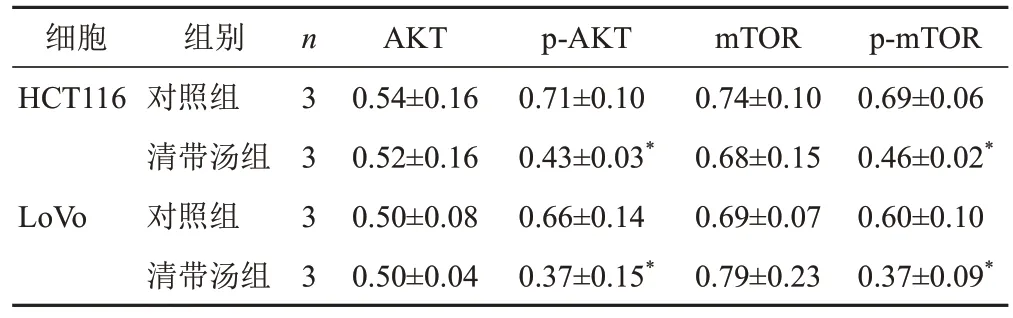
表4 各组细胞PI3K-Akt信号通路相关蛋白表达比较(±sx)
注:与相应细胞对照组比较,*P<0.05
细胞HCT116 LoVo p-mTOR 0.69±0.060.46±0.02*0.60±0.100.37±0.09*组别对照组清带汤组对照组清带汤组n3333 AKT 0.54±0.160.52±0.160.50±0.080.50±0.04 p-AKT 0.71±0.100.43±0.03*0.66±0.140.37±0.15*mTOR 0.74±0.100.68±0.150.69±0.070.79±0.23
4.5 清带汤对裸鼠肿瘤组织PI3K-Akt信号通路相关基因表达的影响
qPCR结果显示,清带汤组裸鼠肿瘤组织PI3K-Akt信号通路下游基因CDK2、BCL-2和MCL-1表达均显著降低(P<0.01),见图9。
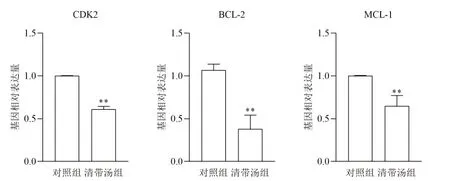
图9 各组裸鼠肿瘤组织PI3K-Akt信号通路相关基因表达比较(±sx,n=6)
5 讨论
大肠癌可归属中医学“积聚”“肠风”“脏毒”等范畴,其病机总属本虚标实,常见为正气亏虚、癌瘀内阻[6]。吴行等[7]通过数据挖掘发现,“虚滞”在大肠癌发展中有重要地位,故治疗需在扶正固本基础上配合消瘀化滞、软坚散结之法。司富春等[8]对近30年中药治疗大肠癌用药规律进行分析也发现,补虚药和祛瘀药占较高比例。
根据大肠癌正气亏虚、癌瘀内阻的病机,清带汤以山药固元气,茜草、海螵蛸化滞祛瘀,龙骨祛痰化浊,牡蛎软坚散结[9]。张锡纯提出“大肠病则流白痢,子宫病则流白带,其理相同”的观点,为清带汤用于大肠癌的治疗提供理论基础。同时,张锡纯“尝考神农本经,龙骨善开癥瘕,牡蛎善消……兼具开通之力也……乌鱼骨即海螵蛸,茹芦即茜草,是二药为开通之品。”全方共奏扶正固本、消瘀化滞、软坚散结之功。
本研究通过CCK-8实验发现,清带汤对体外培养的人大肠癌HCT116、LoVo、HT29细胞增殖具有明显抑制作用,而对人肠上皮NCM460细胞增殖无明显影响。为进一步明确清带汤在体内的抑瘤作用,通过荷瘤裸鼠模型发现,清带汤能明显抑制裸鼠移植瘤生长。由此可见,清带汤在治疗大肠癌方面有良好的应用前景。
通过网络药理学对清带汤治疗大肠癌的潜在靶点进行GO功能注释及KEGG通路富集分析,排除非特异性通路及与大肠癌关联较小的通路后,发现其与PI3K-Akt通路密切相关,并发现核心靶点PIK3CG、AKT1、MTOR,基于核心靶点筛选出核心有效成分alizarin、mollugin、chitosan、diosgenin和(-)-taxifolin等。对核心靶点与有效成分进行分子对接结合能力分析,配体与受体蛋白间的结合受范德华力、静电相互作用及氢键等影响,通常AutoDock结合能越低说明结合能力越强。结果显示,各有效成分与核心靶点具有较高亲和力,推测清带汤可能通过调控PI3K-Akt信号通路抑制大肠癌。
研究表明,PI3K-Akt信号通路能调节大肠癌细胞增殖[10-12],是包括大肠癌在内的多种癌症常见的调控通路之一[13-15]。PI3K是一种细胞内脂质激酶,PI3K信号通路的激活可以由癌基因PIK3CA、PIK3CB、PIK3CG等诱发,也可以由受体酪氨酸激酶和活化的Ras等激活[16],PI3K将磷脂酰肌醇4,5二磷酸(PIP2)磷酸化为磷脂酰肌醇3,4,5三磷酸(PIP3),随后PIP3在细胞膜上积累导致AKT募集[17],AKT可以磷酸化和抑制凋亡及细胞周期阻滞蛋白[18],并激活mTOR[19]。PI3K突变常见于转移性或晚期癌症,表明其可能有助于癌细胞的进化和远处扩散[20]。PIK3CA的突变基因被描述为腺瘤-癌序列中的晚期事件[21]。AKT是PI3K信号传导的关键下游靶点,在大肠癌发生发展的各个环节都起着重要作用,包括增殖、侵袭、转移和预后[22]。正常结肠黏膜和增生性息肉AKT表达较低,而结直肠腺瘤和肿瘤中可高表达AKT[23]。本研究通过Western blot和qPCR检测清带汤对大肠癌细胞PI3K-Akt信号通路相关蛋白和基因表达的影响以验证网络药理学预测结果。结果显示,清带汤组大肠癌细胞p-AKT和p-mTOR蛋白表达较对照组下调;体内外实验中,清带汤组PI3K-Akt信号通路重要下游基因CDK2、BCL-2和MCL-1表达较对照组均显著下降。综合以上检测结果,推测清带汤可能通过调控PI3K-Akt信号通路抑制大肠癌细胞增殖。
综上所述,清带汤在体内外均能抑制大肠癌细胞增殖,同时具有一定的安全性。结合网络药理学和分子对接技术及实验验证,表明清带汤抑制癌细胞增殖与调控PI3K-Akt信号通路有关。现有研究结果既能体现中医学“异病同治”的辨证思维,又能体现中医药抗肿瘤减毒增效的治疗特色,同时为后期系统、深入阐明药物作用机制提供参考,丰富传统复方治疗大肠癌的思路与方法,扩大复方的适应证范围。对于清带汤中有效成分的挖掘尚需进一步深入。
