大气颗粒物表面液态水中典型多环芳烃光解的模拟研究*
2023-09-23李佳敏吴水平翁孙贤江世雄
李佳敏 张 宁 吴水平# 翁孙贤 江世雄
(1.厦门大学环境与生态学院,福建 厦门 361102;2.国网福建省电力有限公司,福建 福州 350003)
多环芳烃(PAHs)是一类具有“三致”效应的有毒有机污染物,大气环境中的PAHs主要来自生物质和化石燃料的不完全燃烧等[1]。由于PAHs的半挥发性特点,一旦进入大气环境就会在气相和颗粒相间进行平衡分配[2],再经光解和大气沉降的方式被清除[3-4]。研究显示,PAHs因可光解生成具有更强致癌和致突变效应的含氧和含氮衍生物而增大其生物毒性[5]。因此,了解大气环境中PAHs的环境行为,对于准确评估其环境健康风险有重要意义。
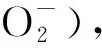
研究表明,大气颗粒物普遍表现为酸性[14-15],表面液态水中的Fe3+为10-7~10-2mol/L[16-19],在酸性条件下可构成光芬顿体系,催化降解液态水中PAHs[20]。草酸是大气颗粒物中重要组成部分[21],在大气降水中,草酸对总游离酸度的贡献率可达3.69%,在南方个别酸雨城市的贡献率更高[22]。此外,草酸能与Fe3+配合形成具有较高光反应活性的配合物,也可能影响PAHs的光解[23-24]。受光照强度、温度和湿度等环境条件的影响,大气颗粒物表面液态水含量及水相组成是动态变化的,水相共存物浓度的改变在一定程度上也会影响PAHs的光解过程。因此,研究大气颗粒物液态水中共存物组成及浓度变化对PAHs光解动力学的影响,探讨其光解促进机制,是进一步研究PAHs大气环境行为和健康风险的关键。
本研究通过构建大气颗粒物模拟液态水环境体系和大气细颗粒物(PM2.5)水提取液体系,进行蒽(Ant)、菲(Phe)和芘(Pyr)在UV光照射下的直接光照模拟,探讨酸度和共存物对3种PAHs光解动力学的影响,并对Phe的主要光解产物(9,10-菲醌)进行了定性定量分析,为进一步评估大气颗粒物液态水组成对PAHs光解的影响提供参考。
1 材料与方法
1.1 仪器与试剂
仪器:旋转式光化学反应仪(YM-GHT-VI);UV—可见(Vis)分光光度计(UV-1800PC);气相色谱质谱联用仪(5977/7890B);高效液相色谱仪(UFLC-20AD)。
试剂:Ant、Phe、Pyr的纯度均>98%;甲醇和正己烷为色谱纯;HCl、FeCl3和草酸均为分析纯;高纯水(电阻率为18.2 mΩ·cm)。
1.2 实验方法
1.2.1 模拟液态水环境体系构建
(1) 纯水体系。用甲醇溶解PAHs,然后用高纯水稀释成质量浓度为100 μg/L的反应液(初始pH为6.5),作为对照组。用HCl调节反应液pH分别为4.0、2.0,考察不同酸度条件下PAHs的光解过程。由于大气颗粒物的酸性会随着大气老化程度的增大而逐渐增强,pH为6.5、4.0、2.0的酸度体系在一定程度上还可代表大气颗粒物在初始、中度和重度老化阶段的情形。
(2) 草酸-铁混合体系。草酸与Fe3+所形成的草酸铁配合物通常具有较高的光化学活性[25]2898,能够影响环境中有机物的光解[26]。在进行草酸铁复合体系的光解实验前,分别用不同pH的反应液配置Fe3+溶液和草酸溶液,根据实验要求调节Fe3+、草酸浓度,考察Fe3+、草酸对PAHs光解的单独影响;在草酸铁复合体系中,先控制草酸为3.00 mmol/L、Fe3+为10 μmol/L,在不同pH下进行PAHs的光解模拟实验,分析草酸、Fe3+共存下对PAHs光解的影响;然后固定Fe3+为10 μmol/L,逐渐添加草酸,获得Fe3+∶草酸摩尔比(M)为1∶3、1∶30和1∶300的混合体系,考察M对PAHs光解的影响。
(3) 大气PM2.5水提取液体系。采用石英滤膜采集厦门城区秋季大气PM2.5样品,截取部分滤膜,纯水超声萃取,测定水溶性有机碳(WSOC)。在此基础上,制备接近大气云雾水中WSOC实际观测值的大气PM2.5水提取液体系考察其对PAHs光解的影响。
1.2.2 PAHs光解模拟
将反应体系置于光化学反应仪内,在20 ℃左右的环境下,以300 W高压汞灯作为光源,辐射波长为280~1 200 nm,UV光区主要辐射波长为300、313、334、366 nm,Vis光区主要辐射波长为405、434、544、575~582 nm,开启循环冷却系统和通风系统,进行PAHs光照模拟。光照实验设定取样时间为0、1、2、5、10、15、20、30 min,用1 mL正己烷进行液-液萃取,测定石英试管中PAHs的残留量。正式实验前,进行暗反应对照实验。结果显示,在光照30 min后,黑暗环境下静置30 min,3种PAHs的残留量变化不到4%,表明光照之外其他因素的干扰可忽略。研究PAHs光解产物时,光照实验的取样时间为1、5、10、20、30、45、60 min。
1.2.3 仪器分析
为了解3种PAHs本身结构的差异,采用UV—Vis分光光度计对其进行全波长扫描(200~800 nm,扫描间隔1 nm)。为确定水相共存物是否具有光屏蔽效应,对不同pH的反应液、草酸溶液和PM2.5水提取液也进行UV—Vis分光光度扫描分析。
PAHs的残留量分析采用气相色谱质谱联用仪,配备HP-5毛细管色谱柱(30 m×0.25 mm×0.25 μm),以高纯氦气作为载气,进样量1 μL,不分流进样,初始炉温80 ℃,以15 ℃/min升至210 ℃,再以5 ℃/min升到280 ℃,保持1 min。质谱采用电子轰击(EI)源(70 eV),以单离子扫描(SIM)模式进行检测,Ant、Phe、Pyr的定量离子碎片分子量分别为178、178、202,外标法定量。
分别对纯水体系(pH=6.5)、Fe3+体系(pH=2.0、Fe3+为10 μmol/L)和大气PM2.5水提取液体系(WSOC为0.25 mg/L)的光解实验进行Phe及其光解产物9,10-菲醌的液相色谱分析。液相色谱柱为Agilent ZORBAX SB-C18柱,柱温30 ℃,进样量30 μL,流速1 mL/min,流动相选用甲醇水溶液,甲醇∶水体积比为90∶10,检测波长为264 nm,外标法定量。
1.3 光解动力学拟合
采用一级动力学方程对PAHs的光降解过程进行分析,拟合公式见式(1):
-ln(Ct/C0)=kt
(1)
式中:Ct和C0分别为t时刻和初始时刻反应液中PAHs的质量浓度,μg/L;k为PAHs的表观光解速率常数,min-1;t为光降解时间,min。当Ct/C0<1%时,认为PAHs已经降解完全。
2 结果与讨论
2.1 纯水体系下Ant、Phe和Pyr的直接光解
UV光照能显著加快PAHs的光解反应,但不同PAHs的光解速率常数存在差异。Ant的光解可分为两个阶段,第1阶段(0~2 min)与第2阶段(2 min后)光解速率差异明显,第1阶段Ant(Ant-1)的光解速率常数明显大于第2阶段Ant(Ant-2),而Phe和Pyr的光解速率常数一直维持在较低水平(见表1)。分析原因,Ant、Phe和Pyr的UV—Vis吸收峰都集中在200~400 nm,且Ant的吸收峰面积明显大于Phe和Pyr。在高压汞灯照射下,Ant的吸收光谱与光源的发射光谱重叠度更大,更容易发生光解。Ant-1光解生成的反应中间体可与Ant竞争光子,使得Ant-2的光解速率降低[27]。有研究表明,在夏季中午太阳光照射下,Ant、Phe和Pyr的光量子产率分别为4.2×10-3、3.5×10-3和2.1×10-3,进一步说明Ant的光反应活性强于Phe和Pyr[28]。

表1 不同酸度条件下纯水体系中PAHs的光解速率常数Table 1 Photolysis rate constant of PAHs in pure aqueous solution with different acidity min-1

2.2 草酸-铁混合体系中PAHs的光解
2.2.1 Fe3+对3种PAHs光解的影响
在Fe3+为10 μmol/L时,不同pH条件下3种PAHs的光解都遵循一级动力学反应方程。图1为添加Fe3+后不同PAHs光解速率常数与未添加Fe3+时光解速率常数的比值(RFe)变化。针对pH=6.5的中性条件及Ant-1,Fe3+的催化效果不明显,甚至表现为抑制作用。这是因为芬顿反应的最佳pH在2.5~4.0,当pH>4.0时,Fe3+与OH-配合或形成沉淀,会抑制Fe2+的再生和·OH的产生,影响PAHs光解。Ant-1以直接光解为主,溶液中Fe3+可以形成对溶液透光度产生影响的配合物和胶状物,抑制Ant-1的光解。Fe3+对不同PAHs的催化促进作用呈现Ant-2>Phe>Pyr的趋势,这种差异与各PAHs本身的活性相关,即反应活性强的PAHs受Fe3+催化光解的影响也更大。另外,Ant-1直接光解产生的配合物在第2阶段生成Fe2+和·OH,·OH的存在也加速了Ant-2的光解。
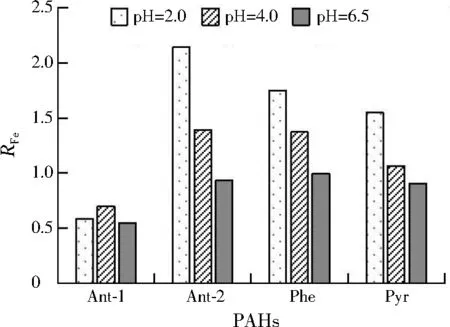
图1 不同酸度下Fe3+对PAHs光解速率常数的影响Fig.1 Effect of Fe3+ on photolysis rate constant of PAHs under different acidity
当大气颗粒物表面液态水含量或酸度发生改变时,水相中Fe3+浓度也会出现相应变化。鉴于Ant-1以直接光解为主,与Fe3+的浓度大小并无相关性,因此仅考察不同浓度Fe3+在pH=2.0时对Ant-2、Phe、Pyr的影响。由表2可知,Ant-2的光解速率常数随Fe3+浓度的增大呈波动变化趋势,在Fe3+为50 μmol/L时光解速率常数最大。Fe3+较低时(5 μmol/L),光屏蔽作用超过了自由基的促进作用,而当Fe3+增大到100 μmol/L时,Fe3+与·OH发生反应或复合,Fe3+的光屏蔽效应也有所增大,影响了芬顿体系的有效性[32],导致Ant-2光解速率常数下降。Phe和Pyr的光解速率常数随Fe3+浓度的升高而增大,在Fe3+超过50 μmol/L后,两者的光解动力学曲线呈明显的3阶段变化。第1阶段的光解速率增加主要因为Fe3+羟基配合物的促进作用,第2、3阶段的光解速率明显降低,可能与反应体系中H+不断被消耗,Fe3+的反应活性逐渐降低和·OH浓度的减少有关,Fe3+达到100 μmol/L时会使光解分段的拐点提前。

表2 Fe3+对PAHs光解速率常数的影响Table 2 Effect of Fe3+ on photolysis rate constant of PAHs min-1
2.2.2 草酸对3种PAHs光解的影响
比较3.00 mmol/L草酸添加前后PAHs光解速率常数比值(Roxa)的变化,结果见图2。草酸对3种PAHs光解的影响并不一致,Ant-1、Phe的光解受到抑制,Ant-2和Pyr的光解得到促进。从图2还可以看到,添加草酸后Ant和Pyr光解速率常数随pH的变化趋势相反。

图2 不同酸度下草酸对PAHs光解速率常数的影响Fig.2 Effect of oxalate on photolysis rate constant of PAHs under different acidity
为进一步考察草酸的影响,在pH=6.5时设定草酸摩尔浓度分别为0.03、0.30、3.00 mmol/L进行光照模拟。由表3可见,随草酸浓度增加,Ant-1的光解速率先增大后减小,但始终低于纯水组的1.824 7,说明草酸有抑制光解的作用;但中高浓度的草酸能促进Ant-2光解。Phe在不同实验组间的光解速率差异不大,均低于纯水组的0.154 8,表明草酸能够抑制Phe的光解,但草酸浓度变化对抑制作用影响不大。Pyr的光解速率随草酸浓度的增加而增大,当草酸摩尔浓度为3.00 mmol/L时,Pyr的光解速率常数达到最大值。目前关于低分子量有机酸影响污染物光解的研究较少,相关作用机制也不清楚。有研究显示,羧酸可抑制普萘洛尔(1-异丙基氨基-3-(萘-1-氧基)丙-2-醇)的光解,且多元羧酸的抑制作用比一元羧酸强,认为中性条件下有机酸会阻止污染物分子转化为激发单重态和激发三重态,而产生对光解的抑制作用[33]。草酸在400 mmol/L以下具有较强的光吸收能力,自身光解能够产生一些还原性自由基,如RCO·等;同时羧酸作为电子供体,能通过光致电子转移的方式传递电子,从而引发还原反应[34]。本研究中,不同PAHs的光解受草酸的影响不同,可能还受草酸与化合物之间相互作用的影响[35]1032-1038,具体还需进一步的研究。
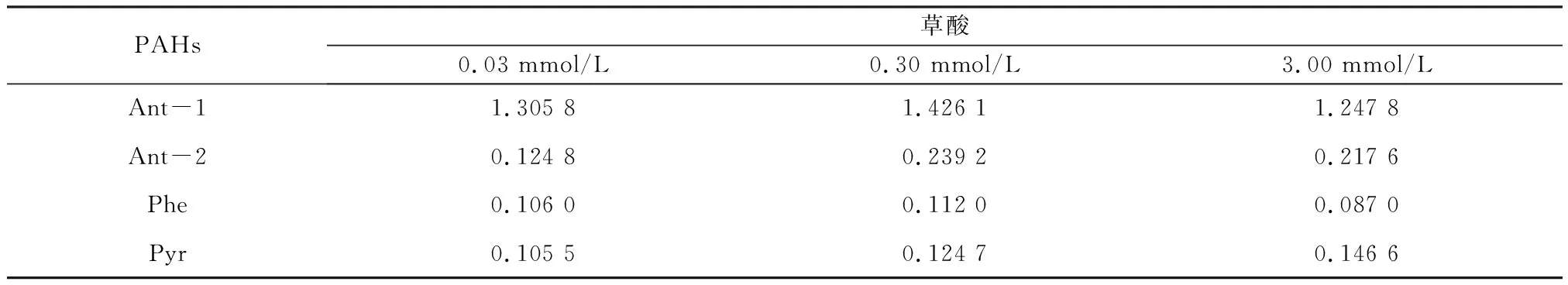
表3 草酸对PAHs光解速率常数的影响Table 3 Effect of oxalate on photolysis rate constant of PAHs min-1
2.2.3 草酸-铁混合体系对3种PAHs光解的影响
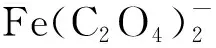
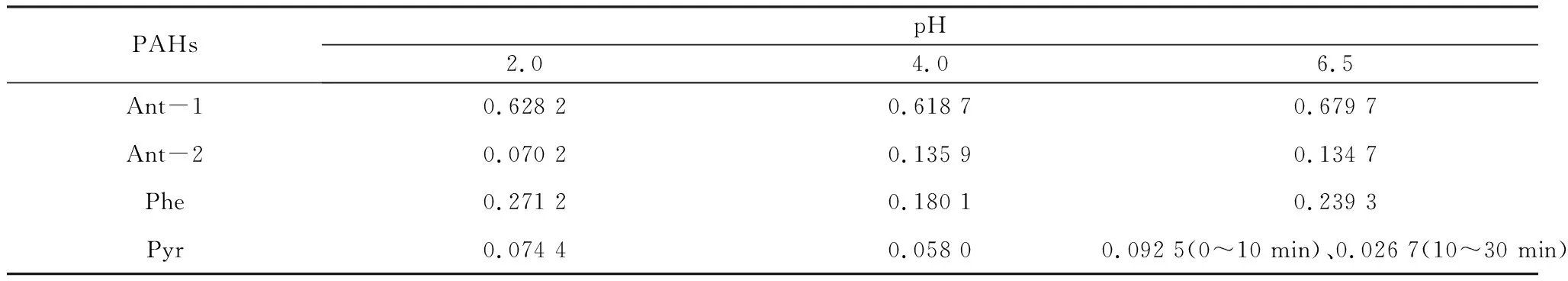
表4 不同酸度下草酸-铁混合体系中PAHs的光解速率常数Table 4 Photolysis rate constant of PAHs in the mixture of oxalate and Fe3+ under different acidity min-1
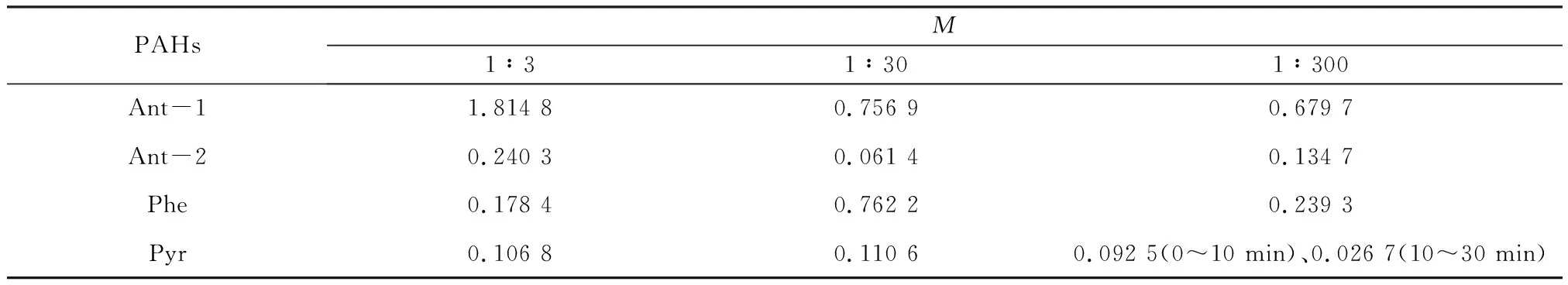
表5 草酸-铁混合体系中M对PAHs光解速率常数的影响Table 5 Effect of M on photolysis rate constant of PAHs in the mixture of oxalate and Fe3+ min-1
M为1∶3、1∶30时,Pyr光解速率常数受草酸相对浓度的影响较小。当M为1∶300时,光照10 min后Pyr出现光解速率常数明显降低的情况,说明当体系中草酸浓度过高时,草酸-铁混合体系能够抑制Pyr的光解。
2.3 大气PM2.5水提取液体系中3种PAHs的光解
大气PM2.5水提取液的溶质(以WSOC来表征)浓度对PAHs的光解速率有影响。与纯水体系相比,WSOC存在时PAHs的光解速率出现明显下降,主要原因是WSOC对190~230 nm的UV光有较强的吸收(类似棕碳),对入射光有一定的屏蔽作用。调节WSOC质量浓度为0~5 mg/L,随着WSOC含量增大,WSOC对Ant和Phe的光解抑制作用增大,但对Pyr的光解抑制作用逐渐减小,在WSOC超过1 mg/L后甚至变为促进作用。除WSOC的光屏蔽作用外,Cl-的存在对水中的·OH也有一定的猝灭作用[38],导致Cl-对Ant和Phe光解的抑制作用明显。WSOC对Pyr的光解促进作用可能与Pyr的UV-Vis吸收峰不同有关,Ant、Phe和WSOC的主要吸收峰都集中在300 nm以内,而Pyr的吸收峰范围可延伸至350 nm,因而能吸收更多光能。此外,Ant和Phe的正辛醇/水分配系数(lgKow)分别为4.54、4.57,低于Pyr的5.18[39],说明Ant和Phe与WSOC的结合相对较弱,其光解过程受WSOC本身的光屏蔽作用影响更大。
为进一步考察WSOC和Fe3+混合体系对PAHs光解的影响,将不同浓度的Fe3+加入到WSOC为0.25 mg/L的大气PM2.5水提取液中以构建芬顿体系。由于Ant的反应活性强,以直接光解占主导,故只对Phe和Pyr的光解进行探讨。由图3可见,在同等Fe3+浓度条件下,大气PM2.5水提取液体系中Phe的光解速率常数小于纯水体系,且两者之间的差异随Fe3+浓度的增加而增大。Pyr在两种模拟体系中的光解速率常数与Fe3+浓度之间有一定的线性关系,但大气PM2.5水提取液中Pyr光解速率的变化率相对偏低。这种差异表明,大气PM2.5水提取液中光芬顿产生·OH的能力小于纯水体系,WSOC的光屏蔽效应减少了·OH的产生量,但并未阻断光芬顿反应。综上,可推测碳质气溶胶液态水中的PAHs相比于铁质气溶胶液态水有更长的大气寿命。
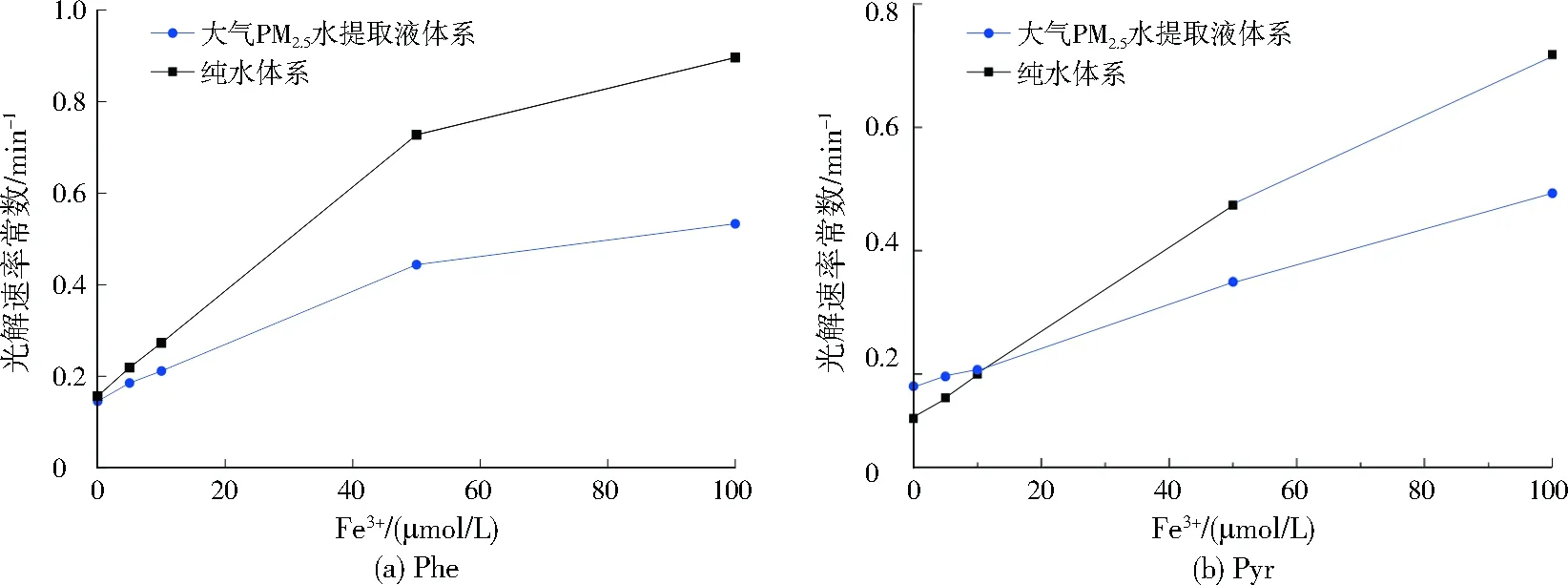
图3 大气PM2.5水提取液和纯水体系中Phe、Pyr的光芬顿反应Fig.3 Photo-Fenton reaction of Phe and Pyr in PM2.5 water extracts and pure water solutions
2.4 光解产物分析
纯水体系、Fe3+体系和大气PM2.5水提取液体系光解过程中Phe及其光解产物9,10-菲醌含量变化见图4。光解前期,9,10-菲醌的生成都伴随Phe浓度的明显下降,但9,10-菲醌最大浓度及出现的时刻有差异。纯水体系、Fe3+体系和大气PM2.5水提取液体系中9,10-菲醌生成量在光照45、20、30 min时达到最大值,分别为67.5、62.0、62.0 μg/L,表明9,10-菲醌是Phe光解的主要产物。Phe分子中9和10号位的Dewar反应活性数略低于其他位置,反应所需活化能低,光照过程中最容易受到攻击,加氧生成9,10-菲醌[40]。在9,10-菲醌产生量达到峰值后,随着光照时间的延长,其浓度也出现下降,说明9,10-菲醌不是Phe光解的最终产物,可继续发生开环反应生成邻苯二甲酸及其衍生物,最后分解为小分子[41]。相比于纯水体系,Fe3+体系中9,10-菲醌的浓度峰值略低,浓度出现下降的时间也提前,可能是Fe3+体系中·OH产生量大,在促进Phe光解的同时,也能够加快9,10-菲醌的进一步氧化降解。在大气PM2.5水提取液体系中,9,10-菲醌的生成和降解达到平衡的时刻相比于纯水体系提前,降解速率也更缓慢,推测大气PM2.5水提取液可延缓中间产物的降解(WSOC的光屏蔽作用),使其具有更长的大气寿命而增加PAHs人群暴露风险。
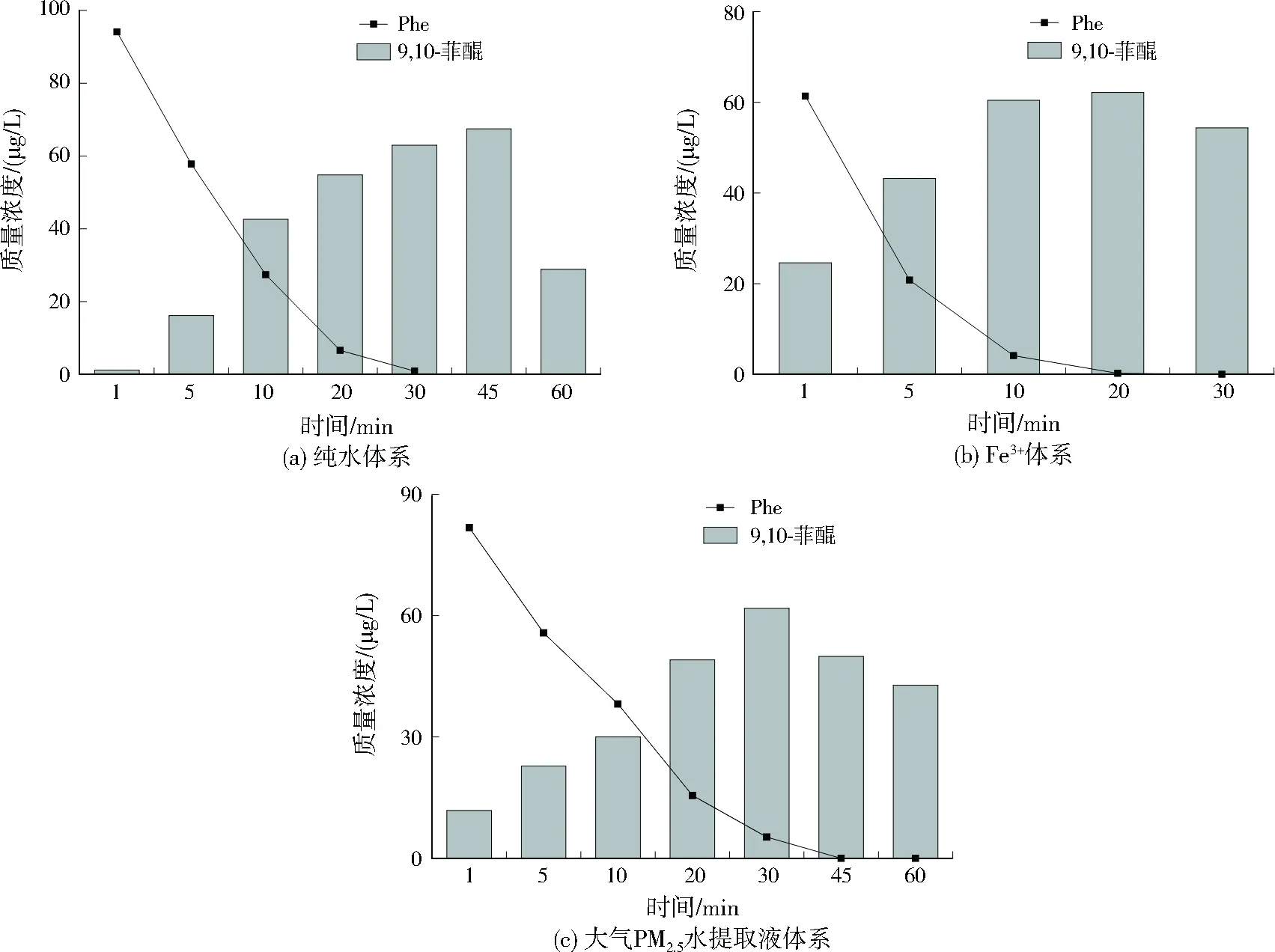
图4 不同体系中Phe和9,10-菲醌随光照时间的变化Fig.4 The variation of Phe and 9,10-phenanthraquinone with time in different reaction systems
3 结 论
(1) 受分子结构、化合物吸收光谱和光量子产率等因素影响,纯水体系中3种PAHs的光解速率为Ant>Phe>Pyr。当pH降低时,Pyr的光解加快,Ant的光解减弱,而Phe的光解变化不大。Fe3+构成的芬顿体系在酸性条件下对PAHs光解的促进作用增强,且促进作用受Fe3+浓度影响。草酸对PAHs光解的影响除酸度作用外,草酸与PAHs之间的相互作用也不能忽略。尽管Fe3+的草酸盐配合物具有光反应活性,但对不同PAHs光解的影响存在促进或抑制不一致的情况,且当体系中草酸相对浓度更高时,对Ant光解产生抑制,对Phe光解为先促进后抑制,但对Pyr光解的影响较小。
(2) 大气PM2.5水提取液对Ant和Phe光解表现为抑制,在WSOC浓度较高时对Pyr光解表现为促进。比较Fe3+在大气PM2.5水提取液体系与纯水体系对PAHs的影响,由于WSOC光屏蔽效应,Phe和Pyr在大气PM2.5水提取液中的光解速率常数随Fe3+的变化率低于纯水体系。因此,可推测碳质气溶胶液态水中的PAHs相比于铁质气溶胶有更长的大气寿命。
(3) 不同液态水环境中,9,10-菲醌都是Phe的主要光解产物,受水相共存物的影响,9,10-菲醌的大气寿命存在不同。
