HDXRF法农田土壤镉测定结果准确度评价与精准校正模型构建①
2023-09-22傅赵聪吴春发骆永明
傅赵聪,王 翀,吴春发*,骆永明,刘 东
HDXRF法农田土壤镉测定结果准确度评价与精准校正模型构建①
傅赵聪1,王 翀1,吴春发1*,骆永明2,刘 东1
(1 南京信息工程大学农业资源与环境系,南京 210044;2 中国科学院土壤环境与污染修复重点实验室(南京土壤研究所),南京 210008)
以甘肃白银某污灌区重金属污染农田土壤为研究对象,对影响高精度便携式X荧光光谱(HDXRF)法总镉(CdT)测定精度的主要因素进行了筛选,分别研究了土壤水分、有机质类型与含量、土壤类型对HDXRF法CdT测定的影响,并采用相对误差(RE)、相对标准偏差(RSD)和决定系数(2)对测定结果的准确度和精密度进行了评价。结果表明:HDXRF法CdT测定的RE≤10%、RSD≤10%、2>0.99,符合农田土壤环境质量监测技术规范和美国环境保护署标准的准确度和精密度规定。HDXRF法CdT测定结果随着土壤水分含量的增加呈指数衰减趋势,衰减方程为=0.803e–1.3284x,衰减系数(μ)为–1.328 4,2为0.984 5。HDXRF法CdT测定结果与有机质含量呈显著的负相关关系(= –0.955),且腐殖酸(HA)比泥炭(Peat)对测定结果的影响更大,HA与测定结果的校正方程为= –1.555+ 0.780,2为0.934 4。土壤类型对HDXRF法CdT测定结果存在一定的影响,相对于红壤和水稻土,灰钙土的测定结果与传统实验室分析方法测定结果更接近。总之,虽然HDXRF法CdT测定结果受多种因素影响,但通过校正模型校正,其校正结果的可靠性能够满足Cd污染农田土壤精准调查需求。
X射线荧光光谱法;重金属;快速检测;影响因素;校正方程
污水灌溉是导致我国矿区周边农田土壤重金属污染的主要原因之一,矿区周边农田土壤重金属污染导致农产品重金属超标现象十分普遍,已严重威胁我国粮食安全,急需开展污染调查与修复[1–3]。精细调查是农田土壤重金属污染高效低耗修复的前提条件,而精细调查离不开大量土壤样品的采集与精准分析。虽然传统的实验分析方法精度高、误差小,但其前处理和分析过程繁琐、费时费力且成本高,易产生二次污染,难以推广应用[4]。X射线荧光光谱(XRF)法,利用X射线光管发出的初级X射线照射样品,样品中原子的内层电子被激发,当外层电子跃迁时产生特征X射线,通过分析样品中不同元素产生的特征荧光X射线波长(或能量)和强度,从而获得样品中的元素组成与含量信息,可以达到定性定量分析的目的。早在20世纪50年代商用X射线发射荧光光谱仪的问世,使得X射线光谱学技术进入了实用阶段;至60年代能量色散型X射线光谱仪(EDXRF)的出现,促进了X射线光谱学仪器的迅速发展,并使现场的原位X射线光谱分析成为可能;至80年代初,XRF法已成为一种成熟的分析方法,是实验室和现场分析主、次量和痕量元素的首选方法之一,具有不破坏样品、样品制备简单、分析速度快、分析精度高等优点,在无损分析和原位分析中具有不可替代的地位[5–7];21世纪初国际标准组织(ISO)、美国环境保护署(EPA)和职业安全与健康研究所(NIOSH)先后将该方法作为土壤重金属分析的标准分析方法之一[8],我国也在2015年将其列为土壤和沉积物无机元素测定的标准分析方法之一。
随着激发源和探测器等仪器部件小型精密化发展,便携式X射线荧光光谱仪(PXRF)的出现,极大推动了XRF分析技术的商业应用;而采用多个单色光激发样品的高精度便携式X荧光光谱仪(HDXRF)的出现,使土壤中超低含量重金属的快速分析得以实现。相比PXRF,HDXRF检测限和精度都有了很大的提高,理论上甚至可以与实验分析方法相媲美[9-10],然而其检出限和检测精度易受到如粒径、均匀性和表面条件等物理基质效应,水分和有机质含量等理化性质,及元素间光谱干扰的化学基质效应等因素影响[11-12],原始测定结果难以直接满足农田土壤重金属污染精准调查的需求。虽然国内外学者在HDRXF土壤重金属检测的影响因素、模式与校正方法方面开展了一些研究[13],并建立了一些校正模型,但这些校正模型大多是建立在基于特定区域统计学上的简单定量校正,而很少涉及基于影响机制机理上的定量校正,致使校正模型无法推广应用。
1 材料与方法
1.1 研究区概况与样品采集
研究区位于甘肃省白银市白银区,属温带大陆性半干旱气候,年均气温6 ~ 9℃,年降水量180 ~ 450 mm,年蒸发量达1 500 ~ 1 600 mm,土壤类型以灰钙土为主。白银是我国重要的有色金属工业生产基地,由于水资源缺乏,城郊农民长期截流东大沟和西大沟含有重金属的工业污水灌溉,导致白银市郊区土壤Cd等重金属污染较为严重[15]。
本研究分别在东大沟和西大沟2个典型污灌区各选择1个样区(面积分别为9.09 hm2和10.64 hm2)开展土壤重金属污染精细调查。在两个样区采用网格布点法(20 m×20 m)共布置880个采样点,每个样点采用5点取样法采集耕层土壤混合成1个土样。所有土样带回实验室后在室温下风干,剔除植物残体、石块等杂物后研磨至2 mm备用。考虑到样品数量大,实验室分析费时费力,采用HDXRF法测定所有土壤样品CdT含量,根据HDXRF法 CdT原始测定结果采用浓度梯度法分段筛选,分别筛选38个和58个土壤样品用于实验室分析,以构建校正模型并评价HDXRF法CdT测定结果的准确度。
1.2 样品处理与分析方法
1.2.1 HDXRF 仪器校正与性能评价 本研究采用的HDXRF(E-max,美国 XOS 公司)配备高性能硅漂移探测器(SDD)和双曲面弯晶晶体(DCC)。前人研究表明,PXRF内置的基本参数法校正模型并不能提供完整的仪器性能和最佳检测精度,采用经验系数校正法可有效提高HDXRF测定结果的准确度[16]。本研究拟选择8种国家土壤标准物质(GSS)和2种水系沉积物标准物质(GSD),通过分析国家土壤标准物质HDXRF测定结果与认证值之间的线性相关性,采用线性回归和分段线性回归等方法构建校正模型,校正HDXRF法Cd的测定结果[17-18]。根据HJ 168—2020[19]、NY/T 395—2012[20]和美国环境保护署标准[21],分别采用相对误差(RE)、相对标准偏差(RSD)和决定系数(2)3个指标对仪器的准确度和精密度进行评价[22],当RSD≤10%、RE≤10% 和2= 0.85 ~ 1,则表明仪器准确度和精密度符合“确定性”标准[10,23]。
1.2.2 不同水分含量土壤样品的制备 为了定量研究水分含量对HDXRF法CdT测定结果的影响,本研究选取100目采自研究区的灰钙土(CdT0.8 mg/kg),经干燥处理后(105℃ 烘箱烘烤6 h),分别添加干土质量的0%、2%、5%、10%、15%、20% 和25% 的去离子水,形成不同水分含量梯度,放置于冰箱冷藏室(0 ~ 4℃)12 h,保证水分在土壤中完全分散,采用HDXRF法及时测定CdT,具体操作步骤参考Turner和Taylor[24]方法。
1.2.3 不同类型和含量有机质土壤样品的制备 为了定量研究有机质含量和类型对HDXRF法CdT测定结果的影响程度,采取先彻底去除供试土壤(取自西大沟研究区)有机质再统一添加有机质的方法。其中,供试土壤有机质去除采用Ravansari和Lemke[25]提出的有机质消除方法,即将供试土壤(CdT0.8 mg/kg)放入马弗炉内600℃ ± 20 ℃ 灼烧3 h,反复灼烧2次,保证有机质彻底去除。选择添加的有机质替代物为腐殖酸(HA)和富营养泥炭(Peat)(表1),分别向供试土壤中添加干土质量的0%、0.5%、1%、2%、4% 和6% 的有机质替代物,形成不同有机质含量梯度。保持土壤水分在田间最大持水量的70%,养护2周,风干磨碎过100目筛,待测。

表1 有机质替代物的相关信息
1.2.4 加标土壤样品的制备 为了定量研究灰钙土等土壤类型对HDXRF法CdT测定结果的影响,选择无污染的红壤和潴育型水稻土作为对比研究对象。根据GB15618—2018《土壤环境质量农用地土壤污染风险管控标准(试行)》[26]中Cd的筛选值和管控值,分别通过向供试土壤(20目)中逐滴加入不同体积的标准溶液配置9个浓度梯度的土壤(0.2、0.3、0.4、0.6、0.8、1.5、2.0、3.0和4.0 mg/kg),用玻璃棒搅拌使其与土壤均匀混合。将样品放置恒温培养箱(25℃ ± 3℃)中培养,并在培养杯上覆盖一层带有数个通气小孔的薄膜,以防水分快速蒸发,培养时间60 d,其间每隔3 d向土壤中添加适量去离子水以使土壤含水量保持在70% 田间持水量附近。培养结束后,将样品风干磨碎过100目筛备用,分别采用HDXRF法和实验室分析方法测定CdT。
土壤CdT测定的HDXRF异位分析方法:将聚丙烯膜(厚度约12 μm,X 射线专用)无褶皱覆于测量杯底,颈圈密封,选取不少于2.0 g的100目风干土(含水量<5%)平铺于测量杯内,将土样压实确保测试面平整,随后将测量杯放入检测器窗口,关闭安全隔板,设定测量时间300 s。每个样品测定3次取平均值。全程使用标准物质GSS-4进行质量控制,每检测 10个样品回测GSS-4 1次。
稻米的品质,除受品种的遗传特性支配外,外界环境如气候、土壤、肥料及栽培措施等也有一定的影响[9]。因此,良好的栽培技术,不仅可使优质稻米的品质不致变劣,而且在某些情况下也有可能使品质有所提高。在施用公主岭霉素防治水稻稻瘟病的同时,稻米的品质也发生了改变。施用公主岭霉素的处理,稻米的外观品质、食味品质和营养品质均有一定程度的提升。该研究中,施用公主岭霉素后稻米出糙率降低,不完善粒降低,食味值提升,外观性状提升,硬度降低,黏度升高,平衡度升高,脂肪含量降低,直链淀粉含量提高(表5)。
土壤CdT测定的实验室分析方法:参照GB/T17141—1997《土壤质量铅、镉的测定石墨炉原子吸收分光光度法》[14]以及江苏省地质调查研究院测试所依据《全国土壤污染状况详查土壤样品分测试方法技术规定》[27]第一部分土壤无机项目分析测试方法2-1编制的《全国土壤污染状况详查土壤样品无机项目金属元素分析ICP-MS 法》(NJTC/DM08- CH22)①李如燕. 全国土壤污染状况详查土壤样品无机项目金属元素分析ICP-MS法(NJTC/DM08-CH22). 2018.,采用盐酸–硝酸–氢氟酸–高氯酸消化,ICP-MS法测定。为确保分析结果的准确性,每批样品设置3个空白,设置10% 的样品为平行样品,全程使用土壤标准物质 GSS-4和GSS-1a进行质量控制。
1.2.5 土壤Cd化学形态分析方法 为研究不同类型和含量的有机质添加对土壤Cd化学形态的影响,采用张朝阳等[28]提出的改进BCR法分析培养后土壤Cd的化学形态。该方法将土壤Cd化学形态分为弱酸提取态(F1)、可还原态(F2)、可氧化态(F3)及残渣态(F4)。
1.3 数据统计分析
采用Excel 2019计算相对误差(RE)和相对标准偏差(RSD), SPSS 26进行单因素方差分析(ANOVA)和Pearson相关性统计分析,Origin 2021对传统实验分析法和HDXRF法测定结果进行拟合建立回归方程并作图。
2 结果与分析
2.1 传统实验室分析方法准确度与精密度
土壤重金属快测结果表明,东西大沟土壤CdT污染程度存在较大差异,因此在实验室分析中按区域分2个批次进行分析,每次分析分别添加2种标准物质(GSS4和GSS-1a)3个平行,此外随机选取10% 的样品作为平行样。由于前期模拟试验是分批开展的,在样品的分析测定过程中也采用上述质控方法进行分析。结果表明,所有平行样品的RSD均在允许限内,合格率为 100%。表2为标准物质分析结果,农田土壤中CdT平行样品测定结果精密度和土壤标准物质回收率,满足土壤检测平行样测定结果的精密度和准确度允许误差,表明实验室测定结果符合我国农田土壤环境质量监测技术规范的质控要求。
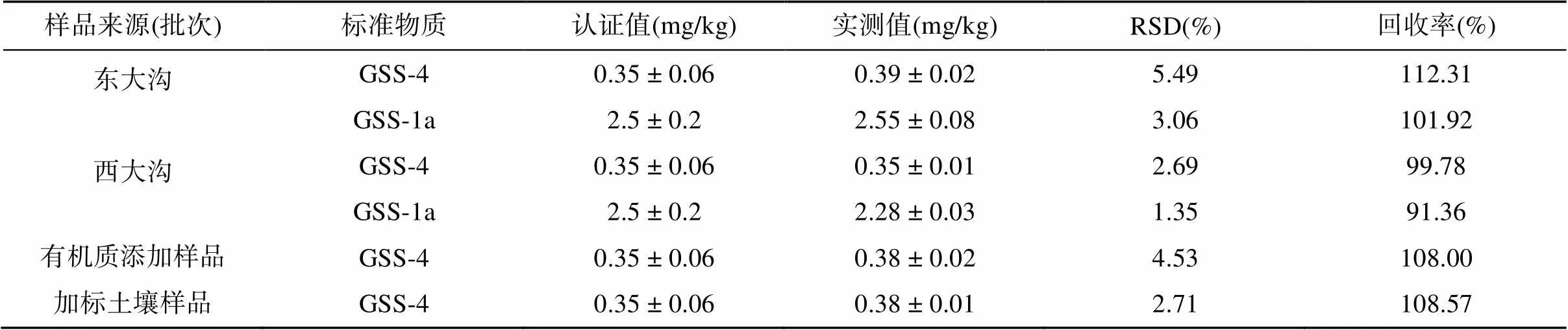
表2 传统实验室分析法质量保证和质量控制结果
注:根据NY/T395—2012[20]要求,每批样品选取10% 的样品作为平行样品,进行实验室分析质量控制。
2.2 HDXRF法准确度与精密度
2.2.1 HDXRF法检出限(MDL) 参考HJ168—2020《环境监测分析方法标准制订技术导则》[19]的规定,对土壤标准物质GSS-4(CdT:0.35 mg/kg ± 0.06 mg/kg)进行21次重复测定,结果表明,土壤中CdT测定范围为0.310 ~ 0.374 mg/kg,计算标准差()为0.0207,根据公式MDL=2.528×(2.528为21次平行测定的取值),计算得出CdT的检出限为0.05 mg/kg,测定下限为0.20 mg/kg,满足GB15618—2018[26]中CdT最低筛选值要求。
2.2.2 HDXRF法准确度与精密度 土壤标准物质的HDXRF法测定结果见表3,RE为–35.38% ~ 50.70%,RSD为0.61% ~ 16.67%,HDXRF法测定结果整体低于传统实验室分析方法测定结果,CdT的测定值和认证值具有较好的线性相关性,相关性达0.999 7,校正方程为= 0.948+ 0.0277(为HDXRF法测定值,为土壤标准物质认证值)。当土壤标准物质认证值低于HDXRF法测定下限时,HDXRF法测定结果存在较大误差。当CdT高于测定下限时,RSD和RE均在 ± 10% 以内,表明HDXRF法CdT测定结果的准确度和精密度符合“确定性”标准。
2.3 研究区土壤CdT的HDXRF法测定结果准确度评价
由图1可知,2个样区土壤CdT的HDXRF法测定结果与传统实验室分析方法测定结果具有较好的线性相关性,相关系数分别为0.900 2和0.972 2,表明HDXRF法速测结果对农田土壤Cd污染调查具有一定的指示作用。但HDXRF法测定结果与传统实验室分析方法测定结果具有一定的波动性误差变化,部分HDXRF法值测定误差较大,造成HDXRF法测定结果的RE不能满足10% 的要求。本研究发现,西大沟和东大沟样区,RE的绝对值范围分别为2.82% ~ 52.94% 和2.13% ~ 25.53%,RE平均值分别为20.17% 和10.14%,RE超过10% 的样品分别有46个和17个。
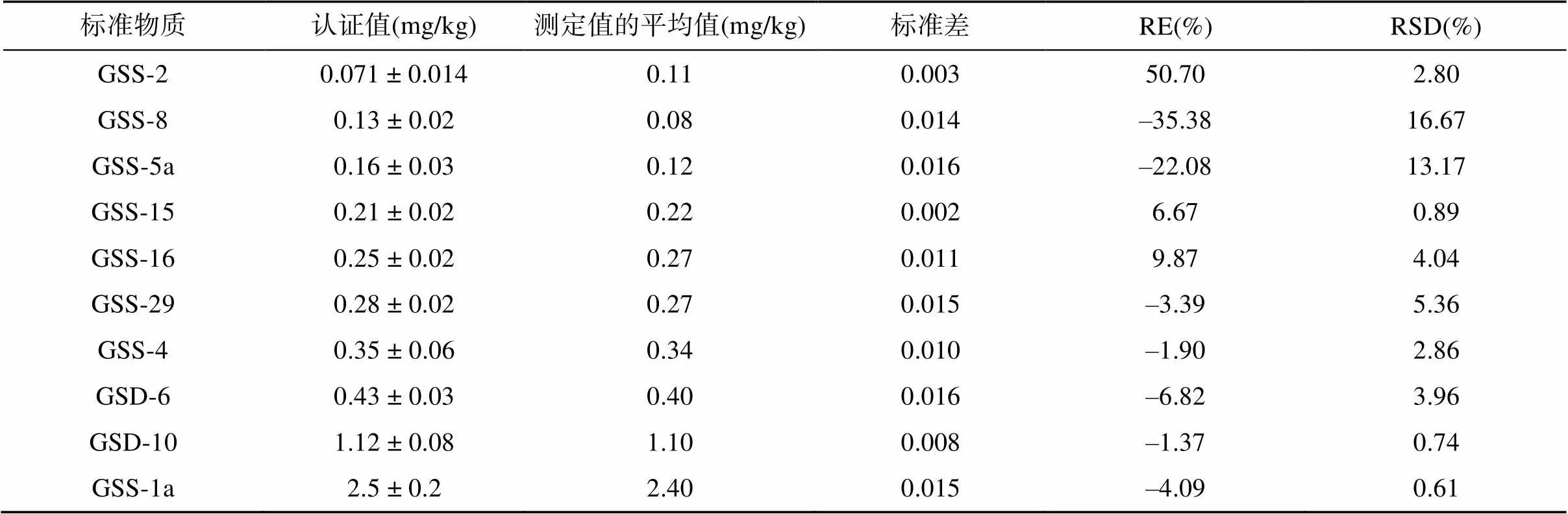
表3 土壤标准物质中CdT含量的认证值与HDXRF法测定值对比
通过建立基于相关性的统计学校正模型,校正后的HDXRF法测定结果与传统实验室分析方法测定结果仍然具有波动性误差变化,且仍有部分样品RE仍超过10%;西大沟和东大沟测定结果经校正后,RE平均值分别下降了7.34% 和1.4%,RE超过10% 的样品分别减少了22个和3个,表明基于统计学的校正模型无法满足农田土壤Cd污染精准调查的需求。导致HDXRF法较大检测误差的原因可能与土壤样品的水分和有机质等影响因素有关,因此,需要构建基于各因素影响机理的定量校正模型,从而提高校正结果的可靠性。
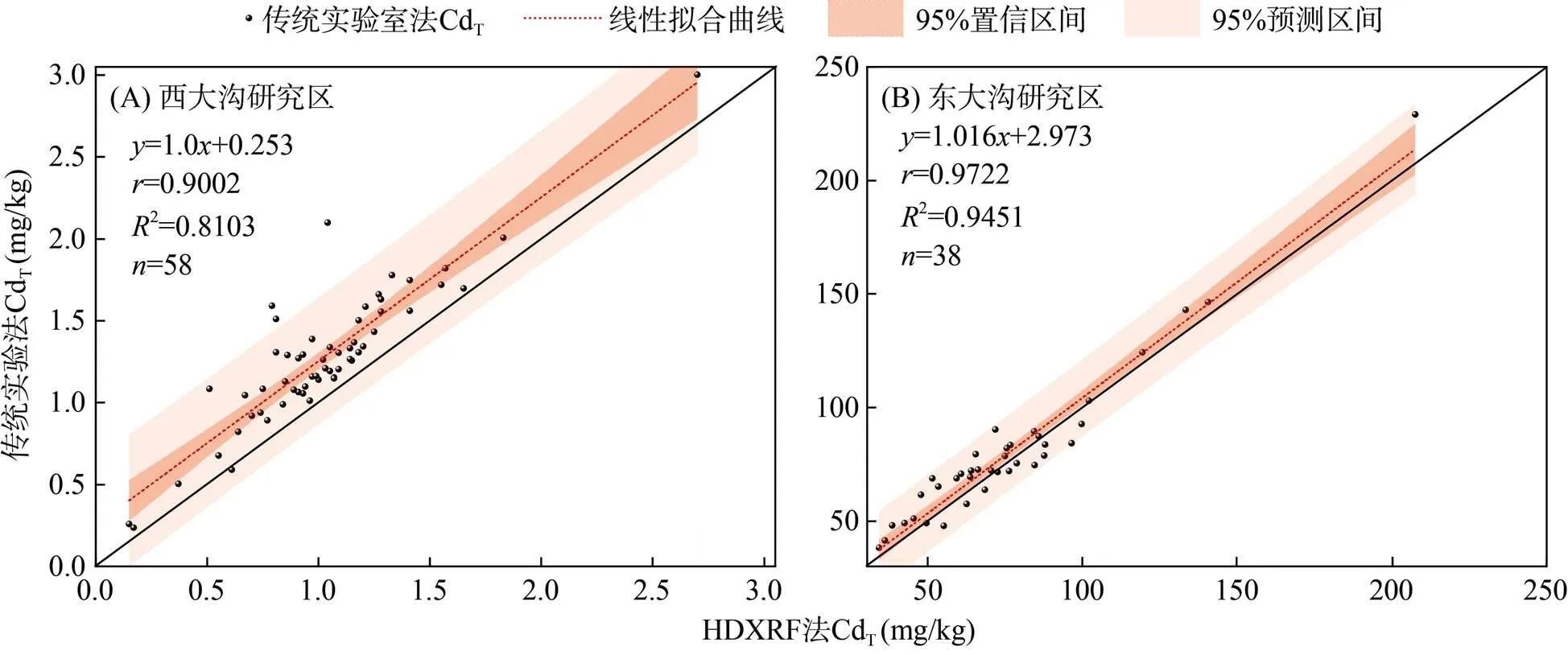
图1 2个样区传统实验室分析方法与HDXRF法土壤CdT测定结果对比
2.4 不同因素对HDXRF法CdT测定结果的影响
2.4.1 土壤水分含量的影响 随着水分含量的增加,HDXRF法CdT测定结果呈指数衰减趋势,衰减函数方程为=0.803e–1.3284x,2为0.984 5,衰减系数(μ)为–1.328 4,μ是特征 X 射线被样品中水分吸收引起的有效衰减系数(图2)。方差分析结果表明,当水分含量>5% 时,测定结果存在显著差异(<0.05)。土壤水分每增加1个百分点会导致CdT的HDXRF法测定结果下降 0.90% ~ 1.43%。随着水分含量增加,HDXRF法CdT测定结果的RSD整体呈上升趋势,但影响有限(RSD<5%)。
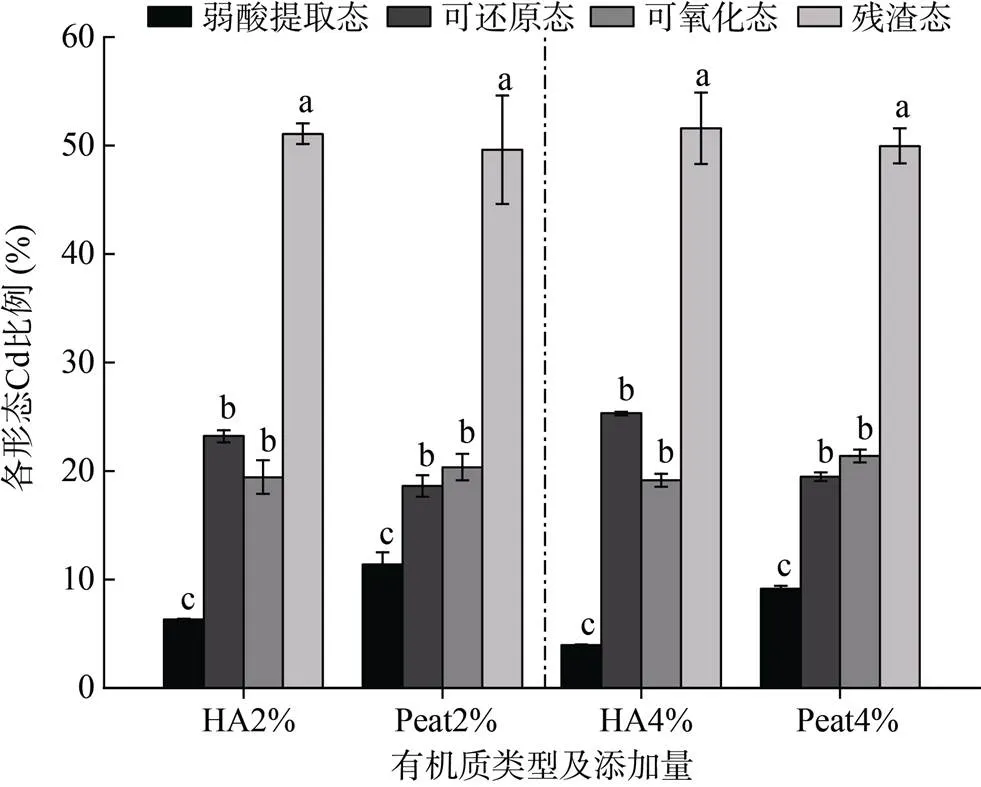
2.4.2 土壤有机质类型与含量的影响 有机质添加会造成Cd赋存形态的变化,由图3和图4可知,添加HA和Peat均造成弱酸提取态Cd(F1)含量降低,可还原态Cd(F2)和可氧化态Cd(F3)含量上升的规律,Cd的赋存形态分布为F4(残渣态)>F2>F3>F1。
供试HA和Peat经试验分析均未检出CdT(低于检测限0.05 mg/kg)。由表4可知,随着土壤有机质含量的增加HDXRF法CdT测定结果降低,二者呈现显著的负相关性,添加两种类型有机质均存在该现象。方差分析结果表明,不同有机质添加量处理后的HDXRF法CdT测定结果存在显著差异(<0.05),均在HA和Peat添加量为2% 时出现显著差异,添加量为2% ~ 6% 时HDXRF法CdT测定结果呈现下降趋势。不同类型有机质处理的HDXRF法CdT测定结果存在显著性差异(<0.05), HA比Peat对HDXRF法CdT测定影响更大,HA影响的校正模型为= –1.555+0.780,2为0.934 4。
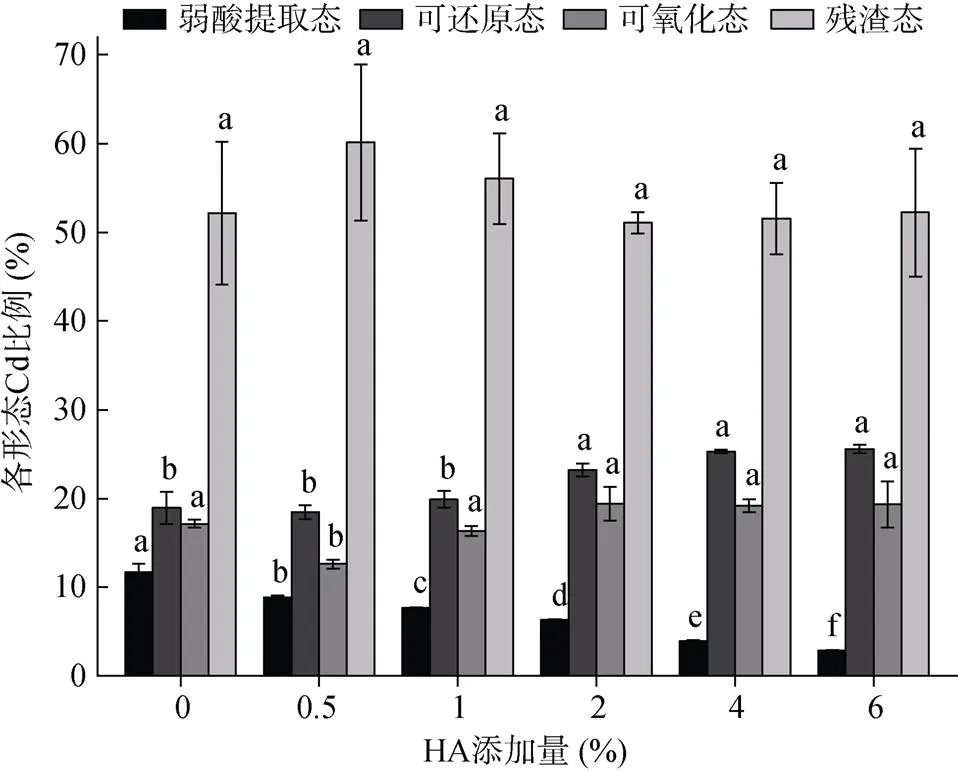
(图中不同小写字母表示同一形态Cd在不同处理间差异显著(P<0.05))
(图中不同小写字母表示同处理组内不同形态Cd占比差异显著(P<0.05))
注:表中同列不同小写字母表示不同添加量处理间差异在<0.05水平显著。
2.4.3 土壤类型的影响 由图5可知,3种类型土壤的HDXRF法CdT测定结果与传统实验室分析方法测定结果具有相似的线性关系,RSD均低于10%,RE为–36.56% ~ 10.53%,2均高于0.99。相对于红壤和潴育型水稻土,灰钙土中两种方法的测定结果更接近,灰钙土中RE在 ± 10% 以内,红壤和潴育型水稻土中在CdT含量>0.6 mg/kg区段RE达到 ± 10%。HDXRF法测定结果在CdT含量>2 mg/kg区域出现高估的现象,3种类型土壤均表现出一致的规律性。
3 讨论
3.1 土壤水分影响HDXRF法测定CdT的机理
水分是影响HDXRF测定结果准确性的重要因素之一[29]。本研究发现,HDXRF法CdT测定值随水分含量的增加而呈现指数衰减规律,遵循朗伯比尔定律,衰减函数方程为=0.803e–1.3284x,2为0.984 5,衰减系数(μ)为–1.328 4,这与Schneider等[30]研究类似。水分影响到土壤样品的均一性,增加样品的有效体积和密度,造成样品的有效原子序数和总的质量吸收系数(衰减系数)的改变[31-32],从而影响初级X射线的吸收与次级X射线的散射[33],从而导致HDXRF测定的精密度、准确度和检测限降低。
本研究中,HDXRF法CdT测定结果随土壤水分含量增加呈下降趋势,当土壤水分含量>5% 时,HDXRF法CdT测定值与传统实验室分析方法的实测值有显著性差异,这与Padilla等[34]研究结果一致;建立基于水分影响的校正方程,因其具有极高的决定系数(2=0.984 5),能提高HDXRF法校正结果的准确性。Schneider等[30]通过利用水分校正方程(0.91<2<0.99),对 215个含水样品的重金属浓度进行校正,结果也表明,水分校正方程可有效地降低水分的影响从而提高PXRF法测定的准确性。本研究中,土壤水分对HDXRF法CdT测定结果的RSD的影响有限,CdT测定结果的RSD随土壤水分含量增加整体上呈上升趋势,这可能与不同水分含量土壤样品制备时水分在土壤中完全分散而导致土壤水分含量不均匀有关。理论上土壤水分含量越高的土壤样品制备导致土壤水分含量的绝对误差越大,从而导致CdT测定结果的RSD越大。
3.2 土壤有机质影响HDXRF法测定CdT的机理
本研究中,HDXRF法CdT测定结果随着土壤有机质含量的增加而降低,与Sut-Lohmann等[35]研究结果类似,其发现去除土壤样品中的有机质会导致PXRF法重金属测定值的升高,通过建立回归模型对有机质进行校正,可以减少基质对PXRF测量的影响。彭洪柳等[2]研究表明,有机质影响 HDXRF 法测定,可通过对方程常数进行校正来提高HDXRF测定精度。有机质主要由碳、氢和氧等低原子序数的轻元素组成,其对HDXRF测定的影响机理与水分类似,有机质的存在改变了样品密度和有效体积,造成样品有效原子序数和总的质量吸收系数的改变,导致X射线的散射和衰减。Rosin等[36]研究表明,有机质中的低原子序数元素显著增加了X射线康普顿散射。
土壤中不同类型的有机质会以不同的方式影响PXRF测定结果[25]。本研究结果表明,HA比Peat对HDXRF测定影响更大。前人研究表明,有机质会造成Cd化学形态变化,这可能会对HDXRF测定结果产生一定的影响。本研究发现,添加HA显著降低了土壤中Cd的有效性,促使弱酸提取态Cd(F1)向可还原态Cd(F2)和可氧化态Cd(F3)转化,具体表现为F1降低了8.85%,F2和F3分别增加了6.62% 和2.17%,与邹传[37]和赵立芳[38]的研究结果类似。Pearson相关分析表明,HDXRF法CdT测定结果与传统实验室分析方法测定的F1、F2、F3具有较好的相关性,其中与 F1呈显著正相关,与F2和F3呈显著负相关(表5)。由图4可知,在同一添加量下,F1含量为HA
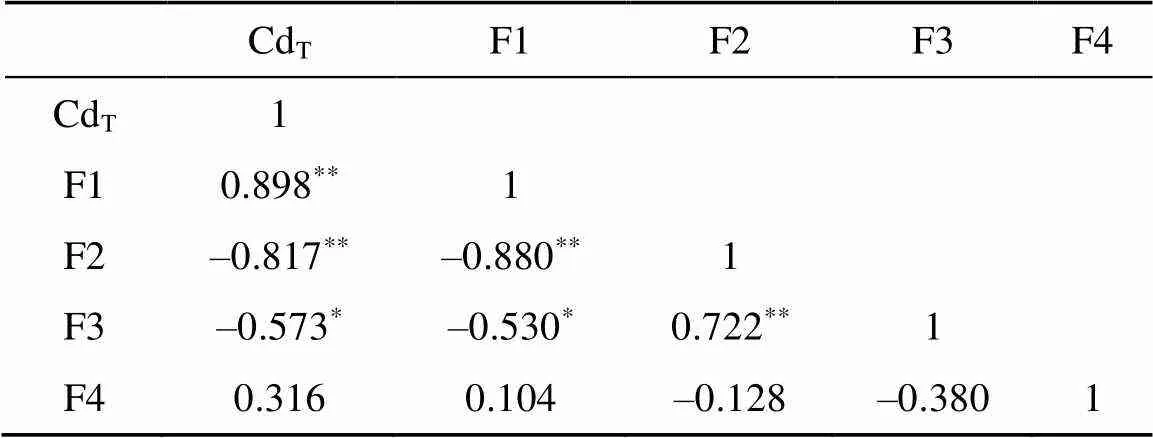
表5 土壤HDXRF法CdT测定值与土壤Cd各种形态含量传统实验室测定值的Pearson相关性分析结果
注:*表示在<0.05 水平上显著相关,**表示在<0.01水平上显著相关。
腐殖酸主要分为胡敏酸和富里酸,胡敏酸富含活性基团(羧基、酚羟基和氨基),分子量大,芳构化程度高,可与Cd2+形成疏水性复合物从而抑制了Cd的有效性和迁移率[39];富里酸对Cd2+具有活化作用从而促进了有效态Cd的增加。胡敏酸对Cd赋存形态的影响机理包括:①离子交换吸附固定,胡敏酸边棱带有正电荷加强了对Cd2+的吸附络合,CS–和SH–等阴离子将Cd2+吸附固定在该类阴离子的S上[40];②羧基、酚羟基等活性功能基团配位络合,胡敏酸与Cd2+的结合能力与胡敏酸的活性基团数量有关[41];③胡敏酸为土壤微生物活动提供能源和载体从而间接地影响Cd的赋存形态。
3.3 土壤类型影响HDXRF法测定CdT的机理
土壤类型对HDXRF测定具有一定影响,HDXRF对灰钙土CdT检测准确度优于红壤和水稻土。红壤和潴育型水稻土在CdT<0.6 mg/kg区段的RE才达 ± 10%,可能是不同类型土壤的基质(如母质矿物组成和颗粒组成)、土壤异质性和理化性质等多种因素导致的。
4 结论
1) 研究区土壤HDXRF法CdT的测定结果与传统实验分析方法测定结果具有较好的线性相关性,相关系数均高于0.9,但基于统计学的校正模型无法满足农田土壤Cd污染精准调查的需求,校正后数据具有较大检测误差。
2) HDXRF法CdT测定结果随着水分含量的增加呈指数衰减趋势,水分定量校正模型为=0.803e–1.3284x,衰减系数(μ)为–1.328 4,2为0.984 5,土壤水分每增加1个百分点会导致HDXRF法CdT的测定值下降0.90% ~ 1.43%。HDXRF法测定结果与有机质含量具有显著的负相关性,HA比Peat对HDXRF法CdT测定结果的影响更大,HA影响的定量校正模型为= –1.555+ 0.78,2为0.933 4;HDXRF法CdT测定结果与传统实验分析方法测定的F1(=0.898**)、F2(= –0.817**)、F3(=–0.573*)具有较好的相关性,表明Cd的化学形态可能会在一定程度上影响HDXRF法CdT的测定结果。
3) 土壤类型对HDXRF法CdT测定结果存在一定的影响,相对于红壤和潴育型水稻土,HDXRF法更适用于灰钙土CdT的测定。
[1] 齐菲, 付同刚, 高会, 等. 污水灌溉农田土壤镉污染研究进展[J]. 生态与农村环境学报, 2022, 38(1): 10–20.
[2] 彭洪柳, 杨周生, 赵婕, 等. 高精度便携式X射线荧光光谱仪在污染农田土壤重金属速测中的应用研究[J]. 农业环境科学学报, 2018, 37(7): 1386–1395.
[3] 骆永明, 滕应. 我国土壤污染的区域差异与分区治理修复策略[J]. 中国科学院院刊, 2018, 33(2): 145–152.
[4] 江晓宇, 李福生, 王清亚, 等. 便携式XRF分析仪检测土壤重金属应用研究[J]. 核电子学与探测技术, 2021, 41(6): 1005–1012.
[5] 万梦雪, 胡文友, 黄标, 等. 便携式X射线荧光光谱法(PXRF)在肥料重金属快速检测中的应用[J]. 土壤, 2019, 51(6): 1137–1143.
[6] Parsons C, Margui G E, Pili E, et al. Quantification of trace arsenic in soils by field-portable X-ray fluorescence spectrometry: Considerations for sample preparation and measurement conditions[J]. Journal of Hazardous Materials, 2013, 262: 1213–1222.
[7] 雷梅, 王云涛, 顾闰尧, 等. 基于知识图谱的土壤重金属快速监测技术进展[J]. 中国环境科学, 2018, 38(1): 244–253.
[8] 陈云, 应蓉蓉, 孔令雅, 等. 手持式X射线荧光光谱快速测定仪的实践应用评价及建议[J]. 土壤, 2022, 54(3): 586–593.
[9] Radu T, Diamond D. Comparison of soil pollution concentrations determined using AAS and portable XRF techniques[J]. Journal of Hazardous Materials, 2009, 171(1): 1168–1171.
[10] Kilbride C, Poole J, Hutchings T R. A comparison of Cu, Pb, As, Cd, Zn, Fe, Ni and Mn determined by acid extraction/ICP–OES and ex situ field portable X-ray fluorescence analyses[J]. Environmental Pollution, 2006, 143(1): 16–23.
[11] Peinado F M, Ruano S M, González M G B, et al. A rapid field procedure for screening trace elements in polluted soil using portable X-ray fluorescence (PXRF)[J]. Geoderma, 2010, 159(1/2): 76–82.
[12] 唐晓勇, 倪晓芳, 商照聪. 土壤中铁元素对铬元素p-XRF测定准确度的影响与校正[J]. 岩矿测试, 2020, 39(3): 467–474.
[13] 陈曾思澈, 徐亚, 雷国元, 等. Pxrf土壤重金属检测的影响因素、模式与校正方法[J]. 中国环境科学, 2020, 40(2): 708–715.
[14] 中华人民共和国生态环境部. 土壤质量铅、镉的测定石墨炉原子吸收分光光度法: GBT17141—1997[S]. 北京: 国家环境保护局, 1997.
[15] 陈伟, 王婷. 白银市污灌区土壤-小麦系统镉赋存特征及其健康风险评价[J]. 核农学报, 2020, 34(4): 878–886.
[16] Hall G E M, Bonham-carter G F, Buchar A Evaluation of portable X-ray fluorescence (pXRF) in exploration and mining: Phase 1, control reference materials[J]. Geochemistry: Exploration, Environment, Analysis, 2014, 14(2): 99–123.
[17] Pearson D, Chakraborty S, Duda B, et al. Water analysis via portable X-ray fluorescence spectrometry[J]. Journal of Hydrology, 2017, 544: 172–179.
[18] 周树斌. 基于PXRF技术的黑龙江阿城白岭铜锌多金属矿区砷元素污染评估[D]. 中国地质大学(北京), 2020.
[19] 中华人民共和国生态环境部. 环境监测分析方法标准制订技术导则: HJ168—2020[S]. 北京: 中国环境出版社, 2020.
[20] 中华人民共和国农业农村部. 农田土壤环境质量监测技术规范: NY/T395—2012[S]. 北京: 中国农业出版社, 2012.
[21] US EPA. Field portable X-ray fluorescence spectrometry for the determination of elemental concentrations in soil and sediment: Method 6200[S]. Washington DC: US EPA, 2007.
[22] Hu W Y, Huang B, Weindorf D C, et al. Metals Analysis of Agricultural Soils via Portable X-ray Fluorescence Spectrometry[J]. Bulletin of Environmental Contamination and Toxicology, 2014, 92(4): 420–426.
[23] McLaren T, Guppy C, Tighe M, et al. Rapid, Nondestructive Total Elemental Analysis of Vertisol Soils using Portable X-ray Fluorescence[J]. Soil Science Society of America Journal, 2012, 76: 1436–1445.
[24] Turner A, Taylor A. On site determination of trace metals in estuarine sediments by field-portable-XRF[J]. Talanta, 2018, 190: 498–506.
[25] Ravansari R, Lemke L D. Portable X-ray fluorescence trace metal measurement in organic rich soils: pXRF response as a function of organic matter fraction[J]. Geoderma, 2018, 319: 175–184.
[26] 中华人民共和国生态环境部. 土壤环境质量农用地土壤污染风险管控标准(试行): GB15618—2018[S]. 北京: 中国标准出版社, 2018.
[27] 中华人民共和国生态环境部. 全国土壤污染详查土壤样品分析测试方法技术规定[EB/OL]. (2017–10–23) [2023–07–14].https://www.mee.gov.cn/gkml/hbb/bgth/201711/W020171106339408983483.pdf.
[28] 张朝阳, 彭平安, 宋建中, 等. 改进BCR法分析国家土壤标准物质中重金属化学形态[J]. 生态环境学报, 2012, 21(11): 1881–1884.
[29] Valérie L, Bruno L. Possible Pitfalls in the Analysis of Minerals and Loose Materials by Portable XRF, and How to Overcome Them[J]. Minerals, 2020, 11(1): 33.
[30] Schneider A R, Cancès B, Breton C, et al. Comparison of field portable XRF and aqua regia/ICPAES soil analysis and evaluation of soil moisture influence on FPXRF results[J]. Journal of Soils and Sediments, 2016, 16(2): 438–448.
[31] 饶盛. 水渣XRF检测中含水率的影响及修正研究[D]. 南京航空航天大学, 2019.
[32] 王清亚. 基于XRF的土壤重金属定量分析方法研究及应用[D]. 东华理工大学, 2021.
[33] Ravansari R, Wilson S C, Tighe M. Portable X-ray fluorescence for environmental assessment of soils: Not just a point and shoot method[J]. Environment International, 2020, 134: 105250.
[34] Padilla J T, Hormes J, Magdi S H. Use of portable XRF: Effect of thickness and antecedent moisture of soils on measured concentration of trace elements[J]. Geoderma, 2019, 337: 143–149.
[35] Sut-Lohmann M, Ramezany S, Kästner F, et al. Feasibility of pXRF to evaluate chosen heavy metals in soil highly influenced by municipal waste disposal—A monitoring study of a former sewage farm[J]. Land Degradation & Development, 2022, 33(3): 439–451.
[36] Rosin N A, Demattê J A M, Almeida Leite M C, et al. The fundamental of the effects of water, organic matter, and iron forms on the pXRF information in soil analyses[J]. CATENA, 2022, 210: 105868.
[37] 邹传. 风化煤矿源腐殖酸对稻田土壤镉赋存形态及生物有效性的影响[D]. 浙江农林大学, 2019.
[38] 赵立芳. 腐植酸、水铁矿及其共沉物对土壤镉的钝化效果研究[D]. 兰州大学, 2019.
[39] Bai H C, Jiang Z M, He M J, et al. Relating Cd2+binding by humic acids to molecular weight: A modeling and spectroscopic study[J]. Journal of Environmental Sciences (China), 2018, 70: 154–165.
[40] Ahrland S. Metal complexes present in seawater[J]. The Nature of Seawater, 1975: 219–244.
[41] 卢静, 朱琨, 侯彬, 等. 腐植酸与土壤中重金属离子的作用机理研究概况[J]. 腐植酸, 2006(5): 1–5.
Accuracy Evaluation and Precision Correction Model Construction of Cadmium Determination in Farmland Soil by HDXRF Method
FU Zhaocong1, WANG Cong1, WU Chunfa1*, LUO Yongming2, LIU Dong1
(1 Department of Agricultural Resources and Environment, Nanjing University of Information Science & Technology, Nanjing 210044, China; 2 CAS Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China)
The main factors affecting the accuracy of high-precision portable X-ray fluorescence spectrometry (HDXRF) for the determination of total cadmium concentration (CdT) in soil were screened with the heavy metal contaminated farmland soil in a sewage irrigation area of Baiyin City, Gansu Province as the object of the research. The influences of moisture, organic matter type and content, and soil type on the determination results of CdTby HDXRF were studied, respectively. The relative error (RE), relative standard deviation (RSD) and determination coefficient (2) were used to evaluate the accuracy and precision of HDXRF method. The results showed that the RE and RSD of HDXRF were ≤ 10%,2>0.99, which met the accuracy and precision requirements of farmland soil environmental quality monitoring technical specifications and US Environmental Protection Agency standards. The determination results of CdTby HDXRF method was exponentially decayed with the increase of moisture, and the attenuation equation was=0.803e–1.3284xwith an attenuation coefficient (μ) of –1.328 4 and a coefficient of determination (2) of 0.984 5. There was a significant negative correlation between CdTby HDXRF method and organic matter content (= –0.955), and humic acid (HA) had a much stronger influence on determination results by HDXRF method than that of peat (Peat). The correction equation of HA was= –1.555+ 0.780 with a2of 0.934 4. The influence of soil type on the determination results of CdTby HDXRF method was limited, and the determination results of CdTin sierozem by HDXRF method were closer to the determination results by traditional laboratory analysis method than that of red soil and paddy soil. In conclusion, although the determination results of HDXRF are affected by many factors, the reliability of the correction results can meet the needs of accurate investigation of cadmium contaminated farmland soils through model correction.
X-ray fluorescence spectrometry; Heavy metals; Rapid detection; Influencing factors; Correction equation
X53
A
10.13758/j.cnki.tr.2023.04.017
傅赵聪, 王翀, 吴春发, 等. HDXRF法农田土壤镉测定结果准确度评价与精准校正模型构建. 土壤, 2023, 55(4): 829–837.
国家重点研发计划项目(2019YFC1804704)和甘肃省白银区重金属污染农用地安全利用与治理修复项目(2020zfcg02205)资助。
(wchf1680@sina.com)
傅赵聪(1993—),男,江苏南京人,硕士研究生,主要从事土壤重金属污染与修复研究。E-mail: 17397959393@163.com
