负载紫杉醇的温敏水凝胶对鼻咽癌的抑制作用
2023-09-20孙海力叶纪拓李绍霄吴秀
孙海力, 叶纪拓, 李绍霄, 吴秀
(温州医科大学附属平阳医院耳鼻喉科,浙江平阳 325400)
鼻咽癌是一种好发于中国南部省份、东南亚国家和北非地区的恶性肿瘤,近20%的鼻咽癌患者在确诊时出现远处脏器转移[1]。癌症复发和转移是当前鼻咽癌患者死亡的主要影响因素。化疗是鼻咽癌的重要治疗手段,但鼻咽癌患者对化疗药物多存在一定的毒性反应和耐药现象,鼻咽癌患者总体生存率提高缓慢[2]。因此,亟需一种安全而有效的治疗方式以改善鼻咽癌患者的预后。肿瘤内注射抗癌药物作为一种有前途的恶性肿瘤治疗方法,具有给药部位精准、持续的药物释放时间和较高的患者依从性等优点[3-4],故药物的负载系统成为研究热点。
水凝胶是由交联聚合物制备的高含水量材料,由于其特殊的三维网状结构、良好的生物相容性和生物降解性,已被广泛地应用于药物的缓释控释技术中[5-6]。智能可注射水凝胶在生物医学中的应用引起了极大的关注,这在很大程度上归因其位点特异性药物释放行为和副作用小等优点[7]。热敏水凝胶在室温或更低温度下是溶液状态,能非常方便地装载活细胞、蛋白质、酶或其他治疗药物用于注射治疗[8]。随着温度升高至体温附近时,水凝胶溶液可以转变为非流动水凝胶,困在其中的药物可以在目标部位释放[9]。
壳聚糖(CS)作为一种天然聚合物,具有生物降解性、生物相容性、黏膜粘附性、无毒和特定的生物活性等独特优势,常用于水凝胶的制备。CS 上丰富的氨基和羟基官能团使其与交联剂反应成为可能,从而原位形成特定的水凝胶[10]。β-甘油磷酸钠(β-GP)是一种天然存在的磷酸盐分子,作为FDA 美国食品药品监督管理局批准的化合物,β-GP 可在生理环境中催化CS 溶液中的溶胶/凝胶转变[11]。CS/β-GP 复合材料作为一种温敏水凝胶,可延长药物的释放时间,显示其作为药物缓释载体的巨大潜力[12]。除了用于装载药物/生物活性分子的可注射水凝胶外,CS/β-GP水凝胶还适用于组织工程领域[13]。本研究旨在将紫杉醇(PTX)与CS/β-GP 混合,以实现具有热敏感性、生物相容性和生物降解性等综合特性的可注射水凝胶,再将制备好的PTX/CS/β-GP 温敏水凝胶用于体内外鼻咽癌的治疗,探索该治疗方式的疗效和生物安全性,现将研究结果报道如下。
1 材料与方法
1.1 药物、试剂与仪器紫杉醇注射液(规格:6 mg/mL,江苏恒瑞医药股份有限公司生产,批号:H10980069)。脱乙酰度>95%的中等分子量CS 和β-GP(浙江金壳生物化学有限公司,批号分别为:20140318C 和20150475C);偶氮二异丁腈(AIBN)和乙酸(阿拉丁公司,批号分别为:A104255 和A433219);所有培养基和细胞培养成分均购自美国Gibco 公司;四甲基偶氮唑盐(MTT)试剂盒(上海碧云天生物公司,批号:C0009S);Ki-67 抗体(美国Thermo Fisher 公司,批号:13-5699-82);末端脱氧核苷酸转移酶介导的dUTP 缺口末端标记(TUNEL)凋亡试剂盒(北京百奥莱博科技公司,批号:7E521C1)。紫外分光光度计(上海元析仪器有限公司);S-3400I 型扫描电子显微镜(日本Hitachi 公司)。
1.2 水凝胶制备制备溶解在乙酸(0.1 mol/L)中的2%(m/V)CS 溶液和溶解在蒸馏水中的40%(m/V)β-GP溶液。将CS溶液和β-GP 溶液均冷却至4 ℃,在搅拌下将β-GP 溶液滴加到CS 溶液中,并调节复合物的pH 值至7.4 左右,再将温度升高到37 ℃制备水凝胶。将PTX 与CS/β-GP 水凝胶混合并搅拌1 h,制备负载PTX的水凝胶制剂(每毫升水凝胶含有2 mg PTX)。
1.3 水凝胶的低临界转变温度(LCST)测定水凝胶的LCST 由紫外分光光度计测定。在540 nm 波长处检测2%(m/V)的水凝胶在磷酸盐缓冲液(PBS,pH=7.4)中的共聚物溶液在25 ~40 ℃之间的吸光度。LCST 定义为与初始吸光度相比,吸光度增加约50%时的温度。
1.4 水凝胶的扫描电子显微镜(SEM)分析水凝胶经真空冷冻干燥,取干品断面真空喷金后使用扫描电子显微镜进行水凝胶的表面结构分析。
1.5 体外药物释放研究在37 ℃条件下温和摇动,将PTX/CS/β-GP 水凝胶转移到PBS(pH=7.4)溶液中。在预定的时间间隔,收集2 mL 释放介质并用2 mL 新鲜PBS(pH=7.4)补偿。释放介质中PTX 的含量通过紫外分光光度计在480 nm 波长处测定。根据“A= 0.024 26c+ 0.000 40”即可计算得到此时释放介质中PTX 的质量浓度,进而计算得到累积释放的PTX 质量。某一时刻PTX 的累积释放率(cumulative release rate,CRR)按照以下公式计算:。式中:Mt代表t时刻PTX 的累积释放质量,M0代表水凝胶中PTX 的总质量。
1.6 体外实验
1.6.1 细胞培养 人鼻咽癌细胞系HNE1,购自美国模式培养物保藏所(American Type Culture Collection,ATCC)。HNE1 细胞用完全培养基(RPMI 培养基中添加10%胎牛血清、100 U/mL 青霉素和100 μg/mL 链霉素)于37 ℃的CO2培养箱中孵育,2 d传代1次。
1.6.2 细胞毒性评估 采用MTT 法测定水凝胶对HNE1 细胞的毒性。按照“1.2”项制备水凝胶溶液,并将其添加到6孔培养板(1 mL/孔)中,37 ℃孵育过夜。凝胶形成后,用完全培养基(5 mL/孔)37 ℃浸泡凝胶24 h,用0.22 μm 过滤器过滤获得的浸泡液。在96 孔培养板中以5×103个/孔的密度培养处于对数生长期HNE1 细胞,37 ℃、5% CO2条件下孵育24、48 h。待细胞生长至40%~50%底面积时,去除培养基并用200 μL 水凝胶渗滤液替换,再孵育24 h。之后去除培养基并用150 μL 新鲜培养基和50 μL MTT 溶液替换,孵育4 h 后去除培养基,加入200 μL DMSO 以溶解形成的甲臜晶体,培养板摇动15 min。使用酶标仪在570 nm 波长处读取吸光度。
1.6.3 4’,6-二脒基-2-苯基吲哚(DAPI)染色法检测细胞凋亡实验 将载有PTX 的CS/β-GP 水凝胶溶液添加到6 孔培养板(1 mL/孔)中,37 ℃孵育以形成凝胶。在凝胶表面培养密度为5×105个/孔的HNE1细胞并孵育48 h,水凝胶用PBS洗涤3次,附着的HNE1 细胞用4%多聚甲醛固定10 min。水凝胶用PBS 洗涤3 次,然后将DAPI 添加到培养板上的细胞上并孵育5 min。通过荧光显微镜记录荧光图像。
1.7 体内抗癌实验
1.7.1 动物 20 只无特定病原体(SPF)级雌性BALB/c 裸鼠,7周龄,体质量18~20 g,购自北京维通利华实验动物技术有限公司实验动物生产许可证号:SCXK(京)2016-0011。所有动物实验均已通过温州医科大学附属平阳医院伦理委员会审核(审批号:20220009),所有实验程序均遵循《赫尔辛基宣言》。
1.7.2 分组、造模与干预 将2 × 106个HNE1 细胞皮下接种到裸鼠右前肢腋下,当肿瘤生长到大约100 mm3时,将荷瘤裸鼠随机分为4 组,每组5 只裸鼠在肿瘤部位给药如下:(1)空白组:BALB/c裸鼠皮下注射生理盐水5 μL/g体质量;(2)CS/β-GP组:裸鼠皮下注射CS/β-GP 水凝胶5 μL/g 体质量;(3)PTX 组:裸鼠皮下注射PTX 混悬液5 μL/g 体质量,PTX 剂量为0.01 mg/g 体质量[14];(4)PTX/CS/β-GP 组:裸鼠皮下注射PTX/CS/β-GP 水凝胶5 μL/g 体质量,PTX 剂量为0.01 mg/g 体质量。在给药后第0、2、4、6、8 和10 天测量荷瘤裸鼠的体质量和肿瘤体积。第10 天处死裸鼠,测量肿瘤质量,然后收集肿瘤组织用于后续的实验。
1.7.3 免疫组织化学实验 肿瘤组织用5%甲醛固定过夜,采用梯度乙醇脱水法将肿瘤组织脱水后包埋在石蜡中,切片。采用SP 染色法进行免疫组织化学染色。Ki-67 阳性少数表达于细胞质中,大部分表达于细胞核中。随机选择20 个视野并在低倍镜下拍照,采用Image-Pro Plus 6.0 图像处理软件分析Ki-67 在肿瘤组织中的积分光密度(IOD)值。
1.7.4 TUNEL法检测移植瘤细胞凋亡 按TUNEL试剂盒说明书操作。细胞核固缩、染色体凝集成块或边集、呈棕褐色染色者为凋亡细胞,采用Image-Pro Plus 6.0 图像处理软件分析TUNEL 在肿瘤组织中的积分光密度(IOD)值。
1.8 统计方法采用SPSS 13.0统计软件,计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 水凝胶的LCST CS/β-GP 水凝胶的LCST 通过紫外分光光度法进行测量:在LCST 以下,水凝胶因为氢键作用而处于亲水状态,表现为透明的液体状态(见图1-a),其吸光度几乎为0%;而随着温度的升高,在LCST 之上,疏水部分发生聚集并从聚合物链中挤出水分子从而形成凝胶状态(见图1-b),溶液变得不透明,同时观察到吸光度急剧增加,溶液在35 ℃左右变得浑浊。

图1 不同温度CS/β-GP水凝胶宏观形态Figure 1 Macroscopic morphology of CS/β-GP hydrogel at different temperatures
2.2 水凝胶表面结构使用SEM 评估水凝胶的表面微观结构形态(见图2)。CS/β-GP 水凝胶在不同温度时表现出不同的形态。25 ℃时的CS/β-GP 水凝胶呈现疏松多孔结构,水凝胶在35 ℃时具有较小的孔径,结构也变得更加紧凑。进一步证实了所得CS/β-GP水凝胶的热响应性。

图2 不同温度CS/β-GP水凝胶表面形态(SEM)Figure 2 The surface morphology of CS/β-GP hydrogel at different temperatures(SEM)
2.3 水凝胶对PTX释放的影响如图3 所示,游离PTX 的释放速度较快,不到24 h 就全部释放。将PTX 引入CS/β-GP 水凝胶中制备PTX/CS/β-GP水凝胶,观察到水凝胶中的PTX 持续释放速度明显延缓,PTX 的释放维持了15 d,表明合成的PTX/CS/β-GP水凝胶具有良好的缓释效果。
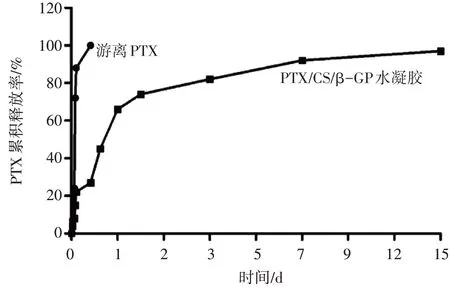
图3 游离PTX和PTX/CS/β-GP水凝胶的体外释放曲线Figure 3 In vitro release curves of free PTX and PTX/CS/β-GP hydrogel
2.4 体外细胞毒性研究结果使用提取的水凝胶渗滤液分别处理HNE1 细胞24 h 和48 h 后,采用MTT 法评估水凝胶的细胞毒性。结果如图4 所示,CS/β-GP水凝胶渗滤液处理HNE1细胞24 h和48 h 后的细胞存活率保持在90%以上,与阴性对照组比较,差异无统计学意义(P>0.05),这表明制备的CS/β-GP 水凝胶具有细胞相容性。PTX/CS/β-GP 水凝胶处理HNE1 细胞24 h 和48 h 后的细胞存活率分别为64.5%和48.9%,与阴性对照组比较,差异有统计学意义(P<0.05)。
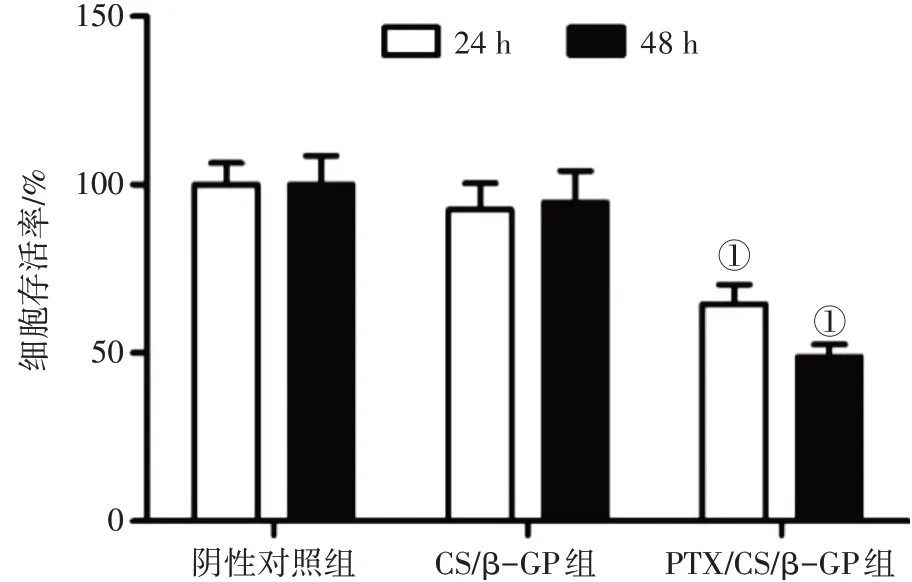
图4 HNE1细胞在水凝胶中培养24 h和48 h后的活性Figure 4 The viability of HNE1 cells cultured in hydrogel for 24 hours and 48 hours
2.5 体外细胞凋亡研究结果DAPI 染色后HNE1细胞核呈圆形,凋亡细胞呈现核浓缩,染色加深,或核染色质呈新月形聚集于核膜一边。取5 个视野,计数凋亡细胞数量,结果显示:阴性对照组、CS/β-GP 组和PTX/CS/β-GP 组细胞凋亡数分别为(1.4 ± 0.2)、(2.8 ± 0.4)、(4.2 ± 0.6)个。使用CS/β-GP 水凝胶处理的细胞核基本完整,见图5,结果表明,CS/β-GP 水凝胶作为药物输送载体具有良好的细胞相容性。PTX/CS/β-GP 水凝胶处理后,HNE1 细胞数量显著低于阴性对照组和CS/β-GP水凝胶组,同时观察到较多碎片化的细胞核(P<0.05),表明PTX/CS/β-GP 水凝胶可有效促进HNE1 细胞凋亡,进一步证实负载PTX 的水凝胶的抗HNE1细胞增殖作用。
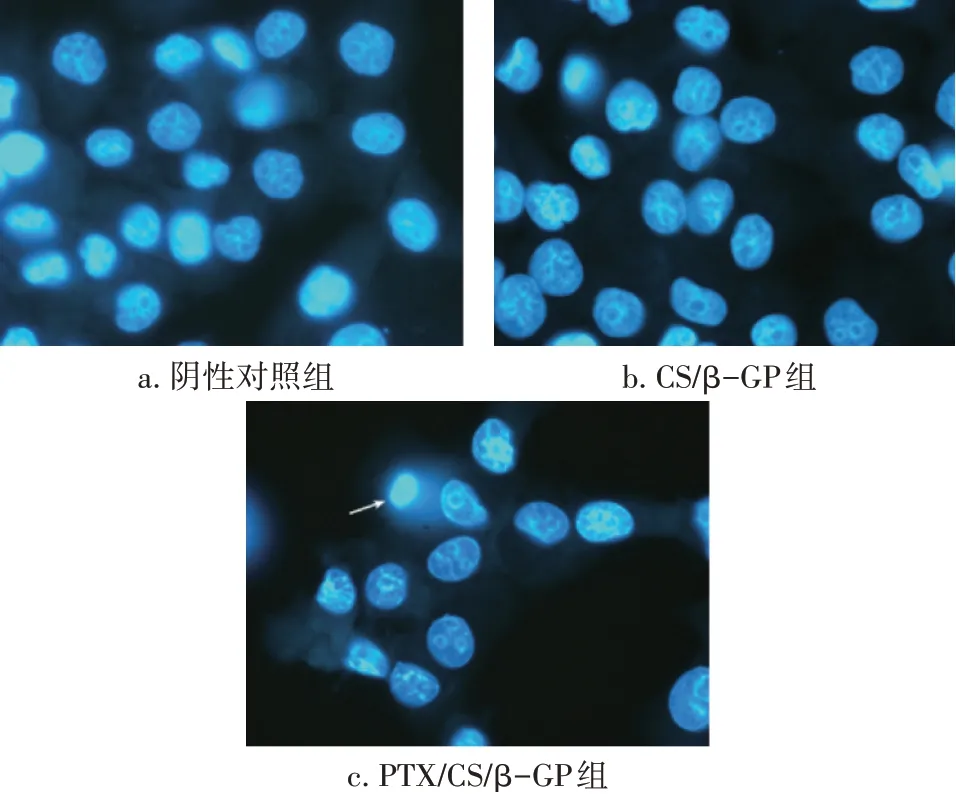
图5 DAPI染色法观察CS/β-GP水凝胶和PTX/CS/β-GP水凝胶对HNE1细胞凋亡的影响(×200)Figure 5 Effect of CS/β-GP hydrogel and PTX/CS/β-GP hydrogel on apoptosis of HNE1 cells observed by DAPI staining(×200)
2.6 体内抗肿瘤研究结果图6-A 结果显示,荷瘤裸鼠皮下注射生理盐水或CS/β-GP 水凝胶后,裸鼠体质量均有不同程度上升,2 组比较无显著性差异(P>0.05),表明体内使用CS/β-GP 水凝胶具有较好的生物相容性。荷瘤裸鼠皮下注射PTX 混悬液后2 d,裸鼠体质量开始逐渐下降,8 d内平均体质量从17.91 g 下降到16.32 g,在一定程度上说明PTX对裸鼠有一定的毒副作用。但PTX/CS/β-GP水凝胶组裸鼠的体质量变化与空白组基本相同,在给药后10 d 内,2 组体质量无显著性差异(P>0.05),而PTX/CS/β-GP 水凝胶组裸鼠体质量明显高于PTX 组(P<0.05),表明PTX 被包裹在CS/β-GP 水凝胶中,释放速度较缓慢,从而对实验动物的毒副作用较小。
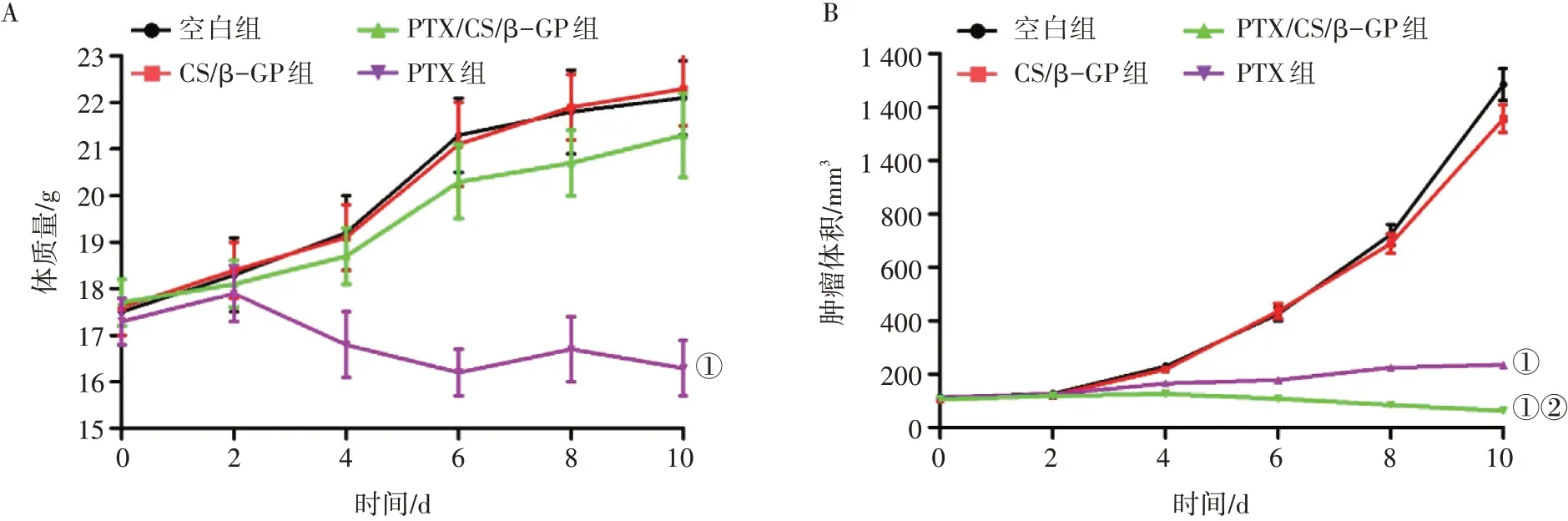
图6 负载紫杉醇(PTX)的CS/β-GP水凝胶对荷瘤裸鼠体质量(A)和肿瘤体积(B)的影响Figure 6 Effect of PTX-loaded CS/β-GP hydrogel on body mass(A)and tumor volume(B)of tumor-bearing nude mice
各组裸鼠肿瘤的变化情况如图6-B所示。空白组的肿瘤体积从112.49 mm3增加到1 285.37 mm3;CS/β-GP水凝胶组裸鼠肿瘤的平均体积从107.65 mm3增加到1 157.82 mm3,与空白组比较,无显著性差异(P>0.05),表明CS/β-GP 水凝胶不能发挥抗肿瘤作用;PTX 组荷瘤裸鼠的肿瘤生长受到明显抑制,肿瘤体积也明显减小(P<0.05),10 d 后的肿瘤抑制率为81.72%;PTX/CS/β-GP 水凝胶对裸鼠体内肿瘤的抑制作用明显强于PTX(P<0.05),10 d后的肿瘤抑制率为92.64%。
实验结束后,切除的肿瘤组织经过清洗、干燥和称定质量。空白组、CS/β-GP 组、PTX 组和PTX/CS/β-GP 组裸鼠肿瘤组织平均质量分别为1.25、1.18、0.25 和0.11 g。各组移植瘤大体形态见图7。PTX 组和PTX/CS/β-GP 组裸鼠肿瘤组织平均质量低于空白组(P<0.05),PTX/CS/β-GP 组裸鼠肿瘤组织平均质量低于PTX组(P<0.05)。可见,游离PTX 和PTX/CS/β-GP 水凝胶均可有效抑制体内鼻咽癌生长,负载PTX 的CS/β-GP 水凝胶的抗癌效果优于游离PTX。这表明PTX/CS/β-GP 水凝胶可以缓慢释放抗肿瘤活性药物PTX,不仅可以减少PTX 的毒副作用,还可以延长PTX 的作用时间,是一种相对理想的药物载体材料。

图7 各组鼻咽癌裸鼠移植瘤大体形态比较Figure 7 Comparison of the gross morphology of nude mice xenograft tumors among various groups of nasopharyngeal carcinoma
如图8 的免疫组织化学结果所示,Ki-67 在各组肿瘤组织中均有不同程度的表达,空白组、CS/β-GP 组、PTX 组和PTX/CS/β-GP 组Ki-67 的IOD值分别为(145.6 ± 18.9)(168.3 ± 20.1)(58.7 ± 4.5)和(41.9±3.6)。与空白组比较,PTX 组和PTX/CS/β-GP 组肿瘤组织中Ki-67 的阳性表达水平均明显下降(P<0.05);PTX 组肿瘤组织中Ki-67 的阳性表达水平高于PTX/CS/β-GP 组(P<0.05)。TUNEL法检测肿瘤组织细胞凋亡结果如图8 所示,空白组、CS/β-GP组、PTX组和PTX/CS/β-GP组TUNEL阳性细胞的IOD 值分别为(62.4 ± 8.5)(71.3 ± 6.6)(147.2±18.8)和(197.5±16.3)。PTX 组和PTX/CS/β-GP 组肿瘤组织细胞凋亡率均高于空白组(P<0.05),PTX/CS/β-GP 组细胞凋亡率较PTX 组更高(P<0.05)。免疫组织化学和TUNEL 实验结果表明,负载PTX的CS/β-GP水凝胶具有良好的抗肿瘤性能,与体外实验结果相一致。
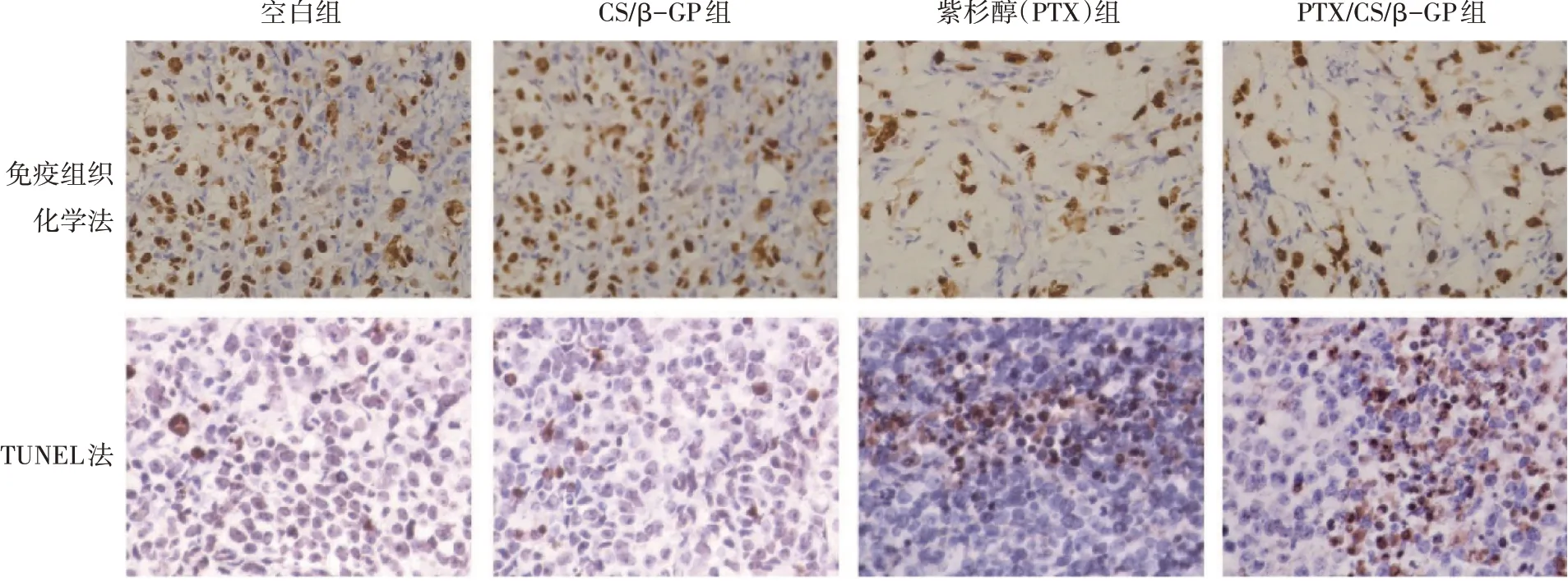
图8 各组荷瘤裸鼠肿瘤组织中Ki-67的表达(免疫组织化学法)及细胞凋亡(TUNEL法)比较(×200)Figure 8 Comparison of Ki-67 expression(immunohistochemical method)and apoptosis(TUNEL method)in tumor tissue of tumor-bearing nude mice among each group(×200)
3 讨论
本研究通过分析CS/β-GP 水凝胶的理化特性,如结构、形态和LCST,证实CS/β-GP 水凝胶具有疏松多孔结构和温敏性;通过MTT 实验和体内注射实验证明了CS/β-GP 水凝胶的生物相容性;通过MTT 实验、DAPI 染色、体内抗肿瘤实验和TUNEL 实验证实负载PTX 的水凝胶的优异抗癌效果。基于这项研究,CS/β-GP 水凝胶作为紫杉醇(PTX)的合适载体应用于鼻咽癌治疗显示出巨大的潜力。
化疗是鼻咽癌的主要治疗方式,传统化疗药物多伴随较为严重的毒副反应。当前,改善药物利用率和降低毒副反应是提高化疗药物疗效的主要策略。作为一种细胞有丝分裂抑制剂,PTX可有效抑制包括鼻咽癌在内的多种恶性肿瘤生长,但PTX具有一定的血液毒性和肝毒性。临床注射PTX的主流给药方式是静脉滴注(每日1次),但这种给药方式导致血药浓度波动较大,PTX的血药浓度过高,容易导致毒副作用,过低的血药浓度难以维持较长时间的抗癌效应,如何维持PTX 较为稳定的血药浓度是临床亟待解决的难题。除此以外,目前应用于临床的PTX 注射液需添加一定量的低极性溶剂来增加PTX 的溶解度,不仅容易导致患者过敏,而且靶向性不够,极大地影响了PTX 的临床治疗效果[15-16]。倘若将PTX直接注射到鼻咽癌组织中,由于鼻咽部肿瘤组织的质地较为疏松且弹性不足,PTX注射液容易从肿瘤组织中溢出,不仅难以在肿瘤组织中保持相对恒定的药物浓度,而且对周围正常组织产生毒副作用。中人氟安作为一种氟尿嘧啶缓释颗粒植入剂,将中人氟安直接注射到肿瘤组织后,可维持氟尿嘧啶药效达15 d之久,同时降低了药物的毒性[17];但其缺点也非常明显,这种植入剂是固体颗粒,不利于注射治疗,这也是限制中人氟安使用的主要原因[18]。因此,目前需要开发一种全新的不仅能较为方便地给药,同时能控制PTX 释放的速度,从而实现增效减毒效应的药物负载系统。
随着材料技术的发展,将聚合物及纳米材料制成新型载药系统应用于医学领域,已经成为目前研究的热点。本研究所应用到的CS 和β-GP 作为无毒材料已被批准用于生物医学应用。CS 作为口腔、鼻腔和眼睛的黏合剂或渗透促进剂,目前已被用于口腔黏膜给药、基因治疗给药系统等[10];β-GP 作为一种磷元素补充药物已广泛应用于早产儿骨代谢和体格发育不良的治疗[11]。已有研究证明,合成的CS/β-GP 水凝胶是一种可注射的温敏性生物材料,毒性较低,具有良好的生物安全性,是一种安全的药物负载系统[12-14]。但迄今为止,尚未有将CS/β-GP 水凝胶应用于临床的实例。本研究将PTX 与CS/β-GP 水凝胶结合,成功制备负载PTX 的温敏性CS/β-GP 水凝胶。这种新型温敏感性凝胶药物在室温下为液态,液态水凝胶可以较为方便地注射到肿瘤组织附近,液态水凝胶在体温的作用下转变为凝胶状态,可在注射部位形成一个药物缓释中心,可在较长时期内维持稳定有效的PTX 浓度,提高其抗肿瘤效应,并减少毒副作用的发生,最终改善化疗药物的治疗效果。本研究体外实验结果显示:PTX/CS/β-GP 水凝胶呈现出良好的缓释性能,可以持续释放PTX 超过16 d;PTX/CS/β-GP 水凝胶可有效抑制体外鼻咽癌细胞生长,并诱导细胞凋亡。在体内实验中,将PTX/CS/β-GP 水凝胶应用于鼻咽癌动物模型,以观察其抗肿瘤效应。考虑到鼻咽癌的生物学特性主要表现为局部浸润生长,同时鼻咽部的所在位置也较为适合注射这种水凝胶药物。结果显示,单独应用PTX 对裸鼠体质量具有明显抑制作用,而应用PTX/CS/β-GP 的实验动物的体质量不降反增,从而表明CS/β-GP 水凝胶可明显缓解PTX 对实验动物的毒副作用。除此以外,在肿瘤组织注射PTX/CS/β-GP 水凝胶还可明显抑制裸鼠体内肿瘤生长,且其抗癌效果优于相同剂量的游离PTX,这可能是由于PTX 被封装在CS/β-GP 水凝胶载体中,通过缓慢地释放,长时间地在移植瘤组织中维持稳定的浓度,实现长时间抑制肿瘤细胞生长和诱导肿瘤细胞凋亡的效果,从而提高PTX 的抗肿瘤疗效,同时减少了PTX 对正常组织的毒性作用。
综上所述,负载PTX 的CS/β-GP 水凝胶具有理想的药物缓释性能和生物相容性,可以明显提高PTX 的细胞毒作用,是一种极具鼻咽癌临床治疗应用前景的候选药物负载系统。
