给水系统微生物检测方法的比较
2023-09-19李相宜尚风雷焦复燃
许 皓,赵 蓓,李相宜,尚风雷,焦复燃
(北京市自来水集团有限责任公司,北京市供水水质工程技术研究中心,北京 100031)
饮用水安全与人类健康息息相关。在2003年世界环境日的致辞中,时任联合国秘书长的科菲·安南指出全世界80%的疾病和50%的儿童死亡都与饮用水水质不良有关,并强调水在人类生存和可持续发展中的核心作用。世界卫生组织于2017年制定的Guidelinesfordrinking-waterquality:Fourtheditionincorporatingthefirstaddendum[1]中指出,保证饮用水微生物安全在于找到方法防止或减少病原体进入水源,并减少对去除病原体的处理过程的依赖。该报告同时指出,饮用水微生物卫生安全除了与粪便污染有关,还会受到生长在供水管网中部分微生物(如军团菌)的影响。此外,还有研究[2]表明自来水厂某些处理过程存在微生物泄漏风险。随着饮用水水质标准的不断严格,水厂微生物安全性和风险管控的需求都提高到新的水平。
部分基于培养的传统微生物检测方法存在不准确、时效性不高等缺点,无法满足全面、深入的微生物检测需求。因此,选择适合的微生物检测方法,实现对给水系统中微生物快速、准确地检测,并能够进一步深入开展微生物溯源尤为重要。本文通过总结基于传统培养、生物化学和分子生物学的3类检测方法,综合对比其优缺点和应用特性,为从源头到龙头全供水过程的微生物安全保障提供参考。
1 基于培养的传统方法
传统的培养方法大多依赖于直接观察培养微生物的生理行为。
饮用水微生物检测中,异养菌平板计数(heterotrophic plate count, HPC)即根据以有机碳源为营养源的培养基检测到的微生物计数,描述所有异养菌数量的方法[3],其作为传统的指示菌检测手段于一个多世纪前提出[4]。该方法现多用于检测水中的细菌总数,在国内外饮用水水质监测指标中均有规定相应的培养时间、温度及检出限值,与总大肠杆菌群一起作为衡量消毒效果的指标[5]。
根据配方不同,HPC培养基多为传统营养琼脂培养基(PCA)、贫营养培养基(R2A)、高营养的5%羊血琼脂培养基(TSA-SB)等[3]。弧菌、埃希氏菌、沙门氏菌、气单胞菌、弯曲杆菌、志贺氏菌等存活但不能检出或生长相对缓慢的细菌,使用PCA的HPC结果被证明低于水体中实际细菌总数[6]。同时,也有人认为使用PCA检测得到的细菌代表着可快速生长的细菌,当存在粪便污染时可能与大肠菌群和肠道病原体一起出现[7]。R2A营养成分较PCA丰富且含量低,适合产色素菌生长,更适合对饮用水中细菌的检测[8]。
根据接种方法的不同,HPC可分为倒平板(pour plate, PP)法、涂布(spread plate, SP)法和滤膜(membrane filter, MF)法,3种方法的优缺点对比如表1所示[7]。

表1 HPC不同接种方法优缺点Tab.1 Advantages and Disadvantages of Different Vaccination Methods of HPC
综上,HPC的优点是成本低廉、操作较简单,且对操作人员的专业水平要求较低,是国内较普遍使用的方法。但具有较多缺点:(1)HPC检测到的总细菌群落比例通常低于饮用水中实际比例[4],该方法除了无法检测饮用水中部分“存活但不可培养”的细菌和生长相对缓慢的细菌外,还无法检测死亡的细菌;(2)可检测最大样品量受限;(3)不同的培养基、培养温度、培养时间对细菌数量和种群影响大[4];(4)培养用时长,需要一天至几天,无法满足快速检测需求[9];(5)部分接种方式对操作环境要求严格。
R2A多用于检测饮用水、颗粒活性炭(granular activated carbon, GAC)、管道内壁生物膜、无损反渗透膜内异养菌的数量[6]。美国在检测供水管网消毒剂效果时,使用PP法加PCA在(35±0.5)℃和(48±2)h的条件下进行检测,来排除高HPC结果对总大肠杆菌检测的影响。若无消毒剂残留,则规定HPC小于500 CFU/mL的检出限值。当用低营养介质的培养基检测到较高数量的细菌时,一些美国自来水公司将其作为水质变化的敏感指标,可能代表氯胺消毒的水存在硝化问题,或次氯酸钠消毒的水存在消毒剂残留量不足等问题[7]。MF法可测定样品体积灵活,但受限于滤膜孔径,适合检测浑浊度较低的样品。HPC可用于检测饮用水水源水的污染[10-12],评价水处理过程中生物稳定性和活性,探究水质指标对生物稳定性的影响,评估各处理单元效率效果[13-17],还可用于评价配水管网中的生物稳定性[16,18-23]。
2 基于生物化学的微生物检测方法
基于生物化学的方法是利用微生物体中不同分子的结构和功能特性,通过特异的生化反应或生物分子特征检测微生物的方法,包括固定底物酶底物法(defined substrate technology, DST)、流式细胞术(flow cytometry, FCM)和三磷酸腺苷(ATP)生物发光法。
2.1 DST
DST是传统的鉴别培养基的一种应用。根据微生物的代谢特点,利用生物化学反应的原理,在培养基中加入某种指示剂或化学药品,一般可直接测定某种微生物的种类。在饮用水检测中,该方法多应用于总大肠菌群和嗜肺军团菌的检测[24]。
DST的优点在于假阳性/阴性的发生率比一般酶底物法低,且检验周期短[25]、灵敏度高、操作流程简单[24]。DST和基于最可能数法(MPN)建立的Colilert®-QuantiTray联合方法(IDEXX, Chalfont St. Peter, UK)对培养的环境、设施和人员要求也更低[26]。该方法已列入《生活饮用水标准检验方法 微生物指标》(GB/T 5750.12—2006)[27]。但是,目前DST所需检测试剂为国外进口,价格较高,可能限制该方法的使用。
在实际应用中,大肠菌群产生的特异性酶可以分解培养基中的色原底物,使培养液呈黄色。检测大肠杆菌可以通过其产生的特异性酶使培养基出现荧光反应[25],或使用伊红-美蓝试剂使大肠杆菌出现深紫色且带有金属光泽的特征反应。DST除了可检测总大肠菌群和埃希氏菌,还可实现大量样品中粪大肠菌群[28-30]、嗜肺军团菌[31-32]、铜绿假单胞菌[33]、肠球菌[34]等特定菌种的快速检测,并能在无法保证无菌的环境下使用[24],适用于应急污染事故的快速评价。
2.2 FCM
FCM是一种基于特定细胞亚群的荧光或光散射特性,利用激光测量分析液相中悬浮细胞或微粒的技术。该技术多用于水中细菌总数的检测。
FCM的优点在于较传统方法耗时短、误差小、灵敏度高,可用于区分活菌和死菌,并获得活菌百分比,适用于各类水质检测[35]。刘晓露[9]、沈朕等[36]证明了FCM在微生物应急快速检测中有较高的可信度。
在实际应用中,FCM可用于分析水源水中水生生物信息,对病毒、细菌、藻类进行计数分类、活性鉴定和功能检测,达到快速区别不同水源水、识别实际操作中的异常值[37-38]、描述水源水中微生物实时波动的目的[11]。通过追踪细胞损伤动力学、微生物水动力学和细菌细胞总数评估过滤单元、消毒单元[39]的效率和效果[17,37,40-43],评估工艺段是否能有效控制由水源水波动引起的微生物波动[11],监控微生物稳定性[16,44-46],用于水厂微生物水质检测系统预警[41]。在管网中,FCM可有效用于检测追踪微生物的再生,识别可能的污染源,分析细菌再生的原因[47-51],也可分析建筑物中水停滞后微生物群落的变化[52]。该技术的突出应用是在微生物全自动在线检测系统的建设和水污染事件快速响应机制的建立方面[53],例如,Hammes等[54]建立了将流式检测和数据分析结合起来的自动检测系统,Besmer等[10]也研究了长期使用FCM系统检测饮用水处理流程和水源水的系统。
2.3 ATP生物发光法
ATP是仅出现在活细胞内的基础能量单位,其数量与细菌数成正比。该方法基本原理是利用荧光素酶试剂对活细胞进行标记,利用生物发光仪检测发出的荧光[9]。优点在于检测时间短、操作简单;缺点在于灵敏度和准确性不高、反应体系的最佳条件未知,并且难以消除天然水体中细胞及游离ATP对结果的干扰[55]。
ATP生物发光法虽然只能判断微生物的数量和活性,但对污染或微生物入侵的敏感性较高,多与其他特异性检测方法搭配使用,用于水源水中检测菌落总数[55-58];监测水厂出现污染的紧急状况[59],检测细菌群落丰度,建立各类模型[60-62];检测判断管网生物稳定性的影响因素[16,23,63]。在在线监测系统中与FCM或作为细菌指示剂与基于微流体的系统相配合,可实现快速实时监测[64]、筛选特定微生物、监测饮用水污染[65-66]的作用,并起到预警作用[67]。
3 基于分子生物学的方法
基于分子生物学的方法依赖于对DNA和RNA研究技术的进步,包括基于聚合酶链式反应(poly-merase chain reaction,PCR)技术的方法、指纹图谱法、基于高通量测序(high-throughput sequencing, HTS)技术的方法。
3.1 基于PCR技术的方法
3.1.1 PCR
PCR是一种体外快速扩增特异性核酸片段的技术,于1983年由Mullis等[68]提出并迅速投入试验。其原理是以人工合成的核苷酸序列为引物,在DNA聚合酶的作用下,通过反应温度的变化,对目的基因进行指数扩增,从而特异性地扩增目标细菌特定基因片段[9]。
PCR分析具有较高的特异性、灵敏度和重复性,检测耗时较短[9],但最大缺点是不能区分病原体的活性。PCR分析是基于完整的核酸,而不是完整的活细胞,因此,病原菌PCR扩增阳性可能来自死亡细胞或非感染性细胞的假阳性[69]。同时,该技术无法对起始模板准确定量,只能通过电泳对扩增反应的最终产物进行定性[70]。
3.1.2 实时荧光定量PCR
实时荧光定量PCR(quantitative real-time PCR,qPCR)与常规PCR相比可以实现定量分析,具有更好的特异性、灵敏度和自动化程度,同时可以解决PCR污染的问题[9],是目前应用最广泛的PCR技术。根据qPCR所用荧光化学物质的不同,可分为荧光染料和荧光探针2类[70]。
荧光染料SYBR Green Ι与dsDNA的结合具有非特异性,可能使试验产生假阳性结果,因此,其特异性不如探针法[71]。但此检测方法较为简单,成本较荧光探针更低。
荧光探针TaqMan具有高度特异性[72]。与荧光染料相比,探针法的特异性节省了时间,敏感性、特异性、稳定性更高,但其缺点是仍无法区分细菌的活性[9]。
3.1.3 数字PCR
数字PCR(digital PCR, dPCR)属于第3代PCR,最早出现于1999年[73]。相较于qPCR,dPCR能够直接读出DNA分子的个数,是一种对起始样品核酸分子的绝对定量技术。该方法的优点是使得该技术能够检测野生型序列背景中的罕见突变,还能降低样本中抑制剂对结果的干扰[74]。
由于能有效进行样本划分和单分子目标扩增,dPCR在理论上优于qPCR,但在实践中,因qPCR具有更高的灵敏度,其在特定应用方面仍优于dPCR[74]。
表2总结对比了3代PCR技术的特点[75]。

表2 3代PCR技术特点对比Tab.2 Comparison of Three Generations of PCR Technologies
PCR对特定检测目标,如致病性大肠杆菌和“两虫”[76-78]的检测,有比较深入而广泛的研究[79-82]。PCR技术可检测水源水、水处理各单元和管网中的特定条件致病菌,并能精确到属水平,对给水系统的微生物风险管控提供建议[83-87]。新建立的多重PCR检测技术可一次性同时检测多种致病菌[88-89]和抗生素抗性基因(antibiotic resistance genes, ARGs),为饮用水中ARGs和潜在抗性致病菌的风险防控提供理论指导[90],评估管网管材腐蚀与微生物群落间的联系[91]。
3.2 指纹图谱法
3.2.1 梯度电泳技术
梯度电泳技术按发展时间可分为变性梯度凝胶电泳(denaturing gradient gel electrophoresis, DGGE)和温度梯度凝胶电泳(temperature gradient gel electrophoresis, TGGE)。DEEG可靠性高、重现性好、操作简便、样品分析量大,且可以实现微生物的时空变化检测[92]。缺点是其仅能检测环境中占总量1%以上的微生物[93],分离片段有长度限制[92],不同序列的DNA分离效果不佳[94-95],也不能区分微生物活性[96]。
3.2.2 多态性分析技术
限制性片段长度多态性分析(restriction fragment length polymorphisms, RFLP)是以分子杂交为基础的分子标记,于1974年创立,被称为第一代分子标记技术,优点是带型清楚[96]。单末端标记限制性片段长度多态分析(T-RFLP)根据16S rRNA设计引物,在引物末端使用荧光标记,其优点在于结果更可靠、分析迅速、结果输出形式便利[97]。单链构象多态性分析(single-strand conformation polymor-phism, SSCP)也是以PCR为基础的分子标记技术[92],利用单链核酸因结构和构象不同在电泳中迁移速率不同做多态性分析。
指纹图谱法常与基于PCR技术的方法联合使用。国内外学者应用PCR-DGGE进行微生物污染溯源[98-99]、群落结构及多样性变化分析[100-102]等方面的研究;利用叠氮溴化乙锭(EMA)-PCR方法检测饮用水中食源性致病菌活菌[103]。SSCP可研究地表水水库不同温度中细菌群落结构和组成的季节动态[104]。
3.3 基于HTS技术的方法
HTS技术也被称为下一代测序技术(next generation sequencing, NGS)。与第一代DNA测序技术(sanger sequencing)相比,NGS技术大幅降低和缩短了测序的难度和时长,可大规模并行分析、通量高、成本低[105]。限制在于读长短,不能超过500 bp。表3中对比了目前NGS 最具代表性的3个测序技术[105]。

表3 NGS技术对比Tab.3 Comparison of NGS Technologies
在实际应用中,HTS技术常基于16S rRNA,或配合PCR技术应用于水源水水质对微生物群落的影响[107-108]和多样性的检测[106];研究工艺段细菌群落及对管网出水的影响[109-111];研究消毒剂对微生物群落的影响[112];研究供水管网中微生物特性[113]、生物膜种群结构[114-116];研究不同水源和处理工艺对管网生物膜微生物群落的影响[117-118];研究不同水力水文条件(输送距离[119]、水龄和管道材料[120-121]、水力状况[122])对细菌群落的影响;对水源、工艺、管网的细菌群落进行时空分布分析[123]和溯源追踪[124];检测水处理和管网中抗生素耐药基因(ARGs)[125]。
4 检测方法对比
上述3类检测技术综合对比如图1所示,其中,深色单元格多代表该技术限制/不足较多,浅灰色单元格多代表该技术短板较少,DST、FCM、ATP和HTS是使用中各方面限制较少也较常用的检测方法。
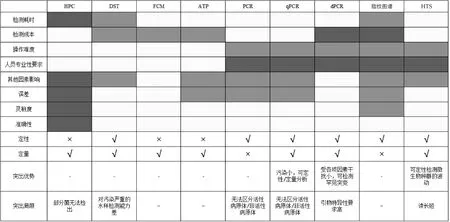
图1 三大类检测技术对比Fig.1 Comparison of Three Kinds of Detected Methods
日常检测中,水厂需及时掌握各工艺流程微生物状况或估算微生物再生能力时,可选择HPC、DST、FCM,其中DST和FCM对操作人员和环境的要求都不高,检测速度快,且因DST特异性高,可以满足重点关注致病菌和指示菌的检测,与FCM配合可达到准确量化的目的。应对水质突发污染事件检测时,可选择FCM、PCR、ATP,其中ATP对不同水源识别和污染入侵敏感,可及时检测到异常并发出预警,PCR配合ATP能定性分析污染来源和类别,协助制定解决方案。需监测水处理工艺和管网中微生物稳定性、开展水质风险评估、研究可改进工艺时,可按需求和实际情况选择多种检测方法联合进行。
5 结论
(1) 各个检测方法的特点和性质决定其适用于不同检测目的,应用实际中较少出现单独使用一种方法的情况,多采用不同方法相互配合。
(2) 随着“智慧水务”概念的推广实践,越来越多基于实时、在线的计算机技术被引入水务行业,水厂工艺和输水管网微生物方面的智能化和自动化管理也将得到更广泛应用。特别是HTS、快速检测技术的发展,大量研究证实了其可靠性和准确度,如何进一步将这些技术发展和应用,实现高效、实时、准确地在线监测和建立预警系统是下一步的研究方向。
(3)基于新技术在饮用水微生物方面的研究成果,在规划水厂的建立和处理工艺时,全流程微生物安全应纳入考虑,在水厂运行制度中也需加入科学、精准的微生物安全风险预警措施,提升水厂水质生物安全保障能力。
