慢性肾脏病患者冠状动脉微循环功能障碍相关研究进展
2023-09-19阿卜杜休库尔玉素甫综述邹建洲审校
阿卜杜休库尔·玉素甫 张 臻 综述 邹建洲 审校
冠状动脉病变(CAD)是慢性肾脏病(CKD)常见的心血管并发症,且是常见死亡原因之一。研究表明CKD中CAD患病率为41.6%[1]。近年来诸多研究表明,随着CKD进展,不仅以主干血管急性栓塞或血管慢性阻塞为主的CAD患病率增加,且冠状动脉微循环障碍(CMD)的发生率亦明显增加[2]。CMD表现为心肌缺血引起的症状(如劳累性心绞痛),可合并心电图特异性改变、心肌结构性病变,而冠状动脉影像学评估往往无明显异常。目前对CKD和CMD之间的联系尚无统一意见。本文对现有研究进行总结,重点探讨CKD相关危险因素和CMD之间的可能联系,为临床认识和干预这一特殊类型冠状动脉疾病提供依据。
CMD概述
定义冠状动脉微循环是心肌血流最小的效应单位,主要由小动脉(直径<500 μm)、微动脉(直径<200 μm)和毛细血管组成(图1),冠状动脉微循环在心肌血流调节中具有重要作用,其功能受到多因素影响。
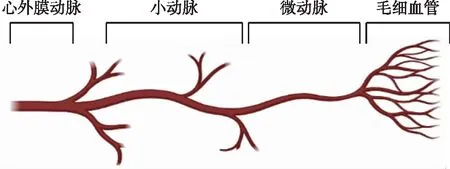
图1 冠状动脉微循环
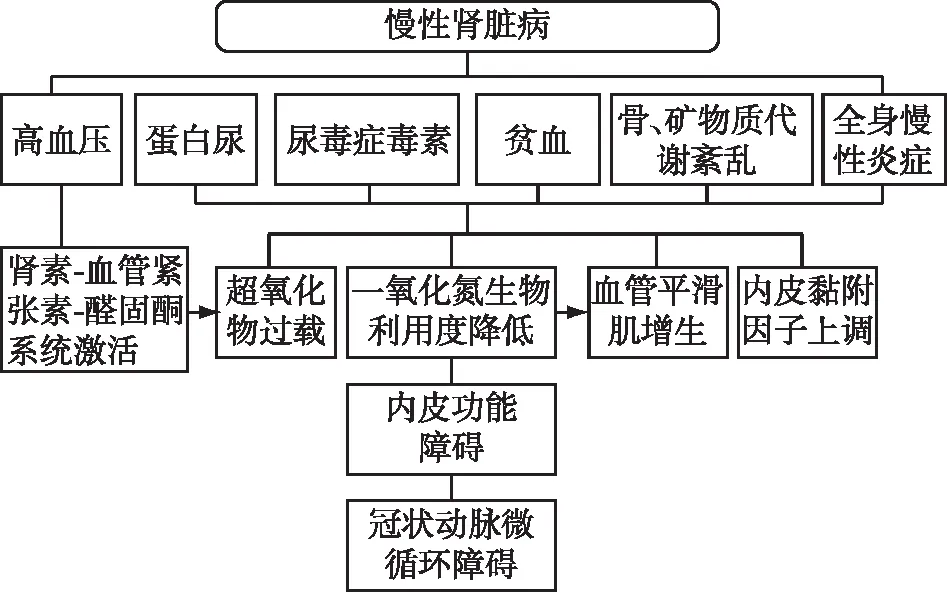
图2 慢性肾脏病患者冠状动脉微循环障碍的发病机制
临床上将具有可疑冠心病症状(心绞痛等),但经检查未发现阻塞性冠状动脉狭窄的疾病,称为缺血伴非阻塞性冠状动脉疾病(INOCA),INOCA可分为微血管性心绞痛和心外膜血管痉挛性心绞痛,其中微血管性心绞痛是CMD引起的心绞痛。CMD是在无阻塞性冠心病的情况下出现心绞痛、心电图表现为缺血性改变的临床综合征。其病理生理基础是微血管舒缩功能障碍,导致血流供应不足,无法满足心肌氧耗。既往亦称之为“心脏X综合征”。
病理生理机制
冠状动脉微循环结构性改变 CMD表现为冠状动脉特别是微血管特征性的结构和功能改变。高血压、微血栓形成等危险因素,可导致冠状动脉微血管管腔堵塞、管壁渗出、血管重建、血管纤维化及血管稀疏等结构性改变。CMD的共同特征为冠状动脉血管壁的不良重塑,主要是由于平滑肌细胞肥大和基膜胶原沉积增加,并伴不同程度的内膜增厚。重塑的肥厚血管壁导致管腔相对缩窄,从而使冠状动脉微血管流体阻力增加,最终导致冠状动脉血流储备(CFR)降低。值得注意的是,早期研究发现右隔心内膜下心肌内冠状动脉小动脉壁增厚,并非由直接暴露于压力过载的环境所致[3]。这表明,冠状动脉微血管的重塑与高血压相关的一些致病因素有关,而不仅仅是继发于血管超负荷或心肌细胞肥大。
冠状动脉微循环功能性改变 (1)内皮功能障碍:冠状动脉微血管内皮功能障碍是CMD的首要特征。血管内皮在调节血管张力和血流中起着重要作用。引起内皮功能障碍有多种危险因素,其中氧化应激被认为是其重要因素。细胞内超氧化物的增加通过多种机制产生内皮功能障碍,如一氧化氮(NO)失活和过氧硝酸盐的形成、NO合成酶的解耦联、前列环素合成的抑制、内皮素表达异常,以及可溶性鸟苷酸环化酶活性的抑制导致NO信号的减少,上述机制共同导致以血管舒缩异常为主要表现的内皮功能障碍[4]。(2)自主神经调节失衡:交感神经在调节血管张力中起着不可或缺的作用,而迷走神经的微血管张力调节作用饱受争议。自主神经功能受损主要包括自主神经兴奋性增高,伴或不伴分布在冠状动脉微血管的自主神经纤维受损,交感神经兴奋性增高将会导致肾上腺素源性血管收缩。
血管外机制 组织水肿是引起CMD的主要血管外因素,其机制包括毛细血管通透性增加、毛细血管内静水压升高和胶体渗透压降低、炎症及缺血再灌注损伤,这导致血液流向组织间隙。组织水肿可直接压迫冠状动脉微血管,从而引起微循环血液淤积,最终导致微血栓形成。
CMD的诊断
诊断标准和临床分型 CMD在临床并非少见,冠状动脉血管运动障碍国际研究小组(COVADIS)提出的CMD诊断标准:(1)CFR<2或2.5;(2)除外冠状动脉微血管痉挛,即反复的心绞痛发作以及心电图改变的同时乙酰胆碱激发试验阴性(使用相应药物后心外膜冠状动脉未痉挛);(3)冠状动脉微血管阻力指数(IMR)≥25;(4)存在冠状动脉慢血流现象,即心肌梗死溶栓帧数治疗(TIMI)帧数>25。
2014年,Filippo和Paolo等提出了CMD的临床分型(表1)[5],用于指导治疗与判断预后。

表1 冠状动脉微循环障碍的临床分型与发病机制
诊断方法 多数微循环的血管管径都小于现有血管造影的分辨率,尚不能直接观察和评估冠状动脉微循环,需借助无创或有创方法进行功能评估。
正电子发射断层成像(PET)可以无创、准确和可重复性地对心肌血流量(MBF)进行测量,因此可用于评估冠状动脉舒缩功能。心脏磁共振(CMR)可量化注射钆基造影剂后的心肌灌注,优点是空间分辨率高,可显示对心肌跨壁血流量,缺乏电离辐射,能全面评估心血管结构和功能。CMD患者的心内膜下区域对血管扩张剂的反应降低,这与不良预后相关[6]。经胸多普勒超声心动图可用来测量冠状动脉血流速度,优点是相对较低的成本和较高的可行性,但变异性较大。心肌超声造影利用静脉注射的回声、充气微泡的特性,这些微泡在大小和流变特性上与红细胞相似。优点是可以重复、定量地测量微血管流速和毛细血管血容量,并提供MBF估计值。而CFR和IMR的测量都需要依靠介入手段。CFR是反映冠状动脉充血相与静息相血流量比值的指标,其大小可表明冠状动脉静息状态下增加血流量的多少,又称血管扩张能力。CFR是通过尖端携带温度传感器的冠状动脉导丝利用热稀释法测量静息相平均传导时间除以充血相平均传导时间计算而得的,<2时被定义为异常。IMR为远端冠状动脉压力除以最大充血状态下平均传导时间的倒数,可使用压力-温度传感器尖端的冠状动脉导丝来测量,其大小可反映冠状动脉微循环阻力。当IMR≥25时可诊断为CMD,且IMR数值越大,心血管预后越差[7]。
虽然CMD已被学界重视,但目前仍缺乏可靠的生物标志物。5-羟色胺可引起血管收缩和血小板聚集,导致有效循环血流量减少。既往临床试验结果表明,血浆5-羟色胺浓度与冠状动脉舒缩功能障碍呈正相关[8]。另一项研究结果显示血浆5-羟色胺浓度与TIMI帧数基线值呈正相关[9],而TIMI帧数是反映冠状动脉血管阻力的指标。这些结果提示,血浆5-羟色胺浓度可能是CMD的生物标志物。
CKD与CMD
流行病学CKD患者CMD的患病率为35.7%[10],研究表明CFR降低往往与估算的肾小球滤过率较低相关[11];CKD患者心绞痛往往更易合并心电图特异性改变及肌钙蛋白T(cTnT)升高,而冠状动脉影像学评估可未见明显异常即没有大血管的明显狭窄[12];维持性血液透析患者CAD发病率高达50%,与透析中出现的心肌顿抑和节段血流量减少相关[13]。
发病机制CKD患者常见的高血压、蛋白尿、尿毒症毒素、贫血、骨和矿物质代谢障碍及慢性炎症状态可通过一系列特殊机制导致冠状动脉微血管不良重塑与内皮功能障碍,从而引起CMD。
高血压 水钠潴留导致的容量过载,以及肾素-血管紧张素-醛固酮系统(RAAS)过度激活可导致CKD患者发生高血压。由于肾和冠状动脉微血管极易受到血压和血流影响[14],高血压将会导致血管壁的不良重塑,最终引起CMD。此外,钠负荷增加是诱发慢性炎症状态的因素之一,可影响冠状动脉微循环[15]。RAAS活化可通过激活烟酰胺腺嘌呤二核苷酸磷酸(NADP)氧化酶和超氧化物的形成导致冠状动脉微循环内皮功能障碍[16]。
蛋白尿 1989年Deckert等[17]提出了Steno假说认为,蛋白尿不仅反映肾脏病变,还提示全身内皮微血管功能障碍。大样本研究表明,微量蛋白尿与肱动脉的内皮依赖性舒缩功能降低有关[18]。既往研究结果提示CKD患者中蛋白尿将导致CFR受损[19]。此外,蛋白尿会导致低蛋白血症,从而引起心肌等组织水肿、压迫冠状动脉微血管,这也是蛋白尿导致CMD的机制之一。
尿毒症毒素 肾小球滤过不足将导致各种代谢产物的潴留,称为尿毒症毒素。根据分子量将其分为小分子(尿素、胺类、酚类),中分子(甲状旁腺素)及大分子(核糖核酸酶、β2微球蛋白、维生素A)。尿毒症毒素的积聚会对多个器官产生影响,其对心血管系统的影响最为严重。尿毒症毒素可导致细胞因子分泌增多,刺激慢性炎症产生[20],抑制内皮细胞增殖并促进其凋亡[21];通过抑制内皮型一氧化氮合酶(eNOS)活性,减少NO的合成,同时促进内皮黏附因子合成、白细胞趋化、导致细胞外基质胶原合成增多及血管平滑肌增殖[22];色氨酸衍生物可特异性地激活芳香烃受体途径,引起血管氧化应激[23];糖基化终产物(AGEs)潴留也将引起血管氧化应激[24];循环中三酰甘油升高将引起氧化应激、血管平滑肌细胞增生、内皮功能障碍[25]。上述机制最终导致冠状动脉微血管的不良重塑。
贫血 CKD患者发生贫血的最主要原因是缺铁和促红素分泌不足。此外,血尿、甲状旁腺功能亢进也可引起贫血。最新研究表明,贫血促进CKD患者CMD的发生[26]。贫血可降低NO生物利用度从而引起内皮功能障碍[27]。NO生物利用度降低可引起血管平滑肌增殖。贫血还可引起超氧化物过载,从而引起冠状动脉微血管损伤[2]。肾性贫血引起慢性缺氧,将导致低氧诱导因子(HIF)过度激活,从而引起冠状动脉微血管纤维化[28]和冠状动脉微血管不良重塑。
骨和矿物质代谢紊乱 肾功能衰竭引起活性维生素D不足,从而导致继发性甲状旁腺功能亢进,其结果是循环中钙、磷、成纤维细胞生长因子23(FGF-23)增多。研究表明,矿物质代谢紊乱与CKD患者心血管死亡率增加有关[2]。Chitalia等[29]的研究提示维生素D缺乏将导致广泛的内皮功能障碍。与此同时,高磷血症也能导致广泛的内皮功能障碍。此外,高磷血症还将引起血管平滑肌细胞的增殖,从而导致微血管纤维化[2]。值得注意的是,Amann等[30]的研究结果表明高甲状旁腺素水平可影响单核细胞和成纤维细胞,导致CMD。
FGF-23是由成骨细胞和骨细胞分泌的激素,可抑制肾脏对磷的重吸收,从而有效地降低血磷水平。在CKD患者中,FGF-23不再能维持血磷稳定且高血磷与心血管死亡率增加有关[2]。有研究表明FGF-23水平升高导致NO生物利用度降低及超氧化物过载,从而引起内皮功能障碍[31]。此外,FGF-23增加还能引起细胞因子分泌增多,导致慢性炎症[32],最终导致CMD。
全身慢性炎症 慢性炎症状态被认为是导致CMD的关键因素,因为细胞因子可以直接诱导内皮细胞功能障碍,引起冠状动脉微血管内皮细胞黏附分子的上调,降低NO的生物利用度,导致血管舒缩功能和纤维化信号的启动[22]。
CMD的治疗进展
大多数合并CMD的CKD患者存在内皮功能障碍,因此积极管理传统心血管危险因素(如戒烟、控制体重、降压、降糖、降脂),健康饮食、定期锻炼、健康的睡眠模式尤为重要。抗血小板药物能减少微血管阻塞的发生,他汀类药物能降低血脂水平和炎症反应,与RAAS拮抗剂联合使用可有效改善CMD患者的内皮功能和生活质量。硝酸酯类药物可能会降低心脏后负荷导致灌注压下降甚至反射性引起RAAS激活,从而刺激冠状动脉收缩,并且硝酸酯类药物对冠状动脉的扩张作用不佳,因此硝酸酯类药物对CMD的疗效较差。既往研究表明,尼可地尔能显著减少缺血性心脏病患者的心血管死亡率[33],而其对CMD的疗效有待进一步研究。在一项小规模研究中,西地那非显著改善了INOCA患者的CFR[34],提示此类药物特别是长效制剂伐地那非治疗CMD可能有效,但尚需进一步的研究。钙通道阻滞剂是治疗血管痉挛性心绞痛的一线药物,最新研究表明T型钙通道阻滞剂可有效防止微血管痉挛。在一项小规模研究中,伊伐布雷定在矫正心率后仍然能显著改善稳定性冠心病患者的CFR[35],提示此类药物不仅通过降低心率减少心肌耗氧量来改善心绞痛,对微循环功能可能也有改善作用。CKD合并CMD的患者目前缺乏有效的治疗方法,影响了患者的生存质量和预后,控制CKD疾病进展同时早期预防CMD的发生,减少心血管不良事件,因此迫切需要进一步探索有效的治疗方法。
小结:CKD患者中高血压、蛋白尿、尿毒症毒素、贫血、矿物质代谢障碍和慢性炎症状态等因素通过一系列特殊机制导致冠状动脉微血管不良重塑与内皮功能障碍,从而引起CMD,目前缺乏有效的治疗方法。故CKD患者CMD防治的靶点主要针对上述病理生理紊乱。其诊断主要通过PET和带有传感器的血管导管等有创手段,仍有待研发更为可靠的生物标志物,以更加早期精确地识别CMD。
