基于T1WI增强影像组学在鉴别高级别胶质瘤复发与假性进展中的应用价值
2023-09-18苏春秋唐文天鲁珊珊洪汛宁
林 洁,苏春秋,唐文天,鲁珊珊,洪汛宁
南京医科大学第一附属医院放射科,江苏 南京 210029
脑胶质瘤是颅内最常见的原发恶性肿瘤。2021年WHO中枢神经系统肿瘤分类将胶质瘤分为1~4级,其中3~4 级为高级别胶质瘤(high-grade gliomas,HGG)[1]。HGG具有病死率高、复发率高、生存率低的特点。
HGG标准治疗方案是最大安全范围切除肿瘤,术后给予同步放化疗(concurrent chemoradiotherapy,CCRT)及替莫唑胺(temozolomide,TMZ)辅助化疗[2]。同步放化疗后在T1WI(T1 weighted imaging)增强上出现新发强化灶或强化范围增大,可能是假性进展,也可能是复发,但其治疗及预后完全不同,复发需二次手术、放疗及使用激素控制症状,而假性进展则继续TMZ化疗,仅对症处理。假性进展有更好的预后及生存率,而复发的中位生存时间仅3~9 个月[3]。目前,假性进展的机制尚未完全阐明,可能是由于同步放化疗造成血管内皮细胞损伤,以及血脑屏障破坏和炎症、水肿等继发反应,从而出现类似肿瘤进展的影像学表现[4]。病理是诊断的金标准,但组织学检查作为一种侵入性的检查方法,具有创伤性及样本误差。目前常用神经肿瘤疗效评估标准(response assessment in neuro-oncology,RANO)[5]区分假性进展与复发,但其依赖于连续的磁共振(magnetic resonance,MR)随访检查,要获得可靠诊断需要数月时间,可能导致HGG术后真性进展延误治疗或假性进展治疗不当。在临床实践中,由于相似的影像学表现,鉴别二者具有较大难度。因此,寻找一种可靠方法早期无创地鉴别HGG复发和假性进展对患者治疗及延长生存率具有重要的临床意义。
既往研究多基于功能MR鉴别二者,而功能MR不在常规扫描方案中,其失败率、诊断不确定性仍然存在[6]。T1WI 增强作为常规检查,广泛应用于HGG 的术后随访。影像组学通过大量提取图像纹理特征并结合机器学习算法,可以指导临床决策,已在医学领域引起越来越多的关注,尤其是肿瘤诊断、分期和预后方面。在胶质瘤方面,影像组学已被用来预测胶质瘤的分级及分子分型[7]、预测复发风险[8]等。本研究通过评估基于增强T1WI 的影像组学在鉴别标准化治疗后HGG 患者复发与假性进展的诊断效能,为临床及时调整治疗策略,改善患者的生存状况提供指导和帮助。
1 对象和方法
1.1 对象
回顾性分析2014 年1 月—2021 年12 月于南京医科大学第一附属医院就诊并经病理证实为HGG的患者临床及影像学资料。纳入标准如下:①所有患者均为初发首治的成人患者,均未经过术前放疗、化疗以及其他治疗;②根据WHO 2021年中枢神经系统肿瘤分类及分级标准,术后病理学证实为WHO 3~4 级HGG;③术后48 h 内行CT 或MR 扫描作为基线图像;④所有患者均行标准化治疗(术后CCRT,6 个周期的TMZ 辅助化疗);⑤CCRT 开始后的8 个月内,多次影像学随访中出现新增或扩大的强化病灶(增强病灶的大小在MR 图像上至少是10 mm×10 mm);⑥取第1次出现新发可测量强化病灶或强化病灶增大(最大截面的强化面积较上次增加>25%)的时间入组,且此次的T1WI增强图像资料完整;⑦具有最终的病理学诊断或临床影像学随访结果,随访时间不少于6 个月。排除标准如下:①MR 运动伪影大,图像质量差;②患者未满18 周岁;③术后未行标准化放化疗;④基线图像示肿瘤未全切;⑤在CCRT开始后的8个月内未出现新发强化或强化范围增大;⑥随访资料缺失。根据纳入排除标准共纳入104例患者。
根据二次手术病理或2010 年RANO 诊断标准将入组的所有患者分为复发和假性进展两组。复发标准(以下满足任一条):①二次手术病理证实为复发;②多次MR随访强化灶范围不断增大,周围水肿及占位效应明显,临床症状恶化;③强化出现在放射野之外的远处(例如超出高剂量区或80%等剂量线)。假性进展标准(以下满足任一条):①二次手术病理证实为假性进展;②多次MR 随访强化灶无变化或在不更改治疗方案情况下病灶逐渐缩小,周围水肿及占位效应逐渐减轻,临床表现稳定或趋于好转。根据以上标准,104例患者分为复发组71例,假性进展组33 例,其中二次手术病理证实为复发12 例,证实为假性进展8例。
1.2 方法
1.2.1 扫描方法
采用3.0T MR 成像扫描仪,使用头颅正交线圈。所有患者均行头颅MR 平扫与增强扫描方案,先行常规头颅横断位平扫T1WI、T2WI、FLAIR 及DWI 序列扫描,随后行动态磁敏感对比增强灌注成像(dynamic susceptibility contrast-enhanced perfusion weighted imaging,DSC-PWI)扫描,以静脉团注对比剂钆喷酸葡胺(Gd-DTPA)(0.1 mmol/kg,流率4 mL/s),然后进行T1WI轴位及矢状位三维T1WI增强扫描。扫描参数:T1WI,TR 400 ms,TE 2.48 ms,层厚5 mm,矩阵320×256,视野(FOV)230 mm×230 mm;T2WI,TR 5 090 ms,TE 91 ms,层厚5 mm,层间距1 mm,矩阵448×224,FOV 230 mm×230 mm;FLAIR,TR 8 000 ms,TE 97 ms,层厚5 mm,层间距1 mm,TI 2 300 ms,矩阵256×256,FOV 230 mm×230 mm。DWI图像采用自旋回波平面回波成像(SEEPI)序列轴位成像,扫描参数:TR 4 800 ms,TE 100 ms,层厚5 mm,层间距1 mm,FOV 230 mm×230 mm,b值分别选取0 s/mm2和1 000 s/mm2。表观扩散系数(apparent diffusion coefficient,ADC)图由机器自动处理生成。DSC灌注图像使用单次激发梯度回波-平面回波成像(GRE-EPI)序列,扫描参数:TR 1 400 ms,TE 32 ms,层厚5 mm,层间距1.25 mm,矩阵128×128,FOV 230 mm×230 mm。
1.2.2 常规MR影像特征评估
由1名经验丰富的放射科医师收集患者的一般资料及常规MR影像特征分析,记录患者一般资料,包括性别、年龄、手术时间、标准化治疗时间、多次随访时间、入组时间。常规MR影像特征分析:根据伦勃朗视觉感受图像(visually accessible rembrandt images,VASARI)特征集[9]评估肿瘤定位、肿瘤中心部位;并测量双侧颞肌厚度、最大强化面积、水肿带最大面积。测量方法如下:在三维T1WI 增强序列上进行多平面重建轴位图像,以前联合-后联合连线水平为基线,于眶顶水平在垂直颞肌长轴测量双侧颞肌厚度;在强化灶的最大截面上测量相互垂直的最大长径,计算最大强化面积;在FLAIR 图像上测量水肿相互垂直的最大长径,并计算最大面积。
1.2.3 图像分割与特征提取
由1 名经验丰富的放射科医师使用ITK-SNAP软件在T1WI增强图像上逐层手工勾画肿瘤强化区作为最终分析的三维感兴趣区容积(volume of interest,VOI),避开明显的大血管及坏死囊变区。所有分割的图像由1 名具有20 年神经影像诊断经验的神经放射学家评估和验证。
采用FeAture Explorer 软件[10](https://github.com/salan668/FAE)对每例T1WI 增强图像的VOI 提取1 648 个特征,包括:①形状特征;②一阶直方图特征;③二阶纹理特征:包括灰度共生矩阵、灰度游程矩阵、灰度大小区域矩阵、邻域灰度差矩阵及灰度依赖矩阵;④高阶特征:包括对以上特征进行小波变换等高阶变换。将所有病例以7∶3的比例随机分为训练组(72例)和验证组(32例),同时导入临床特征以确保随机分类的组间具有相同临床特征的分布。影像组学流程图如图1所示。

图1 影像组学分析流程图
1.2.4 特征处理
为了避免不同采集参数产生的偏倚,使用Zscore 方法将所有的特征进行标准化。通过主成分分析(principal component analysis,PCA)进一步数据降维,将潜在相关的高维特征转变为线性独立的低维特征。最后,采用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)来选择具有非零系数的最优特征。
1.2.5 模型建立与效能评价
支持向量机(support vector machine,SVM)建立组学模型,为了尽可能避免偏差和过拟合,采用5倍交叉验证法对模型进行检验。并绘制模型训练组和验证组的受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under curve,AUC)、准确率、灵敏度、特异度。绘制校准曲线验证模型效能。
1.3 统计学方法
使用SPSS 23.0软件及Python 3.0软件进行统计分析。首先对计量资料包括年龄、颞肌厚度、最大强化面积、水肿带最大面积进行Kolmogorov-Smirnov正态性检验和Levene方差齐性检验,符合正态分布的计量资料用均数±标准差()表示,采用独立样本t检验;不符合正态分布者以中位数(四分位数)[M(P25,P75)]表示,采用非参数Mann-WhitneyU检验进行比较。对于分类资料包括性别、肿瘤定位、肿瘤中心部位,用频数(百分比)表示,采用卡方检验进行比较。P<0.05为差异有统计学意义。绘制校准曲线,计算准确度、灵敏性、特异度和AUC以评估模型性能。
2 结果
2.1 临床影像资料
患者临床影像资料见表1,假性进展组的年龄为(49.281±11.627)岁,复发组的年龄为(55.457±10.428)岁,差异有统计学意义(P<0.05)。假性进展组与复发组的性别、肿瘤定位、肿瘤中心部位、颞肌厚度、最大强化面积及水肿带最大面积差异均无统计学意义(P均>0.05)。
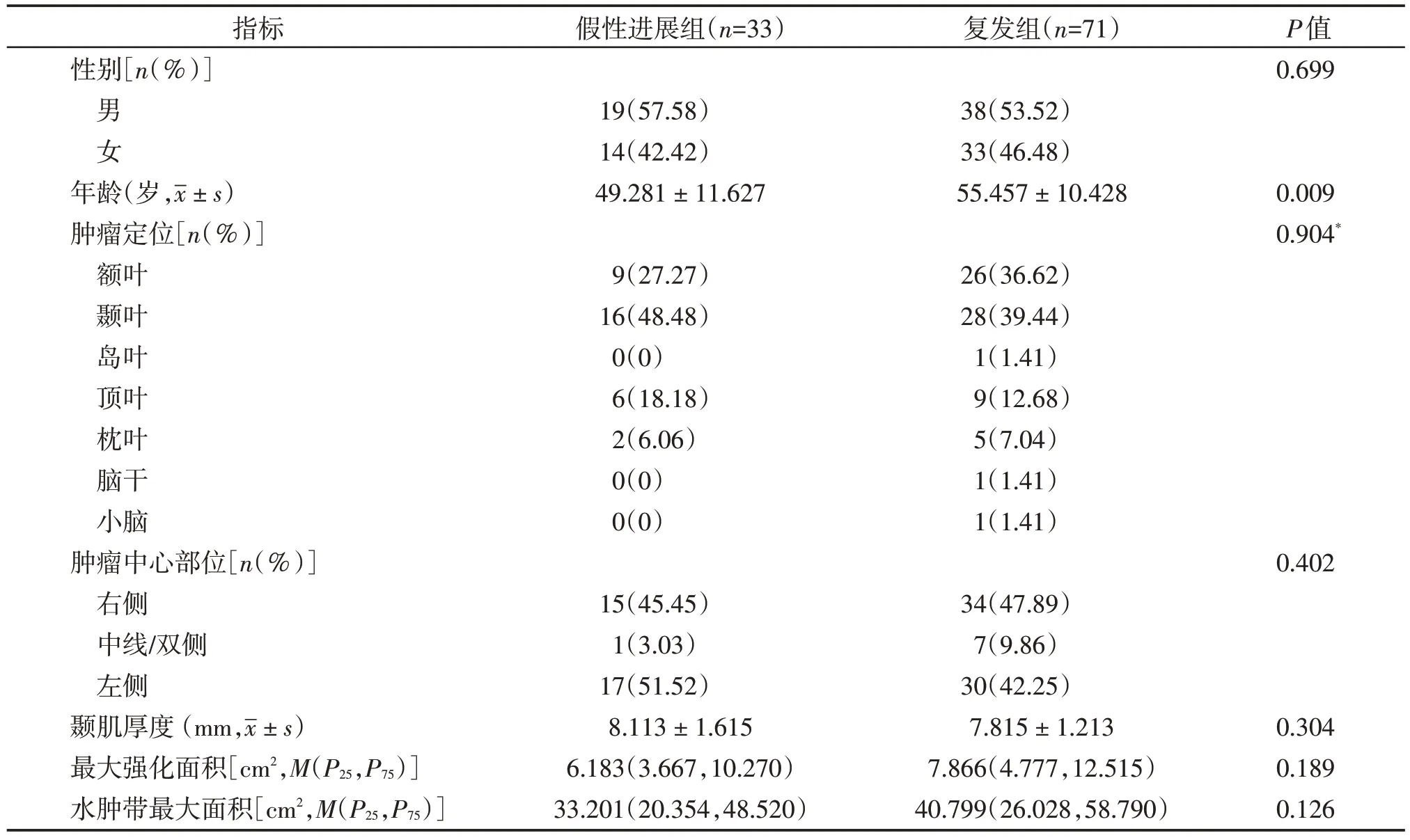
表1 假性进展组与复发组的一般资料与影像学资料
2.2 特征筛选
将1 648 个特征进行PCA 降维,获得64 个PCA特征,然后通过LASSO 筛选获得13 个非零特征,随着λ逐渐变大,越来越多的特征系数被压缩为0,在最优λ值时只剩13个非零特征。因此,最终获得13个最佳PCA特征用于建模(图2)。
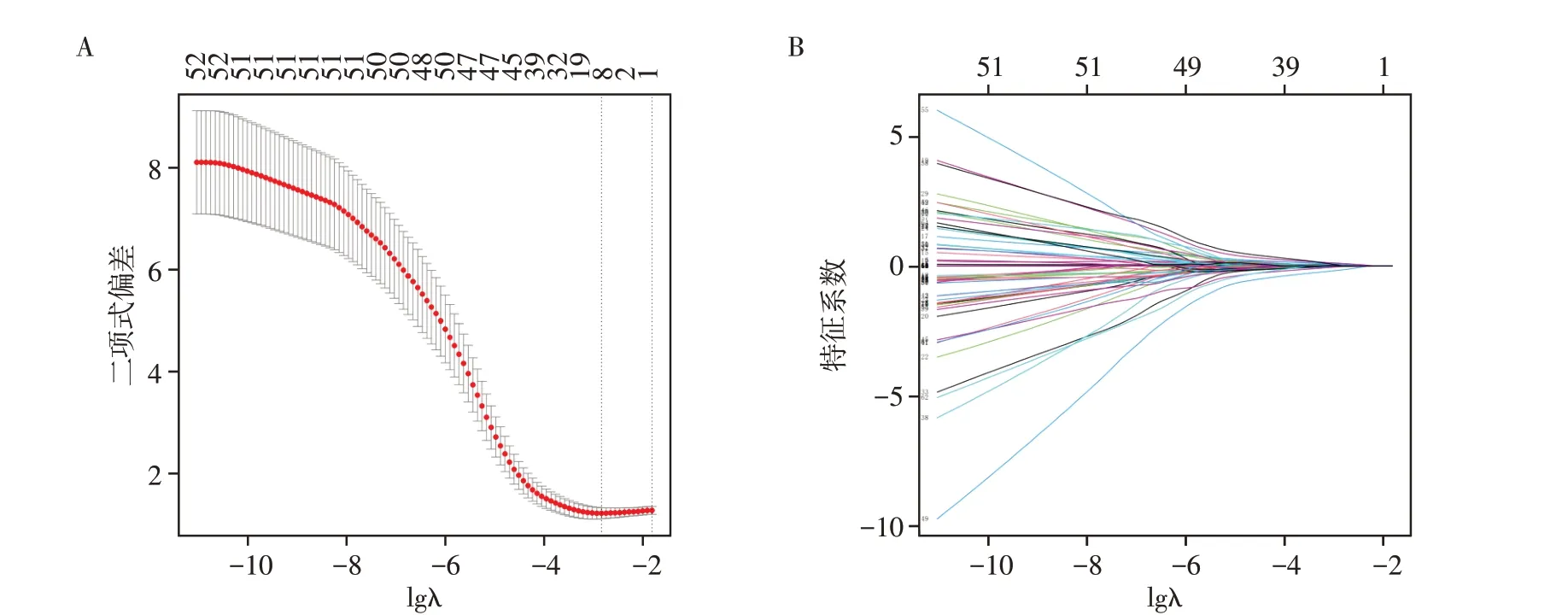
图2 LASSO回归筛选影像组学特征图
2.3 影像组学模型及效能评价
使用最终获得的13 个PCA 特征建立SVM 组学模型,利用ROC 曲线来评估组学模型的诊断效能(图3)。校准曲线分析模型校准效能(图4)。训练组鉴别HGG 复发与假性进展的AUC 为0.929,准确率为0.889,灵敏度为72.7%,特异度为100.0%。验证组的AUC 为0.853,准确率为0.813,灵敏度为90.9%,特异度为71.4%。校准曲线结果显示模型一致性较好。

图3 训练组及验证组鉴别复发与假性进展的ROC曲线
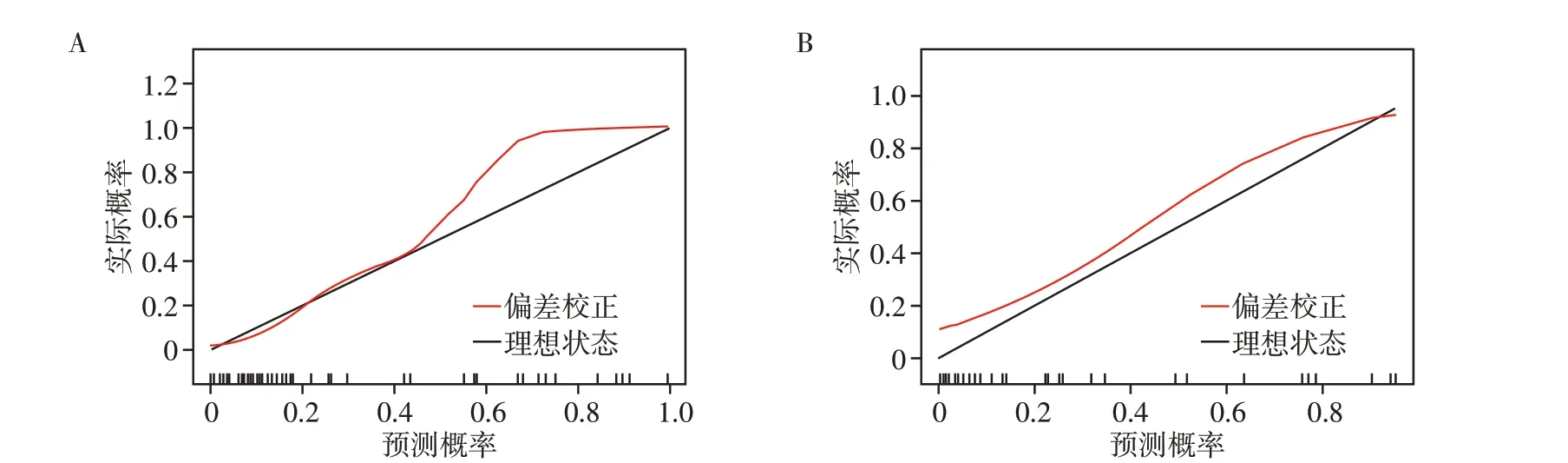
图4 校准曲线
3 讨论
HGG 标准化治疗后出现新发强化灶或强化范围增大,可能是复发,也可能是假性进展,二者酷似的影像学表现使得鉴别成为一大难题,复发与假性进展的治疗方案及预后完全不同,因此,准确鉴别二者成为临床的迫切需求。本研究基于T1WI增强建立影像组学模型,验证组的AUC为0.853,准确率为0.813,有助于无创地鉴别HGG 术后假性进展与复发,为临床及时进行干预、制定合适的诊疗方案提供帮助。
HGG 术后复发与假性进展常规影像特征表现相似,鉴别困难,本研究结果显示假性进展组与复发组之间的年龄差异有统计学意义,假性进展组的年龄更轻,进一步将年龄纳入模型后与单纯影像组学模型进行DeLong检验比较,结果显示差异无统计学意义(训练集、测试集P值分别为0.658、0.480)。除此之外,两组常规影像特征差异无统计学意义(P均>0.05),与Agarwal 等[11]的研究结果相符。此外,研究表明颞肌厚度与胶质瘤预后相关[12-13],本研究结果表明颞肌厚度在假性进展与复发间的差异无统计学意义,有待更多研究进一步验证。
既往研究多使用功能MR 鉴别假性进展与复发[3,14],虽然这些研究取得了良好的结果,但功能MR 不在常规扫描方案中,且扫描失败率及诊断不确定性仍然存在。T1WI增强作为常规扫描方案,可以反映肿瘤血脑屏障的破坏程度。此外,影像组学作为一种新兴研究方法,可以高通量地提取肉眼无法观察到的特征,进行客观定量的分析,受到了越来越多研究的关注[15]。本研究提取了丰富的影像组学特征,并通过PCA降维及LASSO筛选以获得最佳特征,从而构建SVM模型。PCA通过正交变换将可能存在相关性的高维特征转换为线性独立的特征,相比原始的大量特征,PCA 可以缓解维度灾难,消除众多特征之间的互相影响,实现降低噪声且不受数据集以外因素干扰的优点。目前已有研究将PCA 特征用于预测胶质瘤MGMT 基因状态,并获得了较好的结果[16]。LASSO 通过构建一个惩罚函数,将简单线性回归L1正则化,可以将不重要的特征系数收缩到0,而非0系数的特征视为最终特征保留下来,从而实现了特征选择,目前已广泛应用于胶质瘤的鉴别诊断、基因状态预测中[17-18]。既往研究多为单独应用PCA或LASSO分别筛选特征建模[19],本研究创新性地将二者结合,有利于更好地筛选最优特征。孙颖志等[20]通过T1WI增强建立机器学习模型鉴别胶质母细胞瘤的假性进展与复发,模型验证组的AUC 值、准确性、灵敏度和特异度分别为0.79、72.78%、78.36%和61.33%,本研究提取了更丰富的影像组学特征,并将其降维为PCA 特征,通过LASSO 进行筛选,构建SVM 模型,获得了更高的效能,验证组AUC值为0.853,准确性为0.813,较以往研究有所提升。
本研究存在以下局限性:①样本量较小,因此可能存在过拟合的风险,为了解决此问题,本研究通过对原始图像中提取的特征进行多种高阶变换以获得较多的特征并进行5 次交叉验证,以尽量避免过拟合;②手动勾画VOI可能存在差异,但本研究VOI 包含整个肿瘤的实质区可以减小由于单一层面选择带来的误差,能够更加全面地反映肿瘤内部的异质性特征;③本研究的临床资料中未纳入HGG 的分子标志物,需要在今后的研究中进一步纳入分子标志物评估;④本研究是回顾性研究,且仅对本中心的胶质瘤数据进行了研究,可能存在局限性,下一步将联合其他研究中心开展更广泛、更深入的研究。
综上所述,基于T1WI 增强影像组学可以鉴别HGG 术后的假性进展与复发,有助于临床及时干预,为临床决策提供支持。
