儿童急性淋巴细胞白血病诱导缓解期并发严重感染的临床分析
2023-09-18付文凤方拥军
刘 畅,付文凤,张 姮,薛 瑶,方拥军
南京医科大学附属儿童医院血液肿瘤科,江苏 南京 210008
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是儿童最常见的恶性肿瘤性疾病,近来年,随着危险分层的调整、化疗方案的改进、综合管理水平的提高,ALL 的预后已经得到明显改善。根据圣裘德儿童研究医院数据显示,ALL 患儿5 年总体生存率已经超过90%[1-3]。然而,尽管疾病结局有所改善,但与治疗相关的不良反应仍然很高。感染是ALL 化疗的公认并发症,是患儿死亡的重要原因,这与多种药物联合化疗引起的不良反应密切相关。ALL本身、年龄因素、骨髓抑制、屏障功能受损、静脉置管和大剂量化疗都与感染的高风险相关。
感染可发生在ALL 化疗的任何时期,在诱导缓解期更为常见。诱导缓解期是ALL 化疗的重要组成部分,该时期化疗强度大,大剂量化疗药物在杀灭大量白血病细胞的同时,对造血功能及免疫屏障造成破坏,增加了感染的风险。严重感染不仅延长住院时间,增加了家庭经济负担,也会导致化疗延迟或者化疗药物剂量减少,进而影响预后,甚至威胁患儿生命[4]。因此,了解诱导缓解期发生严重感染的高危因素,对于预防严重感染的发生具有重要意义。本研究探讨使用CCCG-ALL-2020 方案化疗的患儿诱导缓解期感染的临床特点,对感染部位、致病菌进行分析,并寻找发生严重感染的危险因素,为临床干预提供理论依据。
1 对象和方法
1.1 对象
纳入2020年6月—2022年6月在南京医科大学附属儿童医院收治并诊断为ALL 的患儿,均采用中国抗癌协会小儿肿瘤专业委员会(Chinese Children’s Cancer Group,CCCG)最新修订的CCCG-ALL-2020方案治疗,在患儿及监护人知情同意下采集患儿的基本临床资料。纳入标准:①年龄1~14岁;②所选病例均经骨髓细胞形态学、免疫学、细胞遗传学及分子生物学等确诊,符合英法美协作组ALL诊断标准;③病例资料完整,且诱导缓解期在本中心完成;④在诱导缓解期间至少发生1次感染。本研究得到南京医科大学附属儿童医院医学伦理委员会批准(批件号:202304067-1),所有患儿监护人知情同意。
1.2 方法
1.2.1 定义
根据美国常见不良反应术语评定标准(common terminology criteria for adverse events,CTCAE)(5.0 版),感染发作主要为临床感染,即有特殊的症状体征或影像学检查阳性。是否有感染相关不良反应作为严重感染组和非严重感染组的分组依据。根据CCCG-ALL-2020方案和CTCAE,严重感染包括脓毒症(脓毒性休克)、重症肺炎、严重腹腔感染和临床或微生物学记录的感染,以及其他被认为感染相关的3级或者3级以上的不良反应。发热指单次口腔测定温度≥38.3 ℃,或温度持续≥38.0 ℃超过1 h。中性粒细胞缺乏指外周血中性粒细胞绝对值(absolute neutrophil count,ANC)<0.5×109个/L。中性粒细胞缺乏持续时间以发生感染前实际中性粒细胞减少时间计算。住院时长为患儿从入院开始到出院的总时间。体表面积(m2)=[身高(cm)×体重(kg)/3 600]2。
1.2.2 治疗
确诊ALL 后,所有患儿均进入层流病房,经外周静脉行中心静脉置管(peripherally inserted central catheter,PICC),并每周进行护理。每周3 d 服用复方磺胺甲恶唑预防卡氏肺孢子虫感染,此外,未使用任何常规预防性抗生素、抗真菌或粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)。在骨髓缓解后,中性粒细胞缺乏患儿使用G-CSF 刺激中性粒细胞产生。对于有发热或潜在感染的中性粒细胞缺乏患者,根据感染部位、临床特点以及检查给予经验性广谱抗生素治疗,并根据培养结果调整治疗方案。对于抗感染治疗72 h 内没有反应的患儿,经验性使用抗真菌药物治疗。出现导管相关血流感染、感染性休克或合并严重的肺部感染、皮肤软组织感染,加用万古霉素。对于出现卡氏肺孢子虫感染或病毒感染,通过气管镜或支气管肺泡灌洗进行诊断和治疗。
1.2.3 数据收集
回顾性收集患儿的人口学和临床资料、化疗出现感染时的实验室参数和感染的发生情况。人口学和临床资料包括性别、年龄、免疫分型、风险分层(根据ALL患儿初次发病年龄、初诊时白细胞计数、免疫分型、对糖皮质激素的反应、细胞遗传学、分子生物学特点等可分为低危、中危及高危)、住院时长、身高、体重、住院花费、抗菌药物使用费用。实验室参数包括初诊时白细胞(white blood cell,WBC)计数、初诊时血红蛋白(hemoglobin,HB)浓度、初诊时血小板(platelet,PLT)计数、血清白蛋白(albumin,ALB)含量、中性粒细胞缺乏持续时间、感染时ANC。记录患儿静脉血培养、粪便培养、尿培养、痰培养或其他感染部位的病原学检测结果。
1.3 统计学方法
采用SPSS 26.0 软件对数据进行统计学分析。分类变量用例数、构成比或率(%)表示,组间比较采用χ2检验;连续性变量用均数±标准差()表示,组间比较采用t检验,危险因素分析采用Logistics回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 诱导缓解期感染发生情况
结合临床表现、实验室检查、影像学检查结果,188例患儿被诊断为ALL,180例患儿符合入组条件,感染发生率95.7%,共发生313例次感染,89例为单次单部位感染,91例为多次、多部位感染。在313例次感染中,感染部位/原因前3位分别为不明原因感染、上呼吸道感染、下呼吸道感染,分别占28.4%、23.6%、16.9%(表1)。本研究纳入的患儿有48例发生严重感染,严重感染发生率为26.7%(48/180),包括脓毒症(脓毒性休克)28 例(58.3%)、重症肺炎10 例(20.8%)、严重腹腔感染5例(10.4%)、严重胃肠道感染4例(8.3%)、感染性心内膜炎1例(2.1%)。

表1 180例患儿313例次感染发生部位情况Table 1 The distribution of 313 infections in 180 pediatric patients
2.2 诱导缓解期感染的微生物检出及耐药情况
180 例患儿共检出43 株微生物,包括革兰氏阴性菌(G-)20 株(46.5%),其中铜绿假单胞菌4 株,C群沙门菌、肠炎沙门菌各3 株,鲍曼不动杆菌、肺炎克雷伯菌肺炎亚种、阴沟肠杆菌复合菌、致病性大肠埃希菌各2株,D群沙门菌、植生拉乌尔菌各1株。革兰氏阳性菌(G+)19 株(44.2%),其中表皮葡萄球菌6株,金黄色葡萄球菌5株,人葡萄球菌亚种4株,肺炎链球菌、头状葡萄球菌各2株。真菌4株(9.3%),其中白假丝酵母菌3 株,新型隐球菌1 株。共检测出产超广谱β内酰胺酶(extended spectrum beta lactamase,ESBL)的肺炎克雷伯菌亚种、致病性大肠埃希菌、鲍曼不动杆菌、C群沙门菌共12株,未检出凝固酶阴性葡萄球菌。G-菌对氨苄西林、氨苄西林舒巴坦、复方新诺明、哌啦西林、头孢呋辛酯耐药(图1)。G+菌对苯唑西林、复发新诺明、红霉素、克林霉素、青霉素耐药(图2)。
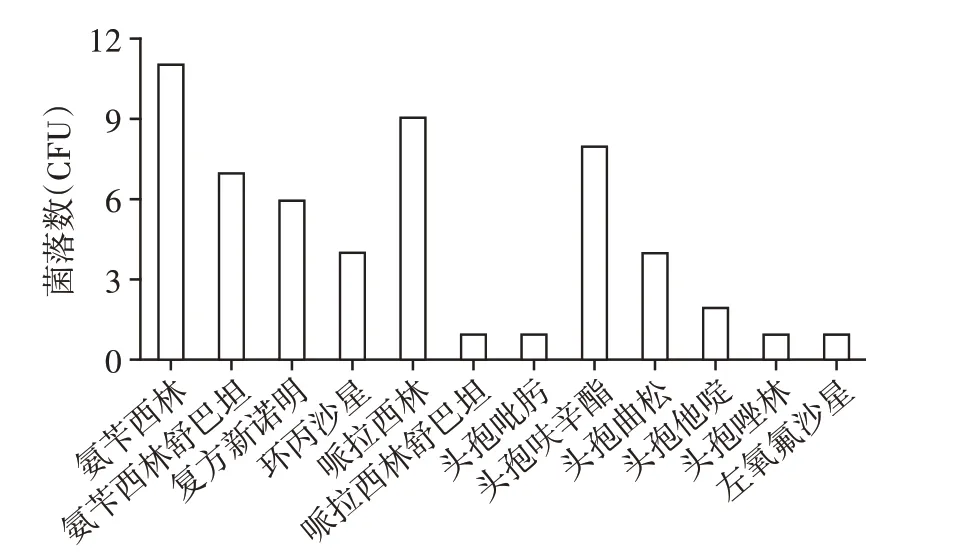
图1 G-菌耐药情况Figure 1 Drug resistance of the G-bacteria

图2 G+菌耐药情况Figure 2 Drug resistance of the G+bacteria
2.3 诱导缓解期严重感染与非严重感染患儿的临床因素比较
ALL患儿在诱导缓解期的住院时长、住院费用、单位体表面积抗生素费用,经两独立样本t检验,严重感染组均明显高于非严重感染组患儿(P<0.05)。对ALL患儿诱导缓解期可能出现严重感染的相关因素进行分析显示,中高危、初诊时WBC≥10×109个/L、初诊时HB<90 g/L、ALB<35 g/L、中性粒细胞缺乏持续时间>7 d、ANC<0.1×109个/L与严重感染的发生具有相关性,差异有统计学意义(P<0.05,表2)。

表2 诱导缓解期严重感染与非严重感染患儿的临床因素比较Table 2 Comparison of clinical factors in pediatric patients with severe infection and non-severe infection during induction period
2.4 诱导缓解期严重感染的多因素Logistic分析
将P<0.05 的因素纳入多因素Logistic 分析,结果显示中高危(OR=2.804,95%CI:1.234~6.375,P=0.014)、ALB<35 g/L(OR=4.708,95% CI:2.067~10.726,P=0.001)、中性粒细胞缺乏持续时间>7 d(OR=3.697,95%CI:1.393~9.816,P=0.009)是诱导缓解期发生严重感染的独立危险因素(表3)。
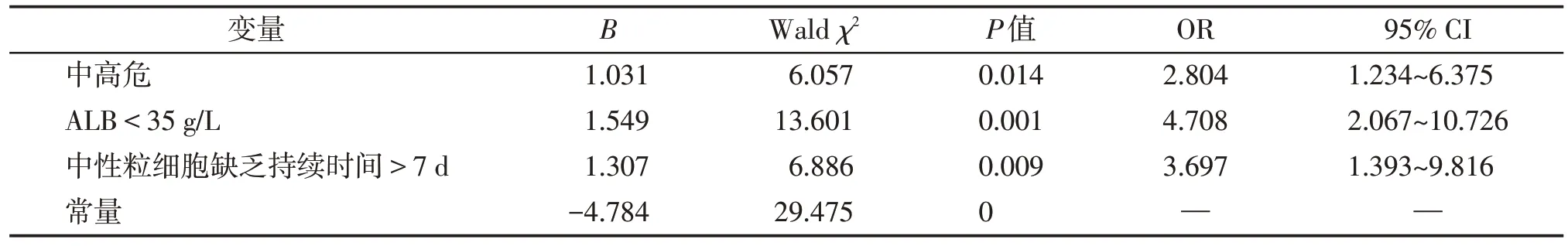
表3 诱导缓解期严重感染的多因素Logistic回归分析Table 3 Multiple logistic regression analysis of severe infection during induction period
3 讨论
在化疗中,不可避免的免疫系统损伤使得患儿面临感染的风险,绝大多数患儿在接受化疗过程中会经历多次感染,感染具有发生率高、发展快、病程长、病情复杂等特点,这不仅增加家庭经济负担,影响ALL 治疗效果,也是导致患儿死亡的重要原因。CCCG-ALL-2020方案自发布以来,尚无研究探讨该方案诱导缓解期的感染情况,因此本研究具有一定指导意义。本研究详细分析了CCCG-ALL-2020 方案在治疗中严重感染和非严重感染的发生情况、病原分布特点、以及影响严重感染发生的因素。
本研究中ALL 诱导缓解治疗期间,感染的总体发生率为95.74%(180/188),以呼吸道感染(40.5%)较常见,与其他研究结果类似[5],其中肺部感染最主要的病原体为肺炎链球菌、流感嗜血杆菌、肺炎克雷伯杆菌及铜绿假单胞菌[6],诱导缓解期呼吸道感染高发与该时期患儿免疫功能低下、大剂量化疗药物损伤呼吸道黏膜有关。此外,医院环境中致病菌浓度高,儿童鼻道狭窄,纤毛运动弱,清理呼吸道、口腔分泌物能力差,均使得病原体容易定植、入侵,导致呼吸道感染的发生[7-8]。研究表明,最常见的感染事件为不明原因感染性发热[9],本研究中约89例次(28.4%)感染未找到明确感染灶,这说明在化疗中,由于患儿免疫功能低下,机体无法产生足够的炎症反应,感染的局部表现可能消失或出现不明原因发热,全面检查有助于及时发现早期感染迹象,针对性治疗。血流感染、消化道感染也常见于ALL诱导缓解期,因此,在化疗期间应密切关注患儿上述部位感染情况,控制感染的进展。
在西方发达国家,常见的病原感染以G+菌为主,亚洲国家以G-菌为主[10]。对本中心病原菌进行分析中,23.8%(43/180)的ALL患儿在诱导缓解期经历了1 次微生物学记录上的感染,G-菌与G+菌的比例相当,这与侵袭性操作、深静脉置管导致的条件致病性G+菌感染有关[11-12]。在经验性应用抗生素时,应尽量覆盖患儿可能感染病原菌的广谱抗生素。研究中,产ESBL G-检出率高达60%(12/20),因此,诱导缓解期对疑似G-感染的患儿初始抗感染治疗推荐单一广谱的碳青霉烯类抗生素[13]。近年来,由于中性粒细胞缺乏时间长,免疫抑制剂、糖皮质激素、抗生素使用等因素,真菌感染率逐渐上升[14],对于普通抗生素无法控制的感染,应及时使用抗真菌药物。
本中心应用CCCG-ALL-2020 方案化疗的患儿诱导缓解期的平均住院时长为45.8 d,长时间住院治疗花费巨大。由于ALL疾病本身的特殊性,多数患儿病情严重,免疫力低下,存在多种并发症的可能。研究表明,医院感染的发生加重了患者的经济负担[15]。本研究中,相比非严重感染患儿,严重感染患儿平均花费增加2.41万元,单位体表面积抗生素使用费用增加1.39 万元,因此,有效减少严重感染的发生是控制ALL治疗成本的关键[16]。
根据统计结果,中高危、ALB<35 g/L、中性粒细胞缺乏持续时间>7 d 是ALL 诱导缓解期发生严重感染的独立危险因素。与低危患儿相比,中高危患儿化疗强度更大,骨髓造血功能受到严重抑制,更容易出现严重感染,说明危险分层是ALL并发严重感染的危险因素之一。本研究中ALB 具有最高的OR值。ALB是营养评估的基础,也是免疫状态的生物标志物[17-18]。持续炎症反应和肿瘤细胞释放的细胞因子导致ALB水平降低,ALB异常降低导致内环境紊乱,体液免疫功能下降,是患儿发生严重感染的独立危险因素。ALB 中的巯基可通过细胞内氧化还原反应介导炎症细胞信号的调节,从而减轻机体炎症,保护脏器功能,减轻组织损伤[19]。在诱导缓解期,几乎所有患儿都出现中性粒细胞缺乏,感染的频率和严重程度与ANC呈反比,中性粒细胞具有强大的趋化和吞噬作用,中性粒细胞减少时,趋化和吞噬作用降低,感染发生率升高。文献报道,ANC<0.1×109个/L是发生感染的独立危险因素[7],本研究中,严重感染组中ANC<0.1×109个/L的患者比例高于ANC≥0.1×109个/L 的比例,但多因素分析中未发现有统计学意义。我国一项对于中性粒细胞缺乏伴发热的多中心、前瞻性流行病学研究显示,随着中性粒细胞缺乏时间的延长,感染的发生率增高[20]。文献指出,凡符合中性粒细胞缺乏伴发热定义的患者均应积极使用G-CSF 刺激中性粒细胞产生,并早期预防性抗感染治疗,根据患儿临床表现、检查结果调整抗生素使用,避免错过治疗时机,给患儿带来不良影响[21]。
综上所述,在CCCG-ALL-2020 化疗方案中,感染是儿童化疗后的主要并发症之一。常见的感染以不明原因感染、上呼吸道感染、下呼吸道感染为主,中高危、ALB<35 g/L、中性粒细胞缺乏持续时间>7 d是严重感染的独立危险因素,在积极治疗原发病的基础上,根据危险因素个体化评估、护理,及时应用G-CSF、抗生素,对于降低严重感染的发生率、减少住院时长、减轻家庭经济负担十分重要。
