活化转录因子4参与甲基化修饰与巨噬细胞炎症反应的关联研究
2023-09-17赵奕琳刘田恬冯舒云张育才王春霞
赵奕琳 刘田恬 冯舒云 张育才 王春霞
脓毒症是危重症患者死亡的主要原因。“脓毒症3.0”定义脓毒症为由宿主对感染的反应失调引起的危及生命的器官功能障碍,其临床特征表现为早期的急性炎症因子风暴和后期的免疫抑制所致的二次感染风险的增加,从而诱发多器官功能障碍,导致患者预后不良[1-3]。据估计,全球范围内每年约有120万儿童脓毒症病例和300万新生儿脓毒症病例[4]。脓毒症免疫炎症反应与细胞代谢变化息息相关,尤其是固有免疫细胞的功能改变。已有学者提出了“脓毒症免疫代谢”的概念[5]。表观遗传学、转录组学、转录因子等综合分析研究[6]发现,基因启动子或增强子区组蛋白的修饰标记[如组蛋白H3第4位赖氨酸上单甲基化修饰(monomethylation of histone H3 on lysine 4,H3K4me1)和组蛋白H3第4位赖氨酸上三甲基化修饰(trimethylation of histone H3 on lysine 4,H3K4me3)等]与免疫活性调控有关。与非脓毒症患者相比,脓毒症患者全血DNA的443个基因中存在668个甲基化位点差异,多聚焦于IFN-γ等免疫反应信号途径,从而影响患者的病情严重程度[7]。目前,脓毒症表观遗传学调控机制的研究尚处于起步阶段[8],而甲基化修饰为脓毒症的病理生理研究提供了新视角,亟待深入探索。

表1 ATF4参与巨噬细胞炎症反应的甲基化修饰相关基因的GO分析
活化转录因子4(activating transcription factor 4,ATF4)靶向下游基因,参与脂肪细胞糖脂能量代谢[9-11]、肝脏糖异生和脂质代谢[12-13]等病理生理过程。本课题组前期研究[14-15]发现,肝细胞内ATF4表达水平增高及其介导的肝细胞自噬激活是脓毒症发生时肝脏自我保护的重要机制。相关研究[16]也显示,ATF4可作为新型调节因子调控单核细胞向肠道驻留巨噬细胞分化。在人单核巨噬细胞中,ATF4被toll样受体4(toll-like receptor 4,TLR4)招募,促进炎症因子分泌[17];或者ATF4调控细胞代谢重编程,以促进巨噬细胞向M2亚型极化[18]。鉴于甲基化修饰在脓毒症病理生理机制调控中的重要作用,本研究拟采用脂多糖(lipopolysaccharide,LPS)处理小鼠单核巨噬细胞白血病细胞系(即RAW264.7细胞系),并基于染色质免疫共沉淀测序(ChIP-seq)和RNA高通量测序(RNA-seq)技术,应用生物信息学技术探究ATF4作为甲基化修饰调节因子参与巨噬细胞免疫反应的可能分子机制。
1 材料与方法
1.1 实验细胞及其分组 采用1μg/m L LPS(批号为E.coli 0111:B4,美国默克Sigma-Aldrich公司)处理小鼠RAW 264.7细胞系(购于中国科学院上海生命科学研究院细胞库)8 h,纳入LPS组;采用PBS(广州兰杰柯科技有限公司Biosharp)在同等条件下处理RAW 264.7细胞系8 h,纳入对照组。每组各3例样本,收集各组细胞系用于后续实验。
1.2 实时荧光定量聚合酶链式反应(qRT-PCR)将设计好的引物粉末[生工生物工程(上海)股份有限公司]以12 000 r/min(离心半径为16.5 cm)常温离心2 min后,加入双蒸水溶解;在96孔板(美国Corning公司)中以1μL前引物+1μL后引物+5μL SYBR Green+3μL稀释过的样本工作液的体系加样;于Light Cycler仪器(瑞士罗氏公司)进行q RT-PCR。目的基因和内参基因的扩增效率均为100%,采用2-△△CT法分别计算LPS组和对照组目的基因ATF4 mRNA相对于内参基因GAPDH的表达量。
1.3 免疫印迹(Western Blotting)实验 LPS组和对照组细胞系均经RIPA裂解液提取总蛋白质。配置好电泳凝胶后,将煮沸、离心后的蛋白质样品吹打均匀后上样。加样完成后,设置电泳仪为恒压150 V,电泳50 min,待目的蛋白质分离至所需位置,终止电泳。电泳完成后,准备适当大小聚偏二氟乙烯(PVDF)膜,在低温条件下,将凝胶与PVDF膜固定,设置电泳仪为恒流200 m A,转膜90 min。转膜完成后,先将PVDF膜置于5%脱脂牛奶内封闭60 min。封闭完成后,将目的蛋白质对应的PVDF膜置于以ATF4抗体(批号为60035-1-Ig,美国Proteinted公司;使用5%脱脂牛奶稀释,稀释比例为1∶1 000)配制的溶液中,4℃条件下孵育过夜,以GAPDH作为内参。一抗孵育完成后,使用配置好的山羊抗兔辣根过氧化酶标记二抗(上海莱兹生物科技有限公司),室温孵育1 h后曝光。应用ImageJ软件分析蛋白质条带的灰度值,以定量蛋白质的相对表达量。
1.4 ATF4 ChIP-seq分析 以1×107/m L的密度接种细胞系于10 cm培养皿中,经LPS处理8 h后,使用1%甲醛交联,使DNA与蛋白质的相互作用被交联固定;交联完成后,裂解细胞系,得到全细胞的裂解液,去除蛋白质,分离纯化核酸,去除杂质等,提取核DNA;随后行超声处理,将基因组DNA打断,取部分破碎产物解交联。应用凝胶电泳检测总DNA完整性和片段化情况,后分别结合ATF4抗体或免疫球蛋白(Ig)G(对照抗体),孵育过夜。应用免疫沉淀试剂盒(上海Aksmics公司)沉淀与目的蛋白质结合的染色质片段,应用TruSeq Nano DNA样本制备试剂盒(美国Illumina公司)制备测序文库DNA样本,并在Illumina HiSeq 4000平台(美国Illumina公司)进行测序。基于模型的ChIP-seq分析中具有统计学意义的芯片富集区域(即峰,P≤0.01)进行进一步分析,以差异倍数(Fold Change,FC)值≥2.0、P≤0.001作为差异富集区的分类标准,利用ChIP-seq数据生成UCSC WIG文件格式的信号剖面(分辨率为10 bp),并在UCSC基因组浏览器上完成可视化。
1.5 RNA-seq转录组测序分析 应用TRIzol试剂(批号为15596018,美国英杰生命技术有限公司)提取RAW264.7细胞系总RNA,应用RNAseq文库准备试剂盒(美国Illumina公司)将总RNA转化为测序文库,应用Agilent 2100 Bioanalyzer(美国Agilent Technologies公司)评估RNA文库质量后,在Illumina HiSeq 4000平台进行测序。以log2|FC|≥0.585、P≤1作为差异表达基因(DEGs)的分类标准。
1.6 甲基化相关DEGs的富集分析 整合ATF4 ChIP-seq分析和RNA-seq转录组测序分析结果,采用京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG;网址为https:∥www.genome.jp/kegg/)、基因本体(Gene Ontology,GO)分析,寻找与甲基化修饰相关通路,设定P<0.05,获得最终富集通路。从富集通路中获取ATF4调控的甲基化修饰核心基因。
1.7 胞嘧啶-磷酸-鸟嘌呤(Cp G)岛分布情况分析应用MethPrimer平台(http:∥www.urogene.org/methprimer)[19]在线预测ATF4参与巨噬细胞炎症反应甲基化修饰的关键靶基因的Cp G岛的分布情况。
1.8 通路富集分析和蛋白质相互作用分析 基于甲基化修饰相关DEGs,应用STRING在线工具(https:∥cn.string-db.org/)识别蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,应用Cytoscape软件(3.9.1版本)的MCODE插件分析出最重要的功能模块,以及各基因间的相互作用关系。应用DAVID 6.8在线生物信息数据库(https:∥david.ncifcrf.gov/)进行DEGs的功能和通路富集分析。应用Sangerbox 3.0在线分析网站[20](http:∥sangerbox.com/home.html)制作上述分析结果的可视化图像。
1.9 统计学处理 应用Graphpad Prism 8.0.1统计学软件。呈正态分布的计量资料以±s表示,两组间比较采用非配对t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 LPS刺激RAW 264.7细胞系后ATF4蛋白质和mRNA表达情况 LPS组ATF4蛋白质和mRNA的相对表达量分别为0.446±0.049和0.089±0.009,分别显著高于对照组的0.079±0.049和0.047±0.009(t=7.507、4.771,P值均<0.001)。见图1。

图1 RAW264.7细胞系ATF4蛋白质的表达情况
2.2 ATF4介导参与巨噬细胞炎症反应的甲基化修饰相关基因 对LPS组开展ATF4的ChIPseq和RNA-seq分析实验,并经KEGG和GO通路富集分析发现,ATF4参与巨噬细胞炎症反应的甲基化修饰相关基因为40个,其功能分别聚焦于组蛋白甲基化、组蛋白去甲基化、蛋白质甲基化、mRNA甲基化通路。见表1、图2。

图2 经GO通路富集分析发现的40个核心基因的功能富集分析
2.3 筛选受c AMP反应元件(c AMP response element,CRE)调控且存在甲基化修饰功能的关键基因 基于KEGG与GO富集通路分析结果,对40个相关基因中的单个基因甲基化修饰的功能进行文献检索,锁定潜在的19个靶基因:Bcor,Brca1,Btg1,Carm1,Ehmt1,Ezh2,Jmjd1c,Kdm3a,Kdm4b,Kdm4c,Mettl8,Mettl14,Mettl16,Nsd3,Nsun2,Prmt2,Prmt6,Tet2,Tet3。CRE为ATF4公认的DNA结合位点,以此参与基因表达调控。进一步结合文献检索结果,根据上述基因是否存在CRE位点调控,筛选并获得ATF4调控甲基化修饰相关的7个潜在靶基因:Brca1,Btg1,Carm1,Ezh2,Kdm3a,Kdm4b,Prmt6。
2.4 Cp G岛分布情况 通常将基因的启动子区域5’端非翻译区(5’UTR)和第1个外显子区的鸟嘌呤(G)和胞嘧啶(C)配对占比≥50%的区域称为Cp G岛,其长度为200 bp~1 kb。DNA的Cp G岛被甲基化后,蛋白质不能结合DNA,进而使转录沉默。为了揭示ATF4潜在靶基因是否受甲基化修饰影响,本研究应用MethPrimer平台在线预测7个基因翻译起始位点的Cp G岛,结果发现:Prmt6有1个CpG岛,为48~1 135 bp;Kdm3a有2个CpG岛,分别为48~611 bp、1 073~1 224 bp;Brca1有2个CpG岛,分别为49~239 bp、405~533 bp;Ezh2有1个CpG岛,为48~1 161 bp;Carm1有1个Cp G岛,为46~647 bp;Btg1有3个CpG岛,分别为48~407 bp、467~1 020 bp、1 096~1 232 bp;Kdm4b有2个Cp G岛,分别为49~718 bp、748~898 bp。见图3。
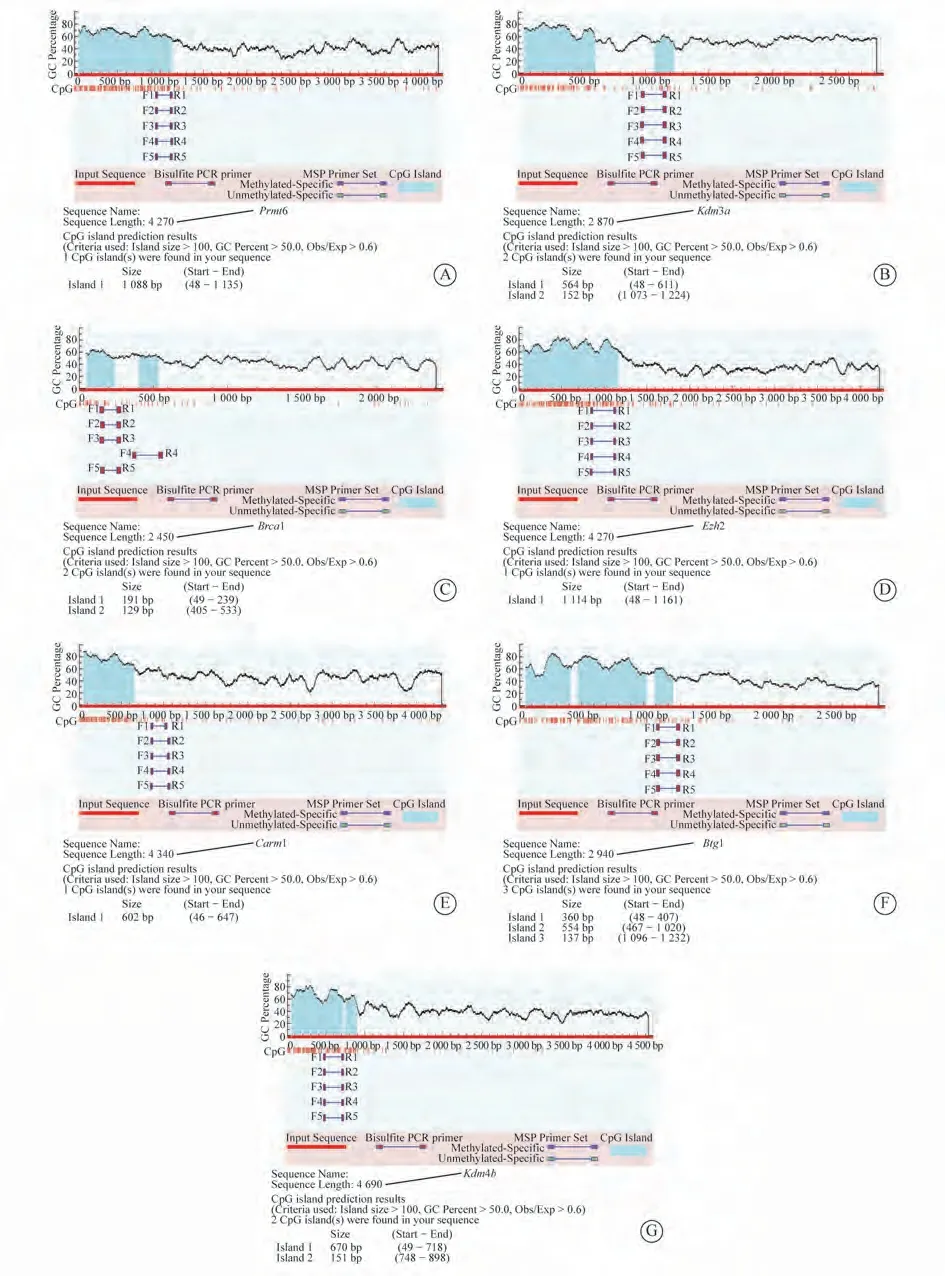
图3 7个潜在靶基因启动子区域的CpG岛分布情况
2.5 ATF4调节甲基化修饰的PPI网络分析与GO分析 PPI网络分析结果显示,Brca1、Btg1、Carm1、Ezh2、Kdm3a、Kdm4b,Prmt6之间分别存在交互作用。进一步通过Sangerbox3.0在线分析网站的GO分析发现,Brca1、Btg1、Carm1、Ezh2、Kdm3a、Kdm4b、Prmt6的功能主要聚焦于组蛋白甲基化、组蛋白修饰、染色质的共价修饰等。见图4。
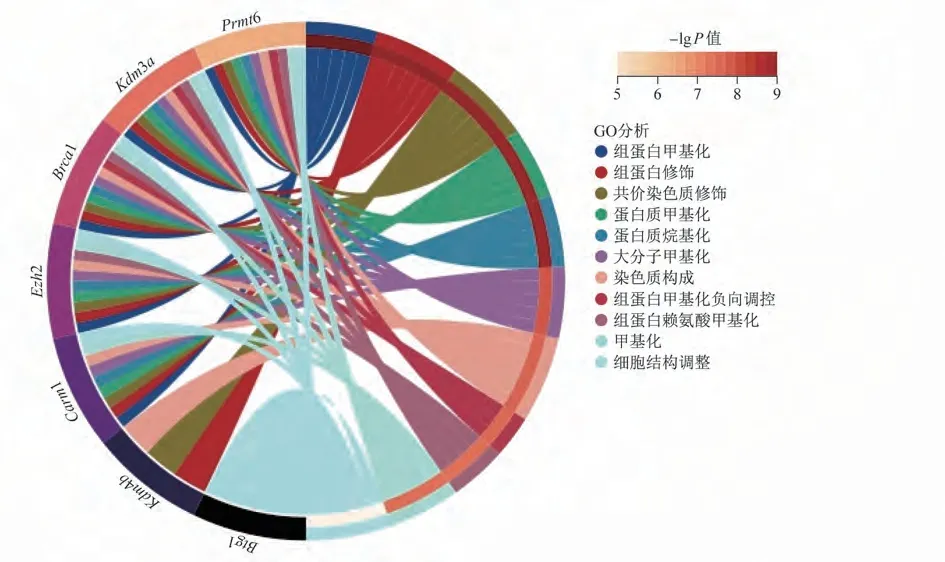
图4 7个潜在靶基因的GO分析
3 讨 论
在脓毒症的病理生理学过程中,机体的巨噬细胞可通过适度的免疫炎症反应上调一定水平的炎症因子清除感染病原体。本研究采用LPS处理RAW264.7细胞系,基于ATF4 ChIP-seq和RNA-seq转录组数据分析,发现ATF4参与的巨噬细胞免疫炎症反应与甲基化修饰的相关通路紧密相关,亦发现Brca1、Btg1、Carm1、Ezh2、Kdm3a、Kdm4b、Prmt6是潜在的靶基因,并通过PPI网络分析进一步发现,ATF4通过参与调控巨噬细胞的基因甲基化修饰,进而参与免疫炎症反应的调控。
近年来,甲基化修饰作为表观遗传学的修饰方式之一而受到广泛关注,其涵盖蛋白质甲基化、蛋白质去甲基化和mRNA甲基化等多个通路。蛋白质甲基化通常发生在赖氨酸或精氨酸残基,组氨酸、谷氨酰胺、天冬酰胺、半胱氨酸、谷氨酸和天冬氨酸都可发生甲基化反应。甲基化修饰影响蛋白相分离,以及调控蛋白质与蛋白质、蛋白质与DNA、蛋白质与RNA的相互作用,影响蛋白质稳定性等[21-24]。目前,甲基化修饰在脓毒症的发生、发展中的作用日益受到重视。本项研究结果显示,在LPS处理RAW264.7细胞系的炎症反应激活过程中,ATF4参与甲基化修饰的核心基因为40个,其功能主要聚焦于组蛋白甲基化、组蛋白去甲基化、蛋白质甲基化、mRNA甲基化通路;提示ATF4是巨噬细胞炎症反应中调控甲基化修饰的关键因子。
本研究发现,40个基因中有7个基因具有CRE调节位点和Cp G岛特征,分别为Brca1、Btg1、Carm1、Ezh2、Kdm3a、Kdm4b和Prmt6。Btg1属于BTG抗增殖蛋白家族,在针对B细胞性慢性淋巴细胞白血病的研究中首次被发现。近期有研究[25]证实,ATF4直接靶向调控Btg1基因;也有研究[26]发现,Btg1在肝细胞中通过介导ATF4来调控肝脏脂质累积。Ezh2编码一种组蛋白赖氨酸N-甲基转移酶,是目前肿瘤学研究较多的免疫靶点。Ezh2参与巨噬细胞炎症反应和极化[27-30]、脓毒症相关的急性呼吸窘迫综合征(ARDS)性肺损伤[29-30]等病理过程。另有研究[31]发现,在细胞中加入Ezh2抑制剂沉默Ezh2基因,导致ATF4启动子区的组蛋白H3第9位赖氨酸上三甲基化修饰(H3K9me3)和组蛋白H3第27位赖氨酸上三甲基化修饰(H3K27me3)水平显著降低,组蛋白乙酰化修饰的增加可促进ATF4表达水平的上调,加剧内质网应激,促进氧化应激等病理生理过程的发生。在巨噬细胞免疫炎症反应过程中,ATF4是否直接靶向调控Ezh2,是否与脓毒症相关的氧化应激和器官损伤有关,目前鲜见相关研究报道。
Brca1、Carm1、Kdm3a、Kdm4b和Prmt6与ATF4相关的研究报道较少。Brca1编码DNA损伤修复关键调控蛋白,参与肿瘤免疫细胞浸润,与患者预后密切相关,是新型的肝癌预后生物标志物[32]。Carm1与组蛋白乙酰化修饰、NF-κB基因表达相关[33-34],笔者推测,该基因可能与巨噬细胞炎症反应路径相关。此外,Kdm3a、Kdm4b作为编码组蛋白去甲基化酶的基因,与肿瘤发生、线粒体合成密切相关[35-36],其可能在巨噬细胞炎症反应中参与免疫代谢的调控。精氨酸甲基转移酶的编码基因Prmt6在肿瘤代谢中,可感受低氧环境,激活丙酮酸激酶M2-细胞外调节蛋白激酶介导的Warburg效应[37]。Warburg效应及糖酵解是巨噬细胞启动免疫炎症反应的必要条件,故Prmt6可能是ATF4经甲基化修饰调控巨噬细胞免疫炎症反应的重要介导分子。
脓毒症的免疫炎症反应的机制解析为临床开发新型脓毒症治疗方案提供了可能。本研究着力于ATF4介导的巨噬细胞免疫炎症反应的甲基化修饰水平,探究参与调节巨噬细胞免疫炎症反应相关甲基化修饰的可能分子机制,并分别聚焦于组蛋白甲基化、组蛋白去甲基化、m RNA甲基化等通路,结合分子生物学实验技术和生物信息学分析手段,锁定了7个(Btg1、Ezh2、Brca1、Carm1、Kdm3a、Kdm4b和prmt6)与ATF4调控甲基化修饰相关的潜在靶基因,这为进一步探究ATF4通过甲基化修饰调节巨噬细胞免疫炎症反应提供了机制层面的研究线索。但本研究尚存在一定局限性,RAW264.7为小鼠来源的巨噬细胞系,LPS刺激该细胞系的脓毒症模型不能有效模拟菌血症、阳性细菌感染引发的巨噬细胞的免疫炎症反应。此外,细胞系与原代培养的细胞,以及鼠源细胞和人源细胞在表型和功能上存在一定差异,故本研究结果仍需进一步的验证。其次,本研究未进一步开展细胞及动物模型实验层面的靶基因功能分析,故ATF4与潜在靶基因的上下游关系仍需进一步明确。但本研究结果仍在一定程度上证实了ATF4可能是巨噬细胞炎症反应过程中参与甲基化修饰的新型调节因子,为后续的进一步研究奠定基础。
