微量营养素在炎症性肠病中的作用
2023-09-14宋文轩于梓涵任祥凤陈济华
宋文轩,于梓涵,任祥凤,陈济华,陈 鑫
宋文轩,于梓涵,任祥凤,陈济华,陈鑫,天津医科大学总医院消化内科 天津市 300052
© The Author(s) 2023.Published by Baishideng Publishing Group Inc.All rights reserved.
0 引言
炎症性肠病(inflammatory bowel disease,IBD)是一种病因尚未明确的慢性、进行性、反复复发性的自身免疫性肠道疾病,包括克罗恩病(Crohn’s disease,CD)、溃疡性结肠炎(ulcerative colitis,UC)和病理学不能确定的未定型结肠炎[1].IBD的典型症状是腹痛、腹泻、黏液脓血便和体重下降[2].营养不良是IBD的常见并发症,其全球患病率为20%-85%[3].约65%-75%的CD患者和18%-62%的UC患者存在营养不良[4].小肠是人体消化和吸收营养的主要部位.由于CD病变好发于小肠,UC病变多见于结直肠,因此CD患者伴有营养不良的情况较UC多见[3,5].但也有作者报道这两种疾病的营养不良患病率几乎没有差别[6].IBD患者的营养不良与住院时间延长、围手术期并发症增加和感染率、死亡率升高有关[7].另一方面,伴有营养不良的IBD患者较营养良好的患者住院花费多34%,对医疗保健系统造成了沉重的负担[8].
营养不良表现为能量失衡或营养摄入不足,包括蛋白质-能量营养不良、疾病相关营养不良、肌肉减少症和微量营养素缺乏[9].CD患者微量营养素缺乏患病率为82.5%,UC患者为11.3%[10].许多病程较短的IBD患者往往面临较高的微量营养素缺乏风险[11].
微量营养素,包括维生素和矿物质[12].维生素是有机化合物,分为水溶性和脂溶性.水溶性维生素包括硫胺素(B1)、核黄素(B2)、烟酸(B3)、吡哆醇(B6)、钴胺素(B12)、生物素、泛酸、叶酸和维生素C(抗坏血酸).脂溶性维生素包括维生素A、D、E和K[13].膳食矿物质分为宏量元素和微量元素.宏量元素是重要的组织成分,可作为辅助因子和催化剂维持细胞结构和参与酶促反应过程,如钙、钾和镁等.微量元素是体内酶反应所必需的,包括锌,铜和硒等[13,14].正常情况下,食物中95%的维生素和矿物质在小肠近端被吸收.唯一的例外是维生素B12,它与内因子结合后在回肠末端被吸收.此外,远端回肠吸收的胆汁酸对脂溶性维生素的吸收至关重要[13].IBD患者常伴有微量营养素缺乏.微量营养素缺乏会导致IBD患者出现不良反应,如增加疾病的内镜和组织学活动风险、加重肠道炎症、增加疲劳负担和降低健康相关的生活质量等[15-19].综上,探讨微量营养素在IBD中的作用进而找到行之有效的方法预防微量营养素缺乏是非常重要的.
本文的目的是探索微量营养素在IBD中的可能作用,阐明微量营养素缺乏对IBD的影响,从而指导IBD的临床实践(表1).
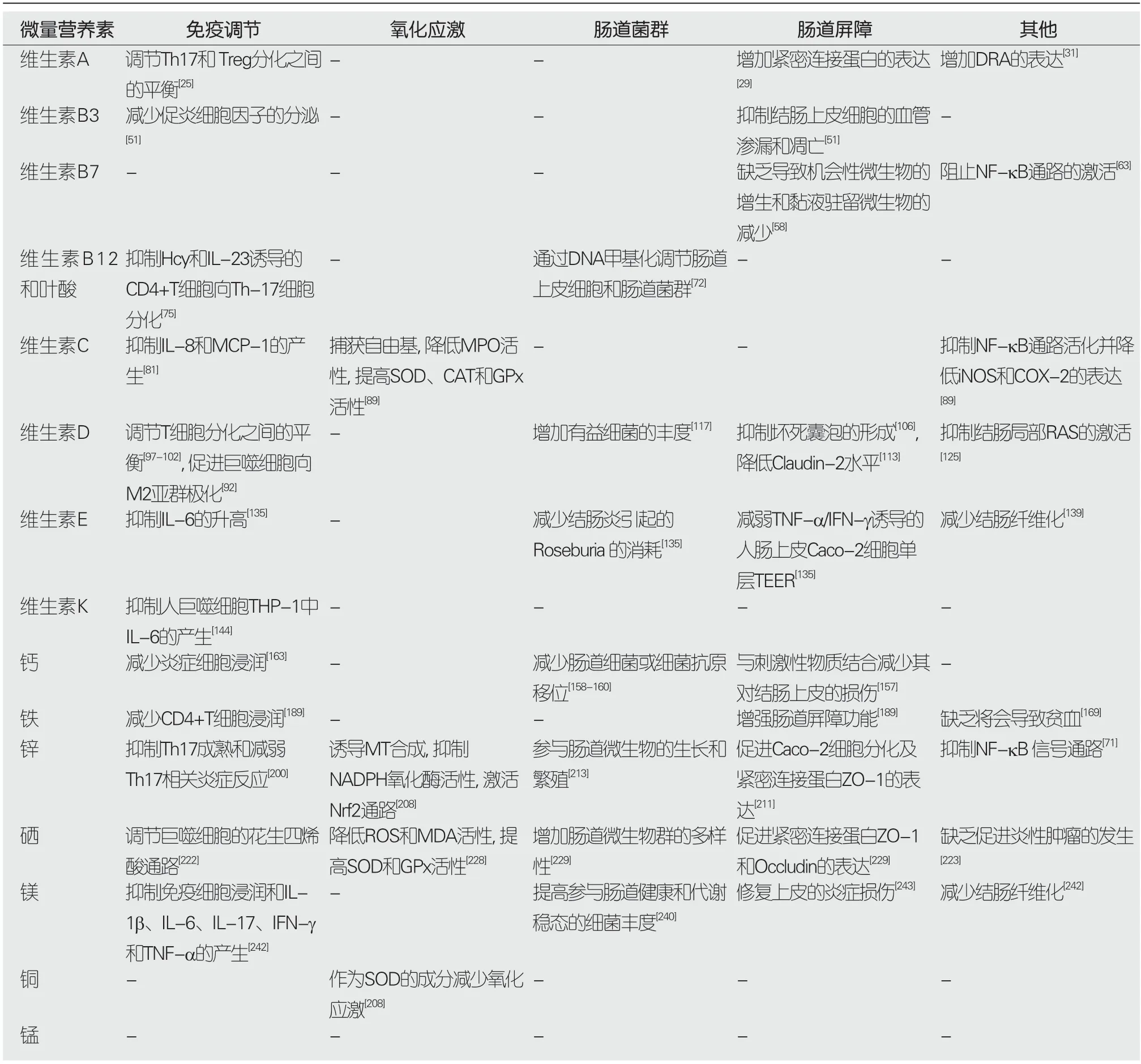
表1 生理水平下微量营养素对IBD的影响
1 维生素
1.1 维生素A 维生素A(vitamin A,VA)及其活性成分视黄酸(retinoic acid,RA)、全反式维甲酸(all-trans retinoic acid,at-RA)在广泛的生理过程中发挥了重要作用,如视力、免疫调节、细胞增生和分化、细胞间通讯和再生等[20,21].人体必须从膳食或补充剂中获取VA.动物食品可以提供VA的制备原料,而水果蔬菜则是类胡萝卜素的重要来源[21].VA的吸收主要发生在近端小肠,可通过肠道上皮细胞直接转化为RA[22].VA摄入不充分导致维生素A缺乏(vitamin A deficiency,VAD)[21].VAD会导致夜盲症和免疫力下降[21].IBD患者面临VAD的风险.一项涉及323例CD患者和114例UC患者的Meta分析显示,CD和UC患者的血清VA水平低于健康对照组[23].除此之外,VA水平似乎与炎症的严重程度相关.VA水平较低的CD患者伴有更高的C反应蛋白(C-reactive protein,CRP)水平[23].
1.1.1 调节免疫应答:全反式维甲酸可以调节B细胞、T细胞和树突状细胞(dendritic cells,DtC),通过其核受体视黄酸受体(retinoic acid receptor,RAR)抑制白介素6(interleukin-6,IL-6)驱动的促炎辅助性T 细胞17(T helper cell 17,Th17)分化,促进抗炎调节性T细胞(regulatory cells,Treg)分化[24].在肠道中,DtC产生RA.RA促进叉头盒蛋白3(forkhead box protein 3,FOXP3)表达.FOXP3是Treg的关键转录因子,通过抑制干扰素-γ(interferon-γ,IFN-γ)、白介素4(interleukin-4,IL-4)、白介素17(interleukin-17,IL-17)的产生从而调节Th17和Treg分化之间的平衡[25].在动物模型中,RA在体外抑制了UC的结肠炎症反应,直接调节FOXP3、IL-17和/或RAR γt基因的表达进而改善2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid,TNBS)诱导的小鼠急性结肠炎,而RAR拮抗剂LE135加重了实验性结肠炎的异常辅助性T细胞应答[26](图1).
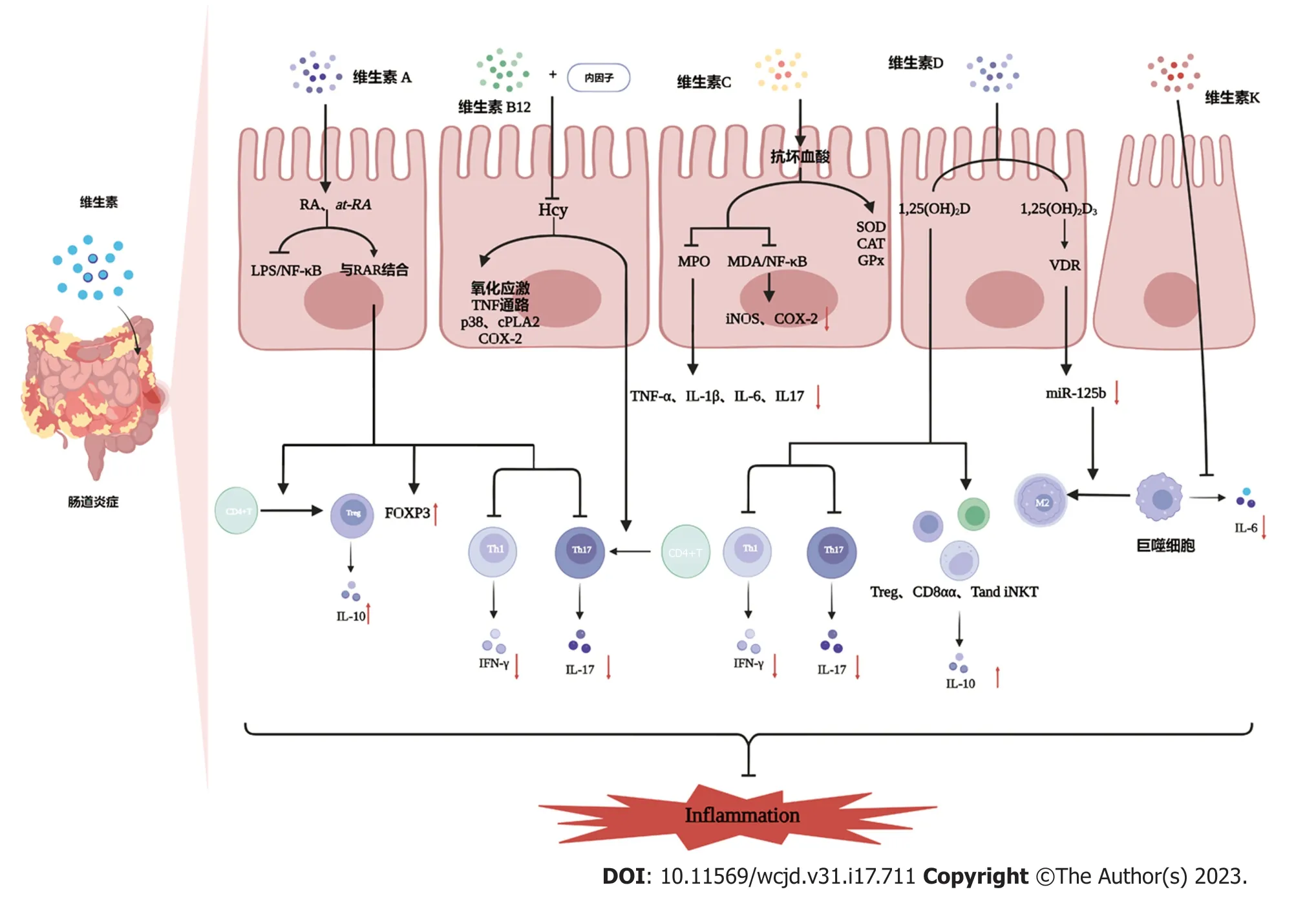
图1 维生素在IBD中的免疫调节作用.维生素A可以抑制IL-6驱动的促炎Th17的分化,并通过RAR促进抗炎Treg的分化,抑制IFN-γ和IL-17的产生,促进FOXP3的表达.at-RA 可以抑制LPS诱导的NF-κB信号通路激活.维生素B抑制同型半胱氨酸诱导的CD4+T细胞中Th17的分化,抑制氧化应激和相关的促炎机制[包括TNF通路、p38、cPLA2和COX-2]以抑制肠道炎症.维生素C可以显著降低结肠中MPO活性和TNF-α、IL-1β、IL-6和IL-17的产生,增加SOD活性.维生素C还可以通过抑制MDA和NF-κB途径以及减少促炎蛋白iNOS和COX-2的表达来改善结肠炎的炎症.维生素D直接抑制产生IL-17和IFN-γ的T细胞以及诱导IL-10产生的调节细胞[Tregs、CD8αα和Tand-iNKT细胞]的生成.维生素D还能通过下调miR-125b的表达促进巨噬细胞向M2亚群的极化.维生素K可以抑制人体巨噬细胞中IL-6的产生.at-RA:全反式维甲酸;CAT:过氧化氢酶;COX-2:环氧合酶-2;cPLA2:细胞质磷脂酶A2;FOXP3:叉头盒蛋白3;GPx:谷胱甘肽过氧化物酶;IFN-γ:干扰素-γ;IL:白介素;iNOS:诱导型一氧化氮合酶;Inflammation:炎症;LPS:脂多糖;MDA:丙二醛;MPO:髓过氧化物酶;NF-κB:核因子kappa-B;RA:视黄酸;RAR:视黄酸受体;SOD:超氧化物歧化酶;TGF-β:转化生长因子-β;TNF:肿瘤坏死因子;TNF-α:肿瘤坏死因子;VDR:维生素D受体.
1.1.2 保护肠道屏障:维生素A可以改善肠上皮细胞的迁移和增殖,并防止艰难梭菌毒素A刺激引起的跨上皮耐药性的降低[27].跨上皮耐药性与肠上皮完整性成正比[27].此外,VA可以通过RARβ信号通路上调肠上皮Toll样受体4的表达水平和促进闭塞小带-2(zonula occludens-2,ZO-2)表达,从而改善结肠屏障功能[28].He等[29]的研究表明,VA能够通过增强闭塞小带-1(zonula occludens-1,ZO-1)、闭塞蛋白和跨膜蛋白1的表达,改善肠道屏障功能,逆转肠道菌群诱导的肠道屏障损伤.相反,Amit-Romach等[30]发现VAD通过改变肠道菌群和先天免疫相关基因表达来破坏胃肠道黏膜屏障的完整性.
1.1.3 降低腹泻的发病率:全反式维甲酸能刺激肠上皮细胞中腺瘤下调因子(downregulated in adenoma,DRA)的表达[31].腹泻是IBD的一种重要症状,与DRA功能和/或表达紊乱有关.DRA基因突变可能导致先天性氯中毒性腹泻[32].DRA敲除小鼠表现出腹泻表型[33],补充VA可降低与腹泻相关的婴儿死亡率、腹泻患病率和发作严重程度[34].在此基础上,Priyamvada等[31]提出at-RA可以通过RAR-β刺激DRA启动子活性,诱导转录并增加DRA信息和蛋白质表达.在肠道炎症模型中,at-RA通过阻断IFN-γ诱导的信号通路上调右旋糖酐硫酸钠(dextran sodium sulphate,DSS)诱导的小鼠结肠炎中DRA的表达对腹泻表型产生抑制[35].
总之,VAD可能导致IBD患者肠道免疫失衡、肠道屏障功能受损和肠道菌群失调.这可能在早期加速IBD的发生,也可能在活动期促进疾病复发或恶化.鉴于此,患有VAD的IBD患者需要补充VA.然而,补充VA对CD患者没有益处[36,37].Crockett等[38]和Shale等[39]提出类视黄醇治疗会增加人类患IBD的风险.Oehlers等[40]发现RA会加重实验性小肠结肠炎.最近的一项大规模全球研究指出,缺乏VA不会增加UC的风险,但可能与UC风险的轻微和短暂增加有关[41].因此,需要进一步的研究来确定补充VA是否能使IBD患者受益.
1.2 维生素B 维生素B(vitamin B,VB)是B族维生素的总称,是人类和植物健康必需的一组水溶性微量营养素.每种维生素B(B1、硫胺素,B2、核黄素,B3、烟酸,B5、泛酸,B6、吡哆醇,B7、生物素,B9、叶酸和B12、钴胺素)都是一个调节人体各种代谢过程的化合物家族[42,43].VB的多样性体现了其对细胞功能和稳态的重要性[43].近年来,人们也越来越关注VB在IBD中的作用.然而,目前没有研究关注维生素B1、维生素B2和维生素B5在IBD中的作用.因此,我们在以下部分仅讨论维生素B3、维生素B6、维生素B7、维生素B12和叶酸.
1.2.1 维生素B3:维生素B3(也称为烟酸)及其水溶性形式烟酰胺,是所有活细胞必不可少的一种微量营养素[44].它在动植物性食物中含量丰富,主要在人体的胃或肠中被吸收[45],参与人体细胞能量代谢.维生素B3在临床上被广泛用于治疗高脂血症和皮肤病[46,47],其缺乏会导致疲劳、皮炎和厌食症[48].关于维生素B3在IBD中的作用的研究并不多.Kyme等[49]首次发现高剂量烟酰胺可以增强中性粒细胞的抗菌活性,并通过增强中性粒细胞特异性抗菌清除率来改善结肠炎的病程[50].Li等[51]研究发现烟酸通过激活D前列腺素受体1对DSS/TNBS诱导的小鼠结肠炎具有多种保护作用,包括抑制血管渗漏和结肠上皮细胞凋亡、减少促炎细胞因子的分泌.同时,含烟酸的保留灌肠治疗可有效促进中度活动期UC患者的临床缓解和黏膜愈合.上述研究结果表明,补充维生素B3可能有助于缓解结肠炎,但还需要更多的研究来探索其在人类IBD中的临床潜力.
1.2.2 维生素B6:维生素B6(vitamin B6,VB6)是一种参与氨基酸、碳水化合物、神经递质和脂质代谢等酶促反应的重要辅助因子[52].人体可以从多种食物中获得VB6,包括肉类、乳制品、豆类、坚果、土豆和水果等.VB6在小肠中被人体吸收[53].严重的VB6缺乏症是一种罕见的疾病,通常继发于严重营养不良、酗酒或异烟肼治疗,其最显著的表现是周围神经病变[54].VB6在IBD中的作用尚未得到广泛研究.一项为期一年的前瞻性随访研究发现,30%的IBD患者缺乏VB6[55].IBD患者的血浆维生素B6水平与急性期反应物水平之间存在统计学上的显著负相关[54].有趣的是,Benight等[56]报道,VB6不足可以减轻炎症.他们发现,与喂食充足的VB6(0.007 g/kg)的小鼠相比,缺乏VB6的饮食(0.0 g/kg)可以降低DSS诱导的急性和严重结肠炎小鼠的死亡风险、疾病活动评分以及诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白介素10(interleukin-10,IL-10)的黏膜表达水平,缓解体重减轻.同样,Selhub等[57]发现,在IBD的IL10-/-小鼠模型中,轻度VB6缺乏(0.5 mg/kg)可显著减弱结肠炎的组织学和分子特征.这似乎表明VB6不足的抗炎作用.然而,Selhub等[57]也指出,适度补充VB6(6 mg/kg)可以显著降低该模型的炎症表型.因此,补充VB6对IBD患者和啮齿动物模型疾病严重程度的影响及其具体机制仍有待进一步探索.
1.2.3 维生素B7:维生素B7(生物素)作为羧化酶的辅酶,在各种代谢途径以及细胞应激反应、基因调节和免疫反应[58]中发挥着重要作用.它可以从蛋黄、牛奶、坚果、谷物、补充剂等食物中获得,也可由肠道细菌合成[59].肠道对生物素的吸收是通过载体介导实现的,该过程涉及钠依赖性多种维生素转运蛋白[60].小肠和大肠都有该转运蛋白.膳食生物素主要在小肠被吸收,而共生细菌产生的生物素在大肠被吸收[61].IBD患者的维生素B7缺乏情况尚未被报道.小鼠的维生素B7缺乏,无论是通过肠道特异性生物素转运蛋白缺失建模[62]还是通过生物素缺乏饮食建模,都会导致与IBD表型一致的肠道炎症,而生物素可以通过抑制核因子-κB(nuclear factor kappa-B,NF-κB)途径的活化来改善小鼠结肠炎[63].最近,Yang等[58]报道了生物素缺乏可诱发肠道微生态失调.他们在上述两种生物素缺乏模型中收集了粪便和肠道样本,发现机会性微生物(包括克雷伯菌、肠杆菌和幽门螺杆菌)的增生和黏液常驻微生物(包括阿克曼菌)的减少,这可能会促进肠道炎症的发生.未来,仍需要大量研究来阐明生物素缺乏相关微生物失调在炎症中的作用.
1.2.4 维生素B12和叶酸:维生素B12(vitamin B12,VB12)和叶酸是单碳代谢的关键调节因子,在细胞增殖和存活中发挥重要作用[64].在人体中,VB12需要与内因子结合形成初级复合物,才能在小肠近端被吸收,也有少量VB12通过被动运输在整个小肠被吸收[13].叶酸存在于动物和植物性食物中,并在十二指肠和空肠近端被吸收[65].IBD患者通常伴有VB12和叶酸缺乏[15,66],CD患者的血清VB12和叶酸缺乏比UC患者更常见[65,67].IBD中VB12和叶酸缺乏的主要原因有回肠疾病或切除、瘘管、小肠细菌过度生长、摄入量减少、生理需求增加、蛋白质丢失性肠病和肝功能障碍等[68].此外,在IBD治疗中使用甲氨蝶呤或劳拉西泮会导致叶酸缺乏[69].
维生素B12主要在各种生物化学反应中发挥辅酶作用,如脱氧核糖核酸(deoxyribonucleic acid,DNA)合成和叶酸代谢[70].目前尚没有研究证实VB12与免疫调节之间存在直接联系[71].叶酸参与DNA甲基化并产生表观遗传学变化,影响肠道菌群和系统免疫反应之间的相互作用,进而影响IBD的发展[72].Chen等[73]研究了甲基缺乏饮食对DSS诱导的大鼠结肠炎的影响.结果表明,甲基缺乏饮食诱导的大鼠甲基供体缺乏(叶酸和/或VB12缺乏症)通过促进氧化应激、减少细胞凋亡和激活相关的促炎机制[包括TNF途径、p38、细胞质磷脂酶A2和环氧合酶2(cyclooxygenase-2,COX-2)],提高了组织中同型半胱氨酸的水平,进而加重了实验性结肠炎.
如上所述,VB12和叶酸缺乏可导致高同型半胱氨酸血症[70].在结肠炎动物模型中,高同型半胱氨酸血症会加重肠道炎症[74],而叶酸会抑制CD4+T细胞中同型半胱氨酸和白介素23诱导的Th17分化,以抑制肠道炎症[75].同样,叶酸缺乏导致肠道中Treg减少[76],这可能会增加肠道炎症的风险.此外,叶酸和VB12缺乏可能导致大细胞贫血[77].一些研究已经确定,补充VB12和/或叶酸可能是IBD治疗的潜在靶点[69,75],因此未来需要更多的研究来确定其在IBD中的抗炎和免疫调节机制,以指导临床实践.
1.3 维生素C 维生素C(vitamin C,VC)是一种必须从饮食中获得的必需维生素,主要在空肠和回肠被吸收[78].它是生物系统中的一种强效的抗氧化剂[79],通过捕获自由基来防止活性氧(reactive oxygen species,ROS)引起的细胞膜氧化和损伤[80].VC作为一种抗炎剂,可抑制白介素8和单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1)的产生,有效抑制炎症反应[81].VC水平降低与炎症、器官衰竭和死亡率增加有关[82],而VC水平升高与降钙素原等炎症标志物水平降低有关[83].活动期IBD患者的VC摄入量显著低于健康人群[84],一些非活动期IBD患者尽管总体营养状况正常,没有显著的临床表现,但常伴有VC缺乏[15,85].SLC23A1是肠道中一个主要的抗坏血酸(也就是VC)转运体,其遗传变异与严重减少的抗坏血酸转运和较低的全身浓度有关[86].Amir Shaghaghi等[87]报道在SLC23A1的抗坏血酸转运蛋白位点上发现了一种遗传变异(rs10063949-G),这与加拿大白人IBD队列中CD风险增加有关.由基因决定的饮食VC或抗氧化剂转运的局部失调加速了IBD的发展[88].
Yan等[89]发现抗坏血酸可以显著降低结肠中髓过氧化物酶的活性,抑制TNF-α、IL-1β、IL-6和IL-17的产生,提高超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶和谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)的活性,并显著改善DSS诱导的小鼠结肠炎.简而言之,抗坏血酸通过加强酶防御系统减轻DSS诱导的结肠炎的严重程度.此外,该研究发现抗坏血酸通过抑制NF-κB通路的激活和减少促炎蛋白iNOS、COX-2的表达来改善结肠炎的炎症.Jo等[90]最近在Gulo(-/-)小鼠中研究了VC对IBD发生和进展的影响.Gulo(-/-)小鼠由于L-古洛糖酸-γ-内酯氧化酶(一种VC产生的必需酶)的表达缺陷而表现出VC缺乏表型.结果表明,VC缺乏会导致白介素22和黏蛋白的产生减少,IL-6的产生增加,从而引起更严重的结肠炎.综上所述,VC通过在肠道中发挥的抗氧化和抗炎作用影响肠道炎症.然而,目前还没有人体研究显示补充VC对IBD患者的益处.IBD患者补充VC的安全性和有效性仍有待探索.
1.4 维生素D 维生素D(vitamin D,VD)是一种具有多种代谢和免疫调节特性的脂溶性维生素[91],主要由皮肤中的7-脱氢胆固醇在阳光照射下合成,也可作为膳食补充剂摄入[92].在IBD等免疫性疾病的发病机制中,维生素D被认为是最重要的元素[93].维生素D缺乏(<20 ng/mL)与IBD的患病率和严重程度相关[94].低VD状态与疾病活动性和黏膜炎症增加、生活质量评分低和未来临床复发有关[19].VD缺乏可能既是IBD疾病进展的决定因素(甚至是风险因素),又是IBD本身的结果[95].因此我们有必要进一步探讨VD在IBD中的可能作用.
1.4.1 免疫调节:众所周知,VD通过调节上皮细胞、固有免疫细胞和获得性免疫细胞来控制胃肠道的稳态[96].VD调节IBD的机制包括直接抑制产生IL-17和IFN-γ的T细胞分化,以及诱导产生IL-10的调节细胞(Tregs、CD8αα和Tand-iNKT细胞)分化[97-101].1,25-二羟基维生素D3(1,25(OH)2D3)是VD的活性形式,通过与VD受体(vitamin D receptor,VDR)结合发挥作用.Zhu等[92]发现在DSS诱导的结肠炎发展过程中,巨噬细胞亚型失衡[102]破坏了产生大量促炎因子的M1巨噬细胞和抑制炎症[103]的M2巨噬细胞之间的平衡.但1,25(OH)2D3预处理通过下调miR-125b表达促进巨噬细胞向M2亚群的极化来改善结肠炎[92].
1.4.2 保护肠道屏障:维生素D状态和VDR表达是肠上皮屏障的重要调节因子[104].小鼠VDR敲低破坏了黏膜屏障,增加了黏膜对损伤的易感性[105].Shi等[106]使用肠道特异性VDR转基因小鼠模型证明抗坏死是VD信号通路改善结肠炎的一种新机制,即VDR过表达上调了半胱氨酸蛋白酶8的表达,导致受体相互作用蛋白激酶1和受体相互作用蛋白激酶3的表达减少,抑制了坏死小体的形成.紧密连接蛋白可以维持肠道屏障,如跨膜蛋白、闭塞蛋白、连接黏附分子和胞质蛋白(如ZO-1).它们的失调是IBD患者肠上皮通透性增加的重要病理机制.在体外实验中,VD治疗上调了肠上皮细胞中ZO-1和闭塞蛋白的表达[107,108].跨膜蛋白2在肠上皮中形成水通道,使水能通过上皮细胞间的孔隙[109].跨膜蛋白2的增加会使肠上皮细胞更易渗漏、通透性增强,引发炎症[110].活动性IBD患者通常伴有跨膜蛋白2的高表达[111].Zhang等[112]证明在感染和肠道炎症中缺乏肠道VDR可能导致跨膜蛋白2功能亢进,出现更严重的肠道渗漏和肠道炎症.并且这种在实验性结肠炎模型中观察到的结果与跨膜蛋白2大幅增加的人类肠道炎症中VDR的失调是一致的.维生素D治疗能够通过抑制白介素13介导的信号传导及转录激活蛋白6的磷酸化来降低跨膜蛋白2水平[113].此外,在活动性IBD中表达下调的跨膜蛋白4[113]和跨膜蛋白15[114]等蛋白质可以通过VD/VDR信号通路实现表达上调,从而预防结肠炎的发生(图2).
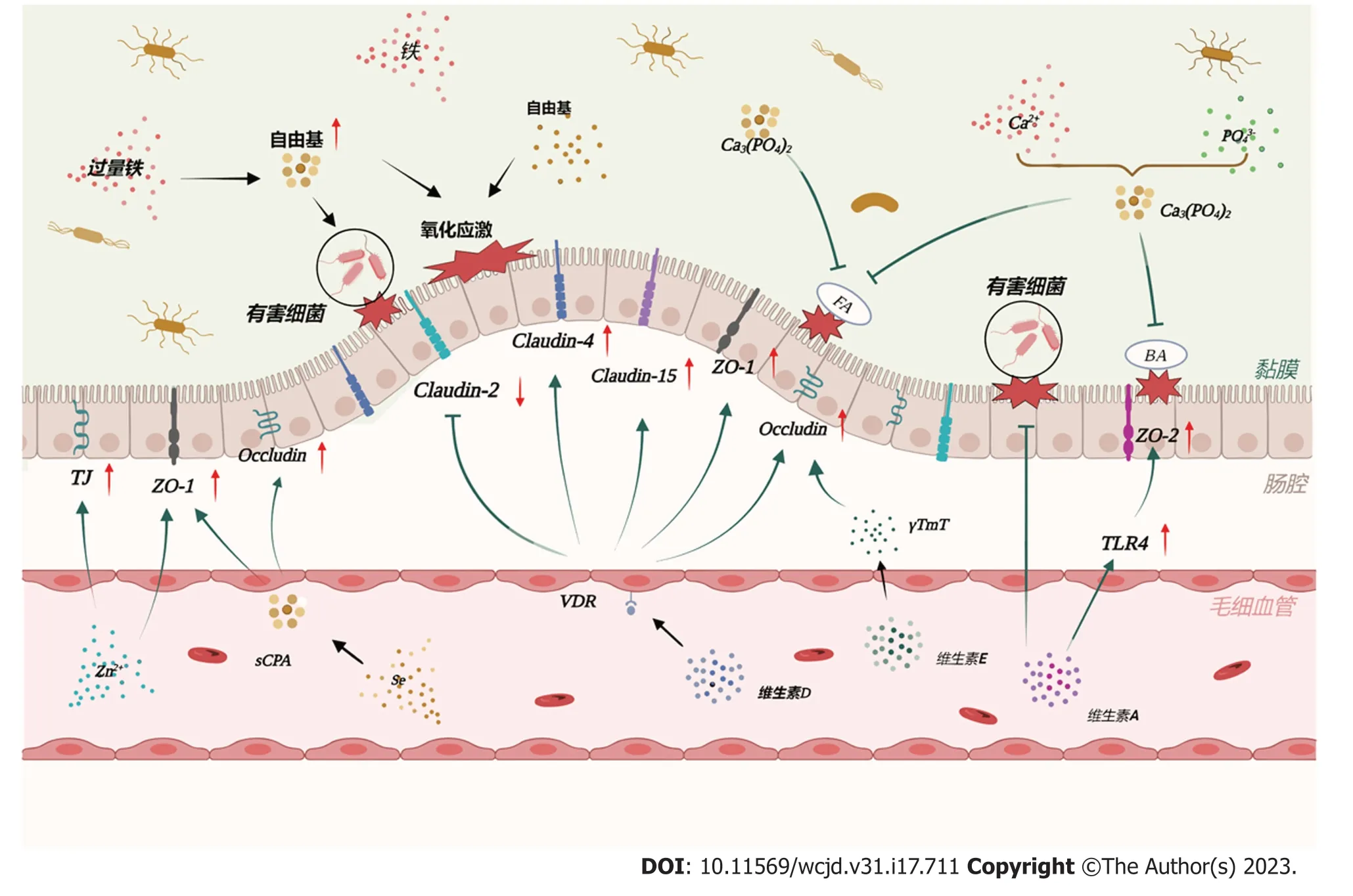
图2 微量营养素在IBD中调节肠道屏障功能.维生素A上调肠上皮TLR4的表达水平并促进ZO-2的表达以改善结肠屏障功能并逆转肠道菌群诱导的肠道屏障损伤.维生素D与VDR联合上调肠上皮细胞中ZO-1、Occludin、Claudin-4和Claudin-15的表达,并降低Claudin-2的水平.维生素E可以减轻DSS引起的Occludin的减少.肠腔内的钙和磷酸盐形成不溶性磷酸钙,与肠腔内的胆汁酸和脂肪酸结合,减少对结肠上皮细胞的损伤.锌能增强ZO-1的表达.硒化的α-D-1,6-提取物可促进紧密连接蛋白ZO-1和Occludin的表达.肠腔中过量的铁会刺激自由基的产生,加剧有害细菌和氧化应激对肠上皮的损伤.BA:胆汁酸;Ca2+:钙离子;Ca3[PO4]2:磷酸钙;Claudin:跨膜蛋白;FA:脂肪酸;Occludin闭塞蛋白;PO43-:磷酸盐离子;sCPA:硒化的α-D-1,6-提取物;TLR4:Toll样受体4;VA:维生素A;VD:维生素D;VDR:维生素D受体;VE:维生素E;Zn2+:锌离子;Se:硒;ZO-1:闭塞小带-1;ZO-2:闭塞小带-2;αT:α-生育酚;γTmT:富含γT的混合生育酚.
1.4.3 改善肠道菌群:有研究指出结肠炎症和细菌移位的显著增加与丁酸盐产生物种的减少有关,VD可以逆转这种影响.用丁酸盐处理肠上皮细胞增加了VDR蛋白的表达[115].敲除潘氏细胞VDR的小鼠肠道菌群中有益细菌(如乳酸菌)的相对丰度和抗菌肽释放减少,使其更容易感染沙门氏菌和发生DSS诱导的结肠炎[116].Schäffler等[117]报道,补充维生素D3(4周后总计300000 IU)会改变CD缓解期患者肠道菌群的组成,即有益细菌的丰度增加.另一项队列研究评估了血清VD水平的季节性与微生物组变化之间的可能关联.结果表明,在夏季和秋季,当VD主要循环形式25-羟基维生素D(25(OH)D)浓度较高时,与炎症相关的细菌属的相对丰度较低,如迟缓埃格特菌(Eggerthella lenta)、梭杆菌属(Fusobacteriumspp.)、幽门螺杆菌属(Helicobacterspp.)和普拉梭菌属(Faecalibacterium prausnitzii)[118].考虑到原核生物中不存在VDR[119],VD对细菌的直接影响似乎不太可能.相反,细菌可能会影响VD的代谢和功能[115].VDR的下调或不能产生活性形式的VD与肠道菌群中乳酸菌的减少和曲霉菌门的增加有关[120].
此外,VD是肾素-血管紧张素系统(renin-angiotensin system,RAS)的抑制剂[121,122].目前已知晓的是RAS可以促进结肠炎的发展[123,124].Wei等[125]在TNBS诱导的实验性结肠炎模型中证明VD缺乏可激活结肠局部RAS并加重结肠炎症.因此我们推测VD可能通过抑制结肠中局部RAS的激活抑制了结肠炎的发展.
鉴于VD的多种功能,IBD患者可能需要预防性或治疗性VD补充.口服VD补充剂是安全且耐受性良好的,患者血清1,25(OH)2D3水平的正常化有利于IBD的预后[126].预防维生素D缺乏所需的VD补充剂量是一个有争议的问题.欧洲食品安全局[127]建议成人每日补充维生素D 4000 IU,内分泌学会[128]建议成人每天摄入维生素D 1500 IU-2000 IU.然而,目前尚不清楚预防和/或治疗IBD的最佳1,25(OH)2D3循环水平是多少.最近的一项综述表明[129],IBD患者可能需要每天1800 IU-10000 IU的剂量.在如此宽泛的剂量范围内,很难确定可能最有效的剂量,这可能是未来VD补充和临床影响研究的重要考虑因素.
1.5 维生素E 维生素E(vitamin E,VE)是一种存在于细胞膜中可以保护质膜的磷脂双分子层免受自由基氧化,同时还具有显著抗炎作用的脂溶性抗氧化剂.其天然形式包括α-生育酚(alpha-tocopherol,αT)、γ-生育酚(gammatocopherol,γT)和δ-生育酚[130],并通过不同的生物化学途径发挥作用.人体不能合成VE,必须从饮食中获得.所有VE亚型都存在于不同的食物中,如植物油、种子、坚果、谷物、水果和蔬菜[131].VE在人体内的吸收率从20%到80%不等,具体取决于食物基质[131].当饮食受限时,容易出现VE缺乏症.VE缺乏在IBD中很常见,尤其是青少年和儿童[132].
由于VE具有强大的抗氧化和抗炎特性,研究人员已经开始关注VE在IBD中的作用.Isozaki等[133]率先报道VE及其衍生物可以有效治疗TNBS诱导的大鼠结肠炎.Jiang等[134]证实,γT可缓解中度结肠炎,并促进肿瘤发生,但其机制尚不清楚.
Liu等[135]进一步研究了αT和富含γT的混合生育酚(mixed tocopherols enriched with γT,γTmT)对IBD的影响.结果表明,αT和γTmT除了可以减少DSS诱导的小鼠大便出血、减轻腹泻、提高IL-6水平外,还减轻了TNF-α/IFN-γ诱导的人肠上皮Caco-2细胞单层跨上皮电阻,减弱了DSS引起的紧密连接蛋白闭塞蛋白的减少,并抑制了循环脂多糖(lipopolysaccharide,LPS)结合蛋白的升高,这是肠道屏障功能障碍的替代标志物.在肠道菌群方面,γTmT减少了结肠炎引起的罗氏菌属的消耗,其中含有丁酸盐.丁酸盐已被证明在IBD患者的粪便中减少[136],并与IBD遗传风险评分呈负相关[137].
此外,VE具有抗纤维化特性,并已被证明可改善肝纤维化[138].肠纤维化也是IBD常见且严重的并发症.Lee等[139]评估了己酮可可碱和VE联合治疗对人原发性肠肌成纤维细胞(human primary intestinal myofibroblasts,HIMF)的抗纤维化特性,以及联合治疗小鼠IBD模型的潜力.结果表明,己酮可可碱和VE的联合治疗在HIMFs和IBD体内模型中都具有显著的抗纤维化作用,并且在体内IBD模型中,这种联合治疗比单独使用己酮可可碱更能减轻结肠纤维化程度.综上所述,VE可能有助于提高IBD患者的肠道抗炎能力、增强肠道屏障、调节肠道菌群、保持肠道的灵活性,但未来还需要进一步的临床研究来评估VE治疗的疗效和安全性.
1.6 维生素K 维生素(vitamin K,VK)也是一种脂溶性维生素,其基本功能是作为VK依赖性羧化酶的辅酶调节凝血因子的产生并维持骨密度[140].人体中的VK有两个来源,一个是饮食摄入,另一个是由肠道共生细菌产生,然后在小肠中被吸收[141].维生素K缺乏和骨密度降低在炎症性肠病患者特别是CD患者中非常常见.血清羧化不足骨钙素(undercarboxylated osteocalcin,ucOC)是骨骼维生素K缺乏的敏感标志[142].研究表明[143],CD患者ucOC水平显著高于UC患者,提示CD患者骨骼维生素K不足.另外,ucOC水平与CD的临床活动指数显著相关.
维生素K参与抑制免疫介导的炎症和调节疾病活动.Ohsaki等[144]证实,VK通过抑制人类巨噬细胞THP-1中IL-6的产生来抑制LPS诱导的大鼠炎症过程.同样,Shiraishi等[145]指出,VK缺乏会加剧DSS诱导的小鼠结肠炎,这与IL-6表达增加有关,补充VK具有保护作用.除了实验研究外,一项基于社区的流行病学研究表明VK水平高与循环炎症标志物(如IL-6)浓度较低有关[146].鉴于VK在调节凝血因子产生、维持骨密度和抗炎方面的作用,IBD患者补充VK可能具有多种治疗效果,如降低出血和骨折的风险、改善肠道炎症.然而,目前没有临床试验证据证实VK的这种有益作用.未来的工作仍需探索VK在人类肠道炎症中的作用,并阐明VK治疗是否有助于改善IBD的症状.
2 矿物质
2.1 钙 钙(Ca2+)在机体和细胞的生理生化功能中起着重要作用.除了与VD一起维持骨骼稳态[147]外,Ca2+还作为信号分子或第二信使调节先天性和适应性免疫反应[148].例如,干扰Ca2+信号可以通过Ca2+释放激活的Ca2+(Ca2+release-activated Ca2+,CRAC)通道控制T细胞过度激活[149].在低Ca2+浓度时,淋巴细胞会处于静息状态[150].Ca2+反应失调与一些自身免疫性和炎症性疾病有关,包括系统性红斑狼疮、类风湿性关节炎、银屑病和IBD等[151].IBD住院患者常伴有缺钙,钙缺乏的患者比钙水平正常的患者住院时间更长.钙含量低表明生活质量差[10].Wang等[152]发现细胞内Ca2+储存异常会促进UC结肠运动障碍的发展并加重肠道炎症.Letizia等[153]报道,CRAC通道抑制剂可以减少人类结肠T细胞和先天淋巴细胞产生的促炎细胞因子,包括白介素2(interleukin-2,IL-2)、IL-4、IL-6、IL-17A、TNF和IFN-γ,减少B细胞产生的IL-6和髓系细胞产生的IFN-γ.它的全身应用有效地减少了小鼠IBD模型中的肠道炎症.但CRAC通道抑制剂对肠上皮细胞的活力、分化和功能没有影响.这表明在IBD中靶向CRAC通道治疗可以在不影响健康肠道上皮细胞的情况下特异性地减少炎症.这为IBD治疗开辟了一种新的策略.
此外,饮食中的钙对IBD的严重程度有独立影响[154].低钙饮食会导致VD缺乏小鼠出现更严重的IBD[155].膳食钙可改善人白细胞抗原B27转基因大鼠结肠炎的严重程度.饮食中的钙有效地防止了炎症性肠病患者肠道通透性的增加,减轻了腹泻[156].钙对IBD的影响可能是由于膳食钙进入小肠后与小肠上端的磷酸盐结合形成不溶性的磷酸钙.磷酸钙再与管腔中的胆汁酸和脂肪酸结合,从而限制这些刺激性物质的溶解度,减少其对结肠上皮细胞的损伤,加强黏膜屏障[157].还有研究表明膳食钙可以减少大鼠和人类肠道细菌或细菌抗原的移位,预防食源性细菌病原体引起的肠道感染[158-160].
钙敏感受体(calcium-sensing receptor,CaSR)是一种在钙稳态中发挥核心作用的G蛋白偶联受体[161].肠道特异性敲低CaSR使小鼠更容易患DSS诱导的结肠炎[162],这似乎表明CaSR在肠道炎症中具有保护作用.然而,Elajnaf等[163]的研究发现了CaSR激动剂在小鼠结肠炎中的促炎作用.其表现为血浆中黏液蛋白的减少和促炎细胞因子的增加.CaSR拮抗剂则能显著降低炎症评分,减少炎症细胞浸润.这些结果突出了CaSR在肠道炎症中前所未有的作用,值得进一步研究探讨.尽管如此,膳食钙对IBD的有益作用在动物模型中已经得到证实[156,163],未来需要探索IBD中钙信号通路的变化,为临床治疗和预防提供指导.
2.2 铁 铁作为人体必需的微量元素,参与人体的许多生理过程,包括氧气运输、能量产生和免疫调节等[164].膳食铁有三种形式:无机铁、血红蛋白和铁蛋白.所有形式的铁吸收都发生在十二指肠和空肠上部[165].缺铁(iron deficiency,ID)是世界上最常见的营养缺乏[166],也是IBD常见的肠外表现[164].IBD期间ID的发生是由于黏膜病变中反复肠出血导致的铁损失和炎症诱导的铁调素上调引起的铁吸收障碍[167,168].ID引起的缺铁性贫血(iron deficiency anemia,IDA)也是IBD的常见并发症[169],其患病率从门诊患者的16%到住院患者的68%不等[71].IDA是ID的一种相对较晚的表现,会导致疲劳、头痛、眩晕、心动过速和劳力性呼吸困难等症状[169].最近有研究强调了IBD患者中不伴有贫血的铁缺乏的高患病率[18,166].不伴有贫血的IBD患者的ID与健康相关的生活质量非正常化之间存在显著相关性.在多因素分析中,ID是与健康相关生活质量非正常化相关的独立因素[166].此外,患有IBD的ID患者更有可能经历抑郁和疲劳,但这些症状与炎症无关[170].考虑到ID伴或不伴贫血引起的这些表现,ESPEN指南强烈建议将ID治疗加入IBD患者的临床营养治疗中[12].
口服补铁是治疗缺铁的常用方法.然而,口服铁替代疗法耐受性差,经常会引起胃肠道的不良反应,包括恶心、胀气、腹泻、胃糜烂和肠道铁离子沉积等[171].有研究指出,从标准的200 ppm增加或减少口服铁浓度均会加重DSS诱导的小鼠结肠炎的临床和组织学严重程度[172].在小鼠中,低铁饮食改变了普雷沃氏菌科和卟啉单胞菌科[173]家族的丰度.未被吸收的铁在结肠中产生自由基[174],刺激一些细菌的生长,并导致宿主被大肠杆菌等关键肠道病原体感染[175-177].因此,管腔内铁的低水平和高水平似乎都可能影响微生物群,导致胃肠道副作用并加剧肠道炎症[178].Chen等[179]研究了铁摄入量和血清铁水平与成人IBD和慢性腹泻症状的关系.结果显示,男性铁摄入量与慢性腹泻症状呈正相关,而女性则不然.铁摄入量或血清铁水平与IBD风险之间不存在显著关联.铁摄入量与腹泻呈正相关的确切机制尚不清楚.可能有以下几个方面:(1)补充铁可能增加革兰氏阴性菌的致病潜力,并改变肠上皮界面的微生物群落[180];(2)铁可能通过形成攻击细胞膜、蛋白质和DNA的羟基自由基来产生氧化应激[181];(3)过量摄入铁可能通过超氧化物过量产生的破坏作用诱发肠道炎症,即铁死亡[181,182].铁死亡可能参与IBD的发病机制.Xu等[183]于2020年首次报道了UC患者和UC小鼠模型发生铁死亡.Xu等[184]随后报道,TNBS诱导的小鼠CD样结肠炎同样发生了铁死亡.同时,铁死亡特异性抑制剂Ferrostatin-1改善了TNBS诱导的小鼠结肠炎.在DSS诱导的小鼠结肠炎中,铁死亡抑制剂治疗降低了疾病活动评分并改善了结肠长度缩短,这提示抑制铁死亡的有益作用[183,185,186].尽管已经观察到各种铁死亡抑制剂在减轻结肠炎相关的组织损伤方面具有积极作用,但其潜在的分子机制仍然难以捉摸,进一步的分子机制研究对于鉴定更具选择性的铁死亡调节剂非常重要.相比之下,静脉注射铁疗法提供了一种有效的替代治疗选择.因为它不会产生副作用,而且更能有效的恢复患者的铁状态[187],但疾病活动性的变化与铁治疗方式无关[188].此外,最近的一项研究调查了腹腔内补铁对结肠炎的影响,并表明腹腔内补铁可通过增强肠道屏障功能、减少CD4+T细胞浸润和抑制炎症反应来抑制DSS诱导的小鼠结肠炎的发展[189].这一发现为我们提供了一种治疗炎症性肠病ID的新方法,但其安全性和有效性还需要进一步测试.
2.3 锌 锌是人体中含量第二丰富的微量元素,主要在十二指肠远端和空肠近端的小肠中被吸收[190].锌对各种生理功能至关重要,如生长、发育、抗氧化和免疫调节等[191,192].据报道,世界上大约30%的人口患有锌缺乏症[193].锌缺乏会导致皮炎、食欲不振、伤口愈合障碍、血氨增加和性腺功能下降等疾病[194].同样,缺锌在IBD患者中很常见,其患病率在15%-40%之间[195].一项大型单中心队列研究发现与锌水平正常的个体相比,伴有锌缺乏症的IBD患者的住院率、外科干预率和疾病相关并发症都有所增加[196].CD患者的血清锌水平与临床活动性指标Harvey-Bradshaw指数呈负相关[197].缺锌加重了TNBS/DSS诱导的实验性结肠炎[198,199].关于锌在IBD中的作用可能有几个方面.
首先,锌可以减少促炎细胞的数量和促炎细胞因子的产生.锌通过影响STAT3信号通路抑制Th17的发育[200],并通过增强IL-1受体相关激酶4的磷酸化削弱与Th17相关的炎症反应[201].锌缺乏通过诱导巨噬细胞中白介素23p19的表达和激活Th17而加剧结肠炎[198].锌似乎也可以通过增加iTreg的数量参与调控效应T细胞的活性和免疫耐受[202].锌缺乏似乎会减少M2巨噬细胞的数量[203].因此,锌似乎通过增加iTreg和M2巨噬细胞的数量来减弱IBD的炎症过程.Iwaya等[199]报道,饮食诱导的锌缺乏通过调节离体肠系膜白细胞中TNF-α和肿瘤坏死因子受体1的表达,加剧DSS诱导的大鼠实验性结肠炎.锌还能通过抑制NF-κB信号通路下调促炎细胞因子(即IL-6和TNF-α)的表达[71].先前的研究表明,健康志愿者的低锌饮食可能导致Th1细胞因子、IFN-γ和IL-2的减少,以及自然杀伤细胞的溶解活性降低[204].此外,锌缺乏导致淋巴组织发育不良、自然杀伤细胞活性降低、B细胞和T细胞凋亡增加,从而影响先天免疫、体液免疫和细胞免疫过程[205],增加炎症风险.
研究表明,锌缺乏可能导致不同细胞和组织出现氧化应激.补充锌有助于预防氧化损伤[206].作为细胞抗氧化防御系统的一员,锌通过诱导金属硫蛋白的合成、抑制烟酰胺腺嘌呤二核苷酸磷酸氧化酶的活性和激活核因子红系2相关因子2通路,在IBD中发挥抗氧化保护作用[207].同时,锌可以降低活化巨噬细胞中诱导型一氧化氮合成酶的活性,从而防止活性氧和镍离子的产生和预防细胞损伤[208].
此外,缺锌还会破坏肠道黏膜屏障.一项研究表明[209],缺锌会破坏细胞间连接,增加肠道通透性,而补充锌则通过增强Caco-2细胞的分化和紧密连接蛋白ZO-1的表达来改善肠道屏障功能[210].锌缺乏还影响杯状细胞的合成和黏液蛋白的分泌进而影响肠道黏液层的稳定性[211].肠道微生物群的生长和繁殖需要锌的参与.锌缺乏导致肠道微生物群多样性降低,最终导致肠道微生态紊乱[212].简而言之,缺锌增加了肠道屏障受损的风险,使外源性抗原更容易直接接触肠道上皮细胞,增加肠道感染的风险.同时,锌缺乏引起肠道菌群失调和机体免疫失衡,最终引起肠道炎症,促进CD或UC的发生和发展.鉴于此,提供足够水平的锌可能有助于更有效地治疗这种慢性疾病.锌缺乏症患者最初建议食用富含锌的食物,如牡蛎、扇贝和肝脏等.当饮食治疗不足时,日本实用指南建议对缺锌患者补锌,剂量为成人50-100 mg/d,儿童1-3 mg/kg/d.治疗期间需要监测不良反应和血清锌水平[213].
2.4 硒 硒是一种可作为催化剂和抗氧化剂的重要非金属微量元素[214].它通常以含硒蛋白的硒半胱氨酸形式存在于人体内[215].硒的主要膳食来源是面包和谷物、肉、鱼、蛋和牛奶/乳制品[216],也通常包含在各种维生素/矿物质补充剂中[217,218].据报道,IBD患者硒缺乏的患病率为30.9%[219].CD患者血清中的硒蛋白P水平显著降低[220],低硒水平也导致硒依赖性红细胞GPx活性下降[221].在IBD患者中,异常低的硒水平与前列腺素E2、IL-6和TNF-α等促炎介质水平升高有关[222].硒缺乏加重了DSS诱导的小鼠结肠炎.与其他微量营养素不同,硒缺乏可能在炎症性癌变中促进肿瘤的发展[223].补充硒还可以通过自噬和细胞凋亡途径减少肠道损伤的影响[224,225].有研究证明[222],硒通过与硒蛋白结合调节巨噬细胞中的花生四烯酸途径减少TNF-α和前列腺素E2的产生进而抑制炎症.在IBD中,氧化应激可导致NF-κB活化.LPS刺激巨噬细胞后补充硒可抑制NF-κB的激活,这可能得益于硒的抗氧化功能[226,227].Shi等[228]证明,两种含硒氨基酸—硒半胱氨酸和硒胱氨酸—通过降低小鼠体内ROS和丙二醛活性以及增加SOD和GPx活性,显著改善DSS诱导的氧化应激减少肠黏膜损伤并通过降低促炎细胞因子(IL-1、MCP-1、IL-6和TNF-α)水平改善结肠炎症.
硒会影响肠道菌群.不同硒水平的饮食会影响大鼠的微生物组成[229],饮食硒会增加肠道微生物群的多样性.最近,研究人员发现,硒化的α-D-1,6-提取物是一种有机硒化合物,可以修复DSS改变的结肠炎小鼠的肠道菌群组成,尤其是拟杆菌门、厚壁菌门、变形菌门和放线菌门.此外,硒化的α-D-1,6-提取物通过促进紧密连接蛋白ZO-1和闭塞蛋白的表达来保护结肠黏膜屏障[230].基于此,在IBD患者膳食中补充硒似乎是一种有效的治疗方法,但目前相关的临床研究尚处于初步阶段,因此需要进一步的随机临床试验来评估硒缺乏对活动期和静止期IBD的短期和长期影响.
2.5 镁 镁对人体健康至关重要,它参与了人体的多种生理过程,包括酶促过程、磷酸化、蛋白质合成等.人体中的镁主要来自饮食摄入[231].它在肠道中通过两种不同的方式被吸收:一种是在小肠中,由电化学梯度驱动;另一种是盲肠和结肠中的跨细胞转运[如瞬时受体电位通道6(transient receptor potential melastatin 6,TRPM6)][231].镁缺乏似乎与多种炎症驱动的慢性疾病的发展和维持有关,如糖尿病、代谢综合征、心血管疾病和癌症[232].镁摄入量不足(<250 Mg/d)导致血清镁浓度降低[≤0.75 mM]和血清CRP升高[232].相反,补充镁会降低炎症个体的CRP水平[233].IBD患者镁缺乏的患病率在13%-88%之间[13].Trapani等[234]报道了IBD患者严重的镁缺乏,且血清镁水平与疾病活动性呈负相关.早发性IBD儿童最常见的微量营养素缺乏症从高到低是镁、血清铁、VD、锌和钙[235].然而,有人认为血清镁水平并不一定代表全身镁状况[236].毛发沉积可以反映更准确的全身镁状况,从而更好地检测缺镁人群[237].最近,一项大型单中心前瞻性队列研究通过测量头发中的镁浓度评估IBD患者的镁水平.结果显示,与健康对照组相比,IBD组的头发镁浓度显著降低[238].研究发现,在结肠炎小鼠模型中,DSS处理通过TNF-α在信使核糖核酸和蛋白质水平上显著降低TRPM6的表达[234].TRPM6在肠道中是维持系统镁稳态所必需的,其功能不能被其他离子通道取代[239].DSS结肠炎中TRPM6的下调严重影响肠道镁的吸收并加剧肠道炎症.补充镁减弱了TNF-α对TRPM6表达的影响,这可以解释肠道炎症中镁缺乏的现象[234].
膳食镁还通过调节肠道菌群来减轻实验性小鼠结肠炎,因为补充镁会增加参与肠道健康和代谢稳态的细菌丰度[240].异甘草酸镁是甘草酸的镁衍生物,临床上常用于治疗肝病[241].它被发现可显著抑制免疫细胞(CD45+、CD4+、F4/80+)的浸润和促炎细胞因子(IL-1β、IL-6、IL-17、IFN-γ和TNF-α)的产生,以缓解DSS诱导的急/慢性结肠炎,还可以显著减轻结肠纤维化和降低ROS水平,以减少肠道屏障的破坏[242].此外,镁还可以修复上皮的炎症损伤[243].上述动物实验表明,补充镁可能是一种安全可行的减少炎症和恢复正常肠道黏膜功能的策略.未来还需要更多的临床研究来探索镁在IBD中的具体作用,并为临床实践提供指导.
2.6 铜 铜是酶和电子转运蛋白的基本辅助因子.这些酶和电子转运蛋白是抗氧化剂、神经递质、组胺代谢、氧化磷酸化和铁转运所必需的[244].由于铜大量储存在肝脏、肌肉和骨骼中,其缺乏症非常罕见[13].各种研究报告了IBD患者和健康人血清铜浓度的差异.挪威的一项病例对照研究发现,IBD患者的血清铜水平高于对照组[245].另一项来自伊朗的研究发现,IBD患者和对照组之间的铜浓度没有差异[208].最近的一项病例对照研究报告称,IBD患者在诊断时血清铜水平低于对照组[246].这些差异可能是由不同程度的疾病严重程度引起的,但具体原因仍有待探索.据报道,在急性期反应期间,血清铜浓度增加[247].炎症可能会增加铜水平,全身炎症与血清中高铜水平之间存在相关性.高CRP是高铜水平的预测因子[15,248].血清铜浓度升高也会导致结肠黏膜中自由基的产生,导致IBD炎症的持续循环[249,250].此外,铜作为SOD的一种成分,可能有助于降低IBD的氧化应激[208].IBD患者血清铜水平的变化与发病机制之间的关系尚不清楚,但其与炎症反应标志物的关系可能使其成为IBD患者炎症过程的潜在标志物.
2.7 锰 锰是正常细胞功能和生理过程所需的必需微量营养素,在新陈代谢、骨骼生长、酶活性和免疫反应中发挥重要作用[251].当供应水平超过生理需求时,锰可能是有毒的.在饮食中添加过量的锰可能导致自由基的产生、抗氧化酶的失活、免疫反应的损伤以及出现影响其他微量元素生物利用度的拮抗作用[252].锰缺乏会加重DSS诱导的小鼠结肠炎.即使没有DSS处理,单独的膳食锰缺乏也会破坏肠道紧密连接,从而增加肠道通透性[253],这提示锰在维持肠道屏障方面的作用.然而,锰在肠道稳态中的进一步作用仍然未知,其对IBD的贡献仍有待探索.
2.8 其他 除了上述矿物质外,人体必需的常量或微量元素还有钾、碘、钼、钴、铬等.但目前关于这些元素和IBD的研究很少.已知钼具有良好的ROS清除能力,可通过降低小鼠的ROS水平来抑制NF-κB信号通路,从而缓解小鼠结肠炎[254].铬是NF-κB抑制剂家族的一员.补充铬改善了实验性结肠炎的组织学表现,提高IL-10水平的同时降低了TNF-α和IFN-γ的水平[248].未来仍需要大量的动物和临床研究来探索这些元素在IBD中的作用,为临床治疗提供更多指导.
3 结论和未来展望
近年来,微量营养素因其对人体的广泛生理作用而日益受到关注.有人认为,微量营养素在多种疾病中发挥着重要作用,如IBD、肝硬化等.然而,微量营养素在IBD中的作用及其具体机制尚不清楚,因此需要全面研究.本文首先介绍了不同种类微量营养素的基本知识,包括它们的定义、组成、来源、生理功能和活性形式.接下来,我们系统全面地阐明了这些微量营养素在IBD基础实验和临床实践中的作用.我们还讨论了微量营养素缺乏对IBD患者的不良影响.就一些广泛研究的微量营养素而言,我们强调了这些元素在IBD中发挥作用的具体机制,包括调节免疫反应、减少氧化应激、改善肠道微生物群和维持肠道屏障功能.总之,我们得出的结论是,有必要监测IBD患者的微量营养素状况,并根据缺乏情况及时补充.
尽管已有大量研究证明微量营养素在IBD中的重要作用,但仍存在一些疑问.首先,基础研究与临床实践之间存在巨大差距,这可能是因为缺乏足够的研究来探索微量营养素在IBD中的作用.其次,一些微量营养素如VB12、叶酸、VD、铁和钙的作用已经得到了很好的证明[69,75,156,163],但其他微量营养素的类似研究很少,仅限于小规模研究.此外,关于这些微量营养素治疗的安全性和有效性的研究没有得到充分的讨论和探索,阻碍了其在IBD甚至其他相关疾病中的应用.
总之,我们有必要充分认识到不同微量营养素在IBD中的重要作用,并进一步进行充分的研究,以探究其背后的深层机制.此外,未来仍需要进行大规模的循证临床研究,以揭示微量营养素缺乏对不同人群的不良影响和预后,并确定在IBD中补充这些元素的适当剂量.
