血流感染产超广谱β-内酰胺酶大肠埃希菌的耐药性及危险因素分析
2023-09-13徐砚志张亚南
徐砚志,张亚南,刘 丹,李 璐,陈 光
本溪市中心医院检验科,本溪 117000
血流感染(bloodstream infection,BSI)是由病原微生物在循环血液中一过性、间歇性或持续性存在而引起的,严重时可导致休克、死亡等。临床工作中以血培养阳性结果为佐证,称为“菌血症”或“BSI”。目前埃希菌属有7个种,大肠埃希菌是埃希菌属的代表种。大肠埃希菌在BSI病原菌分离率中居首位[1-2],是我国导致院内感染最常见的病原菌[3]。本研究通过回顾性分析本溪市中心医院164例由大肠埃希菌引起的BSI病例,为临床抗感染治疗及感染预防工作提供参考。
1 一般资料
回顾性分析164例发生大肠埃希菌BSI住院患者的临床资料。其中男性患者68例,女性患者96例,男女比例为1∶1.41。
依据产超广谱β-内酰胺酶(extended-spectrumβ-lactamases,ESBLs)分析结果分为ESBLs组(n=81)和非ESBLs组(n=83)。2组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。
入组标准:①达到BSI标准[4];②血培养阳性瓶至少分离、鉴定出1次大肠埃希菌。
2 方法
2.1 试验方法
根据血培养采集规范,成人采集并送检2套血培养标本,每套包括1个需氧瓶和1个厌氧瓶(碧迪医疗器械上海有限公司),血培养瓶经全自动血培养系统BD FX(碧迪医疗器械上海有限公司)培养后,阳性瓶转种至血琼脂培养基和麦康凯培养基(温州康泰生物科技有限公司)。培养基以35 ℃在二氧化碳培养箱(山东博科生物产业有限公司)中孵育18~24 h后,用BD M50型鉴定药敏分析仪(碧迪医疗器械上海有限公司)进行自动化鉴定及药敏试验。并通过ID-4鉴定药敏板卡(碧迪医疗器械上海有限公司)进行自动化ESBLs试验。药敏试验结果依据2021年CLSI S31版进行折点判读[5]。
2.2 统计学方法
用LIS系统进行临床资料的统计。用WHONET软件进行细菌耐药监测数据的分析。用SPSS 25.0软件对数据进行处理,计数资料用“例(%)”表示。根据理论频数T的范围,分别用χ2检验(T≥5)、χ2校正检验(1≤T<5)、Fisher确切概率法(T<1)进行组间差异的比较。危险因素首先进行单因素分析,满足条件的因素(P<0.05)用二元Logistic回归分析进行独立危险因素的变量分析。
3 结果
3.1 抗菌药物药敏试验结果的分析
164例大肠埃希菌BSI患者中,产ESBLs大肠埃希菌占49.3%,检出1株碳青霉烯类抗菌药物耐药菌株。2组对氨苄西林、哌拉西林、头孢唑林、环丙沙星、左氧氟沙星、四环素6种抗菌药物的耐药率均在60%以上。ESBLs组对抗菌药物氨苄西林、哌拉西林、头孢唑林、头孢噻肟4种抗菌药物的耐药率为100%。2组对13种抗菌药物耐药率的差异具有统计学意义(P<0.05)。结果见表2。
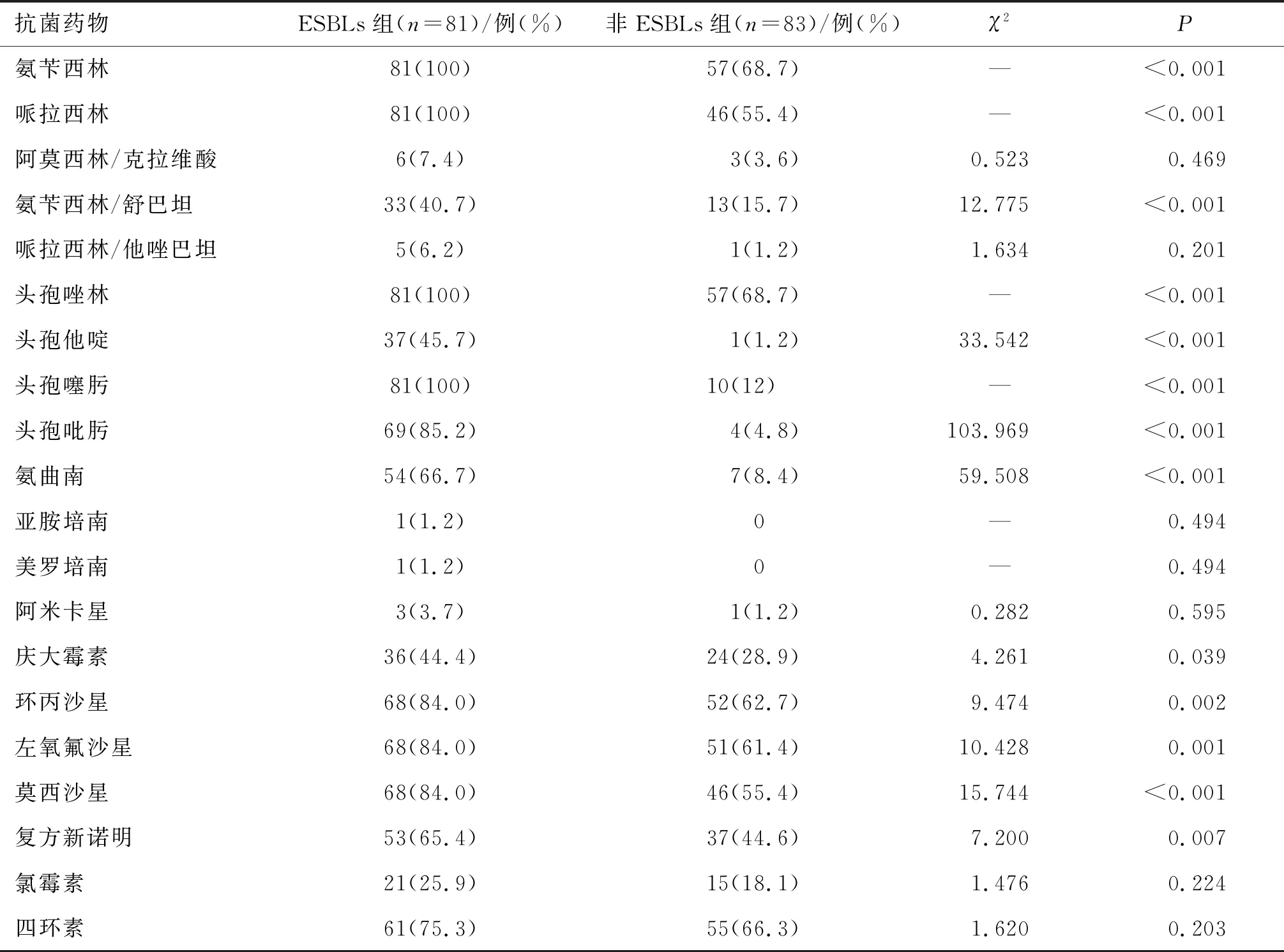
表2 产ESBLs菌株血流感染耐药性分析结果
3.2 BSI危险因素的分析
将协变量患者性别、患者年龄、基础疾病、是否为医院获得性感染、是否入住重症监护病区、感染前90 d是否有住院史、感染前30 d是否有手术史和感染前30 d抗菌药物使用史等18个因素进行单因素分析,结果见表3。由表3可见,侵入性置管操作(χ2=22.823,P<0.001)和β内酰胺/酶抑制剂类抗菌药物的使用(χ2=20.650,P<0.001)的组间差异具有统计学意义。将组间差异具有统计学意义的2个因素进行二元Logistic多因素分析,结果见表4。由表4可见,侵入性置管操作和β内酰胺/酶抑制剂类抗菌药物的使用是引起ESBLs大肠埃希菌BSI的独立危险因素(χ2=6.090,P=0.014;χ2=4.399,P=0.036)。

表3 产ESBLs菌株血流感染危险因素的单因素分析结果

表4 影响产ESBLs大肠埃希菌血流感染的多因素Logistic回归分析结果
4 讨论
大肠埃希菌是该院近3年临床抗感染治疗中分离率较高的细菌,也是引起BSI较常见的革兰氏阴性菌。本次研究的结果与全国细菌耐药监测网统计的数据一致[6]。随着临床广谱抗菌药物的大量使用,肠杆菌科细菌的耐药率呈逐年上升的趋势[7]。大肠埃希菌的耐药机制主要包括产超广谱β-内酰胺酶、AmpC酶和碳青霉烯酶等。超广谱β-内酰胺酶属于分子分类A组氧亚氨基β-内酰胺酶,最常见的是由TEM型和SHV型广谱酶衍生的超广谱β-内酰胺酶,还包括PER型酶和CTX型酶等。该酶经质粒介导可在不同细菌间传递,引起医院暴发感染[8-9]。由于各个国家和地区的抗菌谱存在差异,因此不同地区肠杆菌科细菌中流行的ESBLs耐药基因型有所不同[10]。
该院产ESBLs大肠埃希菌BSI占49.3%,虽然低于相关文献报道(54.1%、54.6%、64.5%)[11-13],但总体分离率仍呈逐年上升的趋势,应引起临床抗感染治疗和院内感染监测工作的重点关注。细菌通过产生和携带超广谱β内酰胺酶获得对β内酰胺酶类抗菌药物的耐药性[14-15]。产ESBLs大肠埃希菌临床检出率逐年升高,主要是由于ESBLs可通过结合和转化等形式使耐药基因在细菌间传递[16]。
本研究结果显示,ESBLs组对抗菌药物的耐药率均高于非ESBLs组。产ESBLs菌株对青霉素类、头孢菌素类等抗菌药物表现出较高的耐药水平,显示出多重耐药的特性,这与质粒同时携带多个耐药基因有关[17]。研究还发现,ESBLs组中有部分菌株对三代头孢菌素头孢噻肟耐药,而对四代头孢菌素头孢吡肟敏感。经手工药敏K-B法复核,结果与仪器药敏MIC法一致,排除了由仪器产生误差的可能。统计分析发现,该类菌株在IPCENTER耐药机制结果报告中均提示产AmpC酶。随着第三代头孢菌素治疗时间的延长,肠杆菌属因去阻遏表达AmpC酶而发展为耐药,值得进一步研究。
在治疗产ESBLs大肠埃希菌BSI时,临床一线抗感染治疗应注意避免青霉素和头孢菌素的经验性使用。根据《桑福德抗生物治疗指南》中关于多重耐药革兰氏阴性杆菌全身性感染的治疗建议,对于产ESBLs大肠埃希菌,治疗时应首选美罗培南或亚胺培南。而酶抑制剂类复合制剂哌拉西林/他唑巴坦在相关BSI经验治疗时的结果存在不一致性,即药敏试验的结果显示敏感,但临床使用可能无效。本次研究发现1例对亚胺培南和美罗培南耐药的ESBLs菌株。产ESBLs大肠埃希菌对碳青霉烯类抗菌药物高度敏感,表明其仍是目前治疗产ESBLs大肠埃希菌感染的首选药物[18]。
本研究结果显示,侵入性置管操作和β内酰胺/酶抑制剂类抗菌药物的使用是引起产ESBLs大肠埃希菌BSI的独立危险因素。本研究的侵入性置管操作主要包括留置导尿管和留置静脉导管等。侵入性置管破坏了人体的天然防御屏障,例如留置尿管使尿道黏膜发生损伤,而定期更换留置尿管又增大了大肠埃希菌定植的风险,一些条件致病菌与分泌物黏附于插管内壁形成生物膜-黏糖复合物,难以被抗菌药物杀灭,从而使感染的可能性增大。引起中心静脉导管BSI的主要原因包括皮肤插管部位细菌定植、导管接头更换过程中引起的细菌污染、导管周围环境和输注液体污染等。进行侵入性操作时应严格执行无菌操作,定期进行留置导管术污染风险评估。每日评估是否需要继续留置导管,严格执行手卫生规则。临床抗感染治疗中对抗菌药物的不规范和过度使用,也使β内酰胺/酶抑制剂类抗菌药物的使用成为引起产ESBLs大肠埃希菌BSI的独立危险因素。具体包括给药剂量小、给药时间过短、未进行联合治疗等,导致临床用药周期过长,从而引起细菌适应性耐药。国内相关报道显示,大肠埃希菌的耐药率与多种抗菌药物的使用强度存在相关性[19]。
对产ESBLs大肠埃希菌BSI的分离率和耐药性的监测刻不容缓。临床医生在进行抗感染经验治疗时,首先应了解患者病史中相关的危险因素,规范地进行侵入性置管操作。根据医院抗菌药物分级管理政策和我院耐药监测分析情况,合理、逐级使用抗菌药物。待分离菌及药敏试验结果回报后,及时调整抗感染治疗方案。积极构建抗感染学科互联,医院应建立抗菌药物应用的会诊制度[20]。
综上所述,细菌耐药监测工作已进入大数据时代,加强医院感染控制、临床和检验多学科的联动势在必行。通过建立感染控制分级管理机制,多学科联动才能最大限度地降低我院血流感染产ESBLs大肠埃希菌的检出率。
