基于miR-128-3p/SIRT1/自噬探讨虎杖苷促进糖尿病溃疡模型大鼠创面愈合的机制*
2023-09-13童海江周恺骅王亚玲孙海燕王社梁夏伟仁
童海江,周恺骅,王亚玲,孙海燕,王社梁,夏伟仁
(绍兴第二医院,浙江 绍兴 312000)
长期高血糖会促进炎症细胞因子和活性氧(reactive oxygen species,ROS)的表达,进而抑制血管生成。这会引起足部伤口不受控制的感染,引起糖尿病(diabetes mellitus,DM)足溃疡(diabetic foot ulceration,DFU)[1]。DM患者终身患有DFU的概率高达15%,也是成年人截肢的主要因素[2]。细胞的自噬可将受损的蛋白质和细胞器运输到溶酶体进行降解,从而减少ROS的生成,是细胞在高糖等压力环境下自我保护的方式。研究发现自噬可以缓解DFU,促进伤口愈合[3]。微小RNA(micorRNA,miR)是内源的小型非编码RNA,可通过与目标mRNA的3'非翻译区(3′untranslated region,3'-UTR)碱基-碱基互补配对来抑制基因表达。研究表明mi-128可通过靶向抑制下游Sirtuin(SIRT1)蛋白的表达调控自噬[4-5]。虎杖苷是从虎杖中分离的天然羟基-二苯基乙烯化合物,研究显示其可通过调节STIR加速蛋白发挥抗氧化和抗炎的作用[6]。虎杖苷可通过调控自噬保护心肌细胞免受心肌梗死损伤[7]。本研究主要基于miR-128-3p/SIRT1探讨虎杖苷对DFU模型大鼠创面愈合和自噬水平的影响。
1 材料与方法
1.1 实验动物 60只SPF级的Sprague-Dawley(SD)大鼠,雄性,12周龄,体质量220~250 g,均购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2021-0006。所有大鼠饲养温度为22~24 ℃,湿度为40%~60%,均饲养在光照12 h/黑暗12 h的环境中。实验过程完全遵守《关于善待实验动物的指导性意见》,并通过绍兴第二医院伦理委员会审核批准,伦理批号:2020031。
1.2 药物与试剂 链脲佐菌素(streptozotocin,STZ)(美国Sigma公司,批号:20190217);HE染色试剂盒(北京Solarbio公司,批号:20211207);RNAspin Mini试剂盒(美国GE Healthcare,批号:217004);Bestar qPCR RT(批号:2020665)和BestarTMqPCR试剂盒(批号:2020890)均购自德国DBI Bioscience公司;一抗anti-GAPDH(批号:ab9485)、anti-LC3Ⅰ(批号:ab232463)、anti-LC3Ⅱ(批号:ab232940)、anti-Beclin1(批号:ab207612)、anti-SIRT1(批号:ab110304)和山羊抗兔HRP-IgG二抗(批号:ab205718)均购自美国Abcam公司;ECL化学发光底物(武汉爱博泰克生物科技有限公司,批号:RMO0021);大鼠内皮祖细胞(美国ATCC公司,批号:BH0015);专用培养基(美国Gibco,批号:2177684);hsa-miR-128-3p、NC mimics、双荧光报告基因载体h-SIRT1-3UTR-wt和双荧光报告基因载体h-SIRT1-3UTR-mu均由上海汉恒生物科技公司合成。Lipofectamine 2000(加拿大Invitrogen公司,批号:11668019);双荧光素酶报告试剂盒(上海生工生物工程股份有限公司,批号:E60800)。
1.3 主要仪器 Agilent Stratagene Mx3000P序列检测系统(美国Santa公司);Leica DM2500光学显微镜、Leica RM2235组织包埋机均购自美国Leica Microsystems公司;KH20R高速冷冻离心机(湖南凯达科学仪器有限公司);Invitrogen Qubit Flex定量PCR仪(美国Thermo Fisher公司);干式生化分析仪-Compass2000(江苏康尚生物医疗科技有限公司);Invitrogen iBright凝胶成像系统(美国Thermo Fisher公司)。
1.4 造模与分组 将45只大鼠连续4周给予高脂高糖饮食,然后根据参考文献通过腹腔内注射STZ(70 mg/kg)建立DM模型[8]。在STZ注射后第3天检测尾静脉血中血糖水平,血糖高于16.7 mmol/L表明模型建立成功。本研究建模成功率为80%(36/45)。随机选择30只建模成功的大鼠,随机分为模型组(n=15)和虎杖苷组(n=15)。另取15只健康大鼠作为对照组,给予连续4周的正常饮食后,禁食12 h,再通过腹腔注射生理盐水(70 mg/kg)。参考文献方法建立DM伤口愈合的模型[8]。3组大鼠均腹腔注射10%水合氯醛溶液进行麻醉(350 mg/kg),随后用脱毛膏脱去除大鼠背部的毛,75%的酒精进行消毒,然后切除圆形范围为1 cm×1 cm的皮肤。
1.5 实验给药 虎杖苷组大鼠予虎杖苷灌胃,剂量为40mg/kg[9],1次/d,持续给药10 d。模型组、对照组作为自然愈合组不给药处理。
1.6 观察指标
1.6.1 伤口愈合评估 每天观察并测量伤口大小,在第5天和第10天拍照并计算伤口面积及伤口愈合率。伤口面积采用最大长宽法进行测量与计算。测量伤口边到边的最大长度和与长径相垂直的最大宽度,长与宽相乘得出伤口估算面积。伤口愈合率=[(初始伤口面积-最终伤口面积)/初始伤口面积]×100%。
1.6.2 组织病理学观察 大鼠腹腔注射3%的戊巴比妥溶液进行麻醉(40 mg/kg),随后收集愈合边缘组织。用4%的多聚甲醛将愈合边缘组织固定,脱水、包埋后切片(4 μm)。用苏木精在室温下染色10 min,然后用0.5%的伊红室温下染色3 min,显微镜(×200)下进行组织病理学观察。
1.6.3 创面组织SOD和MDA水平 取大鼠创面组织,消毒后保存于-80 ℃备用。取适量组织,剪碎后加入生理盐水,在冰水浴中进行匀浆,制作成质量浓度10%的组织匀浆液。2000r/min下低温(4 ℃)离心20 min(离心半径为13.5 cm),收集上清液,分装保存于-80 ℃备用。取待测组织匀浆上清液,采用ELISA试剂盒检测组织匀浆上清液中SOD和MDA水平。
1.6.4 创面组织SIRT1、LC3Ⅰ、LC3Ⅱ和Beclin1蛋白表达水平收集各组愈合边缘组织中总蛋白,每份样本中取出总量为40 μg的总蛋白电泳分离(80~120 V,90 min)。通过湿法将分离的蛋白转到PVDF膜(100 mV)。在5%牛血清白蛋白中于室温孵育1 h。将膜与1∶500稀释的一抗anti-LC3Ⅰ、anti-LC3Ⅱ、anti-Beclin1、anti-SIRT1在4 ℃下孵育过夜。洗涤后在室温下添加HRP标记的二抗孵育1 h。然后加入化学发光试剂进行显影。使用Image J软件分析目标蛋白的灰度值。GAPDH作为内参,通过灰度值分析目标蛋白与GAPDH的比值来分析表达水平。
1.6.5 创面组织miR-128-3p、SIRT1 mRNA表达水平 使用RNAspin Mini试剂盒从愈合边缘组织中提取RNA,然后使用Bestar qPCR试剂盒将其逆转转录为cDNA。条件如下:37 ℃,15 min;98 ℃,5 min。然后使用BestarTMqPCR预混液进行qPCR实验。条件如下:95 ℃,2 min;94 ℃,20 s;58 ℃,20 s;72 ℃,20 s。40个循环,最后在72 ℃下延伸4 min。使用Agilent Stratagene Mx3000P序列检测系统进行RT-qPCR分析。U6和GAPDH分别作为miR-128-3p和SIRT1 mRNA的内参,通过比较循环阈值评估相对表达水平。引物序列见表1。

表1 qPCR 引物序列
1.7 miR-128-3p靶向SIRT1的验证 通过双荧光素酶报告在大鼠内皮祖细胞中验证miR-128-3p靶向抑制SIRT1。首先根据Targetscan预测miR-128-3p与SIRT1 mRNA的3'-UTR的互补位点,将野生型(wt)和突变型(mut)的3'-UTR克隆到pmiR荧光基因中,分别命名为pmiR-wt-SIRT1和pmiR-mut-SIRT1。然后分别将miR-128-3p(50 pmol/mL)或miR-NC(50 pmol/mL)转染到细胞中,将pmiR-wt-SIRT1和pmiR-mut-SIRT1转染到细胞中。分组:pmiR-wt-SIRT1+miR-NC组、pmiR-wt-SIRT1+miR-128-3p组、pmiR-mut-SIRT1+miR-NC组、pmiR-mut-SIRT1+miR-128-3p组。转染体系(96孔板,每组3个复孔):3 μL siRNA(100 nmol/L)、15 μL质粒(40 ng/μL)分别稀释于180 μL无血清高糖培养基,6 μL Lipofectamine 2 000转染试剂稀释于450 μL无血清高糖培养基,室温静置5 min后,按分组及与转染试剂混合继续静置15 min。将上述复合物加入细胞培养基中并混匀。继续培养48 h后进行双荧光素酶检测。
通过双荧光素酶报告试剂盒检测相对荧光素酶活性。当miR-128-3p与SIRT1 mRNA结合后,荧光素酶活性会降低。然后通过荧光定量PCR检测miR-128-3p、SIRT1 mRNA表达水平,通过Western blotting检测SIRT1蛋白表达水平。
1.8 统计学方法 使用SPSS 26和GraphPad Prism 5统计软件对数值进行统计分析处理。对所有数据进行正态性检验及方差齐性检验,计量资料以“均数±标准差”表示,多组数据均数的比较用ONE-WAY-ANOVA检验,两两比较采用SNK-q检验。两组比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 3组大鼠伤口愈合情况比较 第5天,模型组、虎杖苷组大鼠伤口愈合率低于对照组(P<0.05);第10天,对照组大鼠伤口基本愈合,而模型组大鼠出现溃疡且伤口愈合停滞;第10天,虎杖苷组大鼠伤口愈合率高于模型组(P<0.05),低于对照组(P<0.05)。(见图1、表2)

图1 大鼠伤口愈合情况
表2 3 组大鼠伤口愈合率比较 (±s,%)
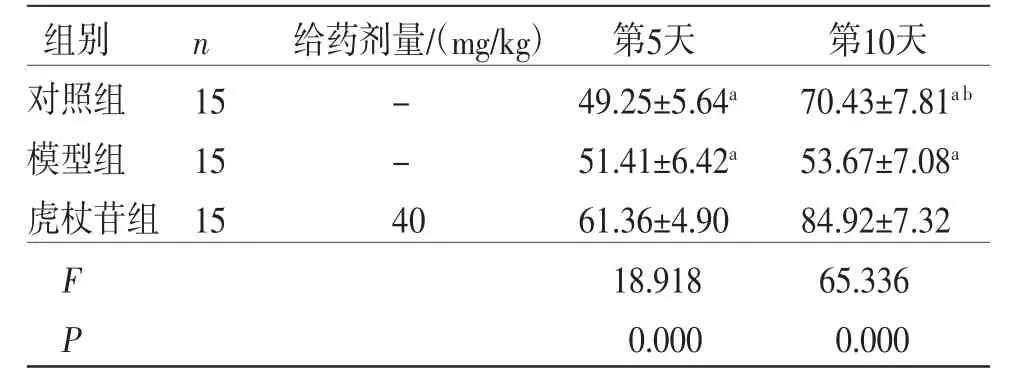
表2 3 组大鼠伤口愈合率比较 (±s,%)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05。
组别 n 给药剂量/(mg/kg) 第5天 第10天对照组 15 - 49.25±5.64a 70.43±7.81a b模型组 15 - 51.41±6.42a 53.67±7.08a虎杖苷组 15 40 61.36±4.90 84.92±7.32 F 18.918 65.336 P 0.000 0.000
2.2 大鼠伤口愈合的组织学情况 图2中红色为细胞质,蓝色为细胞核。对照组有大量的成纤维细胞样细胞及较多的肉芽组织和瘢痕组织;模型组见大量炎症细胞浸润,胶原沉积松散,排列不规则,伤口恢复情况较对照组差;虎杖苷组有较明显的肉芽组织和瘢痕组织,提示伤口愈合情况较模型组好。

图2 大鼠伤口愈合的组织学情况 (HE,×200)
2.3 3组大鼠创面组织中氧化应激水平比较 模型组大鼠创面组织中SOD水平低于对照组(P<0.05),MDA水平高于对照组(P<0.05);虎杖苷组大鼠创面组织中SOD水平高于模型组(P<0.05),MDA水平低于模型组(P<0.05);虎杖苷组大鼠创面组织中SOD水平低于对照组(P<0.05),MDA水平高于对照组(P<0.05)。(见表3)
表3 3 组大鼠创面组织中SOD 和MDA 水平比较 (±s)

表3 3 组大鼠创面组织中SOD 和MDA 水平比较 (±s)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05。
组别 n 给药剂量/(mg/kg) SOD/(nmol/mg) MDA/(U/mg)对照组 15 - 184.93±15.74 7.54±0.94模型组 15 - 87.46±9.05a 23.17±2.21a虎杖苷组 15 40 150.72±15.78a b 12.85±1.43a b F 185.945 355.746 P 0.000 0.000
2.4 3组大鼠创面组织中miR-128-3p、SIRT1 mRNA和SIRT1蛋白表达水平比较 模型组大鼠创面组织中miR-128-3p高于对照组(P<0.05),SIRT1 mRNA和SIRT1蛋白相对表达量低于对照组(P<0.05);虎杖苷组大鼠创面组织中miR-128-3p低于模型组(P<0.05),SIRT1 mRNA和SIRT1蛋白相对表达量高于模型组(P<0.05);虎杖苷组大鼠创面组织中miR-128-3p高于对照组(P<0.05),SIRT1 mRNA和SIRT1蛋白相对表达量低于对照组(P<0.05)。(见图3、表4)

图3 3 组大鼠创面组织中SIRT1 蛋白表达Western blotting 图
表4 3 组大鼠创面组织中miR-128-3p、SIRT1 mRNA 和SIRT1 蛋白表达量比较 (±s)

表4 3 组大鼠创面组织中miR-128-3p、SIRT1 mRNA 和SIRT1 蛋白表达量比较 (±s)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05。
组别 n 给药剂量/(mg/kg) miR-128-3p SIRT1 mRNA SIRT1蛋白对照组 15 - 0.89±0.07 4.97±0.42 3.28±0.29模型组 15 - 3.62±0.32a 1.35±0.11a 0.94±0.07a虎杖苷组 15 40 1.56±0.11a b 3.06±0.24a b 2.15±0.18a b F 745.949 586.327 496.335 P 0.000 0.000 0.000
2.5 3组大鼠创面组织中自噬标志蛋白LC3Ⅰ、LC3Ⅱ和Beclin1表达水平比较 模型组大鼠创面组织中LC3Ⅱ、Beclin1蛋白相对表达量及LC3Ⅱ/Ⅰ均低于对照组(P<0.05);虎杖苷组大鼠创面组织中LC3Ⅱ、Beclin1蛋白相对表达量及LC3Ⅱ/Ⅰ均高于模型组(P<0.05);虎杖苷组大鼠创面组织中LC3Ⅱ、Beclin1蛋白相对表达量及LC3Ⅱ/Ⅰ均低于对照组(P<0.05)。(见图4、表5)

图4 3 组大鼠创面组织中LC3Ⅰ、LC3Ⅱ和Beclin1 蛋白表达Western blotting 图
表5 3 组大鼠创面组织中LC3Ⅱ和Beclin1 蛋白相对表达量及LC3Ⅱ/Ⅰ比较 (±s)

表5 3 组大鼠创面组织中LC3Ⅱ和Beclin1 蛋白相对表达量及LC3Ⅱ/Ⅰ比较 (±s)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05。
组别 n 给药剂量/(mg/kg) LC3Ⅱ Beclin1 LC3Ⅱ/Ⅰ对照组 15 - 2.45±0.21 1.87±0.15 1.95±0.13模型组 15 - 0.87±0.08a 0.81±0.07a 1.12±0.1a虎杖苷组 15 40 1.94±0.17a b 1.43±0.12a b 1.54±0.21a b F 360.331 298.526 106.736 P 0.000 0.000 0.000
2.6 miR-128-3p与SIRT1靶向结合的验证 通过双荧光素酶报告在内皮祖细胞中验证miR-128-3p靶向SIRT1。miR-128-3p与SIRT1靶向结合位点见表6。同时转染miR-128-3p mimic和pmiR-wt-SIRT1后祖细胞中相对荧光素酶活性明显降低(P<0.05),提示miR-128-3p可以与SIRT1靶向结合。(见表7)

表6 miR-128-3p 与SIRT1 靶向结合位点
表7 各组细胞中相对荧光素酶活性比较 (±s)

表7 各组细胞中相对荧光素酶活性比较 (±s)
注:与miR-128-3p NC组比较,aP<0.05;与pmiR-mut-SIRT1组比较,bP<0.05。
组别 n miR-128-3p NC miR-128-3p mimic pmiR-wt-SIRT1 5 1.00±0.08 0.23±0.03a b pmiR-mut-SIRT1 5 0.99±0.10 1.04±0.11 t 0.015 126.173 P 0.890 0.000
2.7 miR-128-3p对SIRT1的抑制作用 为进一步分析验证miR-128-3p能够靶向抑制SIRT1的表达,通过转染miR-128-3p mimic 质 粒 过 表 达miR-128-3p。miR-128-3p mimic 组miR-128-3p水平高于miR-128-3p NC组(P<0.05),提示转染实验成功。miR-128-3p mimic组SIRT1 mRNA和SIRT1蛋白相对表达量低于miR-128-3p NC组(P<0.05)。(见图5、表8)

图5 过表达miR-128-3p 内皮祖细胞中SIRT1 蛋白Western blotting 图
表8 各组内皮祖细胞中miR-128-3p、SIRT1 mRNA 和SIRT1 蛋白相对表达量比较 (±s)

表8 各组内皮祖细胞中miR-128-3p、SIRT1 mRNA 和SIRT1 蛋白相对表达量比较 (±s)
注:与miR-128-3p NC组比较,aP<0.05。
组别 n miR-128-3p SIRT1 mRNA SIRT1蛋白miR-128-3p NC 5 1.07±0.07 4.35±0.38 2.67±0.24 miR-128-3p mimic 5 5.68±0.48a 1.14±0.09a 0.61±0.05a t 225.798 168.920 176.522 P 0.000 0.000 0.000
3 讨 论
DM患者约占世界人口的9.5%,由于人们愈加不良的饮食习惯,预计到2030年,糖尿病的发病率将增加50%以上[10]。DFU是糖尿病最常见的并发症之一,由神经和血管生成受损、慢性低度炎症等引起的足部伤口感染不受控制引起的。DM患者伤口愈合较慢而引起DFU,但是目前尚无治疗DFU的方法,目前临床治疗DFU的方法以控制血糖、延缓病情进展为主[11]。高糖微环境会引起细胞氧化应激损伤,这不但会影响细胞新生,还会导致血管生成抑制和不受控制的炎症反应,进而引起溃疡和不良的伤口愈合[12]。近年来研究发现自噬可将细胞内的ROS和炎症相关蛋白运送至溶酶体溶解,并且可通过细胞内代谢维持细胞活力,减少细胞凋亡,进而促进伤口愈合[13]。临床研究显示诱导自噬在促进伤口愈合中具有关键作用[14]。
虎杖苷为白藜芦醇葡萄糖苷,具有抗氧化应激、抗炎等生物学活性[15]。研究显示积雪草苷可通过提高人黑素细胞内的自噬通量减少ROS的生成,进而保护细胞免受过氧化氢引起的氧化应激损伤[16]。WANG C G等[17]研究显示激活内皮祖细胞中自噬可促进SOD并抑制MDA,进而加速伤口愈合。曹媛媛等[18]研究表明虎杖苷可通过激活细胞内的自噬水平,缓解肺泡上皮细胞氧化应激损伤。体外研究显示虎杖苷可通过诱导自噬缓解阿尔茨海默病模型细胞的损伤[19]。也有研究发现虎杖苷可通过诱导自噬缓解氧化应激水平,进而提高肾小球足细胞对高糖环境的抵抗性[20]。这提示虎杖苷可通过促进伤口组织的自噬水平缓解高糖引起的氧化应激反应,进而促进DM模型大鼠的伤口愈合。本研究结果显示虎杖苷可缓解DM模型大鼠的伤口溃疡并促进组织修复。模型组SOD低于对照组,而MDA高于对照组;虎杖苷组SOD水平高于模型组而低于对照组,MDA低于模型组而高于对照组。表明虎杖苷可能通过调控自噬来缓解糖尿病溃疡组织中的氧化应激反应。
SIRT1可诱导肝细胞的自噬水平从而缓解胰岛素抵抗[21]。有研究显示SIRT1可被白藜芦醇激活进而缓解DM引起的心脏炎症和纤维化[22]。SIRT1会受到miR-128-3p的靶向调控,miR-128-3p可通过靶向SIRT1/ROS途径提高大肠癌对肿瘤坏死因子相关凋亡诱导配体诱导的细胞凋亡敏感性[24]。这些结果提示虎杖苷可能通过影响miR-128-3p/SIRT1自噬通路来缓解糖尿病溃疡组织中的氧化应激反应。为进一步验证这个假设,本研究对虎杖苷调控自噬的机制进行分析,检测了其对miR-128-3p和SIRT1的影响。结果显示模型组大鼠伤口周围组织中miR-128-3p水平被上调而SIRT1转录和翻译的水平被下调,而虎杖苷可以抑制miR-128-3p并促进SIRT1 mRNA和蛋白的表达水平。此外,本研究在内皮祖细胞中验证了miR-128-3p可靶向抑制SIRT1的转录和翻译。研究显示脂肪间充质干细胞衍生的外泌体可通过抑制miR-128-3p促进SIRT1的表达,进而促进DM大鼠的伤口愈合[23]。
虎杖苷可能通过抑制miR-128-3p促进SIRT1的表达,提高内皮祖细胞的自噬,缓解细胞氧化应激损伤,进而抑制炎症反应抑制溃疡的产生,并促进新组织生成。虎杖苷大鼠LC3Ⅱ和Beclin1水平显著高于模型组。为了证实miR-128-3p与SIRT1之间是否存在靶向结合作用,本研究进行生物信息学分析和荧光素酶报告基因检测,结果发现SIRT1 3’-UTR存在1个miR-128-3p的结合位点,而且miR-128-3p mimic可减少wt-SIRT1荧光素酶活性,但对mut-SIRT1荧光素酶活性无影响,从而鉴定SIRT1为miR-128-3p的靶基因。同时过表达miR-128-3p可降低内皮祖细胞SIRT1 mRNA与蛋白表达水平,表明miR-128-3p在转录后水平负性调控SIRT1表达。
综上所述,虎杖苷可能通过调节miR-128-3p/SIRT1通路诱导自噬,进而缓解高糖引起的氧化应激损伤,促进DM模型大鼠的伤口愈合。但是关于虎杖苷促进DM伤口愈合的机制仍需要及进一步研究,并且其调控miR-128-3p/SIRT1通路的分子机制也需要深入探讨。本研究结果为虎杖苷治疗糖尿病溃疡提供了新的理论基础与研究思路。
